重組Apoptin的葉酸修飾及誘導腫瘤細胞凋亡活性研究
董萍 彭海英 高璐 趙洪禮
重組Apoptin的葉酸修飾及誘導腫瘤細胞凋亡活性研究
董萍 彭海英 高璐 趙洪禮
為了使重組GST-Apoptin融合蛋白能夠與腫瘤細胞靶向性結合,并發揮其特異性誘導腫瘤細胞凋亡的作用,本文采用化學方法將葉酸連接到GST-Apoptin融合蛋白,實驗結果表明葉酸與GST-Apoptin融合蛋白的偶聯率為6%,最佳偶聯條件是20 mg/mL活化葉酸在pH 10.0條件下室溫反應60 min。葉酸化的GST-Apoptin融合蛋白(folate-GST-Apoptin)具有顯著誘導腫瘤細胞凋亡作用,1.0 μg/mL的folate-GST-Apoptin可使50%的腫瘤細胞(KG-1)凋亡,而對正常人外周血淋巴細胞沒有誘導凋亡作用。
凋亡;葉酸;Apoptin
來源于雞貧血病毒的雞貧血病毒蛋白-3(vp3)對人的各種腫瘤細胞和異常轉化細胞具有特異性殺傷作用。由于vp3能夠選擇性地誘導腫瘤細胞和轉化細胞的凋亡,而不誘導正常細胞的凋亡,被命名為腫瘤特異性凋亡因子(Apoptin)[1-3]。研究結果表明,Apoptin誘導腫瘤細胞凋亡不依賴于抑癌基因-53(p53)作用途徑,也不被抑制細胞凋亡基因(Bcl-2)過量表達所抑制,因此有希望成為有效治療癌癥的新型生物制劑[4-5]。由于人腫瘤細胞表面沒有雞貧血病毒蛋白受體,故Apoptin蛋白不可能與人的腫瘤細胞結合而誘導腫瘤細胞凋亡,實驗結果亦證明了這一點。為解決這一問題,本研究建立了重組GST-Apoptin融合蛋白葉酸修飾方法,以激活GST-Apoptin誘導腫瘤細胞凋亡的活性,使GST-Apoptin融合蛋白能夠與腫瘤細胞發生靶向結合,并誘導腫瘤細胞凋亡,以達到能夠滿足臨床治療腫瘤的目的。
1 材料和方法
1.1 儀器設備 Unic 2101型紫外可見分光光度計(上海Unic公司)、Startorious 1721型電子天平(德國)、85-2型恒溫磁力攪拌器(上海司樂儀器廠)、SHZ-88-1型臺式水浴恒溫振蕩器(江蘇太倉鹿河生化儀器廠)。
1.2 細胞與試劑 人KG1細胞株購于中國科學院上海細胞所,常規傳代培養KG1細胞;葉酸(Sigma產品),GST-Apoptin本實驗室表達純化,其他所用化學試劑均為國產,分析純。
1.3 GST-Apoptin融合蛋白的化學化修飾
1.3.1 GST-Apoptin融合蛋白預處理 取純化的GST-Apoptin融合蛋白溶解(1.5 mg/mL)10 mL,調至pH 9.0,室溫攪拌下緩慢滴加入25%的戊二醛溶液(終濃度為0.2%),攪拌12 h,對上述平衡液透析24 h,即得戊二醛活化GST-Apoptin融合蛋白的懸液。
1.3.2 葉酸活性酯的制備 500 mg的葉酸溶于10 mL二甲亞砜(已預先加入0.25 mL的三乙胺),攪拌下加入適量的二環己基碳二亞胺和N-羥基琥珀酰亞胺,室溫反應過夜。過濾,除去反應中生成的副產物二環己基脲,減壓濃縮至干。用乙醚洗滌殘余固體,得淺黃色固體粉末,即葉酸活性酯。
1.3.3 Folate-GST-Apoptin的制備 取上述活化的GST-Apoptin液適量2 mL,加入30 mg/mL的葉酸活性酯的二甲亞砜溶液0.5 mL,室溫攪拌2 h。用Sephadex G-50葡聚糖凝膠柱去除游離的葉酸,收集先流出的有乳光部分,即Folate-GST-Apoptin膠體混懸液。過濾除菌,4℃保存備用。
1.3.4 Folate-GST-Apoptin偶聯的證明及偶聯程度的測定 將GST-Apoptin、Folate-GST-Apoptin和葉酸與GST-Apoptin混合物的胰蛋白酶水解液分別作紫外吸收圖譜分析,驗證葉酸是否與GST-Apoptin偶聯。同時將葉酸配制成2~40 μg/mL系列濃度標準溶液,在358 nm處測定吸收度。
1.4 GST-Apoptin融合蛋白的化學化修飾制備工藝的優化
1.4.1 葉酸活性酯用量對偶聯程度的影響 5份GST-Apoptin融合蛋白活化混懸液用NaCO3/NaHCO3緩沖溶液調pH為10,加入不同量葉酸活性酯的二甲亞砜溶液,室溫攪拌,即Folate-GST-Apoptin膠體混懸液。用Sephadex G-50葡聚糖凝膠柱進行分離,收集先流出的有乳光部分,加入適量胰蛋白酶液,37℃水解,水解液在358 rim處作吸光度測定。
1.4.2 反應時間對葉酸偶聯程度的影響 取GST-Apoptin融合蛋白活化混懸液,用NaCO3/NaHCO3。緩沖溶液調pH為10,加入適量的葉酸活性酯二甲亞砜溶液,室溫攪拌。定時取一定體積的反應液用Sephadex G-50葡聚糖凝膠柱進行分離,收集先流出的有乳光部分,加入適量胰蛋白酶液,37℃水解,水解液在358 nm處作吸光度測定。
1.4.3 pH值對葉酸偶聯程度的影響 由于葉酸活性酯在中性及酸性溶液中溶解度不好,在pH<9的溶液中易析出沉淀,因此選擇了9.0、9.5、10.0、10.5、11.0五個pH值來考察偶聯反應的進行程度。取5份GST-Apoptin融合蛋白活化混懸液,用NaCO3/NaHCO3緩沖溶液分別調pH為9.0、9.5、10.0、10.5、11.0,加入適量的葉酸活性酯二甲亞砜溶液,室溫攪拌。用Sephadex G-50葡聚糖凝膠柱進行分離,收集先流出的有乳光部分,加入適量的胰蛋白酶液,37℃水解,水解液在358 nm處作吸光度測定。
1.5 Folate-GST-Apoptin體外誘導腫瘤細胞凋亡作用 采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)法測定Folate-GST-Apoptin誘導腫瘤細胞發生凋亡的活性;人KG1細胞株(購于中國科學院上海細胞所);常規傳代培養KG1細胞;取生長良好的細胞,配制成4×103個/mL的細胞懸液;將細胞懸液加入96孔細胞培養板,0.1 mL/孔,37℃,5%CO2培養過夜;加入上述激活的apoptin,0.1 mL/孔,以125 μg/mL為起點,2倍稀釋,每個滴度作4孔;37 ℃,5%CO2培養72 h;吸棄培養上清液,用磷酸鹽緩沖液洗細胞2次;加入用無酚紅RPMI1640配制的MTT(1 mg/mL),50 μL/孔,37 ℃,5%CO2培養3 h;吸棄培養上清液,用磷酸鹽緩沖液洗細胞2次;加入二甲基亞砜(DMSO),50 μL/孔,37℃,10 min;用EL340 560 nm波長,檢測各孔A值。試驗設PBS組、葉酸組、GST-Apoptin組和葉酸+GST-Apoptin組對照。
2 結果
2.1 Folate-GST-Apoptin偶聯的證明及偶聯程度的測定 GST-Apoptin的胰蛋白酶水解液紫外吸收圖譜為典型的蛋白質紫外吸收圖譜(圖1A),只在210 nm和280 nm處有吸收峰;而Folate-GST-Apoptin胰蛋白酶水解液紫外吸收圖譜除有典型的蛋白質紫外吸收圖譜外(圖1B),在358 nm處有明顯的紫外吸收;并且與葉酸與GST-Apoptin混合物的胰蛋白酶水解液紫外吸收圖譜基本一致(圖1C);說明葉酸已經連接到GST-Apoptin。
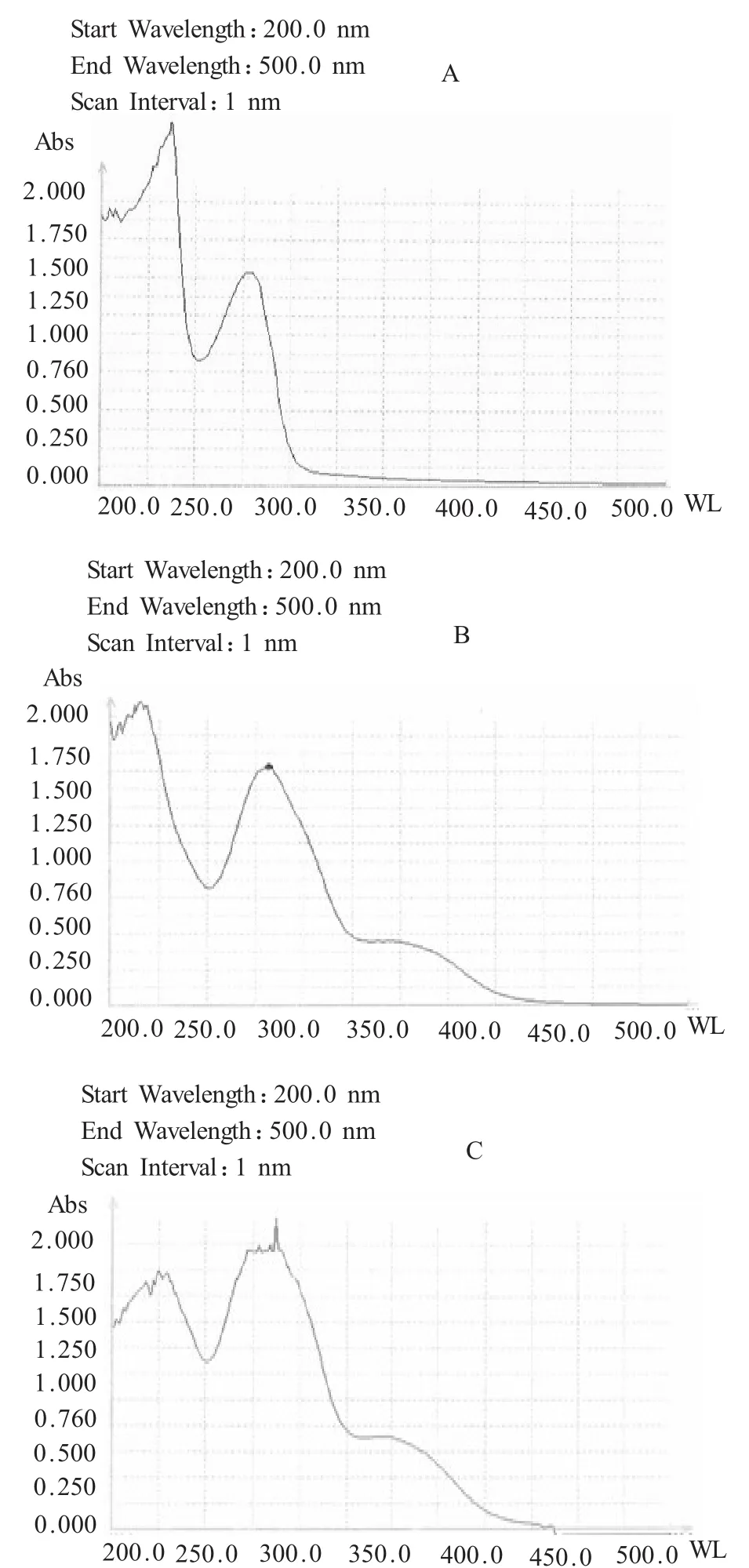
圖1 GST-Apoptin(A)、葉酸偶聯GST-Apoptin(B)、葉酸G與GST-Apoptin混合物(C)的胰蛋白酶水解液紫外圖譜
2.2 Folate-GST-Apoptin制備工藝的優化 ①pH值對葉酸偶聯程度的影響(圖2),可以看出葉酸偶聯GST-Apoptin的反應最好在pH=10時進行。②反應時間對葉酸偶聯程度的影響(圖3),可以看出反應60 min后,反應基本達到平衡,增加反應時間對葉酸偶聯量的增加沒有太大影響。③葉酸活性酯用量對葉酸偶聯程度的影響(圖4),可以看出葉酸活性酯的用量為15 mg時,葉酸偶聯量不再增加。
采用上述最佳條件,pH 10.0,反應時間為60 min,葉酸活性用量為15 mg,得到葉酸偶聯量為60.0 μg/mg GST-Apoptin的folate-GST-Apoptin。
2.3 Folate-GST-Apoptin對KG1細胞的凋亡誘導作用結果 1.0 μg/mL活化的apoptin可使50%以上的腫瘤細胞發生凋亡(圖5)。而未葉酸修飾的GST-Apoptin組細胞與正常對照組細胞沒有差異。
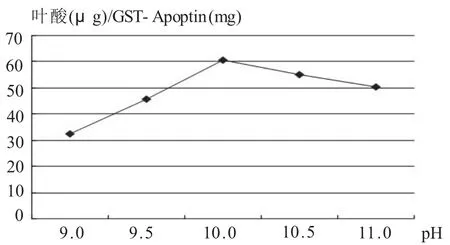
圖2 pH值對葉酸偶聯量的影響
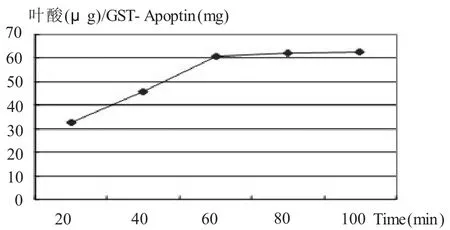
圖3 反應時間對葉酸偶聯量的影響
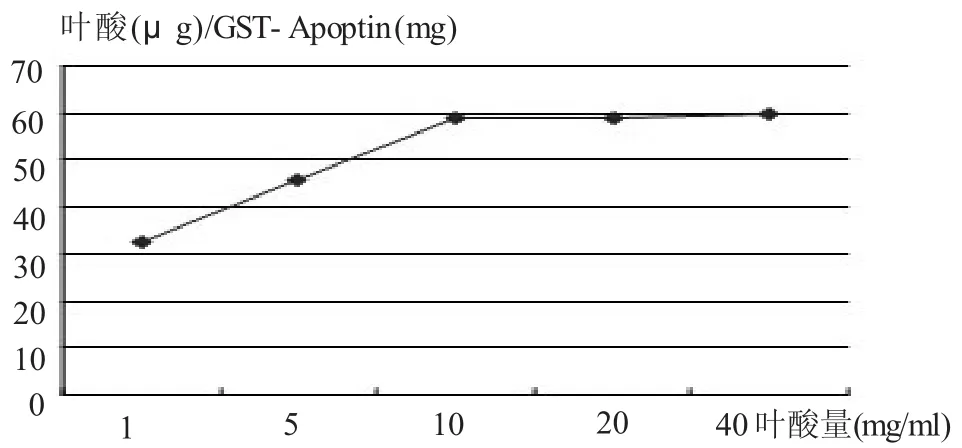
圖4 葉酸濃度對葉酸偶聯量的影響
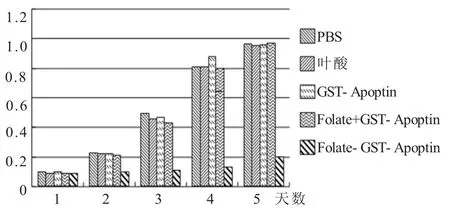
圖5 葉酸修飾GST-Apoptin對KG1細胞的凋亡誘導作用
3 討論
業已證明,Apoptin對人體各種組織器官來源的腫瘤細胞具有不同程度的凋亡誘導作用,而對正常組織細胞沒有毒副作用,是迄今發現的沒有毒副作用的抗腫瘤蛋白。但是由于種屬間的差異,Apoptin的裸蛋白不能自主進入人體來源的細胞,包括正常細胞和腫瘤細胞。為了解決這一問題人們通常采用病毒載體(如腺病毒)將Apoptin基因轉染到腫瘤細胞來發揮其抗腫瘤作用[6];也有學者采用微注射的方法將重組的Apoptin蛋白注射到腫瘤細胞內,研究其抗腫瘤作用[7-8]。但這兩種技術方法只適合實驗室研究,而不利于臨床應用和產業化。
眾所周知腫瘤細胞表面有豐富的葉酸受體,其受體數量是正常細胞的數十倍之多,已經成為腫瘤治療的一個新的靶向性靶點[9]。本文采用化學方法將葉酸連接到重組的GST-Apoptin蛋白,以期解決GST-Apoptin進入腫瘤細胞的理論問題,獲得令人滿意結果,并獲得國家發明專利授權。
由于葉酸與GST-Apoptin表面的氨基反應形成酰胺鍵,胰蛋白酶水解蛋白是不完全水解,僅把蛋白水解成小肽。胰蛋白酶水解之后,并不能完全得到游離的葉酸,有部分的葉酸可能還與小肽相連接。GST-Apoptin的胰蛋白酶水解液在358 nm處基本無吸收,以GST-Apoptin胰蛋白酶水解液作為對照,可消除白蛋白的影響,使其不會干擾葉酸偶聯量的測定。因而,采用紫外分光光度法測定葉酸偶聯白蛋白納米粒的葉酸偶聯量。以A對葉酸濃度C進行線性回歸,得回歸直線方程為A=0.019 6±0.002 5,r=0.999 9,葉酸濃度C在2~41 g/mL范圍內線性良好,這不僅證明了葉酸已經連接到GST-Apoptin蛋白上,而且能進行定量分析。優化了葉酸與GST-Apoptin蛋白連接反應條件,并證實葉酸化的GST-Apoptin蛋白對腫瘤細胞具有很好的凋亡誘導功能,為其進一步的深入研究和產業化打下了理論基礎。
[1]Yuan L,Zhang L,Dong X,et al.Apoptin selectively induces the apoptosis of tumor cells by suppressing the transcription of HSP70[J].Tumor Biology,2013(34):577.
[2]LeaderB,Baca QJ,GolanDE.Protein therapeutics:asummary and pharmacological classification[J].Nat Rev Drug Discov,2008(7):21-39.
[3]TavassoliM,Guelen L,Luxon BA,etal.Apoptin:specific killer of tumor cells[J].Apoptosis,2005(10):717.
[4]Zhou S,Zhang M,Zhang J,et al.Mechanisms of Apoptin-induced cell death[J].Med Oncol,2012(29):2985.
[5]Danen-Van OorschotAAAM,ZhangY,Erkeland SJ,etal.The effect of Bcl-2 on Apoptin in 'normal'vs transformed human cells[J].Leukemia,1999,13(Suppl 1):S75-S77.
[6]Li X,Jin N,Mi Z,et al.Antitumor effects of a recombinant fowlpox virus expressing Apoptin in vivo and in vitro[J].Int J Cancer,2006(119):2948-2957.
[7]Lim SN,Zeenathul NA,Mohd AM,et al.Selective apoptosis induction in MCF-7 cell line by truncated minimal functional region of Apoptin[J].BMC Cancer,2013(13):488.
[8]Leliveld SR,Dame RT,Mommaas MA,et al.Apoptin protein multimersform distincthigher-ordernucleoprotein complexes with DNA[J].Nucleic Acid Res,2003(31):4805.
[9]Juan-Juan Yin,Sonali Sharma,Stepan P,et al.Synthesis and Biological Evaluation of Novel Folic Acid Receptor-Targeted,β-Cyclodextrin-Based Drug ComplexesforCancerTreatment[J].PLOS ONE,2013(8):1.
To integrate fusion protein of recombined GST-Apoptin with cancer cell targeting so as to exert its function of peculiar induced tumor cell apoptosis.The paper adopts chemical process to connect folic acid with fusion protein of GST-Apoptin,and experiments show that the coupling rate of folic acid and fusion protein of GST-Apoptin is 6%,and the best coupling condition is 20 mg/mL excited folic acid reacts for 60 minutes in indoor temperature with pH 10.0.Folate-GST-Apoptin bears remarkable function of induced tumor cell apoptosis,and 1.0 μg/mL folate-GST-Apoptin can achieve 50%of tumor cell(KG-1)apoptosis,while having no function of induced tumor cell apoptosis on peripheral blood lymphocyte of normal people.
Apoptosis;Folic acid;Apoptin
2014-06-17)
1005-619X(2015)01-0007-03
10.13517/j.cnki.ccm.2015.01.003
116013沈陽軍區大連療養院桃源療區檢驗科

