運動訓練對成年大(小)鼠大腦海馬形態結構與功能的影響及其機制
方春露,魏 源
運動訓練對成年大(小)鼠大腦海馬形態結構與功能的影響及其機制
方春露,魏 源
目的:探究運動訓練對海馬形態、結構及其功能的干預效果及其分子機制。方法:通過文獻資料法對運動訓練影響大腦海馬神經元的形態變化和生理功能的發揮及其各生理因子信號通路的研究進展進行綜合分析。結果:發現運動訓練可以通過影響神經營養因子而增加海馬神經元突觸的蛋白含量和樹突的長度及密度,進而改善大腦海馬的生理功能,降低各種神經退行性疾病的發生率。結論:運動訓練可以改善海馬結構并有效延緩其機體功能的退行性變化,其作用機制可能與 FMRP 突變通過 DGCR8 基因 3′UTR 相互作用下調報告基因表達有關。
大(小)鼠;海馬神經元形態;海馬生理功能;運動訓練
人體內海馬是一個雙側結構,為弓狀隆起的皮質腦回,位于大腦半球內,側腦室下角的底壁上,全長約5cm ,前端較膨大。哺乳動物的海馬位于側腦室中央部的內側,為彎曲帶狀隆起,左右海馬均由腦的前內側斜向后外側,再彎向后下方。海馬(hippocampus)又稱海馬本部(hippocampus proper)、安蒙氏角(cornu Ammonis)[1]。海馬并非等同于海馬結構,高等哺乳動物海馬結構除包括海馬外,還包括:(1)海馬內側一條窄而呈鋸齒狀的齒狀回(dentate gyrus);(2)海馬下方皮質區的下托(subiculum);(3)在發生上殘留在聠胝體上面的一簿層原皮質的灰被(indusium griseum),又稱聠胝體上回(supracallosal gyrus)。美國比較解剖學家羅默(Romer)根據其奇特形狀,由冠狀面觀測極似海馬,故名海馬[2]。羅斯 (Rose,1927)根據細胞形態的差異將海馬和齒狀回分為hl-h55個區。洛倫特(Lorenter,1934)依纖維長徑又將其分 CA1、CA2、CA3及CA44個區[3]。當前頗多學者將海馬的機體功能視為重要的課題。
1 大腦海馬的生理功能
海馬體如計算機的內存可暫留幾周或幾個月的記憶,便能快速提取。心理學家與神經學家均認為[2]:海馬的損傷通常造成難以組織新的記憶(順行性失憶癥),而且造成難以搜索過去的記憶(逆行性失憶癥),病人HM有組織新的概念記憶的能力。老鼠實驗的研究顯示[2],海馬體的神經元(neurons)有空間放電區,這些細胞稱為地點細胞(place cells),可發電的細胞對大腦移動的方向特敏感。海馬體可能扮演“認知地圖“(環境格局的神經重現)的角色。海馬體對在熟悉環境中尋找捷徑、新的路線發揮重要作用。在倫敦大學(University College London)的研究顯示[2]:相對一般市民,計程車司機的海馬體體積較大,且有經驗的計程車司機的海馬體體積更大。相反,有較大的海馬體是否有助于成為計程車司機仍待研究。印第安那大學(Indiana University)進行的老鼠實驗提出[2]:海馬體的形態跟“性別雙態”(sexual dimorphism)密切相關。
2 運動訓練對成年大(小)鼠海馬神經元形態的影響
成年大(小)鼠海馬齒狀區(GD區)神經再生是一種重構造,每天新顆粒細胞于大腦海馬齒狀區顆粒下層數以千計的生成,且形成的新細胞具體數目受到運動訓練和生理內環境的影響。新顆粒細胞一旦成熟,將從海馬(GD 區)下層向外遷移至邊緣,顆粒細胞的內層(inner granule zone:IGZ)與外層(outer granule zone:OGZ)均存在神經再生。Kuczewski等[4]提出運動訓練影響大腦海馬神經再生,在不同區域的樹突其數量,復雜的程度以及其總長度受運動訓練的影響有所差異,長期運動訓練的成年大(小)鼠海馬齒狀回顆粒細胞外層(the subgranular zone:SGZ)神經元的樹突增生均值、總長度數值與未經常運動訓練的成年大(小)鼠其樹突分支數值、總長度存在顯著性差異(P<0.05)。而顆粒細胞的內層(inner granule zone:IGZ)差異較小。由成年大(小)鼠實驗顯示[5-7]:海馬神經元的樹突可釋放腦源性神經營養因子(BDNF),參加長期運動訓練的成年大(小)鼠BDNF的mRNA水平上調,促進BDNF的生成,而BDNF又可促進突觸發生,且其附加的分泌物對海馬CA3區神經元前體的形成可能有再一次的促進作用,而且能夠加快基底樹突的分化和軸突的分支速度,對增加海馬CA3區神經元樹突的形成有生理選擇性作用,促進海馬DG區顆粒細胞發出新的軸突并向CA3區蔓延[8-9]。CA3神經元的可能作用:為突觸源性生長提供營養方面的支持;促使其與苔狀纖維突觸的連接;被運輸到苔狀纖維的BDNF通過PI3K信號分子機制增加CA3區神經元的腦源性神經營養因子(BDNF)的mRNA基因水平,從而促進CA3區神經元BDNF的樹突突觸的形成[10]。Vaynman、Yau等人[11-12]的研究結果顯示:長期運動訓練可增加海馬CA3區和DG區神經元的突觸蛋白I含量,增加CA3區的錐體神經元樹突的分支速度、以及其長度和密度。
長期的運動訓練可提高成年大(小)鼠大腦海馬CA1區、CA3區和GD區神經元數量的增加速度,改善新生顆粒細胞的樹突形態,增強錐體神經元“樹突網絡”的復雜性,確保神經信號回路的完整性,但長期的運動訓練對海馬CA2區神經元的影響較小,其長度、密度,以及其樹突的網絡結構均無明顯變化。
3 運動訓練對成年大(小)鼠海馬區神經元機體功能的影響
Raffaella等[13]利用陣列技術檢測主觀運動訓練3天、7天、28天后大腦中1 176種基因的表達,通過Taqman探針RT-PCR(逆轉錄與熒光定量PCR生物技術)實驗和核糖核酸酶實驗對選擇性表達的基因進行量化分析,結果發現:在中樞神經系統突觸發育過程中,突觸前遞質釋放裝置的發育與突觸后受體的轉運尤為重要。Raffaella等[13]通過成年大(小)鼠實驗表明:運動訓練通過BDNF介質誘發成年大(小)鼠海馬神經元的塑造,且能加快塑造過程。通過基因表達的時域剖面觀察發現成年大(小)鼠通過長期的運動訓練均可開通特殊的分子信號通道,CaM-K信號系統無論是在急性運動訓練還是慢性運動訓練后均能被激活,但是,MAP-K 系統只有在較長時間的運動訓練后才能被激活。
Famer[14]等人的成年大(小)鼠實驗的結果顯示:經長期觀察運動訓練過程中轉化為神經元的細胞的百分比,發現不同運動訓練的干預方式對細胞分裂的影響力有顯著性差異(P<0.05)。在試管中用成年大(小)鼠的海馬切片為實驗樣品,得知長期運動訓練能加強海馬DG區LTP的能力。他們還通過用water treatment plant sludge (WTPS)實驗法誘導體內產生機體感應程序,結果表明:僅參加過長期運動訓練的小鼠的LTP能夠被感應,如果不斷加強刺激的強度,則可發現參加過運動訓練的成年大(小)鼠比未能參加長期運動訓練的成年小鼠具有更強的STP和LTP作用,從而他們提出:各種刺激的不同頻率達到不同的閾值(較低機體感應得達400hz閾值,較為敏感的機體則閾值只需400hz)。
Vaynman[15]等人通過觀察突觸蛋白I的mRNA水平、冬氨酸受體、鈣或鈣調蛋白的蛋白激酶II和與有絲分裂原激活蛋白激酶等指標的活性,進而探討長期運動訓練對成年大(小)海馬神經元的可塑性的影響,發現BDNF可誘導海馬神經元的再生,其機制可能是通過調節海馬組織中BDNF 的mRNA基因水平,進而影響蛋白的形成,其影響基因轉錄進行調控與神經元突觸功能緊密相關的分子主要有:NMDA-R、CAMKII和MAP-K等分子,它們通過以BDNF信號通路塑造海馬神經元。
由國內外的研究結果可得:BDNF可提高CREB蛋白與突觸蛋白I的mRNA水平、增加其酪氨酸激酶受體(TrkB),長期的運動訓練可使機體通過生物介質的反饋回路提高BDNF對突觸可塑性的影響力度,經過分子或是離子運用信號回饋通路實驗和Taqman探針法反向轉錄為RNA聚合酶反應(rt - pcr)量化實驗,結果顯示:BDNF可調節mRNA水平,其水平可上調也可下調,且深入地研究了環磷酸腺苷反應結合蛋白(cAMP-response element binding proteins,CREB)和突觸蛋白I,這兩種生物介質對神經元機體功能通過上調或是下調基因的轉錄水平與影響突觸傳遞兩種方式調節神經元的形態塑造與機體功能。
4 FMR1基因錯義突變對成年大(小)鼠海馬神經元退行性病變的影響
4.1 FMR1基因與多種神經系統疾病密切相關
脆性 X 智力低下基因(fragile X mental retardation 1,FMR1)負責編碼脆性 X 智力低下蛋白(fragile X mental retardation protein, FMRP)。FMR1基因主要在神經系統中表達,在腦發育過程和神經元突觸可塑性中發揮重要作用[16]。目前已闡明 FMR1 基因全突變及重復元件內 CpG島異常甲基化可引起 FMRP 的表達水平顯著性下調甚至消失[17],從而證實 FMRP 蛋白缺失導致了 FXS 發生。這一結論在 FMR1 基因全缺失的 FXS 患者及該基因敲除小鼠及果蠅中得到證實[18]。隨后發現前突變的攜帶者進入老年后可發展為一種退行性疾病——脆性 X 相關震顫和(或)共濟失調綜合征(fragile X associated tremor/ataxia syndrome FXTAS)。除上述 CGG 異常擴增致病外,還陸續有 FMR1 基因編碼區錯義突變導致 FXTAS 的報道(如圖1,表示FXTAS患者FMR1基因存在一個錯義突變P626L。),其中P626L與I304N 突變被證實導致 FMRP 功能異常[19]。最近研究發現,FMRP 所調控的信號通路異常還可參與自閉癥、精神分裂癥等多種疾病的發生[20-22]。以上研究顯示FMR1基因突變不僅可導致腦發育障礙而且可致神經退行性病變。
4.2 DGCR8-miRNA信號途徑及其在多種神經系統疾病中的作用
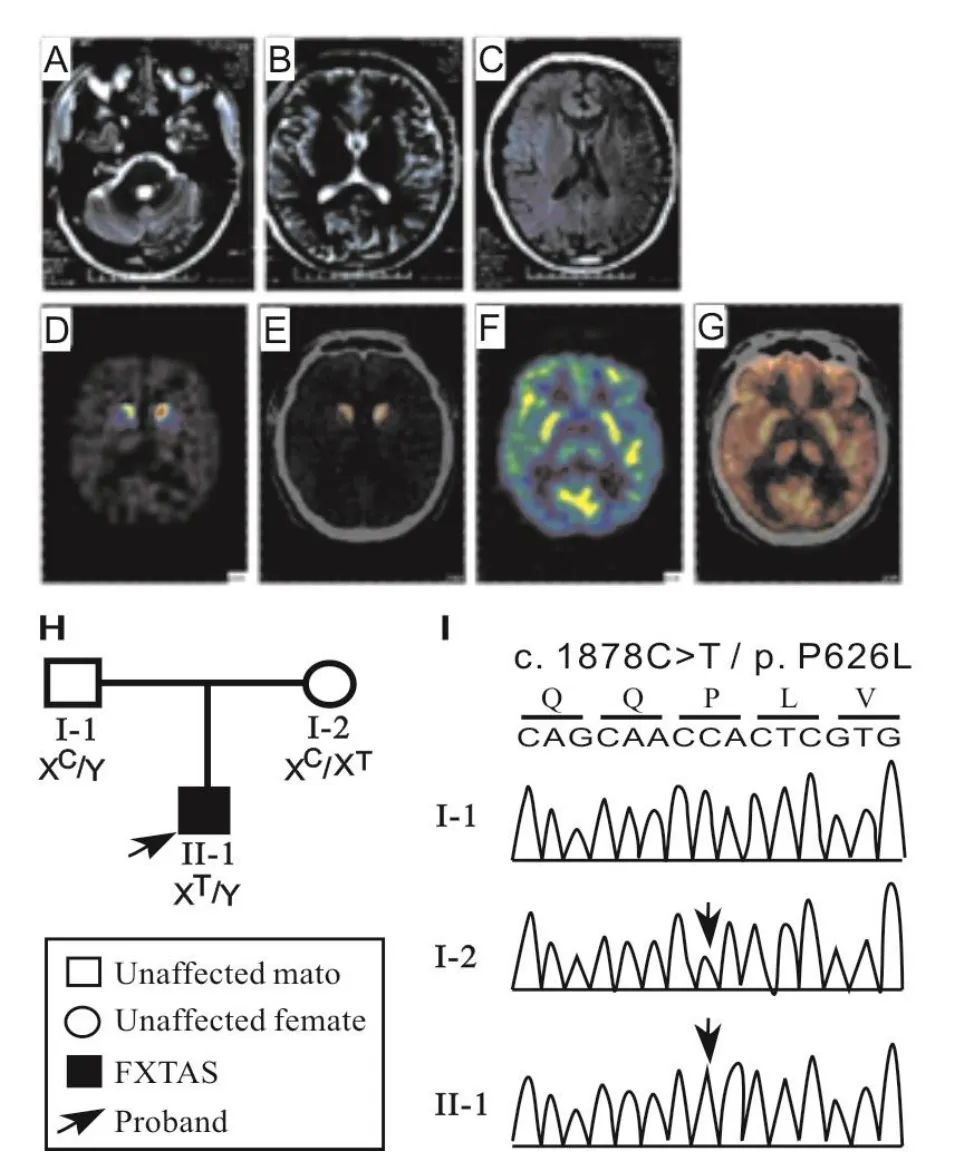
圖1 FXTAS患者FMR1基因存在一個錯義突變P626L
RNA 綁定蛋白 DiGeorge 關鍵區域 8(RNA-binding protein DiGeorge critical region-8,DGCR8)是一種 RNA 結合蛋白,是 microRNA(miRNA)的原始轉錄本(pri-miRNA)加工成前體轉錄本(pre-miRNA)的關鍵因子[23]。DGCR8 與另外一種重要蛋白 DROSHA(RNA 聚合酶 III)組合成DGCR8-DROSHA 復合體,共同完成 miRNA 原始轉錄本的初級加工過程。在這個微處理器復合體(microprocessor complex)中,DGCR8 同時與pri-miRNA 及 DROSHA 結合,是聯系后兩者之間的紐帶[24]。目前已證實,人及小鼠DGCR8基因3′UTR 存在多個保守區(如圖3所示),DGCR8在神經發育中發揮重要作用[25-26]。如圖2所示,FMRP突變通過DGCR8基因基因 3′UTR 相互作用下調報告基因表達。DGCR8 基因表達異常可損害神經元突觸信息傳遞,表現為學習記憶下降、精神分裂癥、帕金森癥等疾病[27-29]。圖4揭示了FMRP-DGCR8-miRNA在FXTAS發病機理中的作用。由此可見,DGCR8 精確表達對維持正常腦功能非常重要。
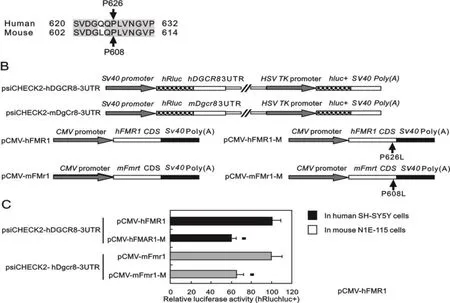
圖2 FMRP突變通過DGCR8基因3′UTR相互作用下調報告基因表達
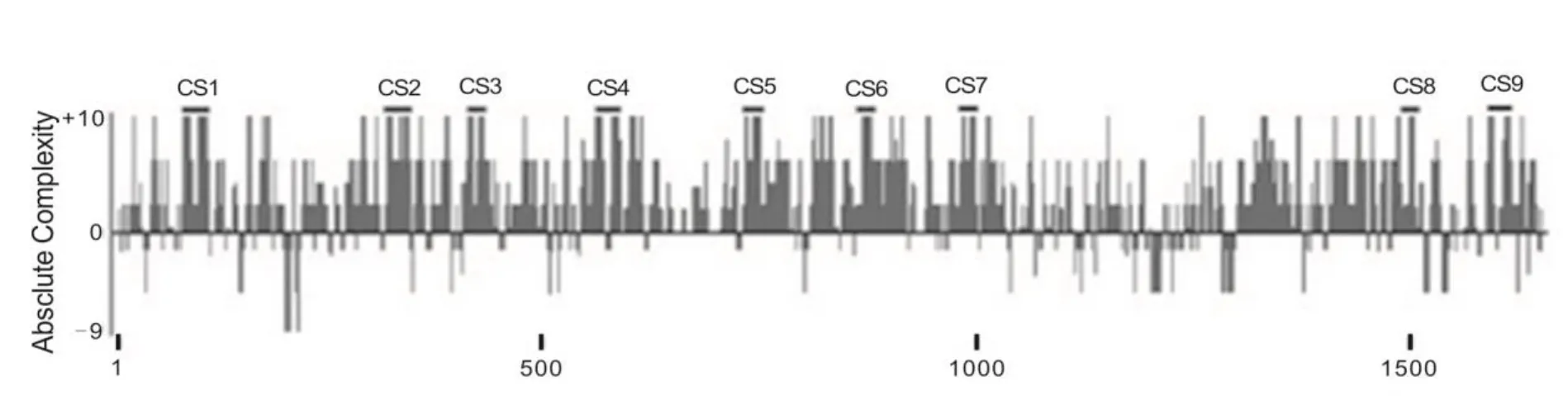
圖3 人及小鼠DGCR8基因3′UTR 存在多個保守區
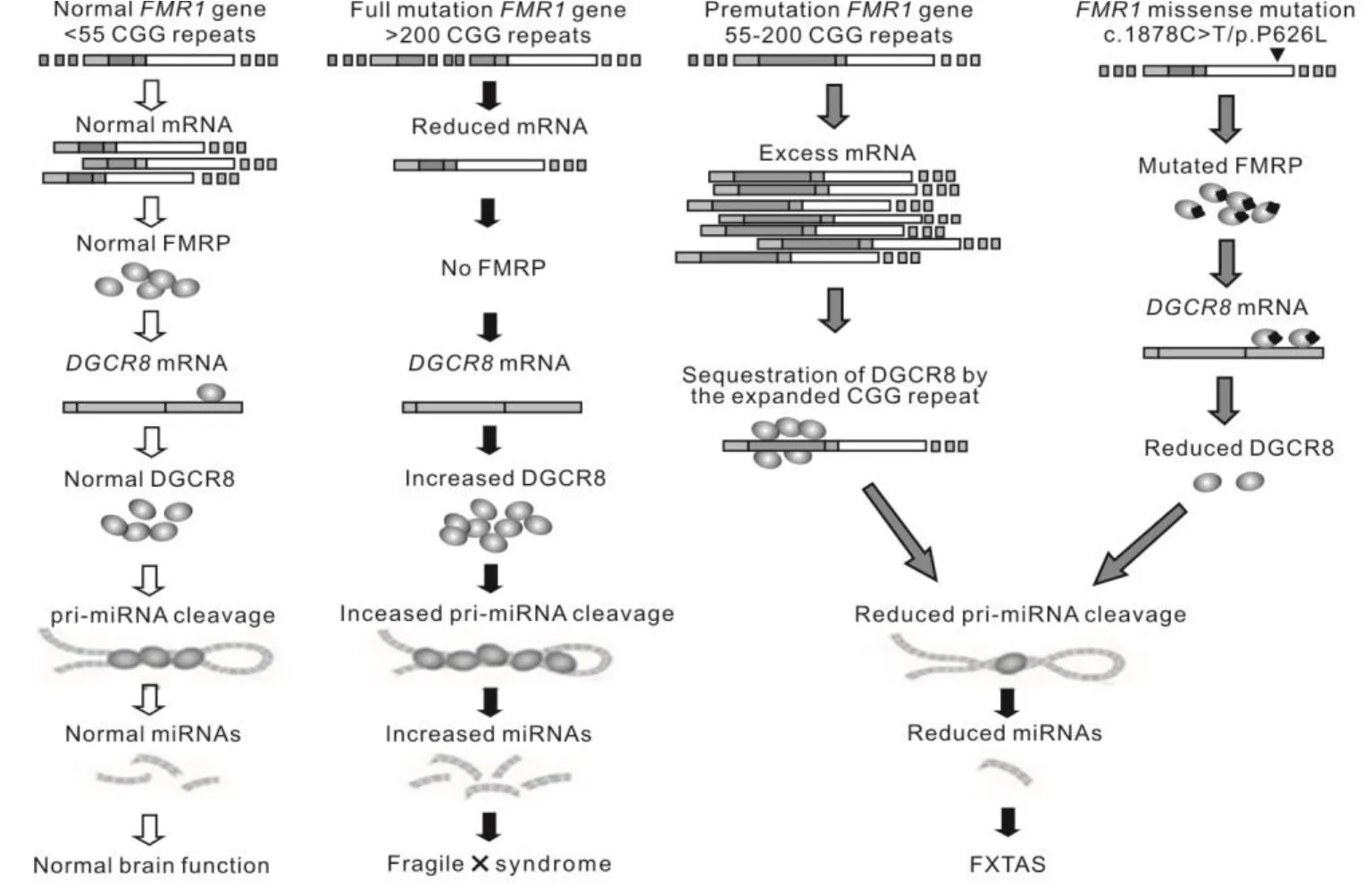
圖4 FMRP-DGCR8-miRNA在FXTAS發病機理中原理圖
4.3 FMRP調控DGCR8表達途徑及其在FXS和FXTAS機制中的可能差異
FMRP 是一種 RNA 結合蛋白,參與調節核蛋白復合物組裝、mRNAs 出核運輸、樹突 mRNAs 定位、RNA 及蛋白翻譯過程調節等過程[43-46]。如圖5所示,FMRP及其突變在轉錄后水平上影響DGCR8基因的表達。FMRP 參與快速調控突觸中新蛋白質合成,以適應頻繁的突觸連接變化,為學習和記憶過程提供物質基礎[18,46]。最近研究發現Fmr1 基因敲除小鼠海馬組織多個miRNAs 表達上調,并證實這些上調 miRNAs 的前體 pre-miRNAs 水平也同樣發生改變,而其相應原始轉錄本 pri-miRNAs水平沒有顯著性變化[48],提示 FMRP 缺失可能通過某種途徑促進pri-miRNAs 加工成pre-miRNAs。
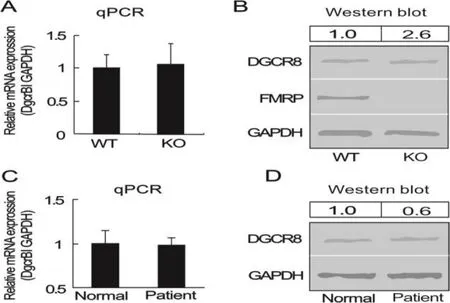
圖5 FMRP及其突變在轉錄后水平上影響DGCR8基因的表達
5 擬待解決的科學問題
(1)長期運動訓練對成年大(小)鼠海馬形態與機體功能的影響有了初步的了解,但需深入地剖析其作用機制。
(2)目前已證實,FMRP 可通過與 mRNA 的相互作用參與其他多個基因的轉錄后調控,但長期運動對FMRP與 DGCR8 基因 mRNA 相互作用的影響尚未見報道。
(3)FXTAS 的神經元退行性病變機制非常復雜,長期運動訓練對其作用機制的影響尚未明晰。
[1] 曾小魯,辜 清,戴惠娟.海馬的形態結構與生理功能[J].生物學通報,1996,31(3):1~3.
[2] 中國科學院 http://wwww.cas.cn/html/Dir/2008/08/11/16/ 05/29.htm.
[3] 新華網 http://news.xinhuanet.com/world/2007-01/17/content_ 5617580.htm.
[4]Kuczewski N, Porcher C, Lessmann V, et al.Activity-dependent dendritic release of BDNF and biological consequences[J]. Mol Neurobiol, 2009, 39: 37~49.
[5]Cohen-Cory S, Kidane AH, Shirkey NJ, et al. Brain-derived neurotrophic factor and the development of structural neuronal connectivity [J]. Dev Neurobiol, 2010,70: 271~288.
[6]Jeanneteau F, Deinhardt K, Miyoshi G, et al. The MAP kinase phosphatase MKP-1 regulates BDNF-induced axon branching [J]. Nat Neurosci , 2010, 13: 1373~1379.
[7]Magarinos AM, Li CJ, Gal Toth J, et al. Effect of brain-derived neurotrophic factor haploinsuffi-ciency on stress-induced remodeling of hippocampal neurons[J].Hippocampus, 2011,21: 253~264.
[8]Santarelli L, Saxe M, Gross C, et al. Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants [J]. Science 301: 805~809.
[9]Castren E. Neurotrophic affects of antidepressant drugs [J].Curr Opin Pharmacol, 2004, 4: 58~64.
[10]Righi M, Tongiorgi E, Cattaneo A. Brain-derived neuro-trophic factor (BDNF) induces dendritic targeting of BDNF and tyrosine kinase B mRNAs in hippocampal neurons through a phosphatidylinositol-3 kinase-dependent pathway [J]. J Neurosci 20:3165~3174.
[11] Vaynman S, Ying Z, Gomez-Pinilla F. Exercise induces BDNF and synapsin I to specific hippocampal subfields [J]. J Neurosci Res 76: 356~362.
[12]Yau SY, Lau BW, Tong JB, et al.Hippocampal neurogenesis and dendritic plasticity support running-improved spatial learning and depression-like beha-viour in stressed rats [J]. PLoS One 6: e24263.
[13]Raffaella Molteni, Zhe Ying and Femando Gomez-Pinilla. Differential effects of acute and chronic exercise on plasticity-related genes in the rat hippocampus revealed by microarray [J]. European Journal of Neuroscience, 2002,16:1107~1116.
[14]J. Farmer, X.zhao, H. Vanpraag,et al. Effects of voluntary exercise on synaptic plasticity and gene expression in the dentate gyrus of adult male sprague-dawley rats in vivo[J]. Neuroscience,2004,124:71~79.
[15]S.Vaynman, Z. Ying and, F. Gomez-pinill,A. Interplay between brain-derived neurotrophic factor and signal transduction modulators in the regulation of the effects of exercise on synaptic-plasticity[J]. Neuroscience,2003,122:647~657.
[16]Sidorov MS, Auerbach BD, Bear MF. Fragile X mental retardation protein and synaptic plasticity. Mol Brain2013 Apr 8; 6(1):15.
[17] Verkerk AJ, Pieretti M, Sutcliffe JS, et al. Identification of a gene(FMR-1) containing a CGG repeat coincident with a breakpoint cluster region exhibiting length variation in fragile X syndrome. Cell 1991.
May 31;65(5): 905~14.
[18] Zhang YQ, Bailey AM, Matthies HJ ,et al.Drosophilafragile X-related gene regulates the MAP1B homolog Futsch to control synaptic structure and function. Cell 2001Nov 30;107(5):591~603.
[19] Zang JB, Nosyreva ED, Spencer CM, et al. A mouse model of the human Fragile X syndrome I304N mutation. PLoS genetics 2009 Dec; 5(12):e1000758.
[20] Fromer M, Pocklington AJ, Kavanagh DH, et al. De novo mutations in schizophrenia implicate synaptic networks. Nature 2014 Jan 22.
[21] Parikshak NN, Luo R, Zhang A, et al.Integrative functional genomics analyses implicate specific molecular pathways and circuits in autism. Cell 2013 Nov21; 155(5): 1008~21.
[22] Steinberg J, Webber C. The roles of FMRP-regulated genes in autism spectrum disorder: single- and multiple-hit genetic etiologies. American journal of human genetics 2013 Nov 7; 93(5): 825~39.
[23] Gregory RI, Yan KP, Amuthan G, et al. The Microprocessor complex mediates the genesis of microRNAs. Nature 2004 Nov 11;432(7014): 235~40.
[24] Roth BM, Ishimaru D, Hennig M. The core microprocessor component DiGeorge syndrome critical region 8(DGCR8) is a nonspecific RNA-binding protein. The Journal of biological chemistry 2013 Sep13;288(37): 26785~99.
[25] Luhur A, Chawla G, Wu YC, et al. Drosha-independent DGCR8/Pasha pathway regulates neuronal morphogenesis. Proceedings of the National Academy of Sciences of the United States of America 2014 Jan 28;111(4): 1421~6.
[26] Petri R, Malmevik J, Fasching L, et al. miRNAs in brain development. Experimental cell research 2014 Feb 1;321(1): 84~9.
[27] Di Carlo V, Grossi E, Laneve P, et al.TDP-43 regulates the microprocessor complex activity during in vitro neuronal differentiation. Molecular neurobiology 2013 Dec;48(3): 952~63.
[28] Ouchi Y, Banno Y, Shimizu Y, et al. Reduced adult hippocampal neurogenesis and working memory deficits in the Dgcr8-deficient mouse model of 22q11.2 deletion-associated schizophrenia can be rescued by IGF2. J Neurosci 2013 May 29;33(22): 9408~19.
[29] Heman-Ackah SM, Hallegger M, Rao MS, et al. RISC in PD: the impact of microRNAs in Parkinson's disease cellular and molecular pathogenesis. Frontiers in molecular neuroscience 2013; 6:40.
[30] Darnell JC, Klann E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci 2013 Nov;16(11): 1530~6.
[31] Zhou Z, Cao M, Guo Y,et al. Fragile X mental retardation protein stimulates ribonucleoprotein assembly of influenza A virus.Nature communications 2014 Feb 10;5: 32~59.
[32] Liu T, Wan RP, Tang LJ, et al. A microRNA profile in Fmr1 knockout mice reveals microRNA expression alterations with possible roles in fragile X syndrome. bioRxiv 2014 Jan 26:doi: 10.1101/002071.
The Research Progress on Effect of Exercise Training On Hippocampus in Adult Brain of Rat/Mouse
FANG Chunlu, WEI Yuan
To investigate the intervention effect of exercise training on the structure and function of hippocampus morphology, and its molecular mechanism. The research methods: by consulting a large number of domestic and foreign literatures to make the comprehensive analysis about the research progress on effect the morphology changes of hippocampus neurons and the exertion of physiological function and each physiological factor of signaling pathways. The result:finding that exercise training can influence brain-derived neurotrophic factor (BDNF) and increase the protein content of hippocampus neuron synapses and dendrites' length and density, and improve brain hippocampus physiological function, reduce the incidence of various neurodegenerative diseases. The conclusion:Exercise training can improve the function of hippocampus structure and delay the degenerative changes of the body function, and its mechanism may be related to FMRP mutation by DGCR8 gene 3 'UTR cut report gene expression related interactions.
The rat/mouse; Morphologic of neurons in hippocampus; Hippocampus function; Exercise training
G804.22
A
1007―6891(2015)04―0036―05
2015-04-27
科技部科研院所專項資金項目“高準確度運動訓練能量消耗模型構建及樣機研制”,項目編號:2013EG145136。
廣州體育學院,廣東 廣州,510500。Guangzhou Sport University, Guangdong Guangzhou, 510500, China.

