促血小板生成素對大鼠局灶性腦缺血-再灌注損傷后JAK2/STAT3信號通路的影響
鄒成林,陳維鈞,孫曉順,方璟,涂軍,趙亞洲
(湖北省荊州市第二人民醫院內一科,荊州 434000)
促血小板生成素對大鼠局灶性腦缺血-再灌注損傷后JAK2/STAT3信號通路的影響
鄒成林,陳維鈞,孫曉順,方璟,涂軍,趙亞洲
(湖北省荊州市第二人民醫院內一科,荊州 434000)
目的 探討促血小板生成素(TPO)對大鼠腦缺血-再灌注損傷的保護作用及相關信號轉導通路機制。方法 采用大腦中動脈線栓法制作大鼠局灶性腦缺血-再灌注損傷模型。將80只雄性SD大鼠隨機分為4組,分別為假手術組、模型對照組、TPO組、TPO+蛋白質酪氨酸激酶抑制藥(AG490)組。于缺血-再灌注前30 min,TPO組給予5 μg·kg-1TPO腹腔注射,TPO+ AG490組于缺血-再灌注前30 min先腹腔內注射5 μg·kg-1TPO,再給予8 μg·kg-1AG490腹腔注射,模型對照組給予等劑量0.9%氯化鈉溶液。再灌注6,12,24,48 h后處死取腦組織、切片,進行蘇木精-伊紅染色、免疫組化染色、Western blotting和細胞凋亡檢測。結果 與模型對照組比較,缺血-再灌注24 h后TPO組細胞凋亡數減少[(67.50±9.37)比(40.20±7.47)個],Bcl-2、蛋白質酪氨酸激酶2(JAK2)及信號轉導和轉錄激活因子3(STAT3)蛋白表達水平升高,分別為(35.40±7.39)比(78.70±9.75),(35.68±6.75)比(62.35±7.53),(25.40±9.45)比(55.36±9.69),均差異有統計學意義(P<0.05)。與TPO組比較,TPO+AG490組Bcl-2、JAK2及STAT3蛋白表達水平降低,分別為(78.70±9.75)比(55.40±9.35),(62.35±7.53)比(40.68±5.89),(55.36±9.69)比(30.40±9.39),細胞凋亡數增多[(40.20±7.47)比(55.23±7.65)個],均差異有統計學意義(P<0.05)。結論 TPO可降低缺血-再灌注所誘導的細胞凋亡,其機制可能與激活JAK2/STAT3信號轉導通路上調Bcl-2有關。
促血小板生成素;大鼠;損傷,缺血-再灌注;細胞凋亡;蛋白質酪氨酸激酶2與轉導激活因子3;Bcl-2
蛋白質酪氨酸激酶2與轉導激活因子3(Janus kinase 2 and signal transducer and activator of transcription 3,JAK2/STAT3)途徑廣泛參與細胞的增殖、分化、凋亡等過程。近年研究表明,JAK2/STAT3途徑參與腦缺血的病理過程,但該途徑的激活與缺血導致的神經細胞存活及凋亡之間的具體關系尚不十分清楚,對其在腦缺血中的作用結論不一。促血小板生成素(thrombopoietin,TPO)是重要的造血生長因子,主要調控巨核細胞的增殖和血小板生成,其通過與細胞膜上的TPO受體(TPO-R,C-mpl)結合,形成同源二聚體,激活與之結合的蛋白質酪氨酸激酶(Janus kinase 2,JAK2),引起受體胞內區酪氨酸殘基的磷酸化,從而激活下游STAT、 磷脂酰肌醇3 激酶(phosphatidylinositol 3 kinase,PI3K)等多條信號轉導通路。楊默等[1]首次證實神經系統中存在TPO受體(C-mpl),能促經神經細胞生長,對抗細胞凋亡。夏文杰等[2]在對體外TPO的神經保護作用的研究中發現TPO通過激活神經細胞PI3K/蛋白激酶B(protein kinase B,PKB)信號通路,拮抗細胞凋亡,具有保護神經祖細胞C17.2的作用。TPO是否通過激活JAK2/STAT3途徑參與腦缺血的病理過程,其機制尚不十分明確。
1 材料與方法
1.1 動物 健康雄性斯潑累格·多雷(Sprague Dawley,SD)大鼠80只,體質量250~290 g,華中科技大學同濟醫學院實驗動物中心提供,合格證號:4200600335,許可證號:SCXK[鄂]2011-0007,實驗動物級別:SPF。動物以標準飼料喂養,自由攝食水,光照12 h,黑暗12 h,室溫20~26 ℃條件下飼養1周后實驗。
1.2 藥品與試劑 磷酸化JAK2多克隆抗體(批號:K0303)、磷酸化STAT3單克隆抗體(批號:C1303)、小鼠抗Bcl-2單克隆抗體(一抗)(批號:G2804)均購自Santa Cruz,CA公司,辣根過氧化物酶標記的山羊抗兔/兔抗小鼠IgG及Western blotting檢測試劑盒(美國Upstate Biotechnology,InC,批號:lotL1609),小鼠抗大鼠β-actin抗體(批號:20070711)、10%水合氯醛(批號:071219)、SABC試劑盒(批號:SA1025)、DAB顯色劑(批號:41281194)均購自武漢博士德生物工程有限公司,原位末端轉移酶標記技術(TdT-mediated dUTP nick end labeling,TUNEL)檢測試劑盒(北京中杉公司,批號:10490800),重組人血小板生成素注射液(沈陽三生制藥股份有限公司,批號:S20050049),蛋白質酪氨酸激酶2抑制藥AG490(Janus kinase 2 inhibitor AG490,碧云天生物科技有限公司,批號:116K1482)。
1.3 主要儀器與設備 PE9700型PCR儀(美國PE公司),PowerPac型電泳儀(美國BioRad公司),DYCP-31B型瓊脂糖水平電泳槽(北京六一儀器廠),2000型凝膠成像分析系統(東勝公司),CX31-72C02型實體顯微鏡(奧林巴斯),Metamorph Imaging SystemV4.6計算機圖像分析軟件(美國UIC公司)。
1.4 動物模型及制備 采用LONGA等[3]的大腦中動脈線栓法制備大鼠局灶性腦缺血-再灌注模型。按隨機數字表法將大鼠分為假手術組、模型對照組、TPO組、TPO+AG490組(各20只),觀察時間點為缺血-再灌注后6,12,24,48 h。于缺血-再灌注前30 min,TPO組給予TPO 5 μg·kg-1腹腔注射,TPO+ AG490組于缺血-再灌注前30 min先腹腔內注射TPO 5 μg·kg-1;再給予AG490 8 μg·kg-1腹腔注射;模型對照組給予等劑量0.9%氯化鈉溶液;假手術組大鼠不進行缺血-再灌注處理。
1.5 免疫組化染色檢測JAK2、STAT3及Bcl-2蛋白表達 4組大鼠至指定時間點處死后取腦組織,常規固定、石蠟包埋、切片,進行SABC法免疫組化染色。胞質有棕褐色顆粒者為陽性細胞。每張切片在缺血區隨機計數5個高倍鏡視野(×400)中的陽性細胞數,取平均值為JAK2、STAT3、Bcl-2陽性細胞數。
1.6 Western blotting法檢測蛋白表達量 磷酸化JAK2、STAT3及Bcl-2蛋白表達Western blotting檢測按照說明書操作。4組大鼠至指定時間點處死后取腦組織,在冰上分離缺血側大腦組織,勻漿,提取蛋白,蛋白定量,用化學發光法記錄結果。蛋白條帶進行相對密度掃描并分析,計算各條帶的灰度值,以內參照β-actin校正后的灰度值比值表示蛋白表達量。
1.7 TUNEL原位凋亡染色法檢測細胞凋亡 按照原位TUNEL試劑盒說明書操作。結果判定:細胞核中有棕黃色顆粒者為陽性細胞。每張切片在缺血區隨機計數5個高倍鏡視野(×400)中的陽性細胞數,取平均值為該切片凋亡細胞數。
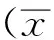
2 結果
2.1 腦組織蘇木精-伊紅(hematoxylin-eosin,HE)染色檢查 模型對照組缺血2 h再灌注24 h后,大鼠缺血側大腦半球明顯腫脹,TPO組腫脹較輕。腦組織切片HE染色顯示:假手術組皮質無壞死細胞,神經元數量多;模型對照組皮質缺血中心神經元數量稀疏,可見大量變性及壞死的神經細胞;TPO組缺血中心區變小,邊緣區神經細胞變性壞死減少,多數存活細胞形態相對正常;TPO+AG490組缺血中心區較TPO組大,邊緣壞死細胞多。
2.2 原位細胞凋亡檢測 模型對照組缺血側可見較多的陽性細胞,以缺血-再灌注24 h后最明顯;假手術組偶見個別陽性細胞;TPO組及TPO+AG490組缺血區陽性細胞數目減少,與模型對照組比較差異有統計學意義(P<0.05);TPO+AG490組缺血區陽性細胞數目較TPO組增加,與TPO組比較差異有統計學意義(P<0.05)。見表1。
表1 4組大鼠缺血-再灌注24 h凋亡細胞數的比較


與模型對照組比較,*1P<0.05;與TPO組比較,*2P<0.05
Compared with model control group,*1P<0.05;compared with TPO group,*2P<0.05
2.3 腦組織免疫組化染色檢測 陽性細胞主要分布在細胞質內,細胞質/胞膜有棕黃色物質沉積為陽性細胞。模型對照組大鼠缺血周邊區可見較多陽性細胞表達,與假手術組相比,差異有統計學意義(P<0.05)。模型對照組、TPO組、TPO+AG490組大鼠再灌注6 h時Bcl-2、JAK2、STAT3表達增強,24 h達峰值,之后表達出現下降。與模型對照組比較,TPO組各時間點Bcl-2、JAK2、STAT3陽性細胞均明顯增加,且差異有統計學意義(P<0.05)。與TPO組比較,TPO+ AG490組各時間點陽性細胞數減少,差異有統計學意義(P<0.05)。見表2。
2.4 腦缺血-再灌注損傷后腦組織P-JAK2、P-STAT3及Bcl-2 Western blotting檢測 假手術組未見明顯P-JAK2、P-STAT3、Bcl-2蛋白的表達,TPO組腦組織P-JAK2、P-STAT3、Bcl-2蛋白表達明顯增多,24 h達峰值,之后表達出現下降,與模型對照組比較差異有統計學意義(P<0.05),TPO+AG490組P-JAK2、P-STAT3、Bcl-2蛋白的表達減少,與TPO組比較差異有統計學意義(P<0.05)。見表3,圖1。
3 討論
TPO是調節血小板和巨核細胞系最主要的造血生長因子[4]。研究發現,TPO不僅參與造血的調控,對神經系統也具有保護作用,它們通過動員骨髓的內源性干細胞,或通過其抗凋亡作用,在神經損傷中發揮一定的作用。TPO可通過減少基質金屬蛋白酶9(Matrix Metallopeptidase 9,MMP-9)的表達保護大腦和改善感覺運動功能[5]。同時陳美苑等[6]發現,外源性TPO能夠在腦缺血發生早期起到神經保護的作用,減輕缺氧缺血導致的腦功能損傷,但其機制尚不明確。本研究采用TUNEL法檢測細胞凋亡發現,模型對照組缺血側可見較多的陽性細胞,而TPO組缺血區陽性細胞數目減少,與模型對照組比較差異有統計學意義(P<0.05)。結果顯示,TPO可能通過抑制細胞凋亡而減輕缺血-再灌注所致腦細胞損傷,但其是通過何種途徑,目前尚不十分清楚。
表2 4組大鼠腦缺血-再灌注損傷后各時間點Bcl-2、JAK2、STAT3的表達


與模型對照組同時間點比較,*1P<0.05;與TPO組同時間點比較,*2P<0.05
Compared with model control group at same time point,*1P<0.05;compared with TPO group at same time point,*2P<0.05
表3 4組大鼠腦組織再灌注損傷后24 h P-JAK2、P-STAT3及Bcl-2蛋白相對表達量


組別P-JAK2P-STAT3Bcl-2假手術組 0 0 0模型對照組0.23±0.040.24±0.020.31±0.05TPO組0.89±0.06*10.87±0.03*10.73±0.08*1TPO+AG490組0.58±0.05*20.48±0.03*20.56±0.04*2
與模型對照組比較,*P<0.05;與TPO組比較,*2P<0.05
Compared with model control group,*1P<0.05;compared with TPO group,*2P<0.05

A.假手術組;B.TPO組;C.TPO+AG490組;D.模型對照組
圖1 4組大鼠腦組織再灌注損傷后24 h P-JAK2、P-STAT3及Bcl-2蛋白的表達Western blotting檢測結果
A.sham operation group;B.TPO group;C.TPO and JAK kinase inhibitor (AG490) group;D.model control group
Fig.1 Western blotting analysis on the protein expression of P-JAK2, P-STAT3 and Bcl-2 among four groups of rats 24 hours after cerebral ischemia reperfusion
本研究通過免疫組化檢測大鼠缺血側皮層JAK2、STAT3蛋白的表達,結果顯示,模型對照組、TPO組再灌注6 h時JAK2、STAT3表達增強,24 h達峰值,之后表達出現下降。同時本研究利用Western blotting方法檢測,結果顯示,在假手術組大鼠腦組織中未出現磷酸化JAK2及STAT3蛋白表達,腦缺血-再灌注損傷6 h缺血周邊區腦組織有少量磷酸化JAK2及STAT3蛋白表達,24 h達峰值。這與免疫組化法檢測JAK2及STAT3蛋白表達在時間動態變化上呈一致性,提示腦缺血后JAK2、STAT3表達及活化在缺血誘導的神經細胞死亡中起一定的作用。SUZUKI等[7]研究結果顯示,大腦局部缺血-再灌注后缺血皮質及紋狀體神經元可檢測到磷酸化STAT3蛋白表達,且再灌注24 h磷酸化STAT3蛋白表達達峰值,此后隨再灌注時間延長磷酸化STAT3蛋白表達漸減少。而WEN等[8]用免疫蛋白印跡法研究雄性黑鼠局灶性腦缺血損傷后磷酸化STAT3表達變化,結果顯示,缺血周邊區磷酸化STAT3蛋白在腦缺血6 h顯著增加。這與本研究結果一致,但缺血-再灌注腦損傷引起JAK2/STAT3信號通路的激活對神經細胞的確切作用,目前還沒有一致的說法。
BROWN等[9]研究顯示在腦缺血后STAT1和STAT3表達上調,而在剔除STAT1基因后,則對腦缺血具有一定的保護作用。SATRIOTOMO等[10]研究顯示,腦缺血-再灌注損傷后磷酸化JAK2和STAT3蛋白在缺血半暗帶表達增強,并參與促進神經細胞的死亡,利用STAT3小分子干擾RNA(siRNA)或JAK2抑制藥(AG490)能夠抑制腦缺血后磷酸化JAK2和磷酸化STAT3的表達,從而減少神經細胞凋亡,縮小腦梗死范圍。JUSTICIA等[11]也證實在腦卒中后JAK2/STAT3信號被激活,并參與神經損傷的病理過程,加重腦卒中后進一步的損傷。而BAKER等[12]在研究TPO對缺血-再灌注小鼠心肌的作用時發現,TPO對損傷的心肌細胞具有抗凋亡的保護作用,JAK2抑制藥(AG490)能使該保護作用消失。YAMASHITA等[13]利用IL-6受體單克隆抗體阻斷IL-6信號轉導,結果顯示,小鼠在缺血皮質半暗帶磷酸化STAT3表達顯著減少,神經凋亡細胞數明顯增多,梗死面積增加,神經功能缺損惡化。
本研究通過免疫組化及Western blotting方法檢測JAK2、STAT3、Bcl-2蛋白表達,與模型對照組比較,TPO組各時間點JAK2、STAT3及Bcl-2陽性細胞均明顯增加,差異有統計學意義(P<0.05)。通過person相關分析發現TPO組Bcl-2蛋白表達與JAK2、STAT3蛋白表達在各時間點呈正相關,而當給予JAK2抑制藥AG490后,JAK2、STAT3及Bcl-2蛋白表達減少,且細胞凋亡數增加,推測TPO可能通過激活JAK2/STAT3通路,上調Bcl-2而減少細胞凋亡。研究結果顯示,缺血預處理可以通過JAK2/STAT3信號通路活化STAT3,上調抗凋亡基因Bcl-2,下凋促凋亡基因Bax,促進缺血后心肌收縮功能的恢復,減少心肌細胞凋亡和心肌梗死面積[14]。KANDA等[15]研究顯示磷酸化STAT3(p-STAT3)可作用于細胞核內特異的DNA結合位點,直接或間接地上調抑制凋亡基因如Bcl-2、Bcl-XL等表達,從而調控細胞增殖和凋亡。
綜上所述,TPO是否通過激活JAK2/STAT3途徑,上調Bcl-2,減輕腦細胞凋亡,在腦缺血中與其他信號轉導途徑之間是否有交叉作用等均還未研究清楚,此外該途徑與腦缺血后神經元發生和分化之間是否存在關聯也有待進一步研究。
[1] 楊默,夏文杰,李桂霞,等.中樞神經系統表達TPO受體的初步研究[J].中國實驗血液學雜志,2004,12(4):494-497.
[2] 夏文杰,項鵬,楊默,等.血小板生成素thrombopoietin對神經保護作用的體外研究[J].熱帶醫學雜志,2007,7(7):622-625.
[3] LONGA E Z,WEINSTEIN P R,CARLSON S,et al.Rev-ersible middle cerebralartery occlusion without crainiectomy in rat [J].Stroke,1989,20(1):84-91.
[4] GEDDIS A E,LINDEN H M,KAUSHANSKY K.Thrombo-poietin:a pan-hematopoietic cytokine [J].Cytokine Growth Factor Rev,2002,13(1):61-73.
[5] ZHOU J,LI J,ROSENBAUM D M,et al.Thrombopoietin protects the brain and improves sensorimotor functions:reduction of stroke-induced MMP-9 upregulaion and blood-brain barrier injury [J].J Cereb Blood Flow Metab,2011,31(3):924-933.
[6] 陳美苑,劉青,曾志,等.TPO對新生大鼠缺血缺氧性腦損傷的保護作用[J].暨南大學學報(自然科學與醫學版),2014,35(1):37-44.
[7] SUZUKI S,TANAKA K,NOGAWA S,et a1.Phosphory-lation of signal transducer and activator of transcription-3(State 3) after focal cerebral ischemia in rats [J].Exp Neurol,2001,170(1):63-71.
[8] WEN T C,PENG H,HATA R,et al.Induction of phos-phorylated of Stat 3 following focal cerebral ischemia in mice [J].Neurosci Lett,2001,303(3):153-156.
[9] BROWN S,ZEIDLER M P,HOMBRIA J E.JAK-STAT signaling in Drosophila controls cell motility during germ cell migration [J].Dev Dyn,2006,235(4):958-966.
[10] SATRIOTOMO I,BOWEN K K,VEMUQANTI R.JAK2 and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia [J].J Neurochem,2006,98(5):1353-1368.
[11] JUSTICIA C,GABRIEL C,PLANAS A M.Activation of the JAK/STAT pathway following transient focal cerebral ischemia:signaling through Jak1 and Stat3 in astrocytes [J].Glia,2000,30(3):253-270.
[12] BAKER J E,SU J,HSU A,et al.Human thrombopoietin reduces myocardial infarct size,apoptosis,and stunning following ischaemia/reperfusion in rats [J].Cardiovasc Res,2008,77(1):44-53.
[13] YAMASHITA T,SAWAMOTO K,SUZUKI S,et al.Block-ade of interleukin 6 signaling aggravates ischemic cerebral damage in mice:possible involvement of STAT3 activation in the protection of neurons [J].J Neurochem,2005,94(2):459-468.
[14] HATTORI R,MAULIK N,OTANI H,el a1.Role of STAT3 in ischemia preconditioning [J].J Mol Cell Cardiol,2001,33(1):1929-1936.
[15] KANDA N,SENO H,KONDA Y,et al.STAT3 is cons-titutively activated and supports cell survival in association with survivin expression in gastric cancer cells [J].Oncogene,2004,23(28):4921-4929.
DOI 10.3870/yydb.2015.08.008
Influence of Thrombopoietin on JAK2/STAT3 Signal Transduction Pathway in Focal Cerebral Ischemia-Reperfusion Injury of Rats
ZOU Chenglin, CHEN Weijun, SUN Xiaoshun, FANG Jing, TU Jun, ZHAO Yazhou
(DepartmentofInternalMedicine,theSecondPeople'sHospitalofJingzhou,HubeiProvince,Jingzhou434000,China)
Objective To investigate protective effects of thrombopoietin (TPO) on cerebral model control in rats and associated signal transduction pathway. Methods Thread embolism was performed to generate cerebral ischemia-reperfusion rat model.Eighty male SD rats were randomly divided into sham operation group, model control group, TPO group, TPO and Janus kinase inhibitor (AG490) group.Before 30 min of ischemia-reperfusion, TPO group was given TPO (5 μg·kg-1) by intraperitoneal injection, TPO + AG490 group was given TPO (5 μg·kg-1) before 30 min of ischemia reperfusion, then given AG490 (8 μg·kg-1), and model control group were given the same dose of 0.9% sodium chloride solution.The observation time points were 6, 12, 24, and 48 h after ischemia reperfusion.Immunohistochemical staining and Western blotting were used to measure the protein levels of Bcl-2, JAK2 and signal transducer & activator of transcription (STAT3).TdT-mediated dUTP nick end labeling (TUNEL) was used to detect apoptosis. Results Compared with model control group, the number of apoptotic cells were significantly reduced [(67.50±9.37)vs.(40.20±7.47)], the expression levels of Bcl-2, JAK2 and STAT3 protein were significantly increased [(35.40±7.39)vs.(78.70±9.75); (35.68±6.75)vs.(62.35±7.53); (25.40±9.45)vs.(55.36±9.69), respectively] 24 h after ischeia reperfusion in the TPO group (allP<0.05).Compared with the TPO group, the Bcl-2, JAK2 and STAT3 protein levels were significantly decreased in TPO and AG490 group [(78.70±9.75)vs.(55.40±9.35); (62.35±7.53)vs.(40.68±5.89); (55.36±9.69)vs.(30.40±9.39), respetively], and the number of apoptotic cells was significantly increased [(40.20±7.47)vs.(55.23±7.65)] (allP<0.05). Conclusion TPO can inhibit cell apoptosis after ischemia-reperfusion injury, the mechanism might be related to the activation of JAK2/STAT3 signal transduction pathway through raising the expression of Bcl-2 gene.
Thrombopoietin;Rats;Injury, ischemia-reperfusion;Apoptosis;Janus kinase 2/signal transducer and activator of transcription;Bcl-2
2014-07-25
2014-10-13
鄒成林(1981-),湖北宜昌人,男,主治醫師,碩士,研究方向:腦血管疾病發病機制及治療。電話:0716-8223833,E-mail:38716711@qq.com。
R973.6; R965
A
1004-0781(2015)08-1019-05

