乙酰半胱氨酸顆粒在健康人體的生物等效性研究
李杰,劉明周,黎維勇,賈萌萌,周穎,李虎群
(1.華中科技大學同濟醫學院附屬協和醫院藥劑科,武漢 430022;2.武漢大學基礎醫學院,武漢 430071)
乙酰半胱氨酸顆粒在健康人體的生物等效性研究
李杰1,劉明周2,黎維勇1,賈萌萌1,周穎1,李虎群1
(1.華中科技大學同濟醫學院附屬協和醫院藥劑科,武漢 430022;2.武漢大學基礎醫學院,武漢 430071)
目的 建立人血漿乙酰半胱氨酸濃度測定方法,研究乙酰半胱氨酸顆粒在健康人體內的相對生物利用度與生物等效性。 方法 采用二制劑三周期自身對照完全三交叉試驗設計,其中每位受試者有一周期不服藥,健康男性受試者24例分別單劑量口服乙酰半胱氨酸受試制劑或參比制劑0.6 g。高效液相色譜串聯質譜法測定血漿乙酰半胱氨酸濃度,應用DAS 3.0版統計軟件計算藥動學參數并評價兩種制劑生物等效性。結果 單劑量口服乙酰半胱氨酸顆粒受試制劑和參比制劑0.6 g的主要藥動學參數:AUC0→t分別為(8 547.64±2 860.04)和(8 783.07±4 042.10) μg·h·L-1;AUC0→∞分別為(9 481.64±3 444.76)和(9 540.51±4 239.30) μg·h·L-1;Cmax分別為(1 994.39±726.42)和(2 090.27±885.46) μg·L-1;tmax分別為(1.18±0.60)和(1.13±0.53) h;t1/2分別為(8.60±3.76)和(7.75±5.01) h;相對生物利用度以AUC0→t和AUC0→∞計算分別為(107.00±43.30)%和(106.50±40.10)%。結論 乙酰半胱氨酸顆粒兩種制劑具有生物等效性。
乙酰半胱氨酸顆粒;生物利用度,相對;生物等效性;液相色譜串聯質譜法
N-乙酰半胱氨酸(N-acetylcysteine,以下簡稱NAC)是L-半胱氨酸乙酰化后的產物,它通過分解黏蛋白復合物、核酸,將痰中的膿性成分及其他黏液分泌物從黏稠變為稀薄而發揮黏液溶解作用[1]。作為一種非處方藥,乙酰半胱氨酸臨床主要作為黏痰溶解藥,適用于手術后、急性和慢性支氣管炎、支氣管擴張、肺結核、肺炎、肺氣腫等引起的黏稠分泌物過多所致的咯痰困難[2]。筆者在本實驗中建立了靈敏準確的高效液相串聯質譜方法(liquidchromatography-tandemmassspectrometry,LC-MS/MS)以氘代乙酰半胱氨酸(d3-N-acetylcy-steine,以下簡稱d3-NAC)為內標測定人血漿中的乙酰半胱氨酸,評價乙酰半胱氨酸顆粒受試制劑及參比制劑的生物利用度及生物等效性,為考核受試制劑的藥品質量提供科學依據。
1 儀器與試藥
1.1 儀器LC-MS/MS儀器:包括Agilent1200型高效液相色譜儀(含四元梯度泵、在線脫氣機、自動進樣器、柱溫箱,美國Agilent公司);API4000型三重四極桿串聯質譜儀(配備電噴霧離子源,美國AppliedBiosystemSciex公司)。數據處理系統為Analyst1.5.2。
1.2 藥品與試劑 乙酰半胱氨酸顆粒受試制劑(批號:120302,規格:每袋0.1g,桂林華信制藥有限公司);乙酰半胱氨酸顆粒參比制劑(商品名:富露施?,海南贊邦制藥有限公司,規格:每袋0.1g,批號:C1311K12)。NAC標準品(批號:140671-200501,含量:100%,中國食品藥品檢定研究院);d3-NAC標準品(內標,批號:1-JUZ-124-3,含量:97%,TorontoResearchChemicalsInc.);二硫代蘇糖醇(以下簡稱DTT,批號:YY11175,含量>99%,上海原葉生物科技有限公司)。
1.3 色譜條件與質譜條件
1.3.1 色譜條件 色譜柱:Polar-RPC18(2.1mm×100mm,5μm;WelchMaterialInc.);預柱:PhenomenesSecurityGuardTMC18(4mm×3.0mm,5μm);流動相:0.1%甲酸水溶液-乙腈=16:84;流速為0.3mL·min-1;柱溫為40 ℃;進樣體積為5μL。
1.3.2 質譜條件 選用電噴霧離子化源,在正離子電離模式下,采用多反應監測的質譜掃描方式,測定NAC和內標的檢測離子分別為:m/z 163.9→122.0和m/z157.0→123.0。
1.4 溶液配制
1.4.1 對照品工作液的配制 精密稱取NAC標準品適量,以50%甲醇溶解,定量配制成100.0,500.0,1 000.0,3 000.0,10 000.0,25 000.0,50 000.0μg·L-1NAC標準工作溶液及濃度為300.0,5 000.0,40 000.0μg·L-1NAC質控工作溶液,置-20 ℃冰箱,待用。
1.4.2 內標工作液的配制 精密稱取d3-NAC標準品適量,給予50%甲醇溶解,定量配制成濃度為1.00mg·L-1的內標工作液,置-20 ℃冰箱,待用。
1.4.3DTT溶液的配制 精密稱取DTT標準品適量,以50%甲醇溶解,定量配制成濃度為46.28g·L-1的DTT溶液,置-20 ℃冰箱,待用。
1.5 血漿樣品處理 精密取血漿200μL至2mL離心管中,加入30μL內標工作液液及50μL,46.28g·L-1DTT溶液,混勻,放置5min,加400μL甲醇沉淀蛋白,渦旋混勻1min,于15 000r·min-1(r=3cm)、4 ℃離心5min,取上清液100μL至2mL離心管中,加入0.05%甲酸-溶液200μL,混勻,取5μL進樣測定,記錄色譜圖。
1.6 臨床試驗
1.6.1 受試者選擇 按照《藥物臨床試驗管理規范(GCP)指導原則》設計試驗方案,并獲得華中科技大學同濟醫學院醫學倫理委員會批準招募健康男性受試者,最終24例健康男性受試者參加了本次試驗。年齡(24.67±3.27)歲,體重指數(21.40±1.39)kg·(m2)-1,體檢證明心、肺、肝、腎功能正常。受試者試驗開始前兩周及試驗期間未服用其他藥物,無藥物濫用史及煙酒嗜好,自愿參加試驗并簽署知情同意書。
1.6.2 給藥方案與樣品采集NAC為內源性生理活性物質,在對血樣進行定量分析時采用了基線扣除法,即將測得的內源性和外源性化合物的總量減去未給藥時測得的內源性化合物的量。為此本次研究采用二制劑三交叉試驗設計,每名受試者均有一周期不服藥而僅采集空白血樣,洗凈期為7d,每周期均在固定時間給藥采血以排除生理節律對內源性NAC的影響。乙酰半胱氨酸顆粒最大臨床使用劑量為每次0.6g,每日1或2次[3-4]。由于NAC為內源性物質,本底濃度為20~30μg·L-1,鑒于本品消除快,若服用劑量較低,則吸收相早期和消除相末期的血樣點的血藥濃度可能接近本底濃度而出現誤差;且Ⅰ期臨床藥代顯示NAC口服制劑在劑量范圍200~3 200mg·(m2)-1呈線性藥代特征[5-6]。為準確檢測血藥濃度,科學評價生物等效性,選用單次服用0.6g作為本次生物等效性試驗的服用劑量。24例健康男性受試者隨機分為3組,每組8例,分別一次口服乙酰半胱氨酸顆粒受試制劑(A)、參比制劑(B) 或不服藥(C),兩次間隔7d。受試者試驗前禁食12h,不禁水,于次日晨空腹口服受試制劑、參比制劑0.6g或不服藥,2h后方可飲水,4h后統一進食低脂清淡飲食。于服藥前(0h)及服藥后10,20min,0.5,0.75,1.0,1.5,2.0,3.0,4.0,6.0,8.0,10.0,12.0,24.0h自肘靜脈采血3mL,置肝素化試管內,離心[3 500r·min-1(r=3cm),4 ℃,5min]分離血漿,置-70 ℃冰箱,待測。
1.7 統計學方法 采用DAS3.0版軟件計算和統計藥動學參數,統計分析先將濃度-時間曲線下面積(AUC)和峰濃度(Cmax)數據進行對數轉換,然后進行方差分析與雙單側t檢驗處理,達峰時間(tmax)用非參數法進行檢驗,評價受試與參比制劑的生物等效性。
2 結果
2.1 方法學確證結果
2.1.1 特異性 在本試驗所采用的色譜與質譜條件下,分別測定受試者空白血漿、空白血漿中加入NAC對照品溶液及內標d3-NAC溶液、受試者服藥后2h血樣。結果如圖1所示,NAC及內標保留時間分別為1.64,1.63min,血漿中內源性物質NAC對藥源性NAC的測定產生了一定的干擾,因此在評價乙酰半胱氨酸兩種制劑的生物等效性時應扣除內源性NAC的干擾。
2.1.2 標準曲線及定量下限 精密取空白血漿180μL,置2mL離心管中,加入不同濃度的NAC標準工作溶液20μL,配制成相當于NAC濃度為10.00,50.00,100.00,300.00,1 000.00,2 500.00,5 000.00μg·L-1的血漿樣品,按“1.5”項血漿樣品的處理操作,進行LC-MS/MS分析,記錄色譜圖,以NAC濃度增加值為縱坐標值(Y),以待測物峰面積增加值與內標物的峰面積比值為橫坐標值(X),用加權(W=1/X2)最小二乘法進行回歸運算。所得回歸方程為:Y=9.78×10-4X+ 2.83×10-2(n=7),r=0.998,表明血漿中NAC在10.00~5 000μg·L-1范圍內有良好的線性關系;定量下限為10.00μg·L-1,6樣本分析后RSD<15%。
2.1.3 精密度及準確度 精密取空白血漿180μL,置2mL離心管中,精密加入不同濃度的NAC質控工作溶液20μL,配制成低、中、高(30.00,500.00,4 000.00μg·L-1)濃度質控樣品,按“1.5”項血漿樣品的處理操作,根據當日標準曲線計算質控樣品的濃度,連續制備并測定3d,每個濃度進行6樣本分析,對計算結果進行方差分析,得出方法精密度與準確度,結果見表1。
2.1.4 基質效應與提取回收率 精密取空白血漿200μL,除不加內標溶液外,按“1.5”項血漿樣品的處理操作,取血漿上清液180μL,分別加入不同濃度的NAC質控工作溶液20μL和內標工作液30μL后,進樣分析獲得峰面積;與相應濃度的標準溶液和內標溶液直接進樣獲得的峰面積按照基線扣除法計算后相比評價基質效應。結果顯示3個質量濃度下血漿樣品的基質效應分別為:(90.83±5.61)%,(100.44±6.47) %,(101.33±4.63)%,內標的基質效應為(91.41±2.50)%,表明本基質效應對不同濃度血漿樣品的影響基本一致。

A.空白血漿;B.空白血漿中加入NAC(μg·L-1)和氘代乙酰半胱氨酸標準溶液;C.受試者服藥后2 h的血樣;Ⅰ.乙酰半胱氨酸;Ⅱ.氘代乙酰半胱氨酸
圖1 血漿NAC和氘代乙酰半胱氨酸的LC-MS/MS色譜圖
A.blank plasma;B.blank plasma spiked with NAC andd3-NAC;C.plasma sample two hours after oral treatment;Ⅰ.NAC;Ⅱ.d3-NAC
Fig.1 LC-MS/MS chromatograms of NAC andd3-NAC
表1 測定方法的精密度及準確度
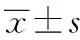

加入濃度/(μg·L-1)日內(n=18)檢測濃度/(μg·L-1)RSDRE%日間(n=18)檢測濃度/(μg·L-1)RSDRE%30.0027.98±3.245.4793.2732.20±4.156.78107.33500.00530.00±62.904.26106.00472.90±58.795.6794.584000.004216.00±347.216.09105.404174.00±348.918.56104.35
此處濃度測得值均按基線扣除法計算后所得
The measured concentrations were obtained using baseline subtraction method
精密取空白血漿180 μL,精密加入不同濃度的NAC質控工作溶液20 μL,配制成低、中、高(30.00,500.0,4 000 μg·L-1)濃度的血漿樣品,按“1.5”項血漿樣品的處理操作,獲取相應的峰面積,與相應濃度的標準溶液和內標溶液直接進樣獲得的峰面積按照基線扣除法計算后相比計算提取回收率,結果顯示3個質量濃度下血漿樣品的平均提取回收率分別為:(99.53±4.09)%,(98.25±1.32)%,(92.04±1.24)%,內標的平均提取回收率為(97.28±1.56)%。
2.1.5 樣品穩定性 按血漿樣品標準曲線測定方法配制成為NAC濃度為30.00,500.00,4 000.00 μg·L-1的低、中、高3個濃度的質控樣本。樣品配制好后分別于室溫下放置4 h、處理后樣品4 ℃進樣器中放置4 h、反復凍融3次、-70 ℃冰箱中冷凍保存30 d后取出室溫融解,按“1.5”項血漿樣品的處理操作,考察血漿樣本中NAC的穩定性。按基線扣除法計算所得結果,結果顯示按上述各條件處理后低、中、高3個濃度血漿樣品中的NAC均保持穩定(RSD均在10%以內),表明樣品在儲存及檢測過程中穩定性良好。
2.2 生物等效性分析
2.2.1 內源性NAC的測定 受試者未服藥周期內所有采血時間點的空白血樣進行測定,結果顯示在24 h內,內源性NAC基礎值為(33.20±1.05) μg·L-1,平均血藥濃度-時間曲線如圖2A所示。
2.2.2 血藥濃度-時間曲線 24例健康受試者單劑量口服乙酰半胱氨酸顆粒受試和參比制劑0.6 g后,按照基線扣除法計算后血漿中外源性NAC的平均血藥濃度-時間曲線見圖2B。
2.2.3 藥動學參數 24例健康受試者單劑量口服乙酰半胱氨酸顆粒受試和參比制劑0.6 g后,血藥濃度測定結果經DAS 3.0版軟件計算藥動學參數,結果見表2。
2.2.4 生物等效性評價 24例健康受試者單劑量口服乙酰半胱氨酸顆粒受試和參比制劑0.6 g后,藥動學參數 AUC(0-t)、AUC(0-∞)、Cmax經對數轉換,進一步雙單側t檢驗和(1-2α)置信區間檢驗,tmax經非參數檢驗,兩種制劑符合生物等效性假設,即兩種制劑具有生物等效性。
2.2.5 方法學可行性評價 以上結果顯示,24 h內內源性NAC濃度基本恒定,不受生理節律的影響出現較大波動,且外源性NAC較內源性NAC濃度變化較為顯著,表明基線扣除法在本次試驗中具有可行性。

圖2 24例健康受試者的內源性NAC(A)及單劑量口服乙酰半胱氨酸顆粒受試和參比制劑0.6 g后藥源性NAC(B,扣除內源性NAC)平均血藥濃度-時間曲線
Fig.2 Plasma concentration-time curve of endogenous and exogenous NAC in 24 healthy volunteers before(A) and after(B) a single oral dose of acetylcysteine granules as reference or test preparation at 0.6 g
表2 24例健康受試者單劑量口服乙酰半胱氨酸顆粒受試和參比制劑0.6 g后的主要藥動學參數


2.2.6 安全性評價 整個試驗過程中未發現與試驗藥物有關的不良事件,試驗結束后受試者均接受體格檢查及實驗室檢查,未發現有臨床意義改變的指標。
3 討論
文獻報道的檢測血漿中的NAC的方法有HPLC法[7-8]及LC-MS/MS法[6],但是均未對內源性和外源性NAC加以區分。筆者采用了基線扣除法排除了內源性NAC對外源性NAC測定結果的干擾,并且得出了內源性NAC的基礎值及其變化規律,進一步證明了該法在本實驗中的可行性。
NAC分子式中含有二硫鍵,在血樣前處理過程中不穩定,DTT的加入能夠減緩這一過程的發生。因此,筆者分別對DTT的用量、濃度及其加入血樣后放置時間進行了考察,發現50 μL,46.28 g·L-1的DTT溶液加入血樣后放置5 min所得待測物的響應值最大。
本次試驗結果顯示,受試者單劑量口服乙酰半胱氨酸顆粒受試和參比制劑0.6 g后,在約1 h血藥濃度即可達峰值,半衰期為約8 h,受試制劑的相對生物利用度為(107.00±43.30)%,兩種制劑的血藥濃度-時間曲線變化趨勢基本一致,其主要藥動學參數的差異無統計學意義(P>0.05),受試制劑AUC(0-t)、AUC(0-∞)、Cmax的90%置信區間均落在生物等效性要求范圍內。綜上所述,受試制劑與參比制劑具有生物等效性。
[1] ROGERS D F.Mucoactive agents for airway mucus hyperse-cretory diseases[J].J Respir Care,2007,52(9):1176-1193.
[2] 陳新謙,金有豫,湯光.新編藥物學[M].17版.北京:人民衛生出版社,2011:426-428.
[3] 鮑紅榮,董立力.N-乙酰半胱氨酸的藥理作用及其臨床應用[J].浙江臨床醫學,2008,10(9):1274-1275.
[4] 程天貴.乙酰半胱氨酸制劑與臨床應用研究進展[J].中國生化藥物雜志,2007,28(6):430-432.
[5] LIU Y M,LIU Y,LU C,et al.Relative bioavailability of gen-eric and branded acetylcysteine effervescent tablets:A single-dose,open-label,randomized-sequence,two-period crossover study in fasting healthy Chinese male volunteers[J].J Clin Ther,2010,32(12):2097-2105.
[6] LU C,LIU G J,JIA J Y,et al.Liquid chromatography tandem mass spectrometry method for determination ofN-acetylcysteine in human plasma using an isotope-labeled internal standard[J].J Biomed Chromatogr,2011,25(4):427-431.
[7] 張樂,胡嵐嵐,周世文,等.柱前衍生-高效液相色譜熒光法測定人血漿中乙酰半胱氨酸及其生物等效性研究[J].中國測試,2013,39(2):52-55.
[8] 席建軍,王福根,莊讓笑,等.反相高效液相色譜法測定家兔體內乙酰半胱氨酸血藥濃度[J].中國藥業,2012,21(5):13-14.
DOI 10.3870/yydb.2015.08.007
Study on Bioequivalence of Acetylcysteine Granules in Chinese Healthy Volunteers
LI Jie1,LIU Mengzhou2,LI Weiyong1,JIA Mengmeng1,ZHOU Ying1,LI Huqun1
(1.DepartmentofPharmacy,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China; 2.SchoolofBasicMedicalScience,WuhanUniversity,Wuhan430071,China)
Objective To establish an analytical method for assessing acetylcysteine in human plasma and study the relative bioavailability and bioequivalence of acetylcysteine granules in Chinese healthy volunteers. Methods In the randomized crossover study, 24 healthy male volunteers
a single oral dose of 0.6 g test acetylcysteine granules, reference acetylcysteine granules or no medication.The plasma concentration of acetylcysteine was determined by LC-MS/MS.Pharmacokinetic parameters were calculated and bioequivalence of two preparations were evaluated by DAS3.0 software. Results The main pharmacokinetic parameters of the test and reference preparations were as follows: AUC0→twas (8 547.64±2 860.04) and (8 783.07±4 042.10) μg·h·L-1, respectively; AUC0→∞was (9 481.64±3 444.76) and (9 540.51±4 239.30) μg·h·L-1, respectively;Cmaxwas (1 994.39±726.42) and (2 090.27±885.46) μg·L-1, respectively;tmaxwas (1.18±0.60) and (1.13±0.53) h, respectively;t1/2was (8.60±3.76) and (7.75±5.01) h, respectively.The relative bioavailabilityF0→tandF0→∞was(107.00±43.30)%and(106.50±40.10)%,respectively.ConclusionTheresultsofstatisticalanalysisindicatethatthetestandreferenceformulationsarebioequivalent.
Acetylcysteinegranules;Bioavailability,relative;Bioequivalence;Liquidchromatography-tandemmassspectrometry
2014-07-04
2014-10-17
李杰(1988-),男,河南鶴壁人,藥師,碩士,研究方向:臨床藥學。電話:027-84289582,E-mail:157512890@qq.com。
黎維勇(1966-),男,湖北鄂州人,主任藥師,教授,博士生導師,研究方向:藥動學和藥物代謝。電話:027-85726063,E-mail:2621239868@qq.com。
R974.1;R969.1
B
1004-0781(2015)08-1014-05

