組織工程骨的牛血清白蛋白殘余量檢測
鄒文燾 劉廣鵬
β-磷酸三鈣(β-tricalcium phosphate,β-TCP)是目前較為常用的骨組織工程支架材料,具有良好的生物相容性[1]和可降解性,構建的組織工程骨有望成為臨床修復骨缺損的新方法[2-3]。組織工程骨的體外構建過程中常應用胎牛血清(Fetal bovine serum,FBS)作為細胞培養介質,而β-TCP的多孔支架結構易于吸附異種蛋白成分,因而會對組織工程骨臨床應用的生物安全性造成影響。本文擬從β-TCP構建的組織工程骨牛血清白蛋白(bovine serum albumin,BSA)殘余量的角度進行研究,為評價組織工程骨生物安全性提供實驗依據。
1 材料與方法
1.1 材料
磷酸三鈣 (β-TCP)(上海組織工程研究與開發中心研制);牛血清白蛋白酶聯免疫試劑盒(無錫博生醫用生物技術開發有限公司);磷酸鹽緩沖液(PBS)、DMEM 低糖培養基(Gibco 公司,美國);胎牛血清(FBS)、胰蛋白酶、EDTA、地塞米松、β-磷酸甘油鈉和維生素C(Sigma公司,美國)。
Beckman XL90低溫離心機 (Beckman公司,德國);TC-100B恒溫水平搖床(上海領成生物科技有限公司);Bio-Rad iMark 酶標儀(Bio-Rad 公司,美國)。
1.2 方法
1.2.1 hBMSCs分離培養
按文獻[4-5]的方法,從正常人骨髓中分離純化BMSCs,按1×106cells/cm2有核細胞的密度接種培養皿,加入含有10%胎牛血清的DMEM基礎培養液,置于37℃、5%CO2、飽和濕度的細胞培養箱培養。48 h后首次換液,以后隔日換液。原代細胞生長至80%融合時,0.25%胰蛋白酶+0.02%EDTA消化傳代,繼續培養擴增至第2代細胞,用于后續實驗。
1.2.2 組織工程骨的體外構建
以 β-TCP 為支架材料(4 mm×4 mm×4 mm),環氧乙烷消毒后置于無菌培養皿內。取第2代hBMSCs,以1×106cells/mL的密度接種于β-TCP。每塊材料接種10 μL細胞懸液,細胞數量為1×104個。將細胞材料復合物置于細胞培養箱4 h后,轉移至96孔培養板,每孔加200 μL成骨誘導培養液(含低糖DMEM,10%FBS,10-8mol/L 地塞米松,10 mmol/L β-磷酸甘油鈉和 10-4mol/L維生素C),37℃、5%CO2條件下繼續培養。體外成骨誘導培養2周后,于檢測前1 d更換為無血清的條件培養液,制備成待檢測的組織工程骨樣品。對照組為未接種細胞的β-TCP,同樣置于200 μL成骨條件培養液中2周,檢測前1 d更換為無血清的條件培養液。
1.2.3 酶聯免疫分析法測定BSA含量
應用酶聯免疫分析法測定標本中BSA含量。首先用純化的抗體包被微孔板,制成固相抗體。包被單抗的微孔中加入BSA抗原,經過結合、洗滌后加入酶標抗BSA抗體,洗滌后用顯色劑顯色。顏色的深淺和樣品中的BSA呈正相關。用酶標儀在450 nm波長下測定吸光度(OD值),計算樣品BSA濃度。
1.2.4 待測樣品準備
1.2.4.1 細胞洗滌液的準備
第2代hBMSCs長滿培養皿底部后常規消化,1 500 r/min離心5 min,棄去液體,細胞計數。添加10 mL PBS,重懸細胞,離心,收集PBS液體。再重復2次,獲得3次細胞洗滌液待測。
1.2.4.2 組織工程骨樣品的準備
取組織工程骨樣品,以體積比1∶100的37℃生理鹽水浸泡并洗滌3次,每次10 min,然后將樣品置于濾紙上吸附殘余液體,剪碎,稱重,置于1.5 mL的Eppendorf管中。根據 《醫療器械生物學評價標準》中關于試驗材料浸提液的規定標準[6],每0.2 g樣品加1 mL PBS平放固定于搖床,37℃、150 r/min振蕩浸提24 h。對照組樣品同法處理獲取浸提液。每例樣品吸取0.3 mL浸提液待測。另將組織工程骨樣品3次浸泡沖洗后的生理鹽水也分別取樣待測。
1.2.5 BSA殘余量測定
96孔酶標板(試劑盒自備)分別設標準孔、待測樣品孔(復孔數均為2)。每孔分別加標準溶液或待測樣品50 μL。輕輕混勻,37℃密封溫育60 min。將酶標板取出棄去液體,甩干,每個孔中加洗滌液300~350 μL,反應30 sec后甩去液體,在濾紙上將酶標板拍干。重復此步驟3次。在標準品孔和樣品孔中加入100 μL的酶標多抗溶液,20℃~25℃避光孵育30 min。洗板4次,拍干。依序每孔加底物溶液50 μL,20℃~25℃避光顯色 10~15 min。 依序每孔加終止溶液50 μL,終止反應。10 min內酶標儀450 nm波長測量各孔的光密度(OD值)。
以標準物的濃度為橫坐標,OD值為縱坐標,用Microsoft Excel統計軟件計算標準曲線的直線回歸方程式,算出樣品實際濃度。
1.3 統計學處理
采用Microsoft Excel統計軟件,通過t檢驗對組織工程骨和單純β-TCP材料的BSA殘余量進行統計學分析,統計結果以s表示,P<0.05為差異具有顯著性。
2 結果
2.1 hBMSCs的分離、純化、培養和傳代
待測細胞為正常人第2代BMSCs(圖1),長滿培養皿底部時的細胞數量約為1.5~2×106個。
2.2 組織工程骨的體外構建
顯微CT和掃描電鏡觀察可見β-TCP呈相互貫通的多孔網狀結構,孔徑為300~500 μm,孔隙率為(92.6±1.1)%。hBMSCs接種 β-TCP 后,體外繼續成骨誘導培養2周,掃描電鏡檢測顯示材料表面可見細胞分泌較多細胞外基質(圖2)。
2.3 細胞洗滌液中BSA濃度
BSA檢測試劑盒檢測范圍為0~40 ng/mL,根據其標準品測定的標準曲線R2=0.9832,符合試劑盒規定的R2>0.97的標準檢測要求。
細胞洗滌液 BSA 濃度為(712.49±111.40)ng/mL、(38.69±26.20)ng/mL 和 (2.32±1.78)ng/mL,3 次結果的差異具有統計學意義(P<0.05,n=3,圖 3)。
2.4 組織工程骨洗滌液BSA濃度
組織工程骨洗滌液中BSA含量,隨洗滌次數增多而明顯降低。3次洗滌液的BSA濃度分別為(305.86±93.41)ng/mL、(39.19±8.26)ng/mL 和(6.43±1.57)ng/mL,3 次結果的差異具有統計學意義(P<0.05,n=10,圖 4)。
2.5 組織工程骨BSA殘余量測定
實驗組平均干重為(26.02±5.07)mg,對照組為(21.59±6.69)mg,兩組差異無統計學意義(P>0.05,n=10,圖5)。實驗組平均BSA殘余量為 (19.54±6.70)ng,單位重量的 BSA 殘余量為(0.656±0.213)ng/mg。 對照組的相應值分別為 (15.67±5.49)ng和(0.796±0.205)ng/mg, 兩組差異無統計學意義 (P>0.05,n=10,圖 6)。

圖1 BMSCs形態觀察Fig.1 Histological observation of BMSCs

圖2 β-TCP支架材料大體觀及鏡下觀Fig.2 General observation and microscopic observation of β-TCP scaffold material

圖3 細胞洗滌液BSA含量Fig.3 BSA content of in the dilution liquid of BMSCs
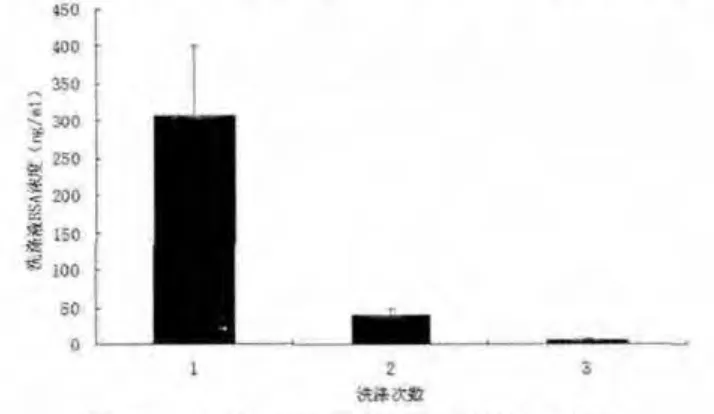
圖4 組織工程骨洗滌液BSA含量Fig.4 BSA content of in the dilution liquid of tissue engineered bone

圖5 每塊樣品BSA殘余量Fig.5 The average residual BSA in tissue engineered bone

圖6 單位重量樣品BSA殘余量Fig.6 The normalized residual BSA in tissue engineered bone
3 討論
組織工程骨在構建過程中,其種子細胞的培養多需添加胎牛血清(FBS);在細胞與支架材料的復合過程中,也需要FBS作為介質,提供細胞營養,維持細胞活性。生物支架材料的三維多孔性結構使材料內表面積增大,有利于細胞的黏附和生長,為細胞基質分泌與合成提供良好的外環境,又便于營養成分的運輸及代謝產物的排出[7-8]。但同時也容易吸附培養液中的BSA等異種蛋白。BSA作為牛血清中含量最高的蛋白質成分,能夠導致機體產生免疫排斥反應。因此,BSA殘余量的多少關系到組織工程產品的安全性。
《中華人民共和國藥典》(2010版三部)規定,人體疫苗的BSA殘余量按酶聯免疫方法進行檢測,每件不超過50 ng[9]。目前,組織工程骨的國家標準尚未建立,相關的研究報道較少。本實驗應用ELISA法檢測常規消化后的細胞洗滌液中的BSA含量。結果表明,BMSCs洗滌液中BSA濃度隨著洗滌次數的增加而明顯降低;經過3次洗滌后,細胞洗滌液中的BSA殘余量能夠降至藥典規定的BSA殘余量上限。
進一步的實驗顯示,以β-TCP為支架的組織工程骨樣品的BSA殘余量平均值為19.54 ng。若修復骨缺損的材料體積為2 cm3,其規格大小對于臨床應用而言并不是很大,但相應的BSA殘余量將達到610.62 ng,這將遠遠超出藥典的規定限量。而接種BMSCs的組織工程骨與未接種細胞的β-TCP材料相比,兩者單位重量的BSA殘余量無顯著性差異,表明支架材料較種子細胞更為容易吸附殘留BSA。
本實驗表明,在種子細胞體外培養階段,所使用的血清成分易于通過離心洗滌的方法予以去除;而當細胞與支架材料進行復合之后,由于支架材料會大量吸附培養基中的血清成分,此時難以再將血清從支架中分離出來。理想的清洗流程應在綜合考慮最大限度清除殘留BSA,并最大限度保留產品生物學活性之間取得平衡,以兼顧產品的安全性和有效性,這方面的研究目前尚未引起足夠重視[10]。
[1]Wiedmann-Al-Ahmad M,Gutwald R,Gellrich NC,et al.Growth of human osteoblast-like cells on beta-tricalciumphosphate(TCP)membranes with different structures[J].J Mater Sci Mater Med,2007,18(4):551-563.
[2]Szpalski C,Wetterau M,Barr J,et al.Bone tissue engineering:current strategies and techniques--part I:Scaffolds[J].Tissue Eng Part B Rev,2012,18(4):246-257.
[3]Panseri S,Russo A,Cunha C,et al.Osteochondral tissue engineering approaches for articular cartilage and subchondral bone regeneration[J].Knee Surg Sports Traumatol Arthrosc,2012,20(6):1182-1191.
[4]劉廣鵬,趙莉,劉波,等.新型β-磷酸三鈣的制備與成骨能力的實驗研究[J].中華創傷骨科雜志,2006,8(8):755-759.
[5]劉廣鵬,趙莉,袁捷,等.多孔β-磷酸三鈣陶瓷表面處理前后的成骨能力比較[J].中國口腔頜面外科雜志,2006,4(3):202-206.
[6]國家質量技術監督局.GB/T 16886.12-2000醫療器械生物學評價—第12部分:樣品的制備與參照樣品[S].北京:中國標準出版社,2000.
[7]Gurin AN,Komlev VS,Fadeeva IV,et al.A comparative study of bone regeneration potency of alfa and beta-tricalcium phosphate bone substitute materials[J].Stomatologiia,2012,91(6):16-21.
[8]Fong EL,Watson BM,Kasper FK,et al.Building bridges:leveraging interdisciplinary collaborations in the development of biomaterials to meet clinical needs[J].Adv Mater,2012,24(36):4995-5013.
[9]國家藥典委員會.中華人民共和國藥典[M].北京:中國醫藥科技出版社,2010.
[10]方玉,馮曉明,奚廷斐.組織工程醫療產品中殘留牛血清白蛋白的檢驗常見問題[J].中國組織工程研究與臨床康復,2008,12(32):6347-6350.

