孤兒藥
全草CHQ
“孤兒”一詞,通常意味著某個不知曉其父母的小孩。其實,研發孤兒藥也需要確認許多撲朔迷離的罕見病致病機理,需要進行多學科、跨領域聯合研究,需要更加緊密的患者信息收集、疾病診斷、研發政策扶持和審批機制。此外,孤兒藥由于研發成本高昂,導致其售價昂貴,也需要良好的商業保險政策來支付天價的治療費用。
與常規藥品研發相比,孤兒藥研發缺乏足夠的患者數量來進行研究、施行臨床實驗,且研發的失敗率更高。即便該類藥物研發成功,供給患者的人數也相當有限。因此,我們不得不從定價、專利保護期限等多方面保證孤兒藥研發者的利益,否則不足以鼓勵更多的資金和頂尖人才進入這一領域。事實上,要判斷一個國家的醫療發展水平是否領先全球,從罕見病診斷、孤兒藥研發等領域就可以窺斑見豹。
國家支持
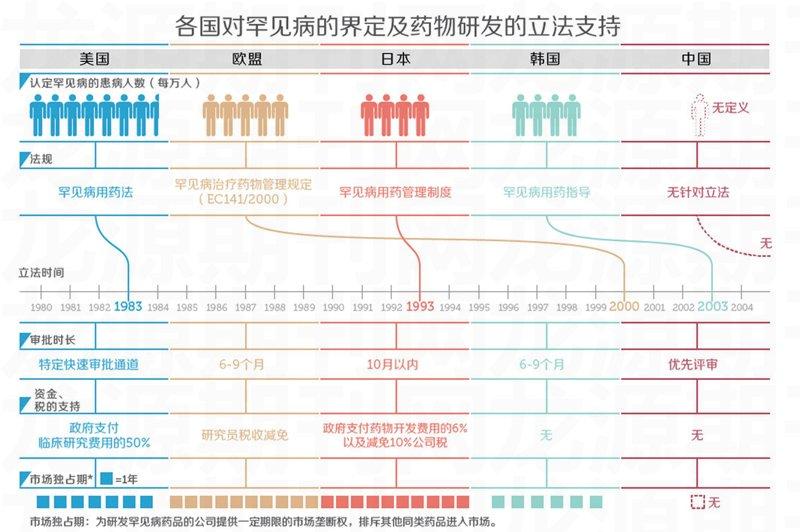
基于孤兒藥研發的高風險現狀,各個國家紛紛給予了政策支持。美國是世界上第一個對孤兒藥實施特別管理制度的國家。美國食品藥品監督管理局在1982年就設立了孤兒藥產品開發辦公室,并于1983年頒布了孤兒藥法案,正式實施針對孤兒藥的特殊管理。1985年,日本緊跟美國步伐,開始對孤兒藥的研發給予支持,并在1993年制定了《罕見病用藥管理制度》,增加了針對孤兒藥的管理內容,包括研究的全過程可享受基金資助、減稅、優先審批、藥品再審查時間延長及國家健康保險支付上的優惠等。2000年,歐洲設立了孤兒藥委員會,負責評審作為罕見病治療、預防和診斷的藥物。
雖然目前在中國大陸,仍沒有針對孤兒藥出臺具體法規和設置管理部門,但在不少政府文件中卻明確了孤兒藥的特殊地位。近期也有媒體報道,2015年即將修訂出爐的《藥品管理法》及實施條例將加入孤兒藥定義等內容,屆時孤兒藥將可以通過醫保、商業醫保、大病救助以及慈善組織實現收支平衡,這對患者來說無疑是一大利好。
其實在計劃經濟時代,中國已經有一些孤兒藥產品,例如治療尿崩癥的長效尿崩停和有機磷農藥的解毒藥氯解磷定等,它們基于當時的定點生產、專門儲備、統一配送和定期報廢的行政制度而存在。但在市場經濟時代,孤兒藥反而因為沒有政策的扶持,導致藥品研發者缺乏生產積極性,國內藥企研發孤兒藥的熱情也因此受到制約。
市場選擇
與相對冷落的國內環境相比,近十年來,孤兒藥的研發開始成為各大跨國藥企的重點研發目標。相關法案的保障、巨大的市場利益驅動和科技人員的不懈努力,造就了海外研發孤兒藥的熱潮。
一些進口藥在無國內臨床試驗的情況下可以獲得條件性批準,利用這一政策優勢,國外孤兒藥產品進入中國市場的速度越來越快,基本上國內的孤兒藥市場都被國外產品壟斷。但可惜的是,目前國內孤兒藥的評審時間長,發展非常困難。更關鍵的是,國內市場定價和支付能力可能才是制約國內孤兒藥發展的關鍵,而改變這一窘境顯然不是一朝一夕能夠做到的。此外,研發者對于孤兒藥產品的一些誤解也助推了這一局面的形成。
由于單種孤兒藥可以適用的患者較少,往往會令大家誤以為其經濟效益低下,但事實上,除了研發經費高昂和研發難度較大外,孤兒藥的生產成本并不一定很高。相反,研發者還可能因此收獲巨大的經濟效益。美國健贊公司就因研發孤兒藥而躋身于全球生物科技公司巨頭的行列,而亞歷克松和比亞馬林等孤兒藥的研發公司更是令投資者趨之若鶩。
其實,一個好的孤兒藥產品往往能拯救一個瀕臨破產的海外藥企,“逆襲”的故事也在不斷精彩上演中。美國食品藥品監督管理局為孤兒藥物的注冊提供了快速通道程序,研發和生產孤兒藥的企業還能享有減稅及7年市場獨占權等優惠政策。而歐盟的孤兒藥法案則規定,一旦某種藥物被選定為孤兒藥,即使該種疾病的患病率或批準時間的條件超出了罕見病定義的門檻,其研發工作依然能獲得相應的保護和優待。
開創歷史
目前,全球孤兒藥研發的一個重要方向是基因治療研究。據不完全統計,從1989年國際上開展第一例人體基因治療開始,截止到2015年1月,國際上的基因治療方案已經超過2100項。
20世紀80年代,美國北卡羅來納大學教堂山分校基因治療中心主任Jude Salmuski,率先利用腺相關病毒(Adeno-associated virus, AAV)作為基因治療載體。Salmuski表示,AAV的幾個特性,使得它成為一種相當有效的基因治療載體。首先,AAV的DNA很少會整合到宿主的基因組中,這減少了基因整合的促癌性突變風險。相反,AAV的潛藏性能,使其可以作為染色體外的DNA片段繼續存在。此外,AAV對人類是不致病的。
我國的第一個基因治療臨床方案是在1992年,由上海復旦大學薛京倫教授操作的,他開展了兩例體外(ex vivo)基因轉移治療血友病B型的臨床試驗。雖然基因治療也曾得到過國家863、973等重大科技計劃的支持,但由于起步時間較晚,我們與世界領先水平相比,仍處于落后地位,且差距不小。盡管在2003年,中國藥監局批準了第一個AAV載體介導的基因治療藥物——AAV2-hFIX注射液,治療血友病B進入一期臨床階段,不過在此后十多年里,我國再無AAV載體基因治療進入臨床。但在同期,國際AAV載體基因治療發展卻如火如荼,成為研究進展最為迅速的領域。
2013年,歐盟批準了AAV載體基因藥物Glybera上市,這一消息無疑是一枚重磅炸彈。Glybera是全球首個上市的基因治療藥物,可以用于治療一種極其罕見的遺傳性疾病——脂蛋白脂肪酶缺乏癥(LPLD)。它利用AAV復制了一個功能性的LPL基因,并傳遞給骨骼肌,從而移除了病毒基因。雖然該藥物的市場價格非常高昂(每名患者需要支付125萬歐元,約合820萬人民幣),但由此引起的各路研發者對于孤兒藥的關注,卻是有目共睹。此后,一系列罕見病基因治療藥物的研發工作紛紛取得突破,將基因治療帶入了新時代,各類孤兒藥也如雨后春筍般相繼問世。
隨著基因測序和診斷技術的飛速發展,人類發現了越來越多的遺傳病基因,單基因遺傳病是天然的人類疾病模型,而基因治療則是一種精準的靶向治療方式。目前,人類已在載體技術、基因表達和替代技術、基因定點糾錯技術、基因遞送技術等方面取得了巨大進步。如果從單基因遺傳病入手,我們甚至可以將此技術擴展應用于其他更為復雜的疾病。
其實,孤兒藥的研發與我們每個人都息息相關,即使你的周圍沒有罕見病患者。如果我們能通過對孤兒藥的研發解開人類疾病與健康的奧秘,那么就能將這些技術推廣到各類常見病癥的研究之中。孤兒藥的研發就好比藥物研發皇冠上的寶石,而醫學水平的進步和提高則得益于對罕見病的認知和不斷探索。

