我院藥品不良反應監(jiān)測與上報工作管理體系建立實踐
沈冬梅,代晶
江西省九江市第一人民醫(yī)院藥學部,332000
為加強藥品的上市后監(jiān)管,規(guī)范藥品不良反應報告和監(jiān)測,及時、有效控制藥品風險,保障公眾用藥安全,我國實行藥品不良反應報告和監(jiān)測管理[1]。隨著我國醫(yī)改政策的不斷深人,醫(yī)療安全問題逐步得到社會的關注,患者用藥安全問題已成為醫(yī)療機構持續(xù)改進的重點[2],醫(yī)療機構是用藥主體,建立醫(yī)療機構藥品不良反應監(jiān)測與報告(ADR)體系是藥品安全監(jiān)管、促進合理用藥、保護公眾用藥安全的重要保障。我院在藥品不良反應監(jiān)測與上報工作方面完善并實踐了管理體系建設,本文就取得的經(jīng)驗和成效總結分析,以對醫(yī)療機構在藥品不良反應監(jiān)測與上報管理工作上提供參考。
1 藥品不良反應監(jiān)測與上報工作管理體系的建立
1.1 領導重視,設立專門機構院領導對藥品不良反應監(jiān)測與上報工作高度重視,在以院長為主任委員的藥事管理與藥物治療學委員會下設立“不良反應管理小組”,組長是分管藥學部的分管領導,副組長由醫(yī)務處、藥學部、護理部、院感組成,臨床各科室負責人與各科室護長為組員,并設立全院不良反應專職人員,成立不良反應監(jiān)測技術小組。
1.2 建立健全不良反應報告制度 加強我院藥物不良反應監(jiān)測與上報管理,推動我院藥品不良反應(ADR)報告和監(jiān)測工作的深入開展,提高我院藥品不良反應報告和監(jiān)測水平和ADR報表的數(shù)量和質量,切實加強各部門、科室藥品安全性監(jiān)測與上報工作,確保臨床用藥安全,我院下發(fā)了紅頭文《藥物不良反應報告制度與程序》,明確了藥品不良反應的定義:是指合格藥品在正常用法用量下出現(xiàn)的與用藥目的無關的或意外的有害反應。要求各藥品使用相關科室設立藥品不良反應監(jiān)測聯(lián)絡員,負責本科室不良反應監(jiān)測。明確藥學部指定專人承辦臨床上報的藥品不良反應報告表的分析鑒別與匯總工作,并定期做好季度和年度總結分析,負責向國家藥品不良反應監(jiān)測中心上報。藥學部內(nèi)設藥品不良反應監(jiān)測技術小組。強調(diào)醫(yī)師、藥師、護士相互配合對患者用藥情況進行監(jiān)測,重點監(jiān)測非預期(新發(fā)現(xiàn))的、嚴重的藥物不良反應,有原始記錄。發(fā)生嚴重藥品不良反應或藥害事件,要積極進行救治,做好醫(yī)療記錄,保存好相關藥品、物品的留樣,并對事件進行及時的調(diào)查、分析,按規(guī)定上報衛(wèi)生行政部門和藥品監(jiān)督管理部門。必須將患者發(fā)生的藥品不良反應如實記入病歷中[3]。
1.3 建立藥品不良反應報告及處理流程 依照制度要求,我院制定了《藥物不良反應報告及處理流程》,明確了各環(huán)節(jié)各部門的責任及任務,具體流程:發(fā)現(xiàn)患者發(fā)生疑似藥品不良反應,責任護士或當班護士必須立即停止懷疑藥品給藥,報告給醫(yī)生處置,同時在病區(qū)“藥品不良反應登記本”上進行簡要登記;醫(yī)生在接到患者發(fā)生疑似藥品不良反應報告后,必須停止懷疑藥品給藥并對癥處理,積極進行臨床救治,并將患者發(fā)生的藥品不良反應、處置如實記入病歷中;若為死亡病例、群體性事件,必須保存好相關藥品、物品留樣,并立即報告藥學部不良反應監(jiān)測技術小組。藥學部及時向醫(yī)院不良反應管理小組匯報,必要時及時報告給衛(wèi)生行政部門和藥品監(jiān)督管理部門。醫(yī)生在處置完患者后必須在內(nèi)網(wǎng)電子病歷系統(tǒng)中點擊藥物不良反應上報系統(tǒng),及時填報“藥品不良反應/事件報告”電子表,必填項不得缺項,關聯(lián)性評價無法判斷的,可電話聯(lián)系責任區(qū)臨床藥師協(xié)助分析判斷。藥品不良反應專職監(jiān)測員每天匯總信息系統(tǒng)中全院藥品不良反應上報表,并認真核查原始病歷,做出必要的分析評價后上報國家藥品不良反應監(jiān)測中心。
1.4 細化考核指標,建立獎懲制度 我院各部門對 ADR監(jiān)測與上報工作高度重視,為調(diào)動臨床各部門工作積極性, 制定了考核細則,將考核細化到醫(yī)療主診組, 并且要求在注重數(shù)量的同時,又注重質量 。把考核結果與績效掛鉤,實行獎懲, 切實調(diào)動醫(yī)務人員的積極性。明確績效掛鉤,獎懲到位的同時,每月進行全院通報。弄虛作假者,一經(jīng)查實,加重處罰,并與年終評先評優(yōu)掛鉤。無故不參加全院藥品不良反應知識培訓的科室,處罰科室責任人。每月由醫(yī)務處和藥學部組成專家組對病歷進行抽查,對出現(xiàn)藥物不良反應未做病程記錄中記錄或未進行不良反應上報,依照制度執(zhí)行獎懲。
1.5 納入醫(yī)療質控體系 藥學部每季度將不良反應上報表及該季度全院不良反應上報過程出現(xiàn)的典型問題匯總分析,并將本季度和上一季度、本季度和上一年同期的數(shù)據(jù)進行比對,拿出數(shù)據(jù)分析圖并寫出總結報告,上報給醫(yī)院質量管理委員會,納入全院醫(yī)療質控體系。
2 采取有效措施,落實ADR報告與監(jiān)測
2.1 加強培訓與宣教,強化依法監(jiān)測上報意識,提高用藥風險與責任意識。
對醫(yī)務工作者來說,認為藥品質量只要符合藥品質量標準規(guī)定,政府允許生產(chǎn)企業(yè)上市流通的藥品,政府部門集中招標采購的藥品質量信任度高,對可能存在的從原料、生產(chǎn)、 儲 存、運輸、 使用等環(huán)節(jié)的安全風險欠缺考慮,對藥品上市后的安全性監(jiān)測還不能完全理解,不能準確把握ADR監(jiān)測的重大意義,不清楚監(jiān)測與上報藥品不良反應是法律規(guī)定的職責,在醫(yī)療過程中缺失風險管理意識。醫(yī)務處、藥學部將法規(guī)要求,重大藥物不良事件、三甲綜合醫(yī)院評審標準要求、ADR工作技術要求、院內(nèi)規(guī)定列入全院藥品不良反應系列培訓課程,反復培訓宣教。將藥品不良反應知識列入新入院的員工藥事管理培訓內(nèi)容。提高了全院醫(yī)務工作者的用藥風險與責任意識,提升了全院醫(yī)務人員ADR監(jiān)測上報綜合水平。
2.2 創(chuàng)新管理,在電子病歷中建立并完善了HIS系統(tǒng)同步的藥品不良反應直報系統(tǒng) 臨床醫(yī)務工作任務重,患者出現(xiàn)藥品不良反應時,醫(yī)護人員常常因為找藥品不良反應紙質報表、內(nèi)容填寫需調(diào)電子病歷等原因上報主動性缺乏,為優(yōu)化上報流程,便捷臨床,藥學部協(xié)調(diào)信息處,從醫(yī)院電子病歷管理軟件改進著手,進行軟件功能拓展,嵌入藥品不良反應上報工作模塊。當患者出現(xiàn)藥品不良反應時,醫(yī)生處置完患者后,在電子病程中記錄不良反應后,即可在當前界面,點開“藥品不良反應監(jiān)測上報系統(tǒng)”,填報“藥品不良反應、事件報告表”,患者姓名、性別,出生日期或年齡,民族、體重、聯(lián)系方式、原患疾病、病歷號等基礎數(shù)據(jù)系統(tǒng)自動生成,不需要醫(yī)生填寫,解決了臨床藥品不良反應監(jiān)測后,上報脫節(jié)的問題,增加了臨床醫(yī)護人員的依從性,實現(xiàn)了藥品不良反應監(jiān)測上報與診療活動的同步,實現(xiàn)了藥品不良反應監(jiān)測上報與實際發(fā)生數(shù)的同步,實現(xiàn)了藥品不良反應監(jiān)測報告與規(guī)范要求的同步。
2.3 臨床藥師分片區(qū)管理,責任到人 因臨床藥師人數(shù)制約,藥學部將臨床科室分片區(qū)管理,責任到人。臨床藥師每周必須深入責任科室,了解ADR情況,協(xié)助臨床預防嚴重ADR病例的發(fā)生,參與ADR救治處置。負責本責任區(qū)的ADR報告因果關聯(lián)性評定分析,對責任科室電子報表存在的問題及時溝通提醒。
2.4 建立并完善了多部門協(xié)作機制 ADR整體工作運行過程中,多部門協(xié)作非常重要,藥學部負責ADR收集、匯總分析、評價、上報等具體事務與技術支持、培訓,醫(yī)務科牽頭協(xié)調(diào),統(tǒng)一指揮,負責抽調(diào)臨床專家與藥學專家組成質量評定專家組對病歷進行抽查,負責對通報、處罰的科室進行談話,負責執(zhí)行公示、處罰決議。護士通常是臨床藥品不良反應發(fā)生的第一發(fā)現(xiàn)人,護理部負責臨床護士對出現(xiàn)的藥品不良反應監(jiān)測,一旦出現(xiàn)必須立即匯報給醫(yī)生,并做好記錄。院感部門參與疑似藥品不良反應出現(xiàn)時的關聯(lián)性評價,以區(qū)分院內(nèi)感染不良事件。
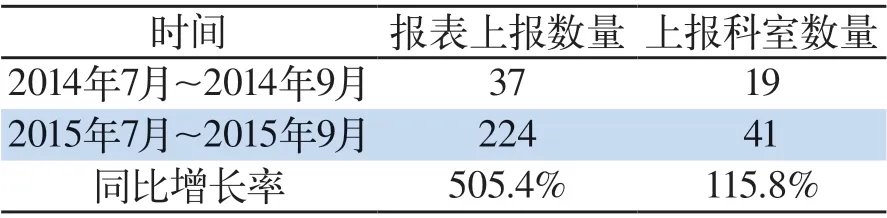
表 1 藥品不良反應報告情況比對Tab 1 Reports of adverse drug reactions in comparison
3 成效
3.1 ADR報告數(shù)量與質量大幅提升 我院藥品不良反應監(jiān)測與上報管理體系的建立,及配套措施的落實,為我院不良反應監(jiān)測報告工作奠定了扎實的基礎,我院不良反應監(jiān)測報告數(shù)量與質量均得到大幅提升,我院藥品不良反應監(jiān)測與報告管理體系自2015年7月正式運行,建立后至今(2015年7月~2015年9月)共上報不良反應報告224例,共41個科室上報,管理體系建立前的同期時間(2014年7月~2014年9月)共上報藥品不良反應報告37例,共19個臨床科室上報。數(shù)據(jù)顯示上報表同比增長達505.4%,具體見藥品不良反應報告情況比對(表1)。管理體系的建立,電子病歷嵌入的藥品不良反應直報系統(tǒng)的運行,顯著提升了醫(yī)務人員的上報意識,上報數(shù)量顯著提升。電子病歷嵌入的藥品不良反應直報系統(tǒng)的運行,使得基礎數(shù)據(jù)系統(tǒng)可以自動提取,避免了錯誤或空項。必填項系統(tǒng)設置了不得空項提醒,整體使藥品不良反應報告質量得以提升,改觀了原來報表缺項嚴重,未能很好的記錄不良反應發(fā)生情況等質量問題。
3.2 院內(nèi)藥品風險意識、應對風險能力提升 我院藥品不良反應監(jiān)測與上報工作管理體系的建立,健全了醫(yī)院應急管理體系。全體醫(yī)務人員加強了藥品風險意識,和藥品使用過程中發(fā)現(xiàn)風險和處置風險的能力,藥品風險信號可及時監(jiān)測并分析警示。建立了《突發(fā)事件藥事管理應急預案》,加強了應急培訓與指導,提升應急處置能力。為減少或避免藥害事件的發(fā)生,提高快捷高效地處理用藥風險的能力,我院還制訂了《藥品召回管理制度及處置流程》,規(guī)定臨床科室發(fā)現(xiàn)所用藥品出現(xiàn)嚴重不良反應后,應及時上報,藥學部應及時指派責任臨床藥師和藥庫工作人員前往相關臨床科室現(xiàn)場查看情況,臨床藥師對藥品不良反應進行分析、評價;必要時可暫停使用并封存。
4 總結
以保障人民群眾用藥安全有效為目的,以提高監(jiān)測評價能力為重點,全面加強藥品不良反應監(jiān)測體系建設,保證公眾用藥安全,是我國政府為落實醫(yī)藥衛(wèi)生體制改革相關要求,進一步完善藥品不良反應報告和監(jiān)測體系建設的指導思想[4]。醫(yī)療機構是藥品不良反應報告和監(jiān)測體系建設的重要基石,我院就如何構建醫(yī)療機構藥品不良反應監(jiān)測上報管理體系,優(yōu)化工作流程,便捷醫(yī)務人員上報工作,開展管理體系實踐后,全院依規(guī)上報意識增強,ADR上報的及時性得以糾正,上報的數(shù)量與質量大幅度提升,藥品安全風險預警和應急處置能力得以提升。但也存在諸多不足,比如新的、嚴重的藥品不良反應報告數(shù)量占比較少,門診患者藥品不良反應監(jiān)測方法的優(yōu)化探索,監(jiān)測數(shù)據(jù)分析評價能力及重點藥物的重點監(jiān)測等,還需進一步完善。醫(yī)院藥品不良反應報告和監(jiān)測體系的建設是一個涉及全院多個部門的系統(tǒng)工程,需不斷自我完善、自我提高,建立更加科學、高效的報告和監(jiān)測體系。
[1] 衛(wèi)生部.《藥品不良反應報告和監(jiān)測管理辦法》衛(wèi)生部令第81號. 2011.
[2] 熊代琴, 李東鋒, 張茂慧, 等. 我院藥品不良反應監(jiān)測上報管理體系建設探討[J].《新疆中醫(yī)藥》, 2015,33(2): 86-89.
[3] 衛(wèi)生部.《三級綜合醫(yī)院評審標準(2011年版)》(衛(wèi)醫(yī)管發(fā)[2011]33號). 2011
[4] 國家食品藥品監(jiān)督管理局.《關于加強藥品不良反應監(jiān)測體系建設的指導意見》國食藥監(jiān)安[2011]466號. 2011.

