高壓氧對(duì)急性有機(jī)磷中毒大鼠氧自由基及海馬HIF-1α mRNA的影響
楊 勇,楊金連,謝智慧
(1.湖北醫(yī)藥學(xué)院附屬東風(fēng)醫(yī)院綜合醫(yī)療科,湖北 十堰 442008;2.遵義醫(yī)學(xué)院附屬醫(yī)院高壓氧科,貴州 遵義 563003)
高壓氧對(duì)急性有機(jī)磷中毒大鼠氧自由基及海馬HIF-1α mRNA的影響
楊 勇1,楊金連2,謝智慧2
(1.湖北醫(yī)藥學(xué)院附屬東風(fēng)醫(yī)院綜合醫(yī)療科,湖北 十堰 442008;2.遵義醫(yī)學(xué)院附屬醫(yī)院高壓氧科,貴州 遵義 563003)
目的 探討高壓氧(HBO)對(duì)急性有機(jī)磷中毒腦損傷的保護(hù)機(jī)制。方法健康雄性SD大鼠60只,隨機(jī)分為正常對(duì)照組、中毒組、常規(guī)治療組和高壓氧治療組,正常對(duì)照組6只,其余3組各18只,建立大鼠急性有機(jī)磷中毒腦損傷模型。中毒組、常規(guī)治療組和高壓氧治療組分別于建模后1、3、7 h(每個(gè)時(shí)間點(diǎn)6只)下腔靜脈采血檢測(cè)丙二醛(MDA)的含量和超氧化物歧化酶(SOD)的活性,熒光定量PCR檢測(cè)海馬組織HIF-1αmRNA的表達(dá)。結(jié)果與中毒組比較,高壓氧治療組的海馬組織HIF-1αmRNA的表達(dá)和血清MDA含量逐漸下降(P<0.05),而血清SOD活性逐漸升高(P<0.05)。結(jié)論高壓氧對(duì)急性有機(jī)磷中毒性腦損傷的保護(hù)機(jī)制與抗氧化損傷和抑制HIF-1α的表達(dá)有關(guān),且高壓氧干預(yù)越早越好。
急性有機(jī)磷中毒;腦損傷;缺氧誘導(dǎo)因子-1α;丙二醛;超氧化物歧化酶;高壓氧
急性有機(jī)磷農(nóng)藥中毒(AOPP)引起的中樞神經(jīng)系統(tǒng)損傷表現(xiàn)為不同程度的驚厥、抽搐、意識(shí)障礙,其發(fā)病機(jī)制尚不完全清楚,且無(wú)特效治療藥物[1]。HBO在顱腦外傷、一氧化碳中毒性腦病、缺血缺氧性腦病等腦損傷的治療中已取得了顯著的臨床效果[2-5],故本研究旨在通過大鼠急性有機(jī)磷中毒腦損傷模型,觀察高壓氧(HBO)對(duì)大鼠血清氧自由基和海馬中缺氧誘導(dǎo)因子-1 mRNA表達(dá)的影響,探討HBO對(duì)急性有機(jī)磷中毒性腦損傷的保護(hù)機(jī)制。
1 材料與方法
1.1 動(dòng)物及分組 雄性健康SD大鼠60只,體重(290±20)g,購(gòu)自第三軍醫(yī)大學(xué)實(shí)驗(yàn)動(dòng)物中心。隨機(jī)分為正常對(duì)照組、中毒組、常規(guī)治療組和高壓氧治療組,正常對(duì)照組6只,其余三組各18只。中毒組、常規(guī)治療組和高壓氧治療組分3個(gè)時(shí)間點(diǎn)(建模后1、3、7 h)進(jìn)行標(biāo)本采集和檢測(cè),每個(gè)時(shí)間點(diǎn)各6只。
1.2 急性有機(jī)磷中毒腦損傷模型的建立和HBO治療 取77.5%敵敵畏乳油0.516 g,溶于100 ml蒸餾水,配置0.4%敵敵畏溶液(4 mg/ml)。參考相關(guān)文獻(xiàn)并結(jié)合前期預(yù)實(shí)驗(yàn)[6-7],采用頸背部皮下累計(jì)注射法,每次敵敵畏用量4 mg/kg,待大鼠抽搐停止后再予同等劑量皮下注射,一共注射5次,保證大鼠不間斷抽搐3 h,即造模完成。動(dòng)物出現(xiàn)驚厥樣抽搐、共濟(jì)失調(diào)或翻正反射消失即判斷為腦損傷。中毒組不予任何治療,常規(guī)治療組立即予長(zhǎng)托寧0.12 mg/kg、氯解磷定30 mg/kg肌肉注射,高壓氧治療組在常規(guī)治療后,立即將大鼠置于動(dòng)物用實(shí)驗(yàn)高壓氧艙內(nèi),進(jìn)行高壓氧治療一次。具體方法如下[8],加壓5 min至0.12 Mpa (1.2ATA),同時(shí)純氧洗艙,之后在5 min內(nèi)使艙內(nèi)壓升至0.2 Mpa(2 ATA),穩(wěn)壓吸氧40 min,減壓10 min,艙內(nèi)氧濃度保持在95%以上。
1.3 標(biāo)本采集 各組于建模完成后1、3、7 h處死大鼠。腹腔注射10%水合氯醛麻醉(0.3 ml/100 g),固定并暴露腹腔,下腔靜脈取血,離心分離血清,用于MDA、SOD的檢測(cè);斷頭取腦,在冰上迅速分離海馬組織,放入去酶凍存管中,置入-80℃冰箱供提取總RNA。
1.4 檢測(cè)指標(biāo)及方法
1.4.1 腦組織HIF-1αmRNA的表達(dá) 采用熒光定量PCR檢測(cè),按說明書操作主要步驟如下:①總RNA提取;②反轉(zhuǎn)錄;③熒光定量PCR,HIF-1α上游引物5'-CCAGATTCAAGATCAGCCAGCA-3',下游引物5'-GCTGTCCACATCAAAGCAGTACTCA-3',擴(kuò)增產(chǎn)物長(zhǎng)度100 bp。④基因相對(duì)定量=2-△△CT,計(jì)算出各樣本HIF-1αmRNA的相對(duì)表達(dá)量。
1.4.2 血清SOD活性的檢測(cè) 采用黃嘌呤氧化法,嚴(yán)格按照試劑盒說明書操作。
1.4.3 血清MDA含量的檢測(cè) 采用硫代巴比妥酸比色法,按照測(cè)試盒說明書操作。
1.5 統(tǒng)計(jì)學(xué)方法 應(yīng)用軟件SPSS19.0軟件進(jìn)行數(shù)據(jù)統(tǒng)計(jì)分析,實(shí)驗(yàn)數(shù)據(jù)中的計(jì)量數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差(±s)表示,多組產(chǎn)間比較采用單因素方差分析,兩兩比較用LSD法,以P<0.05認(rèn)為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 大鼠海馬HIF-1αmRNA的相對(duì)表達(dá)量 海馬HIF-1α實(shí)時(shí)熒光定量PCR結(jié)果表明:中毒組各時(shí)間點(diǎn)mRNA表達(dá)明顯高于正常對(duì)照組(P<0.05);常規(guī)治療組1 h、3 h mRNA表達(dá)高于正常對(duì)照組(P<0.05);常規(guī)治療組各時(shí)間點(diǎn)與中毒組各時(shí)間點(diǎn)比較,mRNA表達(dá)均降低(P<0.05);高壓氧治療組各時(shí)間點(diǎn)與中毒組各時(shí)間點(diǎn)比較,mRNA表達(dá)均明顯降低(P<0.05),與常規(guī)治療組比較,1、3 h mRNA表達(dá)降低(P<0.05),見表1。
表1 各組大鼠海馬HIF-1mRNA相對(duì)表達(dá)量的變化(±s)
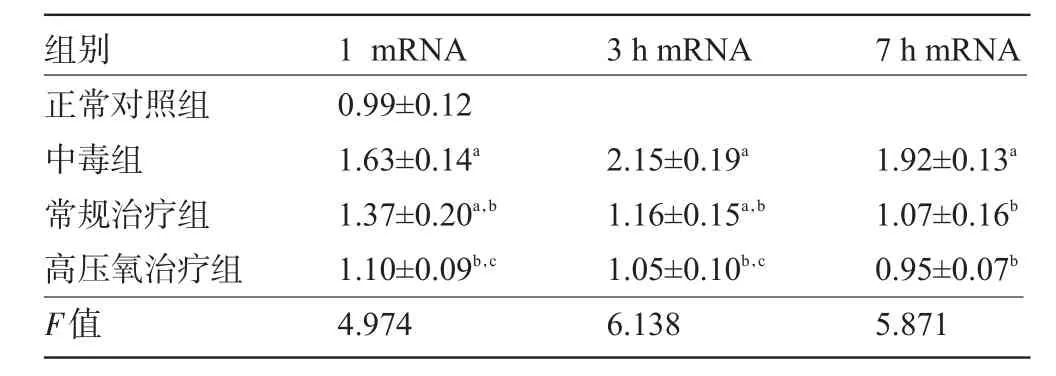
表1 各組大鼠海馬HIF-1mRNA相對(duì)表達(dá)量的變化(±s)
注:a與正常對(duì)照組比較,p<0.05;同一時(shí)間點(diǎn),b與中毒組比較,P<0.05;c與常規(guī)治療組比較,P<0.05。
3 h mRNA 7 h mRNA組別正常對(duì)照組中毒組常規(guī)治療組高壓氧治療組F值1 mRNA 0.99±0.12 1.63±0.14a1.37±0.20a,b1.10±0.09b,c4.974 2.15±0.19a1.16±0.15a,b1.05±0.10b,c6.138 1.92±0.13a1.07±0.16b0.95±0.07b5.871
2.2 血清中超氧化物歧化酶(SOD)活性的變化 與正常對(duì)照組比較,中毒組SOD活性依次下降,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);與中毒組比較,常規(guī)治療組和高壓氧治療組SOD活性依次升高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);與常規(guī)治療組比較,高壓氧治療組SOD活性依次升高,1 h差異有統(tǒng)計(jì)學(xué)意義(P<0.05),3 h、7 h差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),見表2。
表2 各組大鼠血清中SOD活性的變化(±s)
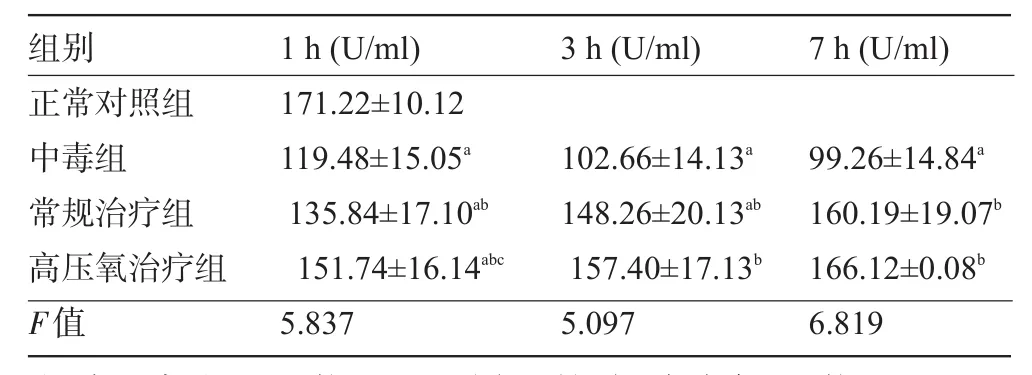
表2 各組大鼠血清中SOD活性的變化(±s)
注:a與正常對(duì)照組比較,P<0.05;同一時(shí)間點(diǎn),b與中毒組比較,P<0.05;c與常規(guī)治療組比較,P<0.05。
7 h(U/ml) 3 h(U/ml)組別1 h(U/ml)正常對(duì)照組中毒組常規(guī)治療組高壓氧治療組F值171.22±10.12 119.48±15.05a135.84±17.10ab151.74±16.14abc5.837 102.66±14.13a148.26±20.13ab157.40±17.13b5.097 99.26±14.84a160.19±19.07b166.12±0.08b6.819
2.3 血清中丙二醛(MDA)含量的變化 與正常對(duì)照組比較,中毒組MDA含量依次增高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);與中毒組比較,常規(guī)治療組和高壓氧治療組MDA含量依次降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);與常規(guī)治療組比較,高壓氧治療組MDA含量依次降低,1 h、3 h差異有統(tǒng)計(jì)學(xué)意義(P<0.05),7 h差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),見表3。
表3 各組大鼠血清中MDA含量的變化(±s)
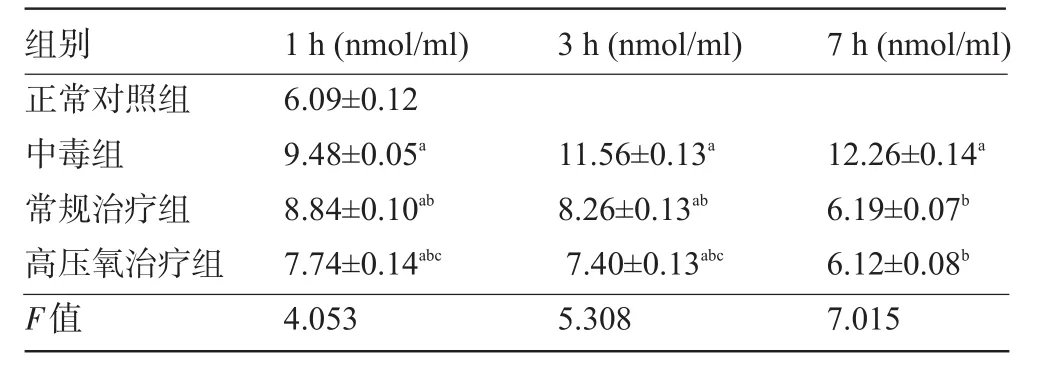
表3 各組大鼠血清中MDA含量的變化(±s)
注:a與正常對(duì)照組比較,P<0.05;同一時(shí)間點(diǎn),b與中毒組比較,P<0.05;c與常規(guī)治療組比較,P<0.05。
組別3 h(nmol/ml)7 h(nmol/ml) 1 h(nmol/ml)正常對(duì)照組中毒組常規(guī)治療組高壓氧治療組F值12.26±0.14a6.19±0.07b6.12±0.08b7.015 6.09±0.12 9.48±0.05a8.84±0.10ab7.74±0.14abc4.053 11.56±0.13a8.26±0.13ab7.40±0.13abc5.308
3 討論
缺氧誘導(dǎo)因子-1(HIF-1)是目前所知的最重要的缺氧感受因子,是一個(gè)調(diào)節(jié)低氧時(shí)機(jī)體反應(yīng)的關(guān)鍵基因[9]。在不同細(xì)胞、不同缺氧時(shí)期和不同缺氧程度時(shí),HIF-1α的功能也不盡相同的,既可發(fā)揮神經(jīng)保護(hù)作用,也可導(dǎo)致神經(jīng)毒性損傷[10]。還有研究亦表明,低氧可導(dǎo)致血管通透性升高,可引起血管源性水腫,并可引起HIF-1α的表達(dá)水平升高[11]。因此,HIF-1α可以作為腦組織缺氧缺血的標(biāo)志物。
缺血缺氧是急性有機(jī)磷中毒性腦損傷的發(fā)病機(jī)制之一[12]。本實(shí)驗(yàn)研究發(fā)現(xiàn),與正常對(duì)照組比較中毒性腦損傷后海馬HIF-lαmRNA的表達(dá)均明顯增高,并呈現(xiàn)一定的規(guī)律。損傷后1 h即出現(xiàn)表達(dá)增加,3 h達(dá)高峰,隨著有機(jī)磷毒性的減弱和缺氧改善、復(fù)氧開始,通過泛素-蛋白溶解酶體通路降解,7 h就發(fā)現(xiàn)其已經(jīng)開始下降,但仍高于正常對(duì)照組。因損傷區(qū)海馬是對(duì)缺血缺氧較敏感的組織,HIF-lαmRNA表達(dá)的增高,表明急性有機(jī)磷中毒性腦損傷發(fā)生與缺血缺氧有關(guān)。給予HBO治療后,HIF-1αmRNA在1 h就明顯下降,低于中毒組及常規(guī)治療組,3 h、7 h時(shí)間點(diǎn)繼續(xù)下降。實(shí)驗(yàn)結(jié)果與相關(guān)的文獻(xiàn)報(bào)道亦相符[13],HBO能通過增加缺血缺氧組織的氧含量,使得缺氧誘導(dǎo)的HIF-1α表達(dá)明顯下調(diào),起到腦保護(hù)作用,且越早應(yīng)用療效越好。
MDA是脂質(zhì)過氧化損傷的最終代謝產(chǎn)物,SOD被認(rèn)為是清除超氧陰離子自由基的主要抗氧化劑[14],檢測(cè)兩者在血清中的變化,可間接反映氧自由基的釋放與清除情況。本研究發(fā)現(xiàn),急性有機(jī)磷中毒時(shí)血清中MDA含量逐漸增多,同時(shí)SOD活性逐漸下降,表明機(jī)體發(fā)生了氧化應(yīng)激反應(yīng),導(dǎo)致抗氧化酶大量被消耗,超過機(jī)體的清除能力,造成組織損害,且神經(jīng)細(xì)胞更易受損[15]。高壓氧治療組中毒大鼠血清MDA含量下降、SOD活性升高,表明HBO治療能增強(qiáng)機(jī)體抗氧化能力,降低神經(jīng)細(xì)胞受氧自由基攻擊的損傷程度。
綜上所述,HIF-1α參與了急性有機(jī)磷中毒性腦損傷的病理生理過程,HBO能通過改善腦組織缺血缺氧,使得缺氧誘導(dǎo)的HIF-1αmRNA表達(dá)明顯下調(diào),并上調(diào)抗氧化酶的表達(dá),清除氧自由基,減輕神經(jīng)細(xì)胞水腫,從而發(fā)揮腦保護(hù)作用,且越早干預(yù)效果越好。
[1]Zhu H,O'Brien JJ,O'Callaghan JP,et al.Nerve agent exposure elicits site-specific changes in protein phosphorylation in mouse brain [J].Brain Research,2010,1342:11-23.
[2]Lou M,Zhang H,Wang J,et al.Hyperbaric oxygen treatment attenuated the decrease in regional glucose metabolism of rats subjected to focal cerebral ischemia:a high resolution positron emission tomography study[J].Neuroscience,2007,146(2):555-561.
[3]Lim SW,Wang CC,Wang YH,et al.Microglial activation induced by traumatic brain injury is suppressed by postinjury treatment with hyperbaric oxygen therapy[J].Journal of Surgical Research,2013, 184(2):1076-1084.
[4]曹義戰(zhàn),李志立,仲月霞,等.高壓氧治療急性一氧化碳中毒遲發(fā)性腦病的療效觀察[J].中華急診醫(yī)學(xué)雜志,2009,17(4):412-415.
[5]周建光,季玉峰,劉長(zhǎng)云,等.高壓氧對(duì)腦缺血再灌注海馬神經(jīng)元Bcl-2和Bax蛋白表達(dá)的影響[J].中國(guó)臨床康復(fù),2013,7(16): 2278-2279.
[6]崔文玉,張雁芳,潘志遠(yuǎn),等.賓賽克嗪拮抗M和N膽堿受體的特征及其抗膽堿酯酶抑制劑的毒性效應(yīng)[J].中國(guó)藥理學(xué)通報(bào),2012, 27(7):915-921.
[7]Baille V,Clarke PGH,Brochier G,et al.Soman-induced convulsions:the neuropathology revisited[J].Toxicology,2010,215(1): 1-24.
[8]謝智慧,陳宗平,曹 瑞,等.高壓氧干預(yù)對(duì)大鼠腎缺血再灌注損傷腎組織低氧誘導(dǎo)因子-1αmRNA表達(dá)的影響[J].中華物理醫(yī)學(xué)與康復(fù)雜志,2010,32(3):182-185.
[9]Ergorul C,Ray A,Huang W,et al.Hypoxia inducible factor-1α(HIF-1α)and some HIF-1 target genes are elevated in experimental glaucoma[J].Journal of Molecular Neuroscience,2010,42(2): 183-191.
[10]Vangeison G,Carr D,Federoff HJ,et al.The good,the bad,and the cell type-specific roles of hypoxia inducible factor-1αin neurons and astrocytes[J].The Journal of Neuroscience,2008,28(8): 1988-1993.
[11]Semenza GL.Hydroxylation of HIF-1:oxygen sensing at the molecular level[J].Physiology,2004,19(4):176-182.
[12]孫建平,何漢群,張愛蓮.有機(jī)磷農(nóng)藥中毒的神經(jīng)系統(tǒng)損害[J].中華急診醫(yī)學(xué)雜志,2007,16(6):666-668.
[13]王光勝,張克忠,王元偉,等.高壓氧對(duì)大鼠腦缺血再灌注損傷的保護(hù)作用及其對(duì)低氧誘導(dǎo)因子-1的影響[J].中風(fēng)與神經(jīng)疾病雜志,2010,27(4):360-362.
[14]王 靜,汪青松,黃海麗,等.依達(dá)拉奉聯(lián)合高壓氧對(duì)CO中毒遲發(fā)性腦病小鼠血清MDA水平,SOD活性及海馬神經(jīng)元凋亡的影響[J].安徽醫(yī)科大學(xué)學(xué)報(bào),2012,47(4):383-387.
[15]Román GC,Erkinjuntti T,Wallin A,et al.Subcortical ischaemic vascular dementia[J].The Lancet Neurology,2012,1(7):426-436.
Effect of hyperbaric oxygen on hypoxia inducible factor-1alpha mRNA in hippocampus and oxygen free radicals after acute organophosphate poisoning.
YANG Yong1,YANG Jing-lian2,XIE Zhi-hui2.1.Department of Integrated Medicine,Dongfeng Hospital Affiliated to Hubei University of Medicine,Shiyan 442008,Hubei,CHINA;2. Department of Hyperbaric Oxygenation,Affiliated Hospital of Zunyi Medical College,Zunyi 563003,Guizhou,CHINA
ObjectiveTo investigate the mechanism of hyperbaric oxygen(HBO)on brain injury caused by acute organophosphate poisoning.MethodsSixty healthy male SD rats were randomly divided into four groups:control group(n=6),poisoning group(n=18),routine group(n=18)and hyperbaric oxygen group(n=18).All rats were sacrificed 1 h,3 h,7 h after model establishment(six rats at each time point),and the blood samples were taken from inferior caval vein,followed by the measurement of malondialdehyde(MDA)content and superoxide dismutase (SOD)activity.The quantitative real time PCR was used to detect the expression of HIF-1αmRNA in the hippocampus.ResultsAfter the treatment of hyperbaric oxygen,the expression of HIF-1αmRNA and serum MDA content were significantly lower than that of both in the poisoning group(P<0.05).Meanwhile,the serum SOD activity was significantly higher(P<0.05).ConclusionThe mechanism of hyperbaric oxygen intervention against AOPP-induced brain injury may be the antioxidation and the inhibition of HIF-1αexpression.The best efficacy will be achieved by the intervention immediately after the brain injury.
Acute organophosphorus poisoning;Brain injury;Hypoxia inducible factor-1alpha;Malondialdehyde;Superoxide dismutase;Hyperbaric oxygen
R-332
A
1003—6350(2015)03—0319—03
10.3969/j.issn.1003-6350.2015.03.0116
2014-09-09)
貴州省科技廳資助項(xiàng)目(編號(hào):20092185)
謝智慧。E-mail:xiezhihui71@126.com

