截?cái)嗄嫱旆綄?duì)慢加急性肝衰竭大鼠肝細(xì)胞超微結(jié)構(gòu)、周期蛋白Cyclin E及轉(zhuǎn)錄因子DP1的影響
黨澤方 李金霞 張秋云 崔利娟 穆凌云 高連印 杜宇瓊
作者單位: 100069北京市,首都醫(yī)科大學(xué)中醫(yī)藥學(xué)院首都醫(yī)科大學(xué)絡(luò)病重點(diǎn)實(shí)驗(yàn)室
截?cái)嗄嫱旆綄?duì)慢加急性肝衰竭大鼠肝細(xì)胞超微結(jié)構(gòu)、周期蛋白Cyclin E及轉(zhuǎn)錄因子DP1的影響
黨澤方李金霞張秋云崔利娟穆凌云高連印杜宇瓊
作者單位: 100069北京市,首都醫(yī)科大學(xué)中醫(yī)藥學(xué)院首都醫(yī)科大學(xué)絡(luò)病重點(diǎn)實(shí)驗(yàn)室
【摘要】目的觀察截?cái)嗄嫱旆綄?duì)慢加急性肝衰竭(ACLF)模型大鼠肝細(xì)胞超微結(jié)構(gòu),周期蛋白Cyclin E及轉(zhuǎn)錄因子DP-1表達(dá)的影響,并考察模型24 h病死率和生存時(shí)間,從提高療效、降低死亡、改善肝細(xì)胞超微結(jié)構(gòu)損傷和調(diào)控肝細(xì)胞代償性增殖的角度,分析該方干預(yù)ACLF的部分療效和作用機(jī)制。方法Wistar大鼠61只,隨機(jī)分為正常組、模型組及截?cái)嗄嫱旆浇M。采用豬血清免疫誘導(dǎo)大鼠肝纖維化或肝硬化模型,再給予D-GalN/LPS一次性聯(lián)合腹腔注射進(jìn)行急性攻擊,建立慢加急性肝衰竭大鼠模型。截?cái)嗄嫱旆浇M在急性攻擊后給予水煎液灌胃連續(xù)3 d,模型組和截?cái)嗄嫱旆浇M大鼠分別在4、8、12 h處死,取肝組織,進(jìn)行電鏡超微結(jié)構(gòu)觀察,Elisa法測(cè)定Cyclin E及其轉(zhuǎn)錄因子DP1的表達(dá),運(yùn)用IPP 6.0軟件進(jìn)行圖像分析,自動(dòng)計(jì)算出陽(yáng)性物質(zhì)的IOD值。結(jié)果截?cái)嗄嫱旆娇梢匝娱L(zhǎng)模型的存活時(shí)間,與模型組比較,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),在一定程度上減輕ACLF大鼠肝細(xì)胞超微結(jié)構(gòu)的損傷;截?cái)嗄嫱旆浇MCyclin E、DP1 IOD值在8 h時(shí)比4 h低,12 h比8 h有增加(P<0.01),而模型組Cyclin E、DP1 IOD則呈持續(xù)下降(P<0.05)。結(jié)論截?cái)嗄嫱旆娇梢匝娱L(zhǎng)模型大鼠的存活時(shí)間,并能改善肝細(xì)胞超微結(jié)構(gòu),對(duì)肝細(xì)胞代償性增殖有一定的調(diào)控作用。
【關(guān)鍵詞】截?cái)嗄嫱旆?肝衰竭,慢加急性;超微結(jié)構(gòu),Cyclin E; DP-1
項(xiàng)目來(lái)源:北京市自然科學(xué)基金資助項(xiàng)目(編號(hào): 7112017)
E-mail: zhangqiuyun8202@ yahoo.com.cn
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是指在原有肝炎和肝硬化的基礎(chǔ)上發(fā)生急劇而廣泛的肝細(xì)胞壞死,主要表現(xiàn)為大塊或亞大塊壞死,出現(xiàn)以肝功能?chē)?yán)重?fù)p害為主要特征的一種臨床綜合征。該病病情進(jìn)展迅速、病死率高。截?cái)嗄嫱旆绞侨珖?guó)名老中醫(yī)錢(qián)英教授治療慢性乙型肝重型肝炎的經(jīng)驗(yàn)方,臨床研究已證實(shí)其有明確的療效[1]。前期實(shí)驗(yàn)研究結(jié)果也顯示該方對(duì)ACLF模型大鼠肝功能、肝組織有保護(hù)作用,并能減少肝細(xì)胞的凋亡和壞死,降低模型大鼠的死亡率[2-5]。肝細(xì)胞異常凋亡減輕的同時(shí),由凋亡引導(dǎo)的代償性增殖增強(qiáng)是改善肝臟壞死、挽救死亡的重要機(jī)制[6-8]。在前期工作基礎(chǔ)上,本研究考察該方對(duì)肝細(xì)胞超微結(jié)構(gòu)、肝細(xì)胞周期蛋白E(Cyclin E)及轉(zhuǎn)錄因子蛋白1(DP1)的影響,并考察模型24 h死亡率和生存時(shí)間,從改善病理變化和調(diào)節(jié)肝細(xì)胞代償性增殖的角度,進(jìn)一步闡明截?cái)嗄嫱旆礁深A(yù)ACLF的機(jī)制。
1 材料與方法
1.1實(shí)驗(yàn)動(dòng)物Wistar大鼠61只,SPF級(jí),雄性,體重120~150 g,購(gòu)自中國(guó)人民解放軍軍事醫(yī)學(xué)科學(xué)院實(shí)驗(yàn)動(dòng)物中心,動(dòng)物合格證號(hào): SCXK-(軍) 2007-004。飼養(yǎng)于首都醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物科學(xué)部屏障設(shè)施動(dòng)物實(shí)驗(yàn)房,實(shí)驗(yàn)室合格證號(hào): SYXK(京) 2005-0022。IVC大鼠自動(dòng)換氣飼養(yǎng)系統(tǒng),分籠飼養(yǎng),每籠3只,自由進(jìn)食飲水。溫度(23.0±1.0)℃,相對(duì)濕度(45.0±1.0) %,每隔12 h開(kāi)燈照明。動(dòng)物墊料和喂養(yǎng)飼料由動(dòng)物房提供,經(jīng)高溫消毒后傳遞到實(shí)驗(yàn)室,動(dòng)物飲用水由動(dòng)物房水處理系統(tǒng)處理成酸化水后給動(dòng)物飲用。
1.2藥品截?cái)嗄嫱旆?由苦味葉下珠30 g、瓜蔞30 g、金錢(qián)草30 g、生黃芪30 g、槲寄生30 g、三七6 g、莪術(shù)6 g、丹參20 g、生地20 g、黑附片15 g(先煎)組成。所有藥材均購(gòu)自北京同仁堂中醫(yī)醫(yī)院中藥房,經(jīng)過(guò)生藥鑒定確認(rèn)后由首都醫(yī)科大學(xué)中醫(yī)藥學(xué)院實(shí)驗(yàn)中心煎制,含生藥量為4.34 g/ml,4℃冰箱冷藏保存?zhèn)溆茫褂脮r(shí)微溫。
1.3試劑豬血清:北京元亨圣馬生物技術(shù)研究所,批號(hào): 120308; D-氨基半乳糖(D-galactosamine,DGalN) : 5 g,sigma公司,批號(hào): 070M1194V;脂多糖(lippolysaccharide,LPS ) : 10 mg,sigma公司,批號(hào): 032M4082V;羊血清原液(中杉金橋,批號(hào): 130908)、兔超敏二步法試劑盒(中杉金橋,PV-9001,批號(hào): K143303A)、DAB試劑盒(中杉金橋,ZLI-9018,批號(hào): K146720D) Anti-DP1(santa cruz,sc610,批號(hào): L2309)、Anti-CyclinE(santa cruz,sc-481,批號(hào): E1413)。
1.4方法
1.4.1大鼠ACLF模型建立:①免疫誘導(dǎo)階段:大鼠適應(yīng)性喂養(yǎng)1周后,按體重將動(dòng)物隨機(jī)分為正常組6只和處理組55只。處理組腹腔注射豬血清,0.5 ml/只,每周2次,共注射13周,整個(gè)造模過(guò)程中死亡2只,死亡率0.04%。造模結(jié)束后,隨機(jī)抽取3只處理組大鼠處死,取肝右葉經(jīng)10%甲醛固定后,切片,行蘇木素-伊紅(HE)染色,光鏡下病理觀察,均達(dá)到肝纖維化/肝硬化標(biāo)準(zhǔn)(肝纖維化程度S3~S4期病理組織學(xué)改變[3])。正常組腹腔注射同等體積的0 9%氯化鈉溶液。②急性攻擊階段:將處理組存活的50只大鼠,根據(jù)體重隨機(jī)分為模型組25只和截?cái)嗄嫱旆浇M25只。模型組和截?cái)嗄嫱旆浇M參照吳其愷等[6]造模方法給予D-GaLN 800 mg/kg和LP 100 μg/kg聯(lián)合腹腔注射進(jìn)行急性攻擊,一次性造成ACLF模型。
1.4.2給藥及分組:截?cái)嗄嫱旆浇M在急性攻擊前取等效劑量水煎劑連續(xù)灌胃3 d,每天2次,每次1.75 ml/只(含生藥量總計(jì)為4.34 g/ml),正常組及模型組給予相同體積的0.9%氯化鈉溶液。模型組和截?cái)嗄嫱旆浇M在急性攻擊后,再根據(jù)體重隨機(jī)分為模型4 h組、模型8 h組、模型12 h組、模型24 h組,截?cái)嗄嫱旆? h組、截?cái)嗄嫱旆? h組、截?cái)嗄嫱旆?2 h組截?cái)嗄嫱旆?4 h組。模型24 h組和截?cái)嗄嫱旆?4組用于生存時(shí)間和死亡率的觀察。其中模型4、8、12組及截?cái)嗄嫱旆?、8、12 h組每組均為6只。模型24組和截?cái)嗄嫱旆?4 h組每組7只。
1.4.3取材:急性攻擊后4、8、12 h點(diǎn)處各組平行取材。各組大鼠均取肝右相同部位的葉組織放入10%甲醛溶液固定24 h,進(jìn)行包埋、切片。
1.4.4觀察指標(biāo)與方法
1.4.4.124 h病死率及生存時(shí)間的觀察:記錄模型組、截?cái)嗄嫱旆?4 h組大鼠在急性攻擊后到24 h內(nèi)的死亡的時(shí)間,進(jìn)行統(tǒng)計(jì)分析,24 h后仍存活的生存時(shí)間記為24 h,并統(tǒng)計(jì)2組大鼠24 h內(nèi)死亡數(shù)量,計(jì)算死亡率,進(jìn)行比較分析。
1.4.4.2肝組織超微結(jié)構(gòu)的觀察:置于2.5%戊二醛磷酸緩沖液中的肝組織放入4℃冰箱固定2 h以上之后,經(jīng)0.1 mol/L冷磷酸緩沖液沖洗3次,每次10 min后將標(biāo)本置入1%鋨酸繼續(xù)固定2 h。梯度丙酮脫水(70%、95%、100%各30 min,室溫),丙烯氧化物室溫浸透2次,各30 min,丙烯氧化物與Epon2812樹(shù)脂混合物浸透過(guò)夜,Epon2812樹(shù)脂包埋,32℃聚合24 h 45℃聚合12 h,60℃聚合24 h。半薄切片經(jīng)甲苯胺藍(lán)染色后在光鏡下定位。玻璃刀70 nm超薄切片,醋酸鈾及檸檬酸鉛雙重染色后,在JEM-1230型透射電鏡下觀察及拍照。
1.4.4.3Cyclin E及DP1的表達(dá):免疫組化SP法檢測(cè)肝組織中Cyclin E及DP1的表達(dá),具體步驟按照說(shuō)明書(shū)操作。先分別于400X高倍鏡下隨機(jī)選取8個(gè)視野進(jìn)行觀察并照相,其中棕色部分為陽(yáng)性物質(zhì),然后運(yùn)用IPP6.0軟件進(jìn)行圖像分析,選擇切片空白區(qū)校正并調(diào)整光源和灰度,對(duì)陽(yáng)性物質(zhì)進(jìn)行標(biāo)記,由計(jì)算機(jī)系統(tǒng)自動(dòng)計(jì)算出陽(yáng)性物質(zhì)的IOD值,量化描述每個(gè)視野中Cyclin E、DP1的表達(dá)程度,取8個(gè)視野IOD值的平均值進(jìn)行對(duì)比分析。
1.5統(tǒng)計(jì)學(xué)分析應(yīng)用SPSS 12.0統(tǒng)計(jì)軟件,計(jì)量資料以±s表示,采用兩獨(dú)立樣本t檢驗(yàn),計(jì)數(shù)資料比較采用獨(dú)立樣本2×2列聯(lián)表資料的χ2檢驗(yàn),P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.12組大鼠24 h死亡率和生存時(shí)間比較急性攻擊后24 h內(nèi)多數(shù)造模大鼠死于肝衰竭,符合ACLF死亡率高的特點(diǎn)。模型24 h組7只死亡6只,死亡率為85.7%;截?cái)嗄嫱旆?4 h組7只死亡5只,死亡率為74.1%,模型組低于截?cái)嗄嫱旆浇M,但差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。截?cái)嗄嫱旆浇M存活時(shí)間明顯長(zhǎng)于模型組(P<0.05)。見(jiàn)表1。
表1 2組大鼠死亡率和生存時(shí)間比較n=7,h,±s

表1 2組大鼠死亡率和生存時(shí)間比較n=7,h,±s
注:與模型組比較,*P<0.05
組別生存時(shí)間模型組15.07±4.06截?cái)嗄嫱旆浇M 20.30±3.79*
2.2對(duì)超微結(jié)構(gòu)的影響
2.2.1正常組肝細(xì)胞結(jié)構(gòu)正常,細(xì)胞核圓形,位于細(xì)胞的中央,糖元豐富,粗面內(nèi)質(zhì)網(wǎng)發(fā)達(dá),表面分布較多核糖體,肝細(xì)胞質(zhì)內(nèi)偶見(jiàn)脂滴;線粒體豐富,單位膜結(jié)構(gòu)清晰,嵴稀疏短小;肝竇內(nèi)皮細(xì)胞扁平,有較多窗孔;肝竇內(nèi)可見(jiàn)到Kupffer細(xì)胞,表面有較多的突起,細(xì)胞質(zhì)內(nèi)可見(jiàn)溶酶體。見(jiàn)圖1。
2.2.2模型4 h組肝細(xì)胞結(jié)構(gòu)尚正常,細(xì)胞核形態(tài)不規(guī)則,核膜部分凹陷,糖元及粗面內(nèi)質(zhì)網(wǎng)較正常組減少,體表核糖體少量脫顆粒。細(xì)胞質(zhì)內(nèi)脂滴較多;線粒體單位膜仍較清晰,嵴斷裂,但仍有部分保留;肝竇內(nèi)皮細(xì)胞窗孔消失,并見(jiàn)基底膜形成; Kupffer細(xì)胞內(nèi)溶酶體豐富,吞噬物較多,細(xì)胞體積增大。見(jiàn)圖1。
2.2.3截?cái)嗄嫱旆浇M4 h組肝細(xì)胞結(jié)構(gòu)正常,細(xì)胞核圓形,位于細(xì)胞的中央,未見(jiàn)核膜凹陷,糖元較正常組明顯減少,然粗面內(nèi)質(zhì)網(wǎng)仍較豐富,體表核糖體部分脫顆粒,細(xì)胞質(zhì)內(nèi)可見(jiàn)脂滴形成,然較模型4 h組少;線粒體單位膜仍較清晰,少量嵴斷裂,大部分仍保留;肝竇內(nèi)皮細(xì)胞窗孔消失,并見(jiàn)基底膜形成; Kupffer細(xì)胞內(nèi)溶酶體豐富,細(xì)胞體積較大。見(jiàn)圖1。
2.2.4模型8 h組肝細(xì)胞結(jié)構(gòu)破壞,胞膜破裂,胞核皺縮,呈蟲(chóng)噬狀,內(nèi)部染色質(zhì)凝集固縮,糖元與粗面內(nèi)質(zhì)網(wǎng)均明顯減少,體表核糖體脫顆粒明顯,有體積較大的脂肪滴散在分布,細(xì)胞質(zhì)內(nèi)可見(jiàn)炎性細(xì)胞及部分紅細(xì)胞浸潤(rùn);線粒體數(shù)量較前減少,部分形態(tài)發(fā)生變化,嵴斷裂,多數(shù)消失;細(xì)胞間連接結(jié)構(gòu)破壞,可見(jiàn)結(jié)構(gòu)不清的壞死灶; Kupffer細(xì)胞內(nèi)溶酶體豐富,因吞噬凋亡小體或壞死物質(zhì)胞體增大,可見(jiàn)到次級(jí)溶酶體。見(jiàn)圖1。
2.2.5截?cái)嗄嫱旆浇M8 h組部分肝細(xì)胞膜破裂,胞核因遭擠壓移到胞質(zhì)周邊部,核膜較4 h時(shí)皺縮,內(nèi)部染色質(zhì)凝集固縮,糖元與粗面內(nèi)質(zhì)網(wǎng)均明顯減少,體表核糖體脫顆粒明顯,但較模型8 h組少,脂滴形成較少線粒體數(shù)量較前減少,嵴斷裂,多數(shù)消失,但較模型8組破壞程度輕;出現(xiàn)細(xì)胞間連接結(jié)構(gòu)破壞,并可見(jiàn)結(jié)構(gòu)不清的壞死灶; Kupffer細(xì)胞內(nèi)溶酶體豐富,因吞噬凋亡小體或壞死物質(zhì)胞體增大,可見(jiàn)到次級(jí)溶酶體。見(jiàn)圖1。
2.2.6模型12 h組肝細(xì)胞膜破裂并消失,細(xì)胞核崩解,糖元消失,僅有少量粗面內(nèi)質(zhì)網(wǎng)保留,體表核糖體脫顆粒嚴(yán)重,脂滴大量形成。壞死灶滿視野,內(nèi)部可見(jiàn)大量炎性細(xì)胞及紅細(xì)胞浸潤(rùn);線粒體數(shù)目明顯減少,固縮,嵴斷裂,消失; Kupffer細(xì)胞吞噬大量壞死物質(zhì)胞體較前增大,次級(jí)溶酶體較多。見(jiàn)圖1。
2.2.7截?cái)嗄嫱旆浇M12 h組肝細(xì)胞膜破裂并消失細(xì)胞核皺縮,內(nèi)部染色質(zhì)凝集固縮,未出現(xiàn)崩解現(xiàn)象糖元消失,僅有少量粗面內(nèi)質(zhì)網(wǎng)保留,體表核糖體脫顆粒明顯,脂滴大量形成,壞死灶滿視野,內(nèi)部可見(jiàn)炎性細(xì)胞及紅細(xì)胞浸潤(rùn),但較模型12 h組少;線粒體數(shù)目明顯減少,少見(jiàn)固縮,多數(shù)嵴斷裂,消失,Kupffer細(xì)胞吞噬大量壞死物質(zhì)胞體增大,次級(jí)溶酶體較多。見(jiàn)圖1。
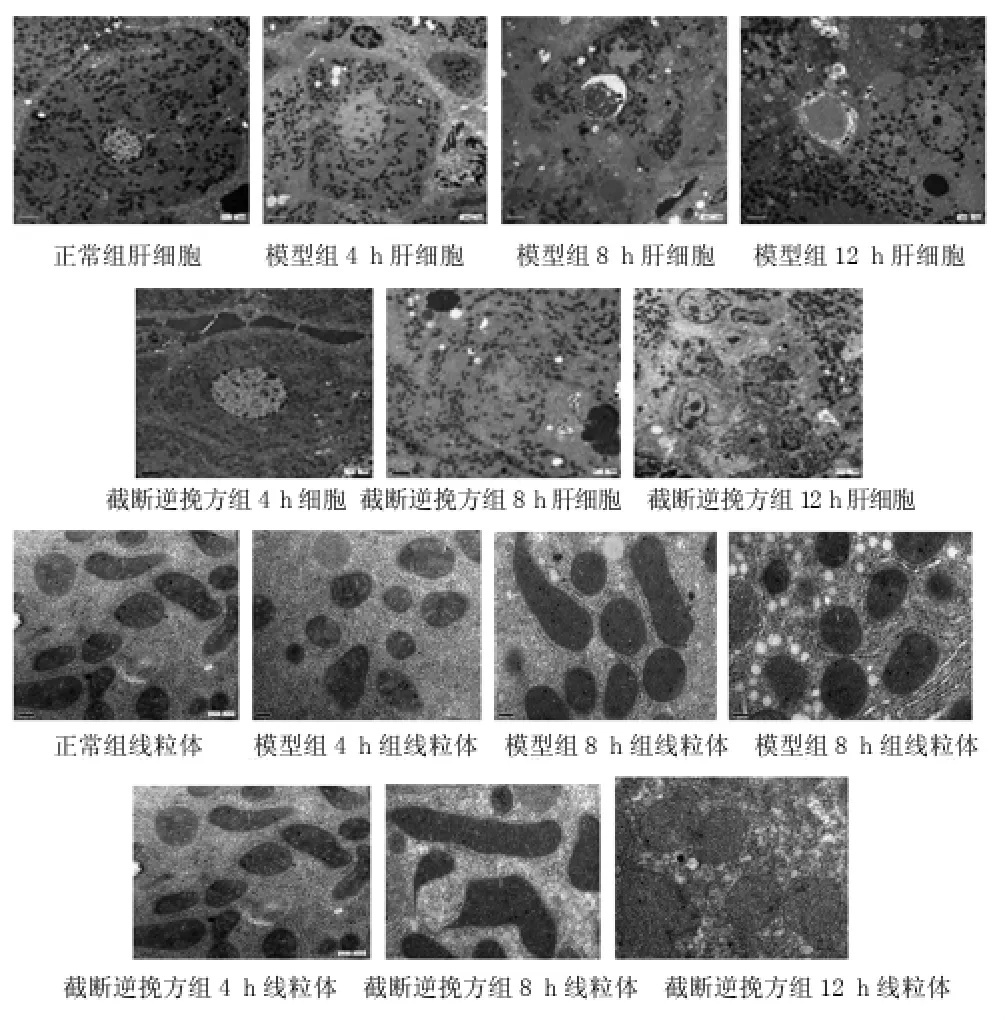
圖1 2組大鼠肝臟超微結(jié)構(gòu)變化(肝細(xì)胞×3 000,線粒體×30 000)
以上結(jié)果提示,截?cái)嗄嫱旆浇M4 h、8 h、12 h組較相應(yīng)時(shí)間點(diǎn)的模型組肝細(xì)胞核、糖元和粗面內(nèi)質(zhì)網(wǎng)及線粒體等破壞程度有一定的改善,說(shuō)明該方對(duì)ACLF大鼠肝臟超微結(jié)構(gòu)的損傷有一定的保護(hù)作用。
2.3對(duì)大鼠肝組織Cyclin E表達(dá)的影響
2.3.1正常組大鼠肝組織Cyclin E有少量表達(dá),模型組4 h、8 h、12 h的表達(dá)均強(qiáng)于正常組;截?cái)嗄嫱旆浇M的表達(dá)較正常組明顯增強(qiáng),但與對(duì)應(yīng)時(shí)間點(diǎn)的模型組比較減輕。見(jiàn)圖2。

圖2 3組大鼠肝組織Cyclin E表達(dá)情況(SP法×400)
2.3.23組不同時(shí)點(diǎn)的肝組織Cyclin E表達(dá)IOD值在4 h、8 h、12 h時(shí)點(diǎn)模型組明顯高于正常組,截?cái)嗄嫱旆浇M雖高于正常組但低于模型組(P<0.05或<0.01)。截?cái)嗄嫱旆浇MCyclin E的表達(dá)在4 h時(shí)降低,8 h時(shí)明顯降低,而12 h時(shí)有所回升。見(jiàn)表2。
表2 3組大鼠肝組織Cyclin E IOD值比較 ×107,±s
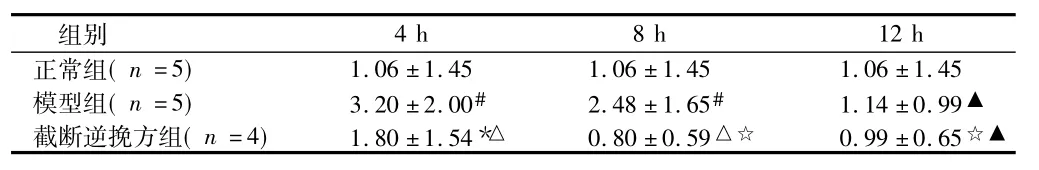
表2 3組大鼠肝組織Cyclin E IOD值比較 ×107,±s
注:與正常組比較,*P<0.05,#P<0.01;與模型組比較,△P<0.01;與4 h比較,☆P<0.01;與8 h組比較,▲P<0.01
組別4 h 8 h 12 h正常組(n=5)1.06±1.45 1.06±1.45 1.06±1.45模型組(n=5) 3.20±2.00# 2.48±1.65# 1.14±0.99▲截?cái)嗄嫱旆浇M(n=4) 1.80±1.54*△ 0.80±0.59△☆ 0.99±0.65☆▲
2.4對(duì)大鼠肝組織DP1表達(dá)的影響
2.4.1正常組大鼠肝組織DP1有少量表達(dá),模型組4 h、8 h、12 h表達(dá)量均顯著高于正常組;截?cái)嗄嫱旆浇MDP1表達(dá)量均高于正常組,但與對(duì)應(yīng)時(shí)間點(diǎn)的模型組比較明顯減弱。見(jiàn)圖3。
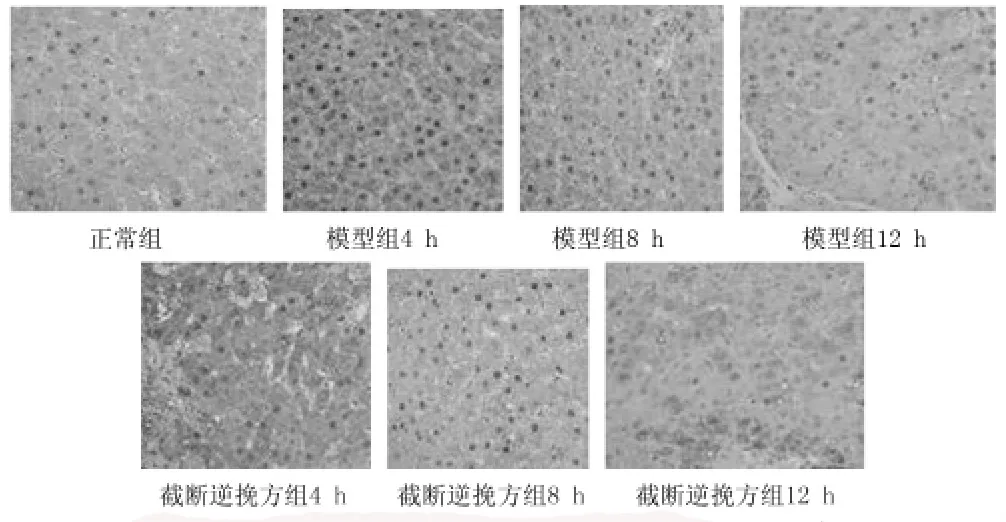
圖3 3組大鼠肝組織DP1表達(dá)情況(SP×400)
2.4.23組不同時(shí)點(diǎn)的肝組織DP1表達(dá)IOD值,在4 h、8 h、12 h時(shí)點(diǎn)模型組明顯高于正常組,截?cái)嗄嫱旆浇M雖高于正常組但低于模型組(P<0.05)。截?cái)嗄嫱旆浇MDP1的表達(dá)在4 h時(shí)降低,8 h時(shí)明顯降低而12 h時(shí)有所回升。見(jiàn)表3。
表3 3組大鼠肝組織DP1 IOD值比較 ×107±s

表3 3組大鼠肝組織DP1 IOD值比較 ×107±s
注:與正常組比較,*P<0.01;與模型組比較,#P<0.01;與4 h比較,△P<0.01;與8比較,☆P<0.01
組別4 h 8 h 12 h正常組(n=5)1.78±2.54 1.78±2.54 1.78±2.54模型組(n=5) 3.85±2.00* 3.53±1.88* 2.52±1.29△截?cái)嗄嫱旆浇M(n=4) 2.71±0.87# 1.64±0.71#△ 2.06±0.72△☆
3 討論
死亡率和存活時(shí)間觀察結(jié)果提示:模型組24 h死亡率為85.7%;截?cái)嗄嫱旆浇M24 h死亡74.1%,兩者比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P<0.05),但后者與前者相比有降低的趨勢(shì); 2組大鼠的存活時(shí)間比較,截?cái)嗄嫱旆浇M明顯長(zhǎng)于模型組(P<0.05)。可見(jiàn)本方對(duì)延長(zhǎng)模型大鼠的存活時(shí)間有效。考察肝細(xì)胞超微結(jié)構(gòu)的病理變化,發(fā)現(xiàn)截?cái)嗄嫱旆浇M4 h、8 h、12 h組較相應(yīng)時(shí)間點(diǎn)的模型組肝細(xì)胞核、糖元和粗面內(nèi)質(zhì)網(wǎng)及線粒體等破壞程度有一定的改善,說(shuō)明該方對(duì)ACLF大鼠肝臟超微結(jié)構(gòu)的損傷有一定的保護(hù)作用,與前期對(duì)肝損傷保護(hù)作用研究的結(jié)果[2,5]一致。
研究發(fā)現(xiàn),ACLF的發(fā)生除肝細(xì)胞壞死外,肝細(xì)胞的異常凋亡在急性肝衰竭過(guò)程中起著重要作用[6,7]而在凋亡的作用下又可以誘導(dǎo)細(xì)胞的增殖,這種現(xiàn)象被稱(chēng)為凋亡誘導(dǎo)的代償性增殖[8]。正常情況下,肝細(xì)胞為暫不增殖細(xì)胞群,即G0期細(xì)胞,在大量肝細(xì)胞凋亡的刺激作用下,肝細(xì)胞可迅速重新進(jìn)入細(xì)胞周期,進(jìn)行增殖再生。轉(zhuǎn)錄起始因子DP1以及細(xì)胞周期蛋白CyclinE都是肝細(xì)胞再生的關(guān)鍵蛋白,DP-1可以正反饋調(diào)節(jié)某些基因的轉(zhuǎn)錄,產(chǎn)生細(xì)胞進(jìn)入S期所必需的蛋白產(chǎn)物,如Cyclin A、Cyclin E,其中CyclinE是肝細(xì)胞進(jìn)入細(xì)胞周期(G1期)的顯著性標(biāo)志[9]。在本實(shí)驗(yàn)中,模型組4 h組大鼠的肝組織中DP-1和Cyclin E的表達(dá)量均顯著高于正常對(duì)照組,推測(cè)這是由于ACL大鼠大量肝細(xì)胞凋亡激活了代償性增殖調(diào)控相關(guān)的通路,從而上調(diào)了DP-1和Cyclin E的表達(dá),到了8 h和12 h,隨著時(shí)間的推移,既往的研究結(jié)果顯示模型組大鼠肝細(xì)胞凋亡逐漸增多[3],而本研究結(jié)果則顯示,細(xì)胞增殖的關(guān)鍵蛋白DP-1和Cyclin E表達(dá)則逐漸減少可見(jiàn)細(xì)胞增殖不足以代償細(xì)胞過(guò)度凋亡,則會(huì)引起肝細(xì)胞大量壞死,使實(shí)驗(yàn)動(dòng)物最終走向死亡。與模型組比較,截?cái)嗄嫱旆? h、8 h組DP-1和Cyclin E的表達(dá)量低于相對(duì)較低,說(shuō)明其所激活的代償性增殖相對(duì)模型組少,這與課題組前期研究結(jié)果一致,因?yàn)榈蛲龀潭容^輕,所激活的代償性增殖則相對(duì)較少[3];到達(dá)12時(shí),截?cái)嗄嫱旆浇MDP-1和Cyclin E表達(dá)與模型組無(wú)明顯差異,且與正常組比較差異也無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),然前期研究結(jié)果則顯示這個(gè)時(shí)間點(diǎn)凋亡明顯增加,可見(jiàn),這時(shí)無(wú)論模型組和截?cái)嗄嫱旆浇M代償性增殖均不能補(bǔ)償異常凋亡,截?cái)嗄嫱旆浇M這個(gè)變化考慮與血藥濃度下降有關(guān)。進(jìn)一步進(jìn)行模型組和截?cái)嗄嫱旆浇M的亞組分析發(fā)現(xiàn),模型組4 h、8 h、12 h時(shí)間點(diǎn)Cyclin E、DP1 IOD值呈持續(xù)下降趨勢(shì),且12 h最低,與4 h、8 h組比較均有統(tǒng)計(jì)學(xué)意義(P<0.01),而截?cái)嗄嫱旆浇M的變化趨勢(shì)則有所不同,Cyclin E、DP1 IOD 值8 h比4 h低,12 h的Cyclin E、DP1 iod值比8 h有所增加(P<0.01)。可見(jiàn),截?cái)嗄嫱旆礁深A(yù)后,不僅可以減輕模型大鼠的異常凋亡,在12 h時(shí)間點(diǎn)肝細(xì)胞代償性增殖相對(duì)8 h有回升的趨勢(shì),這個(gè)結(jié)果提示,如果后續(xù)繼續(xù)給藥治療,有可能出現(xiàn)異常凋亡繼續(xù)減輕,代償性增殖逐漸增強(qiáng),改善動(dòng)物最終走向死亡的不良結(jié)局,然其調(diào)控代償性增殖的具體途徑及繼續(xù)給藥治療后的結(jié)果尚不確定,值得進(jìn)一步研究。
課題組前期建立慢性重型肝炎“毒損肝體”的病因病機(jī)理論,認(rèn)為毒瘀與正虛交織是乙型慢性重型肝炎的病機(jī)特點(diǎn)[10],截?cái)嗄嫱旆秸轻槍?duì)這個(gè)病機(jī)特點(diǎn),同時(shí)采用解毒化瘀、扶助正氣的法則,運(yùn)用苦味葉下珠、瓜蔞、金錢(qián)草、生黃芪、槲寄生、三七、莪術(shù)、丹參、生地、黑附片等藥,達(dá)到截?cái)嗖?shì),扶正祛邪之目的。腸源性?xún)?nèi)毒素血癥對(duì)肝臟的“二次打擊”是ACLF發(fā)病的關(guān)鍵因素之一,內(nèi)毒素既可以直接損傷肝臟,又可以通過(guò)激活Kuffer細(xì)胞釋放細(xì)胞因子、炎性介質(zhì)(如TNF-α、IL-1、IL-6)等引起肝臟炎癥及肝臟微循環(huán)障礙,從而造成肝損傷。現(xiàn)代藥理發(fā)現(xiàn),生黃芪、黃芪總提取物、黃芪多糖等具有抑制內(nèi)毒素對(duì)肝細(xì)胞的直接或間接的損傷[11-13];生地則可以增加細(xì)胞免疫功能,有促進(jìn)網(wǎng)狀內(nèi)皮系統(tǒng)吞噬功能、增加外周血T淋巴細(xì)胞的作用,其有效成分水蘇糖可以加速腸道內(nèi)有毒物質(zhì)排出,減清腸源性?xún)?nèi)毒素對(duì)肝臟的“二次打擊”[14];三七則可以增強(qiáng)免疫能力、改善肝臟微循環(huán)、減少線粒體內(nèi)質(zhì)網(wǎng)等細(xì)胞器的損傷[15]。這些藥理研究成果也可以作為截?cái)嗄嫱旆綔p輕ACLF模型大鼠肝細(xì)胞超微結(jié)構(gòu)病理變化的佐證。
綜上所述,截?cái)嗄嫱旆娇梢匝娱L(zhǎng)模型大鼠的存活時(shí)間,并能改善肝細(xì)胞超微結(jié)構(gòu),對(duì)肝細(xì)胞代償性增殖有一定的調(diào)控作用。
參考文獻(xiàn)
1胡建華,錢(qián)英,姚乃禮,等.“截?cái)嗄嫱旆ā敝委熉砸倚椭匦透窝着R床療效觀察.中西醫(yī)結(jié)合肝病雜志,2010,20: 200-203.
2崔利娟,黨澤方,張秋云,等.截?cái)嗄嫱旆綄?duì)慢加急性肝衰竭大鼠血清ET、肝組織TNF-а含量及肝組織TNFR1表達(dá)的影響.北京中醫(yī)藥,2013,32: 134-138.
3吳文秀,崔利娟,陳煜,等.截?cái)嗄嫱旆綄?duì)慢加急性肝衰竭大鼠肝細(xì)胞凋亡指數(shù)及caspase8/3表達(dá)的影響.北京中醫(yī)藥,2012,31: 62 64.
4吳文秀,張秋云,崔利娟,等.截?cái)嗄嫱旆浇档吐蛹毙愿嗡ソ叽笫笏劳雎实臋C(jī)制探討.中國(guó)醫(yī)藥學(xué)導(dǎo)刊,2012,18: 6-8,11.
5崔利娟,黨澤方,張秋云,等.截?cái)嗄嫱旆綄?duì)慢加急性肝衰竭大鼠血清TNF-а、IL-1β及IL-6的影響.中醫(yī)藥導(dǎo)報(bào),2013,19: 8-11.
6吳其愷,楊大國(guó),樂(lè)曉華,等.赤芍承氣湯對(duì)急性肝衰竭大鼠肝細(xì)胞凋亡的影響J.中西醫(yī)結(jié)合肝病雜志,2001,11: 24-26.
7Galle PR,Hofmann WJ,Walkza KH,et al.Involvement of CD95(APO-1 Fas) receptor and ligand in liver damage.J Exp Med,1995,182: 1223 1230.
8藏國(guó)慶,周霞秋,俞紅,等.腫瘤壞死因子-α誘導(dǎo)肝細(xì)胞凋亡在暴發(fā)性肝衰竭中的作用.中華消化雜志,2000,20: 163-166.
9Nakano K,Chijiiwa K,Tanaka M.Lower activity of CCAAT/Enhance binding protein and expression of cyclin E,but not cyclinD1,activatin protein-1 and p21WAF1,after partial hepatectomy in obstructive jaun dice.Biochem Biophys Res Commun,2001,280: 640-645.
10張秋云,劉紹能,李秀惠,等.慢性病毒性乙型重型肝炎“毒損肝體病因病機(jī)及治療思路探討.遼寧中醫(yī)雜志,2005,32: 19-21.
11李曉東,徐建良,姜楠,等.內(nèi)毒素對(duì)大鼠肝細(xì)胞線粒體膜電位的影響及黃芪注射液的干預(yù)作用.中西醫(yī)結(jié)合肝病雜志,2005,15: 357 58,361
12楊雁,陳敏珠.黃芪總提取物對(duì)體外肝細(xì)胞損傷的保護(hù)作用.中國(guó)臨床藥理學(xué)與治療學(xué),2000,5: 294-297.
13袁媛,孫梅.黃芪多糖對(duì)LPS損傷小腸上皮細(xì)胞的保護(hù)作用.世界華人消化雜志,2008,16: 15-19.
14王樸.生地黃的現(xiàn)代藥理研究與臨床應(yīng)用.中國(guó)中醫(yī)藥現(xiàn)代遠(yuǎn)程教育,2008,6: 986.
15馮陸冰,潘西芬,孫澤玲.三七的藥理作用研究進(jìn)展.中國(guó)藥師2008,11: 1185-1187.
Effects of truncation and inversion prescription on the ultrastructure,Cyclin E and its transcription factor DP-1 in rats with ACLF
DANG Zefang,LI Jinxia,ZHANG Qiuyun et al.
TCM College,Capital Medical University,Beijing 100069, China
【Abstract】Objective To observe the effects of truncation and inversion prescription on the ultrastructure,Cyclin E and its transcription factor DP-1 in liver cells of model rats with acute-on-chronic liver failure (ACLF),to explore 24-hour mortality and survival time of rat models and to analyze the therapeutic effects and action mechanism of the prescription on ACLF.Methods Sixty-one Wistar rats were randomly divided into three groups: normal control group,model group and Chinese traditional medicine group (TCM group).The rat models with hepatic fibrosis or hepatic cirrhosis were established by immune induction of pig serum,then D-GalN/LPS one-time combination intraperitoneal injection was performed to establish the rat models with acute hepatic failure.After the animal models were established,the rats were treated by truncation and inversion prescription decoction through gavage for 3 days,then the rats in model group and TCM group were sacrificed respectively at 4h,8h,12h,and the ultrastructure changes of liver tissues were observed by electron microscopy,and the expression levels of Cyclin E and its transcription factors DP-1 were detected by ELISA.The images were analyzed by IPP6.0 software,and IOD value in positive substance was automatically calculated.ResultsThe survival time in TCM group was significantly longer than that in model group (P<0.05),furthermore,the ultrastructural injury of liver cells in TCM group was relieved at some extent; the IOD vlue and levels of Cyclin E,DP-1 in TCM group at 8h were obviously lower than those at 4h,however,which in 12h were significantly increased,as compared with those at 8h (P<0.01),but IOD value and levels of Cyclin E,DP-1 in model group were decreased continually.Conclusion Truncation and inversion prescription can prolong survival time of model rats,and can improve the ultrastructure of liver cells,which has regulative effects on compensatory proliferation of liver cells at some extent.
【Key words】truncation and inversion prescription; acute-on-chronic liver failure; ultrastructure; Cyclin E; DP-1
(收稿日期:2014-12-20
通訊作者:張秋云,100069北京市,首都醫(yī)科大學(xué)中醫(yī)藥學(xué)院首都醫(yī)科大學(xué)絡(luò)病重點(diǎn)實(shí)驗(yàn)室;
doi:10.3969/j.issn.1002-7386.2015.09.01
【文章編號(hào)】1002-7386(2015) 09-1285-05
【文獻(xiàn)標(biāo)識(shí)碼】A
【中圖分類(lèi)號(hào)】R 575

