植入式柔性神經刺激微電極研究進展
曹張玉,石云波,徐 勝
(中北大學 電子測試技術重點實驗室,山西 太原030051)
0 引 言
柔性神經刺激微電極主要是用于與神經組織相接觸來治療各種疾病,為了微電極能夠滿足急性或慢性應用的不同要求,需要結合生物醫學、電學、機械工程學以及化學等學科來優化解決各種問題。同時,由于神經電極植入于生物體內,必須考慮電極材料的生物相容性和生物穩定性。目前,神經微電極通常采用柔性聚合物作為襯底材料[1,2],常見的神經電極有篩狀電極、卡夫電極、螺旋電極、劍狀電極以及針形電極陣列。本文主要從柔性神經刺激微電極的類型、結構及其優缺點進行概述,提出柔性刺激微電極面臨的挑戰,并對其發展趨勢進行展望。
1 柔性神經微電極的類型與優缺點
1.1 篩狀電極
篩狀電極是一種神經束內電極,如圖1 所示[3]。它通常是通過平面微加工技術在硅片或聚合物材料上加工微孔陣列制作而成,其中微孔直徑通常為40 ~65 μm,每個微孔周圍再濺射一層金屬形成導電微電極。在使用當中,需要先將待處理的神經切斷,把電極安裝到神經之間,神經置于神經生長導管中,然后神經將沿著導管再生,穿過篩型電極后繼續生長直至與遠端神經愈合。篩狀電極主要用于神經纖維內信號檢測[4]和周圍神經的再生研究[5~7]。
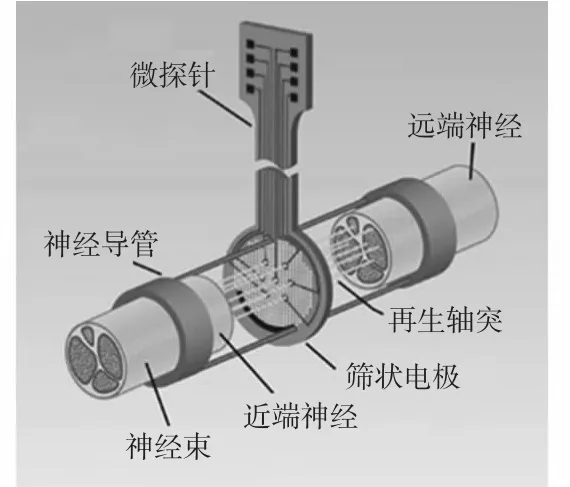
圖1 篩狀電極示意圖Fig 1 Diagram of sieve electrode
早在30 多年前就已經對神經再生做過研究,第一次出現是在1969 年,并在1974 年利用環氧電極對兩棲動物做過調查[8]。在20 世紀90 年代的幾年中,基于聚酰亞胺的篩狀電極也被多人提到過[3,9]。1994 年,Kovacs G T 等人[10]利用神經纖維的再生功能,將篩狀電極植于大鼠的腓神經和蛙的聽神經斷面中。Kovacs G T 觀察了不同直徑孔隙對神經再生的影響,組織學切片顯示:8,16 μm 孔隙的篩狀電極僅有少量有髓神經纖維穿過,多數為無髓纖維。而32,64,96 μm 孔隙的篩狀電極由再生的軸突重新組合形成了微束。電生理結果顯示,篩狀電極可以記錄到單個細胞的動作電位,并在再生的神經中,Gonzalez C 等人驗證了篩狀電極可以作為記錄和刺激自主神經系統的可用的神經接口。
篩狀電極的優點在于它在對神經進行檢測時,神經穿過電極生長,所以,電極的位置固定,臨床實驗中不會產生相對于神經纖維的位移。但主要缺點是在對神經進行再生研究時,需要切斷健康神經來進行研究,有時研究的神經可能無法再生而退化。另外,受電極孔徑和數目的影響,只有一部分神經細胞能穿過電極生長,一定程度上阻礙了神經細胞的再生。
1.2 卡夫電極
卡夫電極是一組絕緣管套型的柔性電極,在它的內表面包括兩個以上的刺激位點,可以連接絕緣導線,如圖2 所示[11]。卡夫電極是使用精密加工在硅膠上集成鉑電極位點和不銹鋼導線制作而成。在使用當中,將神經束起來,利用內壁的電極刺激神經細胞,從而可以記錄到小信號的神經束內電信號。它主要是應用于外圍神經、復合動作電位的記錄,運動神經纖維的刺激以及肌肉的激活[12,13]。

圖2 帶有18 個刺激位點的卡夫電極Fig 2 Cuff electrodes with 18 stimulation sites
傳統卡夫電極的制作方法有以下幾種:將導線鍵合到硅膠管的內壁上[14];將導線纏繞在神經的周圍并通過牙印模化合物在原位置上塑造出導線的模型[15];在柔性的聚合物襯底上噴鍍一層金屬薄膜,并使用光刻工藝在薄膜上光刻出樣品的圖形[16]。這些方法制作出的電極只適用于較粗的神經,而且很難做到微型化和高通量。隨著MEMS 工藝的發展,已經成功地設計出了多種微型化的卡夫電極,并且自從Rodriguez Francisco J 等人成功地將卡夫電極植于老鼠的坐骨神經6 個月,經過組織學和電生理學方面的調查研究,沒有出現神經損傷[17]。到目前為止,卡夫電極已經成功地用于多重整體的神經刺激研究,并在刺激[18,19]和傳導阻滯[20]期間,卡夫電極能使神經纖維重復性復原。
與其它電極相比,卡夫電極對于植入活體有以下幾個優點:卡夫電極更容易植入和移除;卡夫電極的直徑容易改變,這就能確保電極與神經之間的接口更加緊密。但卡夫電極在植入時所需的刺激電流較高,長時間應用可導致神經損傷;電極與神經之間太緊可能會壓迫神經,影響神經供血[21];記錄神經干復合動作電位時,肌肉選擇性差;對肌肉長時間的刺激,肌肉易發生疲勞。
1.3 螺旋電極
螺旋電極是用于迷走神經刺激的電極,它包括一個絕緣的螺旋襯底,具有一層內表面、可以被配置成環繞在神經周圍的形狀,其中電導體沉積在絕緣襯底的內表面,如圖3所示[22]。在使用當中,將螺旋型的電極觸點固定于迷走神經干,通過間斷的電刺激來治療一些神經紊亂類的疾病,如難治性的癲癇病、抑郁癥和慢性心臟病等[23,24]。
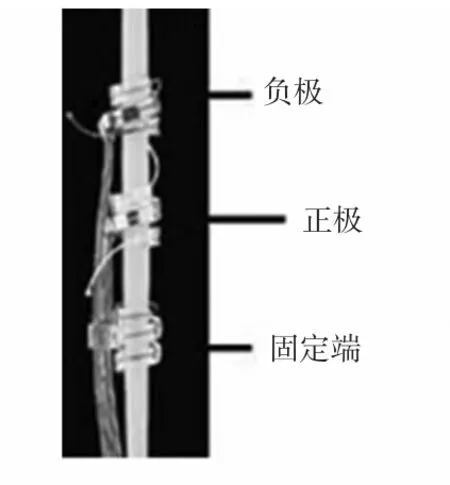
圖3 螺旋電極陣列Fig 3 Helical electrode array
作為一種長期植入的電極,在商業方面,只有美國Cyberonics 公司產品獲得了FDA 批準可以使用螺旋結構的電極用于VNS 治療系統。到目前為止,已經有大約80 000 個病人使用螺旋電極來治療他們的疾病,并且被治愈的病人也多達10 000 例。
與傳統的卡夫電極相比,螺旋電極有以下幾個優點:螺旋電極在神經附近能夠進行自我環繞,無需縫合,減小了植入手術困難和植入后對神經的壓迫損傷;電極緊密地圍繞在神經周圍,它的尺寸可隨神經而變化,優化了神經與電極相抵抗時發生相對移動而引起的磨損[25];電極觸點可根據實際應用設計固定的位置,或通過電選通多觸點來實現位置選擇。但螺旋電極的使用壽命有限,屆時需要手術更換螺旋電極,因此,它在移除的時候會引起神經損傷[26]。
1.4 劍狀電極
劍狀電極是一個硅基的電極微探針,具有一個扁平的尖端,在電極的臂上分布著許多電極位點,如圖4 所示[27]。其制備工藝主要是通過DRIE 工藝,以聚酰亞胺為基底的劍狀電極,然后再浸鍍一層蔗糖液使電極硬化[28],這樣就可以深入生物體內部與神經進行接觸,比如:它可以插入到神經束內進行檢測或是在大腦皮層之間檢測神經信號。在使用當中,需要把受驗動物與電極固定在測定架上,調整好角度和深度,使電極豎直插入目標神經進行神經的刺激與信號的采集。
德國弗朗霍夫生物醫學研究所(Fraunhofer-Institute for Biomedical Engineering,Sankt Ingber)Stiegljtz T 和Schuetter M 與Muester 眼科醫院的Heiduschka P 和Shuettler M 制作了基于聚酰亞胺的雙面劍狀電極,植入老鼠的視神經中,成功地對腦神經信號進行采集[29]。Lee Yutao 等人[30]也采用兩個探針臂的劍狀電極植入成年小龍蝦的腹部和腦神經,證明了電極的雙面和側面都可以連續可靠地檢測神經元信號。同時從組織學分析上也可以看到電極和周圍的組織形成了很好的接口,可以用在大腦皮層假體和腦—機接口系統中。

圖4 劍狀電極示意圖Fig 4 Diagram of shaft electrode
劍狀電極形狀為劍狀,可以直接插入到神經內部,進行神經內和腦皮層內信號的記錄和刺激;正面、反面和側面可以同時記錄神經,并進行多點刺激。但劍狀電極需要插入神經組織內部進行刺激,這樣會對神經細胞產生損害;插入神經組織需要有專門的立體測定儀,成本很高,尺寸誤差大,操作不方便。
1.5 針形電極陣列
針型電極一般是以硅基為材料,結合MEMS 加工工藝制作而成。比較典型的針形陣列微電極主要有Utah 陣列(圖5)[31]和Michigan 陣列(圖6)[32]。針型微電極具有高密度、有序排列以及能實現三維陣列結構等特點,往往在幾個平方毫米的面積內排列數百個電極,每個電極上也分布許多電極位點,它可以植入大腦皮層或神經束內,直接與神經軸突接觸,從而很好地發揮記錄和刺激功能。目前針形陣列電極主要用于大腦皮層神經組織的研究等。

圖5 Utah 型電極陣列示意圖Fig 5 Diagram of Utah electrode array
Utah 型針形微電極是由Utah 大學Jones K E 等人提出的,它是由100 根以硅基為材料的針狀電極組成的三維電極陣列,然后又在硅針尖端上沉積了一層鉑金。Rousche P J 等人將Utah 型針形電極植入貓的感覺皮層,植入三個月后未見組織包覆現象發生。這是驗證了它可以對皮層內的神經進行記錄和刺激[33,34]。Michigan 型針形陣列微電極是由Michigan 大學的Anderson D J 等人在二維單排電極制備完成后,利用深度反應離子刻蝕(DIRE)制作硅材料夾具,并用恰當的方式完成三維組裝。Hoogerwerf A C 等人[35]將4×4 的Michigan 型電極植入幾內亞豬的大腦皮層中,同樣經三個月的生物實驗后,在電極周圍也沒有較大的組織反應發生。所以,Utah 型和Michigan 型的微電極都能夠滿足神經生理學家所提出的長期神經刺激的要求。

圖6 Michigan 型電極陣列示意圖Fig 6 Diagram of Michigan electrode array
針形陣列微電極的優勢是包含大量的記錄或刺激位點,能夠選擇性地激活或關閉單個電極,對神經網絡活動進行區域性研究。其缺點是:腦組織比硅針軟,在大腦微移動時容易對神經膠質的造成損傷;硅基材料的電極高剛性不足,不能用于長時間的慢性實驗。
2 結束語
通過對上述幾種微電極進行比較發現微電極還面臨很多問題的挑戰。如柔性微電極的植入會對神經組織造成損傷、電極位點數量不足及電極刺激的安全性等;目前,電極還不能長期的植入到人體當中,在更換電極時也會對神經引起損壞。所以,為了使柔性微電極能夠長期有效地應用于臨床上,在其微型、柔性、生物相容性及生物穩定性上還需要進行深入研究。
[1] Pellinen D S,Moon T,Vetter R,et al.Multifunctional flexible parylene-based intracortical microelectrodes[C]∥The 27th Annual International Conference on Engineering in Medicine and Biology Society,Shanghai:IEEE,2005:5272-5275.
[2] Cheung K C,Renaud P,Tanila H,et al.Flexible polyimide microelectrode array for in-vivo recordings and current source density analysis[J].Biosensors and Bioelectronics,2007,22(8):1783-1790.
[3] Stieglitz T,Beutel H,Meyer J U.A flexible,light-weight multichannel sieve electrode with integrated cables for interfacing regenerating peripheral nerves[J].Sensors and Actuators A,1997,60:240-243.
[4] Valderrama E,Garrido P,Cabruja E,et al.Microfabrication and characterisation of microelectrode arrays for in-vivo nerve signal recording[C]∥The 8th International Conference on Solid-State Sensors and Actuators,Stockholm,Sweden:Eurosensors IX,1995:63-66.
[5] Wallman L,Zhang Y,Laurell T,et al.The geometric design of micromachined silicon sieve electrodes influences functional nerve regeneration[J].Biomaterials,2001,22(10):1187-1193.
[6] Akin T,Najafi K.A micromachined silicon sieve electrode for nerve regeneration applications[C]∥The 6th International Conference on Solid-State Sensors and Actuators,San Francisco,CA,1991:128-131.
[7] Akin T,Najafi K,Smoke R H,et al.A micromachined silicon sieve electrode for nerve regeneration applications[J].IEEE Transactions on Biomedical Engineering,1994,41(4):305-313.
[8] Mannard A,Stein R B,Charles D.Regeneration electrode units:Implant for recording from single peripheral nerve fibers in freely moving animals[J].Science,1974,183:547-549.
[9] Gonza'lez C,Rodri'guez M.A flexible perforated microelectrode array probe for action potential recording in nerve and muscle tissues[J].Journal of Neuroscience Methods,1997,72(2):189-195.
[10]Kovacs G T,Storment C W.and Halks M M.et al.Silicon-substrate microelectrode arrays for parallel recording of neural activity in peripheral and cranial nerves[J].IEEE Transactions on Biomedical Engineering,1994,41(6):567-77.
[11]Hoffmann Klaus P,Koch Klaus P,Thomas Doerge.New technologies in manufacturing of different implantable microelectrodes as an interface to the peripheral nervous system[C]∥The First IEEE/RAS-EMBS International Conference on Biomedical Robotics and Biomechatronics,Pisa:IEEE,2006:414-419.
[12]Rodriguez Francisco J,Ceballos Dolores,Chuttler Martin,et al.Polyimide cuff electrodes for peripheral nerve stimulation[J].Journal of Neuroscience Methods,2000,98(2):105-118.
[13]Foldes Emily L,Ackermann D Michael,Bhadra Niloy,et al.Design,fabrication and evaluation of a conforming circumpolar peripheral nerve cuff electrode for acute experimental use[J].Journal of Neuroscience Methods,2011,196(1):31-37.
[14]Loeb G E,WaImsIey B,Duysens J.Obtaining proptioceptive information from natural limbs:Implantable transducers vs somatosensory neuron recordings[R].Boca Raton,FL:Physical Sensors for Biomedical Applications.Proc of Workshop on Solid State Physical Sensors for Biomedical Application,CRC Press,1980.
[15]Julien C,Rossignol S.Electroneurographic recordings with polymer cuff electrodes in paralyzed cats[J].Journal Neuroscience Methods,1982,5:267-272.
[16]Puije Van der,Shelley P D,Loeb G E.A self-spiralling thin-film nerve cuff electrode[C]∥Proc of 19th Canadian Medical and Biological Engineering Conference,1993:186-187.
[17]Rodriguez Francisco J,Ceballos Dolores,Schuttler Martin,et al.Polyimide cuff electrodes for peripheral nerve stimulation[J].Journal of Neuroscience Methods,2000,98(2):105-118.
[18]Bhadra N,Bhadra N,Kilgore K L,et al.High frequency electrical conduction block of the pudendal nerve[J].Journal of Neural Engineering,2006,3:180-187.
[19]Miles J D,Kilgore K L,Bhadra N,et al.Effects of ramped amplitude waveforms on the onset response of high-frequency mammalian nerve block[J].Journal of Neural Engineering,2007,4(4):390-398.
[20]Bhadra N,Kilgore K L.High-frequency electrical conduction block of mammalian peripheral motor nerve[J].Muscle Nerve,2005,32(6):782-90.
[21]Ortler M,Unterhofer C,Dobesberger J,et al.Complete removal of vagus nerve stimulator generator and electrodes[J].Journal of Neurosurgery Pediatrics,2010,5(2):191-194.
[22]Anthony W Cowley.Helical electrode for nerve stimulation:US,S8478428B2[P].2013—07—02.
[23]Anholt T A,Ayal S,Goldberg J A.Recruitment and blocking properties of the CardioFit stimulation lead[J].Journal of Neural Engineering,2011,8(3):1-6.
[24]Li Luming,Hao H W,Ma B Z,et al.Development of implantable neuro-stimulator used for brain and nerve stimulation[C]∥7th Asian-Pacific Conference on Medical and Biological Engineering,2008:430-433.
[25]Merrill C A,Jonsson M A,Minthon L,et al.Vagus nerve stimulation in patients with Alzheimer's disease:Additional follow-up results of a pilot study through 1 year[J].Clin Psych,2006,67:1171-1178.
[26]Giulioni M,Martinoni M,Naldi I,et al.Successful removal and reimplant of vagal nerve stimulator device after 10 years[J].Annals of Indian Academy of Neurology,2012,15(2):128-129.
[27]Stieglitz T,Gross M.Flexible bioMEMS with electrode arrangements on front and back side as key component in neural prostheses and biohybrid systems[J].Fraunhofer-Institute Biomedical Engineering,2002,1(3):358-361.
[28]Hassler Christina,Guy Julien,Nietzschmann Max,et al.Chronic intracortical implantation of saccharose-coated flexible shaft electrodes into the cortex of rats[C]∥Annual International Conference of the IEEE,Freiburg,Germany,2011:644-647.
[29]Stieglitz T,Heiduschka P,Shuettler M,et al.Reducing insenion sites of penetrating multipolar shaft electrodes by double side electrode arrangement[C]∥Annual EMBS Intemational Conference,Istanbul,Turkey,2001:3426-3429.
[30]Lee Yu-Tao,Chang Yen-Chung,Fang Weileun,et al.Multi-electrode styles with novel sidewall electrode on glass microprobe implemented by Si-via structure[C]∥Annual EMBS Intemational Conference,Cancun,Mexico,2011:1043-1046.
[31]Jones K E,Campebell P K,Normann R A.A glass/silicon composite intracortical electrode array[J].Annal Biomedical Engineering,1992,20(4):423-437.
[32]Anderson D J,Najafi K,Tanghe S J,et al.Batch-fabricated thinfilm electrodes for stimulation of the central auditory system[J].IEEE Transactions on Rehabilitation Engineering,1989,36(7):693-704.
[33]Rousche P J,Normann R A.Chronic recording capability of the Utah intracortical electrode array in cat sensory cortex[J].IEEE Neuroscience Methods,1998,82(1):1-15.
[34]Rousche P J,Normann R A.Chronic intracortical microstimulation(ICMS)of cat sensory cortex using the Utah intracortical electrode array[J].IEEE Transactions on Rehabilitation Engineering,1990,7(1):56-68.
[35]Hoogerwerf A C,Wise K D.A three-dimensional microelectrode array for chronic neural recording[J].IEEE Transactions on Biomedical Engineering,1994,41(12):1136-1146.

