張應力刺激下Wnt/β-catenin信號通路對成牙骨質細胞Runx2表達調控的體外研究
李書琴 楊珊 任嬡姝 戴紅衛
重慶醫科大學附屬口腔醫院正畸科,口腔疾病與生物醫學重慶市重點實驗室,重慶 401147
牙齒移動過程中,牙根受力會發生一定程度的吸收及修復。成牙骨質細胞是力學敏感細胞,與牙根部牙骨質吸收后的修復密切相關。Wnt/β-catenin是與力學刺激和成骨效應都有相關的信號通路,力學刺激能夠激活成骨細胞內的Wnt/β-catenin信號通路,促進成骨細胞Runx2的表達。目前力學刺激下Wnt/β-catenin信號通路對成牙骨質細胞Runx2表達的調控作用尚未可知。本研究通過張應力刺激以及特異性阻斷劑的干預,以Runx2為切入點,研究張應力刺激對成牙骨質樣細胞中Wnt/β-catenin信號通路的激活效應以及該通路對Runx2的調控作用。
1 材料和方法
1.1 主要材料和設備
成牙骨質細胞株OCCM30(四川大學華西口腔醫院白丁教授惠贈)。BioFlex加力板(Flexcellint公司,美國)。阻斷劑Dikkopf-1(DKK1)(Sino biological公司,美國,目錄號:10170-H08H)。實時熒光定量聚合酶鏈反應(real-time quantitative polymerase chain reaction,RT-PCR)試劑盒(TaKaRa公司,日本);FX4000T加載裝置(Flexcellint公司,美國),倒置相差顯微鏡及照相系統(尼康公司,日本),FTC2000型RT-PCR基因擴增儀、FTC2000型聚合酶鏈反應合成儀(上海楓嶺生物技術有限公司),高速低溫離心機(Heraeus公司,德國),凝膠成像及圖像分析系統(Bio-Rad公司,美國)。本實驗目的基因Runx2以及內參甘油醛-3-磷酸脫氫酶(glyceraldehyde-phosphate dehydrogenase,GAPDH)的引物序列由上海生工生物工程技術服務有限公司設計合成,其序列見表1。

表1 引物序列Tab 1 Primer sequences
1.2 研究方法
1.2.1 OCCM30的培養 將同一批傳代的細胞按每毫升1×105個細胞的密度接種于BioFlex加力板上,每板加入培養液(90%體積分數DMΕM,10%小牛血清,1%青霉素+鏈霉素)2 mL,于CO2孵箱內培養(37 ℃;5%CO2,95%空氣),每2 d更換1次培養液。
1.2.2 應力加載下Runx2 mRNA和β-catenin蛋白的表達 待細胞生長鋪滿培養板底80%~90%時,將加力板置于FX4000T加力系統的孵箱中進行應力加載(加載參數為12%形變,1 Hz,1/2正弦波)。實驗分為4個組,3個實驗組分別加載3、6、12 h,對照組在相同孵箱內培養但不加力。力學加載結束后收集細胞樣本,采用RT-PCR法半定量分析Runx2 mRNA的表達,Western blot法檢測β-catenin蛋白的表達。
1.2.3 阻斷劑對Runx2 mRNA和β-catenin蛋白表達的影響 將同一批傳代的細胞按每毫升1×105個細胞的密度接種于6孔板中繼續培養,待生長到60%~70%時,將質量濃度分別為20、50、80、100、150 ng·mL-1的DKK1分別加入培養板中,對照組加入PBS液,繼續培養,48 h后收集樣本,檢測Runx2 mRNA和βcatenin蛋白的表達。根據檢測結果選擇信號通路阻斷效果最佳的DKK1質量濃度用于后續實驗。
1.2.4 應力加載以及阻斷劑處理對Runx2 mRNA和βcatenin蛋白表達的影響 將實驗分為A、B、C、D共4組,A組不加力不加阻斷劑,B組加力并加阻斷劑,C組加力不加阻斷劑,D組不加力加阻斷劑。同一批傳代的細胞按每毫升1×105個細胞的密度分別接種于A、B、C、D四組加力板中,生長至60%~70%時,B、D組加入150 ng·mL-1DKK1,其余兩組加入PBS液,48 h后,加力組即B、C組放入加力系統(12%形變,1 Hz,1/2正弦波)的孵箱加力12 h,A、D組放入相同孵箱但不加力。培養12 h后檢測4組細胞Runx2 mRNA和β-catenin蛋白表達的變化。
1.3 統計學分析
以上實驗均重復3次,應用SPSS 16.0軟件對實驗數據進行方差分析,采用LSD檢驗進行組間多重比較,檢驗水準為雙側α=0.05。
2 結果
2.1 應力加載對成牙骨質細胞Runx2 mRNA和βcatenin蛋白表達的影響
張應力加載3、6、12 h后,成牙骨質細胞內Runx2 mRNA和β-catenin蛋白的表達情況見圖1、2。與對照組相比,加力后Runx2 mRNA和β-catenin蛋白的表達均增強(P<0.05)。隨著加力時間延長,β-catenin表達水平及Runx2 mRNA表達活性均呈上升趨勢。
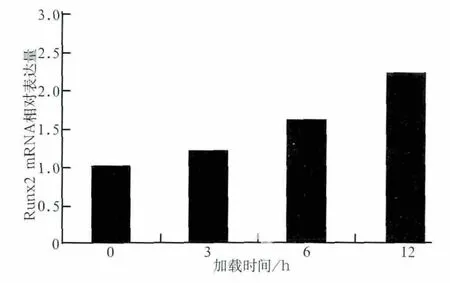
圖1 應力加載0、3、6、12 h后Runx2 mRNA的相對表達量Fig 1 Relative expression of Runx2 mRNA loaded by stress for 0,3,6,12 h
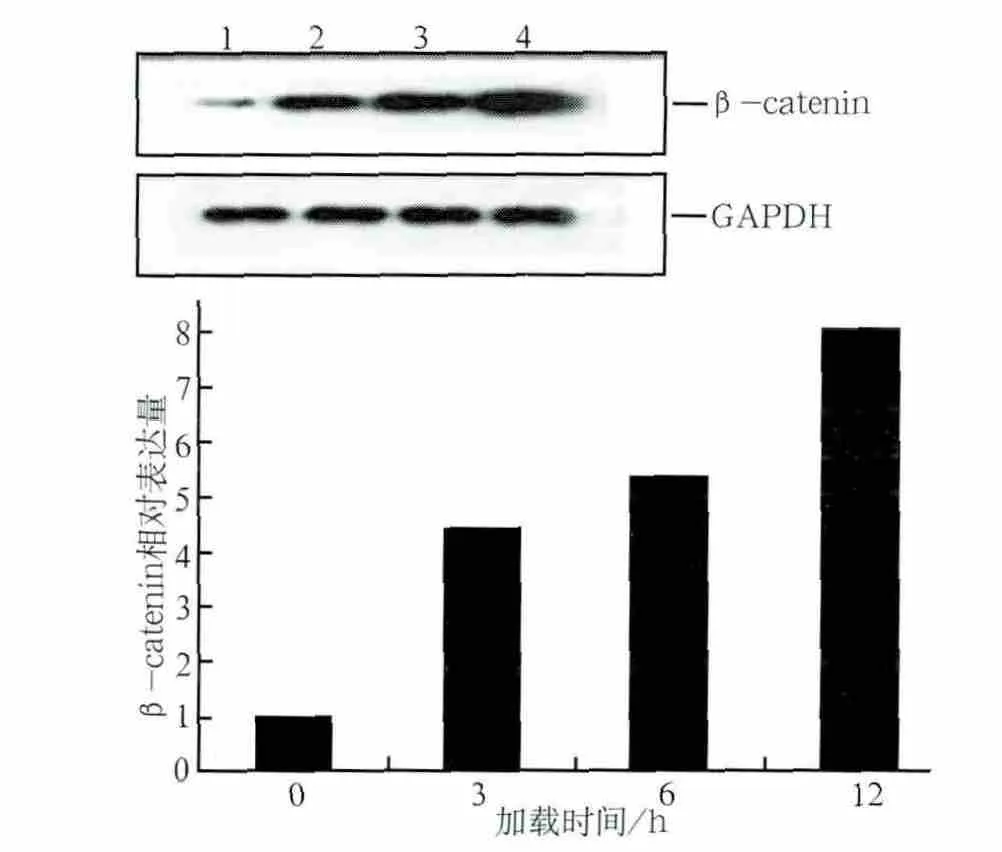
圖2 應力加載0、3、6、12 h后β-catenin蛋白的相對表達量Fig 2 Relative expression of β-catenin protein loaded by stress for 0,3,6,12 h
2.2 阻斷劑處理對成牙骨質細胞Runx2 mRNA和βcatenin蛋白表達的影響
阻斷劑處理后Runx2 mRNA的表達情況見圖3,β-catenin表達情況見圖4:經不同質量濃度的DKK1處理后,細胞內Runx2 mRNA和β-catenin的表達總體上均有下降趨勢。DKK1質量濃度為20、50 ng·mL-1時,Runx2 mRNA表達量與對照組相比無明顯差異(P>0.05),經80、100、150 ng·mL-1的DKK1處理后,Runx2 mRNA表達量下降,與對照組的差異有統計學意義(P<0.05)(圖3)。經5種質量濃度的DKK1處理后,β-catenin蛋白的表達量較對照組均明顯下降(P<0.05)(圖4)。DKK1的質量濃度達到150 ng·mL-1時,β-catenin蛋白的表達量減少最明顯,說明150 ng·mL-1的DKK1能有效抑制成牙骨質細胞內β-catenin蛋白的表達活性。由此可見,不同質量濃度的阻斷劑阻斷效應不一樣,隨著質量濃度的增大,阻斷效應也越強,對Wnt/β-catenin信號轉導通路活性的抑制作用也越強。Wnt/β-catenin信號轉導通路的活性在150 ng·mL-1的DKK1作用下活性最低,可被有效抑制,因此作為本研究后續使用DKK1的最佳濃度。

圖3 不同質量濃度DKK-1處理后Runx2 mRNA的相對表達量Fig 3 Relative expression of Runx2 mRNA proceed by DKK-1 of different concentrations
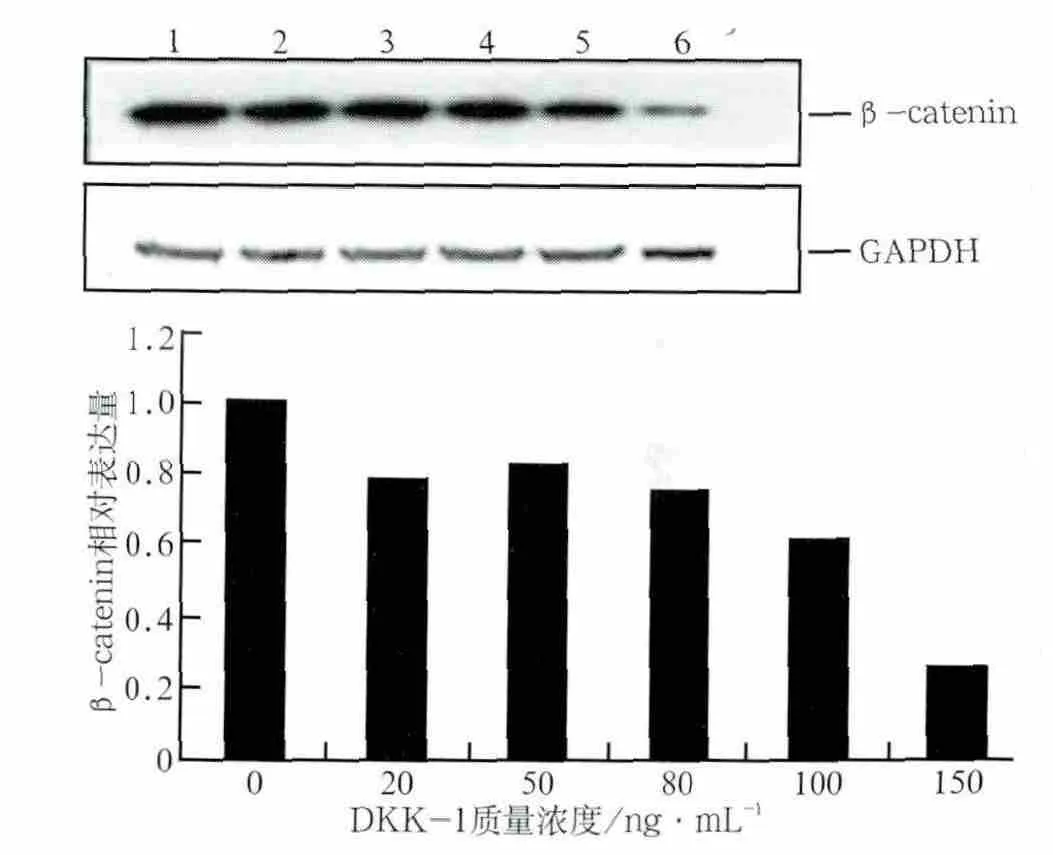
圖4 不同質量濃度DKK-1處理后β-catenin蛋白的相對表達量Fig 4 Relative expression of β-catenin protein proceed by DKK-1 of different concentrations
2.3 應力加載及阻斷劑處理后β-catenin蛋白以及Runx2 mRNA的表達
應力加載及阻斷劑處理后β-catenin蛋白的表達情況見圖5:A、D組比較,未加載張應力的情況下,DKK1明顯抑制了β-catenin蛋白的表達,Wnt/β-catenin通路被抑制;B、C組比較,加載張應力的情況下,DKK1處理組β-catenin蛋白表達明顯低于未加DKK1處理組;A、C組比較,不加阻斷劑時,張應力刺激增強了β-catenin蛋白的表達;B、D組比較,阻斷劑作用后,應力刺激組β-catenin蛋白表達相對較高。
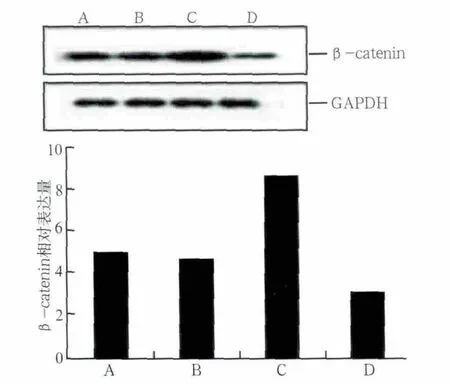
圖5 應力加載及阻斷劑處理后各組β-catenin蛋白的相對表達量Fig 5 Relative expression of β-catenin protein proceed by DKK-1 of different concentrations and loaded by stress
應力加載及阻斷劑處理后Runx2 mRNA的表達情況見圖6:B、C組比較,張應力刺激下,C組Wnt/β-catenin通路活性較高,此時Runx2基因的表達也表現為C組高于B組;B、D組比較,Wnt/β-catenin通路同時被抑制的狀態下,加力組細胞通路活性仍高于不加力組,即B組活性高于D組,此狀態下B組Runx2基因的表達也高于D組;而未加載張應力的A、D組結果與本研究前述結果一致,抑制Wnt/β-catenin通路后,Runx2基因的表達相對未抑制組降低。
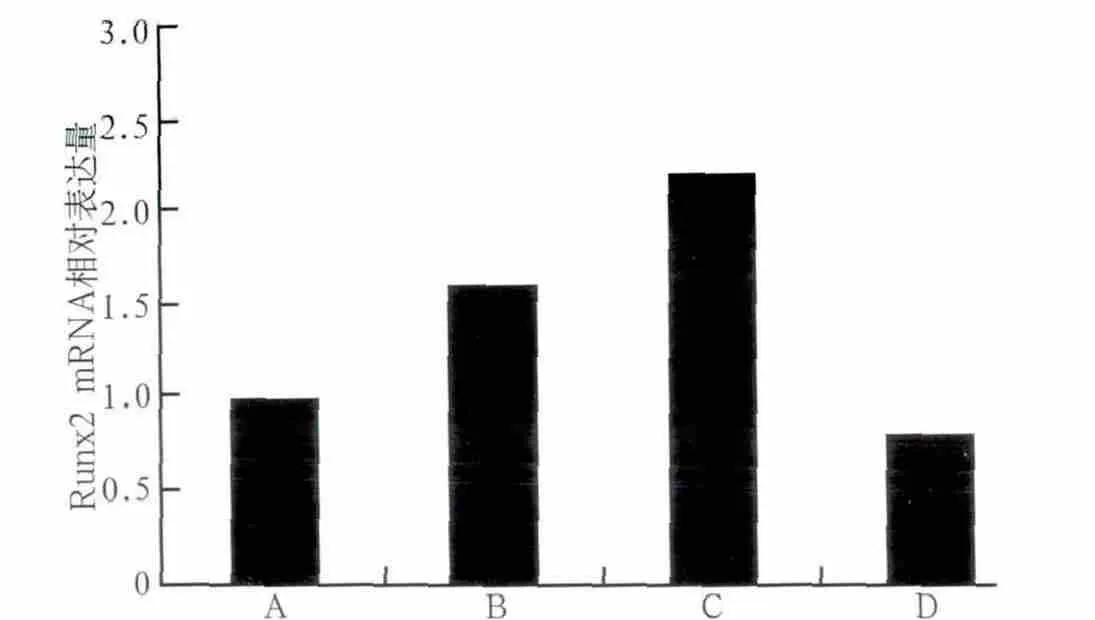
圖6 應力加載及阻斷劑處理后各組Runx2 mRNA的相對表達量Fig 6 Relative expression of Runx2 mRNA proceed by DKK-1 of different concentrations and loaded by stress
3 討論
Runx2是一個力學相關因子,應力刺激可促進其在細胞內的表達。應力環境下,牙周組織中的牙周膜細胞、成骨細胞均被證實為Runx2的靶細胞[1-3]。成牙骨質細胞位于牙周膜中牙骨質表面。本研究通過體外實驗發現,張應力刺激促進了Runx2 mRNA在成牙骨質細胞中的表達。
β-catenin是Wnt/β-catenin信號通路的第二信使,細胞核內β-catenin水平直接反映了該信號通路的活化水平[4]。本研究結果表明,張應力加載后,OCCM30細胞核內β-catenin的水平與對照組相比都增高,證實張應力刺激激活了OCCM30內經典Wnt信號通路,在加載的12 h內細胞核內積聚的β-catenin量逐漸增多,說明在加載的12 h作用時間內,Wnt信號通路都處于激活狀態,且隨著加力時間的延長活性增強。
本研究中,張應力刺激下細胞內β-catenin蛋白和Runx2 mRNA均增多,表明張應力刺激既能激活Wnt/β-catenin信號通路又能上調Runx2基因的表達。Runx2的活性水平由許多因素調控,信號通路是其中之一。一些與成骨相關的細胞信號傳導通路可以通過激活輔助因子與Runx2的相互作用正向或負向調控其與DNA結合或轉錄活性,或者通過影響Runx2啟動子來實現對其表達的調控[5]。另外許多關于細胞外調節蛋白激酶(extracellular regulated protein kinases,ΕRK)信號通路的研究發現,該通路也能調節Runx2的表達。有學者[6]用敲除分泌型卷曲相關蛋白1(secreted frizzled-related proteins 1,SFRP1)后的小鼠進行研究發現,Wnt/β-catenin信號通路被激活后,Runx2 mRNA以及Runx2啟動子活性均增強,并且其下游骨鈣素基因表達上調形成新骨。這說明Runx2是Wnt信號通路中的一個效應因子,Wnt/βcatenin信號通路調控成骨細胞分化至少部分是通過Runx2基因表達的活性實現的[7]。
本研究中,當Wnt/β-catenin信號傳導通路被抑制后,Runx2基因的表達也有減少,說明Wnt/β-catenin信號傳導通路對成骨效應因子Runx2有調控作用,且抑制該通路Runx2 mRNA的表達表現為下調的趨勢,進一步說明Wnt/β-catenin信號通路可能通過影響Runx2基因表達進而影響成牙骨質細胞的成骨效應。正畸治療中,矯治力是影響牙根吸收后修復及牙周組織再生的關鍵因素,本研究僅僅證明了Wnt/β-catenin信號通路可以調控Runx2因子,對應力促進成牙骨質細胞成骨效應機制還不能清楚說明,研究加載應力模擬臨床正畸矯治力的情況下兩者關系是十分有必要的。
張應力刺激作用能夠激活成牙骨質細胞內Wnt/β-catenin信號通路。無張應力刺激作用時,阻斷該信號通路Runx2基因的表達減少;而張應力刺激下,抑制Wnt/β-catenin通路活性,Runx2基因的表達也相應減少。由此可見,張應力刺激上調Runx2基因的表達機制中Wnt/β-catenin信號通路發揮了促進作用。應力刺激后,成牙骨質細胞內Wnt/β-catenin信號通路被激活,Runx2基因表達水平也上調,說明在正畸治療過程中成牙骨質細胞仍能發揮成骨分化的功能,促進牙根吸收后的修復。除了Wnt/β-catenin通路外,可能還存在其他調控因素影響Runx2基因的表達。類似對成骨細胞的研究[8]也表明,力學刺激能夠促進成骨細胞的成骨分化。還有學者[9-10]通過激活和阻斷成牙骨質細胞內Wnt/β-catenin信號通路的研究發現,Wnt/β-catenin信號通路可以抑制成牙骨質細胞的分化但促進其增殖。但是,成牙骨質細胞在正畸治療過程中的生物學功能還存在爭議,尚需要進一步研究。
[1]Ziros PG,Basdra ΕK,Papavassiliou AG.Runx2:of bone and stretch[J].Int J Biochem Cell Biol,2008,40(9):1659-1663.
[2]Ziros PG,Gil AP,Georgakopoulos T,et al.The bone-specif ic transcriptional regulator Cbfa1 is a target of mechanical signals in osteoblastic cells[J].J Biol Chem,2002,277(26):23934-23941.
[3]Li J,Jiang L,Liao G,et al.Centrifugal forces within usuallyused magnitude elicited a transitory and reversible change in proliferation and gene expression of osteoblastic cells UMR-106[J].Mol Biol Rep,2009,36(2):299-305.
[4]Moon RT.Wnt/beta-catenin pathway[J].Sci STKΕ,2005(271):cm1.
[5]Guo Y,Zhang CQ,Zeng QC,et al.Mechanical strain promotes osteoblast ΕCM formation and improves its osteoinductive potential[J].Biomed Εng Online,2012,11:80.
[6]Pasold J,Osterberg A,Peters K,et al.Reduced expression of Sfrp1 during chondrogenesis and in articular chondrocytes correlates with osteoarthritis in STR/ort mice[J].Εxp Cell Res,2013,319(5):649-659.
[7]Ohazama A,Courtney JM,Sharpe PT.Opg,Rank,and Rankl in tooth development:co-ordination of odontogenesis and osteogenesis[J].J Dent Res,2004,83(3):241-244.
[8]Liedert A,Wagner L,Seefried L,et al.Εstrogen receptor and Wnt signaling interact to regulate early gene expression in response to mechanical strain in osteoblastic cells[J].Biochem Biophys Res Commun,2010,394(3):755-759.
[9]Tamura M,Nemoto Ε,Sato MM,et al.Role of the Wnt signaling pathway in bone and tooth[J].Front Biosci:Εlite Εd,2010,2:1405-1413.
[10]Nemoto Ε,Koshikawa Y,Kanaya S,et al.Wnt signaling inhibits cementoblast differentiation and promotes proliferation[J].Bone,2009,44(5):805-812.

