紅景天苷對(duì)百草枯誘發(fā)PC12細(xì)胞損傷的保護(hù)作用*
李海龍 吳守振 李 洺 馮曉霞
西安市第九醫(yī)院(西安 70054)
紅景天苷對(duì)百草枯誘發(fā)PC12細(xì)胞損傷的保護(hù)作用*
李海龍 吳守振△李 洺 馮曉霞
西安市第九醫(yī)院(西安 70054)
目的:研究紅景天苷保護(hù)百草枯(PQ)誘發(fā)PC12細(xì)胞損傷的作用及其機(jī)制。方法:實(shí)驗(yàn)分對(duì)照組、PQ誘導(dǎo)組、不同劑量(10μmol/L、20μmol/L、30 μmol/L)紅景天苷治療組。采用MTT法檢測(cè)細(xì)胞活力,利用流式細(xì)胞術(shù)(FCM)檢測(cè)細(xì)胞凋亡;羅丹明123(Rh123)染色觀(guān)察細(xì)胞線(xiàn)粒體膜電位(MMP)變化,比色法測(cè)定乳酸脫氫酶(LDH)、谷胱甘肽還原酶(GSH-PX)、超氧化物歧化酶(SOD)的活性;免疫組織化學(xué)染色檢測(cè)細(xì)胞色素C(CytC)的表達(dá)。結(jié)果:800 μmol/L PQ明顯抑制PC12細(xì)胞增殖、誘導(dǎo)細(xì)胞凋亡;以不同劑量(10μmol/L、20μmol/L、30 μmol/L)紅景天苷預(yù)處理后,保護(hù)了PQ所致的PC2細(xì)胞增殖抑制,降低凋亡率(P?0.01)。機(jī)制上,紅景天苷抑制了MMP下降(P?0.05),導(dǎo)致LDH、CytC的釋放減少,增強(qiáng)了GSH-PX、SOD的活力(P?0.05)。結(jié)論:紅景天苷保護(hù)了PQ誘導(dǎo)的細(xì)胞損傷,抑制了PQ所致的細(xì)胞凋亡,這可能與抑制CytC的釋放和MMP下降,提高GSH-PX、SOD的活性有關(guān)。
紅景天苷是草本植物紅景天的主要化學(xué)成份之一,在抗衰老、抗疲勞、抗輻射、抗缺氧、抗腫瘤和抗病毒中具有重要作用,能夠有效調(diào)節(jié)免疫力[1-4]。百草枯(paraquat,PQ)具有與多巴胺能神經(jīng)毒素(1-甲基-4-苯基吡啶離子,1-Methyl-4-phenylpyridin-1-ium,MPP+)相似的結(jié)構(gòu),可誘發(fā)氧化應(yīng)激,誘發(fā)細(xì)胞凋亡[5-7],激活多種信號(hào)通路,包括TGF-β信號(hào)通路,NF-κB信號(hào)通路以及胰島素信號(hào)通路等[8-10]。本研究將采用體外培養(yǎng)的PC12細(xì)胞,探討紅景天苷對(duì)PQ導(dǎo)致該細(xì)胞毒性損傷的影響。
1 材 料
1.1 試 劑 紅景天苷購(gòu)自中國(guó)藥品生物制品檢定所(標(biāo)準(zhǔn)對(duì)照品,批號(hào):110818-200404),PQ、annexinV-FITC、PI(Propidium Iodide)、MTT(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide)、Rhodamine(Rh123)購(gòu)自Sigma公司;DMSO、胎牛血清購(gòu)自Gibco BRL公司;乳酸脫氫酶(Lactate dehydrogenase,LDH)、超氧化物歧化酶(SuperoxideDismutase,SOD)、谷胱甘肽過(guò)氧化物酶(Glutathione Peroxidase,GSH-PX-Px)檢測(cè)試劑盒購(gòu)自南京生物工程研究所。兔抗鼠CytC單克隆抗體(mAb)購(gòu)自Pharmingen公司。
1.2 細(xì) 胞 PC12細(xì)胞系由第四軍醫(yī)大學(xué)神經(jīng)生物實(shí)驗(yàn)室饋贈(zèng),以含有10%胎牛血清的DMEM培養(yǎng),并補(bǔ)充10 ng/mL神經(jīng)生長(zhǎng)因子、100 U/mL青霉素。培養(yǎng)細(xì)胞置于37℃、50 mL/L CO2培養(yǎng)箱中,待單層細(xì)胞60%~70%匯合后,用2.5 g/L胰蛋白酶消化,傳代培養(yǎng)。
2 方 法
2.1 藥物處理 3×103個(gè)細(xì)胞接種于96孔板中,24 h加藥處理,分組如下:對(duì)照組;PQ誘導(dǎo)組:不同劑量PQ組;紅景天苷聯(lián)合PQ誘導(dǎo)組:不同劑量(10 μmol/L、20 μmol/L、30 μmol/L)紅景天苷預(yù)處理,24 h后加800 μmol/L PQ。各組均設(shè)3~5個(gè)平行對(duì)照組。
2.2 細(xì)胞活力測(cè)定 以3×103個(gè)細(xì)胞接種于96孔板,每孔加入5 mg/mL的MTT溶液20 μL,37℃下孵育4 h,去除培養(yǎng)液,加入150 μL DMSO,溶解結(jié)晶,測(cè)定570 nm時(shí)的吸光度(A)值。細(xì)胞活力以與對(duì)照組相比的百分?jǐn)?shù)表示。
2.3 流式細(xì)胞術(shù)檢測(cè) 收集各實(shí)驗(yàn)組細(xì)胞,以PBS沖洗2次,700 mL/L冰乙醇重懸細(xì)胞,于4℃固定24 h;1 500 r/min 4℃離心5 min;PBS洗滌2次;將細(xì)胞重懸于結(jié)合緩沖液;分別加入annexinV-FITC (10 μL)和PI(5 μL),于4℃避光孵育30 min,進(jìn)行FCM檢測(cè)。
2.4 Rh123染色檢測(cè)MMP 細(xì)胞爬片后,將細(xì)胞于含10 μg/mL Rh123的Hank,s液中在37℃孵育30 min;0.01 mol/L PBS(pH7.4)漂洗2次,3 min/次;以福爾馬林固定45 min,于熒光顯微鏡下觀(guān)察并拍照。
2.5 LDH活力測(cè)定 通過(guò)LDH催化乳酸生成丙酮酸的量測(cè)定LDH活力。收集各組細(xì)胞的培養(yǎng)液,于4℃下800 r/min離心2 min,取上清液上酶標(biāo)儀以波長(zhǎng)440 nm檢測(cè)每孔的A值。
2.6 SOD、GSH-PX活力測(cè)定 利用黃嘌呤氧化酶法測(cè)定SOD活力,用二硫?qū)Χ趸郊姿岱y(cè)定GSH-PX的活力。處理各組細(xì)胞后,將細(xì)胞裂解后離心,各取100 μL細(xì)胞上清以酶標(biāo)儀分別測(cè)定波長(zhǎng)550 nm、412 nm下的A值。
2.7 PC12細(xì)胞CytC的表達(dá) PC12細(xì)胞爬片,培養(yǎng)24 h,洗滌、固定、封閉,加入兔抗鼠CytC單克隆抗體(1:200),37℃溫育1 h;,PBS洗滌后,加入辣根過(guò)氧化物酶標(biāo)記的羊抗兔二抗(1:100),孵育30 min,DAB顯色;然后,進(jìn)行蘇木素復(fù)染、乙醇脫水、二甲苯透明,封片。隨機(jī)選取8個(gè)視野,計(jì)數(shù)CytC陽(yáng)性細(xì)胞數(shù),計(jì)算百分比。
3 結(jié) 果
3.1 紅景天苷抑制PQ引起的PC12細(xì)胞活力下降 不同劑量(100、200、400、600、800、1000 μmol/L) PQ作用細(xì)胞,觀(guān)察其對(duì)細(xì)胞活力的影響。結(jié)果表明:與對(duì)照組相比,600μmol/L、800μmol/L和1000μmol/L PQ劑量組細(xì)胞生存率明顯下降(P?0.05,圖1A)。但是,當(dāng)用不同劑量(10μmol/L、20μmol/L、30μmol/L)紅景天苷預(yù)處理24 h,再加800 μmol/L PQ后,紅景天苷有效抑制了PQ所致的PC12細(xì)胞增殖活性的下降(P? 0.05),與PQ組相比差異具有統(tǒng)計(jì)學(xué)意義(P?0.05,圖1B),這些結(jié)果表明紅景天苷能夠有效保護(hù)制PQ誘導(dǎo)的PC12細(xì)胞的損傷。
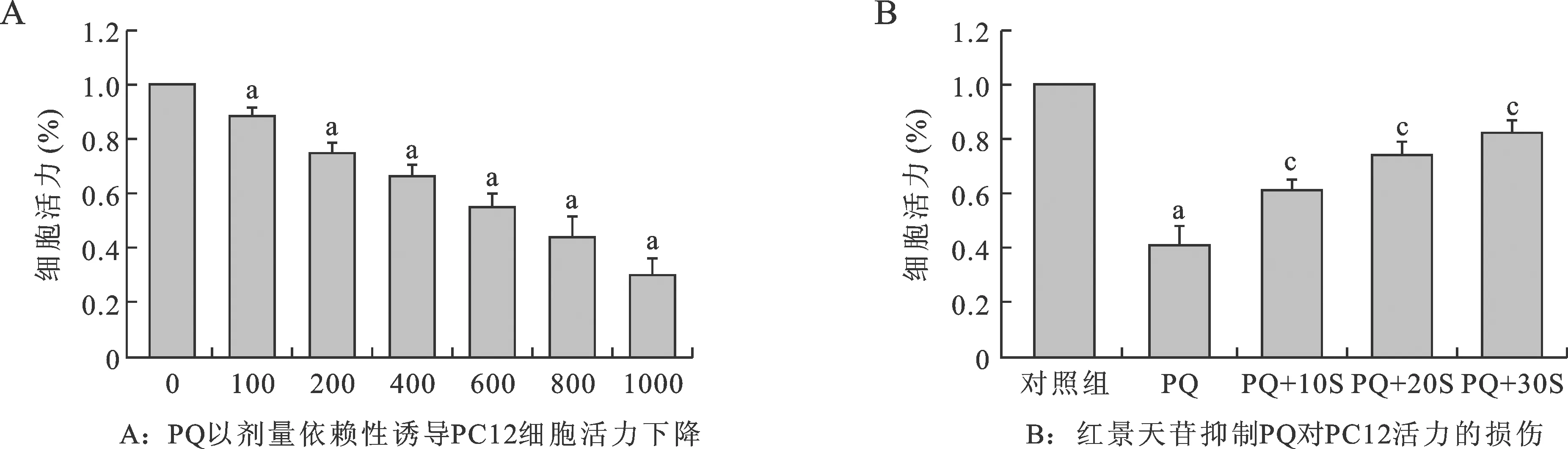
圖1 紅景天苷對(duì)PQ誘導(dǎo)的PC12細(xì)胞的損傷保護(hù)作用
3.2 紅景天苷抑制PQ誘導(dǎo)的PC12細(xì)胞凋亡 結(jié)果顯示:與對(duì)照組相比,800 μmol/L PQ明顯增加促進(jìn)了細(xì)胞凋亡,凋亡率為48.8%,而10 μmol/L、20 μmol/L和40 μmol/L紅景天苷預(yù)處理細(xì)胞24 h后,再加800 μmol/L PQ,細(xì)胞凋亡百分率分別為33.9%、21.1%、10.8%,與其它各組比較有統(tǒng)計(jì)學(xué)意義(圖2),表明紅景天苷可有效抑制PQ誘導(dǎo)的PC12細(xì)胞凋亡,且這種抑制作用具有劑量依賴(lài)性。
3.3 紅景天苷抑制PQ引起的PC12細(xì)胞MMP的下降 PQ作用PC12細(xì)胞后,Rh123染色熒光強(qiáng)度從6.81減弱至0.78,細(xì)胞MMP顯著下降(P? 0.05,圖3B);加入10μmol/L、20 μmol/L和30 μmol/L紅景天苷后,與PQ組相比,細(xì)胞MMP明顯增加,具有顯著性差異(P?0.05,圖3C-E),表明紅景天苷有效地抑制了PQ誘導(dǎo)的細(xì)胞MMP下降。
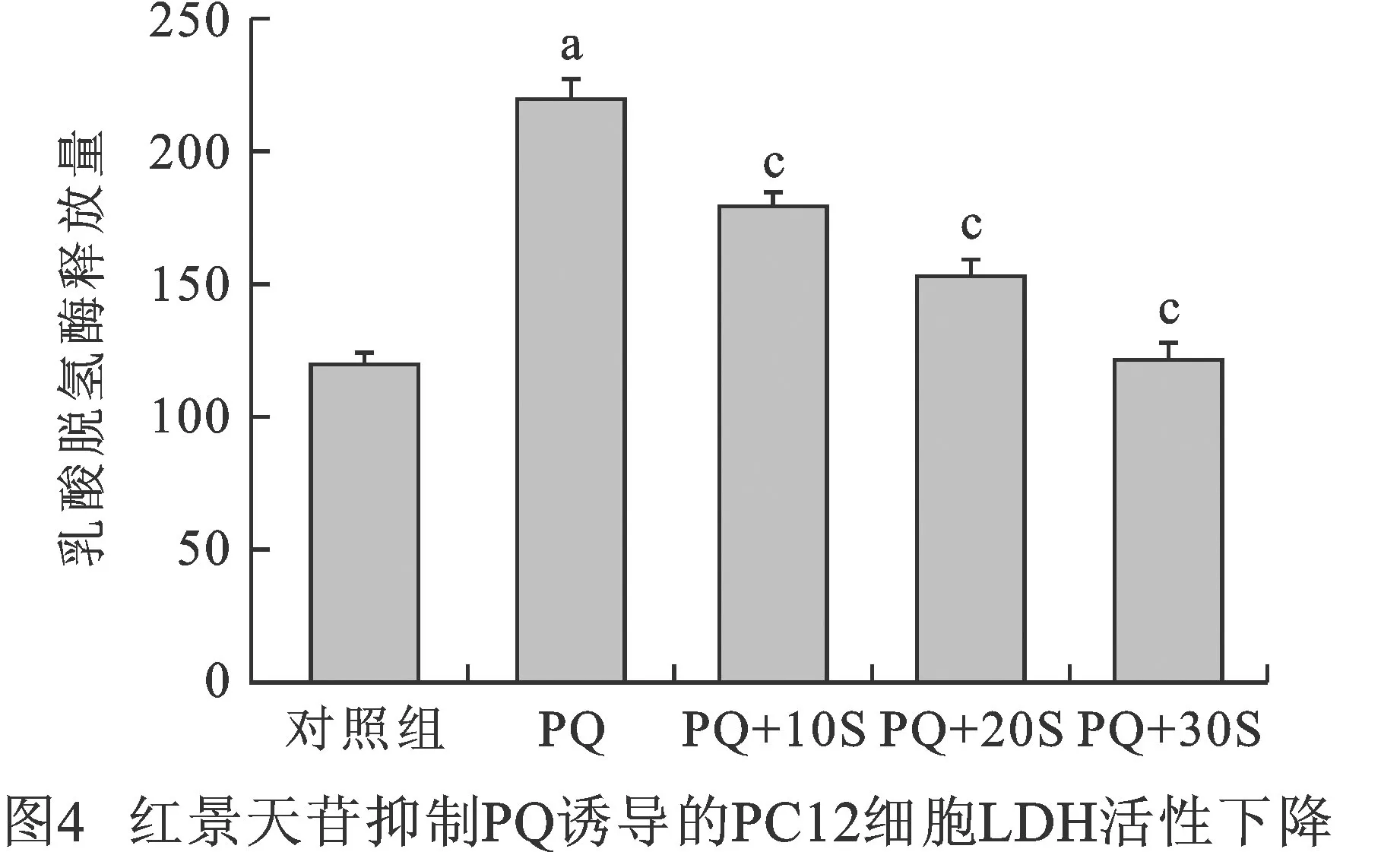
3.4 紅景天苷抑制PQ誘導(dǎo)的PC12細(xì)胞LDH活性下降 與對(duì)照組相比,800 μmol/L PQ明顯增加了LDH釋放量(118.55±3.88VS217.27±5.99,P?0.05),而分別用10 μmol/L、20 μmol/L和30 μmol/L紅景天苷預(yù)處理后,細(xì)胞LDH釋放量分別為177.34±5.59、152.70±5.15和119.82±6.04,與PQ組比較,具有統(tǒng)計(jì)學(xué)差異,說(shuō)明紅景天苷降低了LDH的釋放,有效保護(hù)了PQ誘導(dǎo)的PC12細(xì)胞的損傷(圖4)。
3.5 紅景天苷增強(qiáng)PC12細(xì)胞SOD、GSH-Px活性 與對(duì)照組比較,PQ導(dǎo)致PC12細(xì)胞SOD和GSH-Px活性顯著下降(P?0.05);10 μmol/L、20 μmol/L、30 μmol/L紅景天苷能夠明顯提高SOD和GSH-Px的活性(P?0.05),提示紅景天苷對(duì)PQ減低的PC12細(xì)胞的SOD、GSH-PX的活性有明顯的改善作用(圖5)。

A:對(duì)照組; B:800 μmol/L PQ組; C:10 μmol/L 紅景天苷 + 800 μmol/L PQ 組;D:20 μmol/L 紅景天苷 + 800 μmol/L PQ 組; E:30 μmol/L 紅景天苷 + 800 μmol/L 組
圖2 紅景天苷對(duì)PQ誘導(dǎo)的PC12細(xì)胞凋亡的抑制作用

圖3 紅景天苷抑制PQ誘導(dǎo)的PC12 MMP表達(dá)的下調(diào)

2.6 紅景天苷抑制PQ誘導(dǎo)的PC12細(xì)胞CytC釋放 免疫組織化學(xué)結(jié)果顯示:正常組細(xì)胞形態(tài)良好,CytC均勻分布于胞質(zhì)及突起內(nèi)。PQ處理后細(xì)胞變圓、皺縮,CytC表達(dá)增強(qiáng)。紅景天苷預(yù)處理后,各組中CytC的表達(dá)減少,呈弱陽(yáng)性(圖6)。

A:對(duì)照組; B:800 μmol/L PQ組; C:10 μmol/L 紅景天苷 + 800 μmol/L PQ 組;D:20 μmol/L 紅景天苷 + 800 μmol/L PQ 組; E:30 μmol/L 紅景天苷 + 800 μmol/L PQ 組
圖6 CytC 免疫組織化學(xué)染色結(jié)果 (400×)
4 討 論 帕金森病(Parkinson,sdisease,PD)是一種復(fù)雜的疾病,受多種因素影響。其中,自由基對(duì)神經(jīng)元的損害是帕金森致病的一個(gè)重要因素[3]。百草枯與多巴胺能神經(jīng)毒素MPP+具有相似的結(jié)構(gòu),能夠誘發(fā)氧化應(yīng)激。紅景天苷在抗衰老、抗疲勞、抗輻射、抗缺氧、抗腫瘤、抗病毒中具有重要的作用,調(diào)節(jié)機(jī)體免疫力,有效保護(hù)神經(jīng)發(fā)育和損傷。本課題以PC12細(xì)胞為模型,探討紅景天苷對(duì)PQ導(dǎo)致該細(xì)胞毒性損傷的影響,為紅景天苷治療PD提供實(shí)驗(yàn)依據(jù)。
本研究中,我們以PQ成功誘導(dǎo)了PC12細(xì)胞的細(xì)胞毒性損傷,發(fā)現(xiàn)PQ能夠以劑量依賴(lài)性的方式影響PC12的細(xì)胞活力,這與以往的報(bào)道一致[11],顯示PQ引發(fā)了PC12的細(xì)胞毒性損傷,其分子機(jī)制可能是抑制了PI3K/AKT信號(hào)轉(zhuǎn)導(dǎo)通路[12]。在細(xì)胞實(shí)驗(yàn)中,我們選擇了800 μmol/L PQ作為我們實(shí)驗(yàn)的作用濃度,因?yàn)檫@一濃度能夠有效誘導(dǎo)PC12的細(xì)胞毒性損傷。我們的研究發(fā)現(xiàn),紅景天苷能夠有效地抑制PQ誘導(dǎo)的PC12細(xì)胞的細(xì)胞活力下降。進(jìn)一步,我們的實(shí)驗(yàn)結(jié)果表明,PQ對(duì)PC12細(xì)胞的活力影響主要是通過(guò)誘導(dǎo)細(xì)胞凋亡引起的,而紅景天苷逆轉(zhuǎn)了PQ誘導(dǎo)的PC12的細(xì)胞凋亡。這些結(jié)果表明,紅景天苷有效地抑制PQ誘導(dǎo)的PC12細(xì)胞毒性損傷。
SOD、GSH-PX是機(jī)體主要抗氧化酶,能夠有效清除自由基的產(chǎn)生。SOD、GSH-PX表達(dá)水平是神經(jīng)系統(tǒng)衰老和損傷最為敏感和可靠的指標(biāo)[13]。本研究中,我們檢測(cè)了PQ對(duì)PC12細(xì)胞中LDH、SOD和GSH-PX的表達(dá)和活力的影響,我們發(fā)現(xiàn)PQ抑制了LDH、SOD和GSH-PX的表達(dá)和活力,進(jìn)一步表明,PQ能夠誘導(dǎo)PC12細(xì)胞的細(xì)胞毒性,并且與氧化應(yīng)激有密切的關(guān)系。為此,我們研究了紅景天苷對(duì)氧化應(yīng)激的保護(hù)作用。我們的結(jié)果表明,紅景天苷能夠抑制PQ能夠誘導(dǎo)PC12細(xì)胞的細(xì)胞毒性,恢復(fù)了LDH、SOD和GSH-PX的表達(dá)和活力。這些結(jié)果提示,紅景天苷可能是通過(guò)氧化應(yīng)激酶發(fā)揮神經(jīng)保護(hù)作用。
線(xiàn)粒體膜電位的穩(wěn)定性有利于維持細(xì)胞正常生理功能,為ATP的合成和線(xiàn)粒體攝取Ga2+提供保障[14]。線(xiàn)粒體也是細(xì)胞內(nèi)活性氧的主要來(lái)源,但是,過(guò)多活性氧將導(dǎo)致正常細(xì)胞和組織的損害,引發(fā)多種疾病,如老年癡呆、帕金森病等[15]。為此,我們觀(guān)察了紅景天苷對(duì)PQ誘導(dǎo)的PC12細(xì)胞線(xiàn)粒體膜電位及CytC的釋放的影響。實(shí)驗(yàn)結(jié)果表明,PQ導(dǎo)致了PC12細(xì)胞的線(xiàn)粒體細(xì)胞膜電位下降和增加了CytC的釋放,提示產(chǎn)生了明顯的細(xì)胞毒性損傷。但是,紅景天苷處理后,能夠有效逆轉(zhuǎn)這一現(xiàn)象,使細(xì)胞線(xiàn)粒體膜電位增強(qiáng),減少了CytC的釋放。
因此,我們的實(shí)驗(yàn)結(jié)果表明紅景天苷對(duì)PQ誘導(dǎo)的PC12細(xì)胞損傷具有保護(hù)作用,提高了細(xì)胞抗氧化能力,減少氧化應(yīng)激損傷,維持了細(xì)胞線(xiàn)粒體正常功能,為其臨床應(yīng)用治療PD提供了實(shí)驗(yàn)依據(jù)。
[1] 李 巖,呂曉華.紅景天苷膠囊對(duì)小鼠抗疲勞的效應(yīng)[J]. 川北醫(yī)學(xué)院學(xué)報(bào),2012,6(27):531-533.
[2] 申佳佳,苑隆國(guó),李電東,等.紅景天苷對(duì)自然衰老小鼠模型的抗衰老作用研究[J]. 中國(guó)醫(yī)藥生物技術(shù) 2012,6(7):412-417.
[3] 呂紅梅,趙云波.紅景天抗腫瘤機(jī)制研究[J]. 中國(guó)醫(yī)藥導(dǎo)報(bào),2012,11(9):15-18.
[4] 宋漢軍,呂少春,李麗疆,等.紅景天苷的抗腫瘤作用[J]. 中國(guó)老年學(xué)雜志,2011,10(31):3991-3992.
[5] Fei Q,McCormack AL,Di Monte DA,et al. Paraquat neurotoxicity is mediated bu a Bak-dependent machanism [J]. J Biol Chem,2008,283(6):3357-3364.
[6] 張志堅(jiān),周從陽(yáng),羅雅娟,等.百草枯中毒大鼠腎組織Livin蛋白與Caspase-3的表達(dá)及干預(yù)[J]. 中華急診醫(yī)學(xué)雜志 2011,20(7):717-721.
[7] 張志堅(jiān),周從陽(yáng),羅雅娟,等. 烏司他丁對(duì)百草枯中毒大鼠腎臟損傷的保護(hù)作用及機(jī)制研究[J]. 中華急診醫(yī)學(xué),2011,31(8):718-720.
[8] Satomi Y,Sakaguchi K,Kasahara Y,et al. Novel and extensive aspects of paraquat-induced pulmonay fibrogenesis:comparative and time-couse microarray analysis in fibrogenic and non-fibrogenici rats[J]. J Toxicol Sci 2007,32(5):529-553.
[9] Dinis-Oliveira RJ,Sousa C,Remiao F,et al. Full survival of paraquat-exposed rats after treatment with sodium aslicylate[J]. Free Radic Biol Med 2007,42(7):1017-1028
[10] Shibata M,Hakuno F,Daisuke Y,et al. Paraquat-induced oxidative stress represses phosphatidylinositol 3-kinase activities leading to impaired glucose untake in 3T3-L1 adipocytes[J]. J Biol Chem 2010,285(27):20915-20925.
[11] 楊新玲,蔡 堅(jiān),姚亞妮,等.胰島素對(duì)百草枯誘導(dǎo)損傷PC12細(xì)胞的保護(hù)機(jī)制的研究[J]. 中華神經(jīng)醫(yī)學(xué)雜志,2010,2(9):137-140.
[12] Guo LP,Wang J,Jiang YP. Effect of insulin on 1-methyl-4-phenylpyridinium ion-induced apoptosis of PC12 cells [J]. Neural Regeneration Research 2006,1(4):313-316.
[13] Moorthy K,Sharma D,Basir SF,et a1.Administration of estradiol and progesterone modulate the activities of antioxidant enzyme and aminotransferases in naturally menopausal rats[J].Exp Gerontol 2005,40(4):295-302.
[14] Johnstone RW,Ruefli AA,Iowe SW. Apoptosis:a link between cancer genetics and chemotherapy[J].Cell,2002,108(2):153-164.
[15] Balahan RS,Nemoto S,F(xiàn)inkel T.Mitochondria,oxidants,and aging[J]. Cell,2005,120(4):483-495.
(收稿2015-01-05;修回2015-02-21)
The protective effects of salidroside against paraquat-induced PC12 Cell line damage
The Ninth Hospital of Xi'an City (Xi’an710054)
Li Hailong Wu Shouzhen Li Min et al
Objective:To explore the neuroprotective effect and related mechanisms of Salidroside against paraquat(PQ) induced the damage in pheochromocytoma (PC12) cells. Methods:Using PQ-induced PC12 cells damage as the model of Parkinson’s disease in vitro,Cells were divided into 3 groups:control group;PQ treated group:800 μmol/L PQ treated alone;preventive groups:(10,20,30)μmol/L salidroside + 800 μmol/L PQ. the cytotoxicity of PQ was measured by MTT assay,the apoptosis of PC12 cells was detected by flow cytometry,Mitochondrial membrane potential(MMP)of PC12 cells was detected by Rh123 staining,the release of LDH and the active of SOD,GSH-PX were detected by shade selection assay,CytC immunostaining were used to detect the expresion of this protein. Results:10,20,30 μmol/L Salidroside played a protective role in the damage induced by 800 μmol/L PQ for 24 h. Salidroside significantly increased the cell viability,inhibited LDH,CytC release induced by PQ. MMP collaps in preventive groups were inhibited and the active of SOD,GSH-PX were markedly enhanced. Conclusion:Salidroside can protect cells from the necrosis and apoptosis induced by PQ,The mechanism of the protective effects of Salidroside may include increasing the activation of active of SOD,GSH-PX,inhibiting the release of CytC and MMP collapse induced by PQ.
Salidroside PC12 cells Paraquat Cenapoptosis Neuroprotective
*國(guó)家自然科學(xué)基金項(xiàng)目(81100001)
△西安市兒童醫(yī)院(西安 710003)
紅景天苷 百草枯 細(xì)胞凋亡 PC12細(xì)胞 神經(jīng)保護(hù)
R966
A
10.3969/j.issn.1000-7369.2015.07.082

