環孢子蟲食源性感染及其檢測技術研究進展
李俊強,孫芳芳,王榮軍,張龍現*
(河南農業大學牧醫工程學院,河南省人獸共患病國際聯合實驗室,河南 鄭州 450002)
?
環孢子蟲食源性感染及其檢測技術研究進展
李俊強,孫芳芳,王榮軍,張龍現*
(河南農業大學牧醫工程學院,河南省人獸共患病國際聯合實驗室,河南 鄭州 450002)
摘 要:環孢子蟲(Cyclospora)是一種新發現的細胞內寄生的腸道寄生性原蟲,食入被環孢子蟲卵囊污染的蔬菜或水果會引起感染發病,環孢子蟲主要寄生于人類和嚙齒類、爬行類、哺乳類、非人靈長類等動物體內。環孢子蟲病在世界范圍內散在感染或暴發流行,主要引起人和動物的胃腸炎和腹瀉等癥狀,甚至導致死亡,造成嚴重的健康威脅和經濟損失。本文概述近幾年來環孢子蟲的分類情況、遺傳特性研究、流行病學現狀以及常用檢測技術等方面的研究進展。
關鍵詞:環孢子蟲;食源性感染;流行性;檢測技術
環孢子蟲(Cyclospora)是一種新發現的細胞內寄生的腸道寄生性原蟲,引起人和動物的胃腸炎和腹瀉,同時還伴隨有食欲減退、乏力、腹脹、腹痛、惡心、嘔吐、體質量減輕等癥狀,嚴重的甚至導致死亡[1]。光學顯微鏡下,環孢子蟲卵囊是一個近球形的折射體,中間是桑葚胚,卵囊直徑為8.6 μm(7.7~9.9 μm)[2],經改良抗酸染色多呈深紅色或不著色[3]。紫外激發光照射下,其卵囊壁在330~380 nm波長范圍光譜下發藍色熒光,在450~490 nm波長范圍光譜下發綠色熒光[4]。環孢子蟲的生活史是單宿主型,可以分為無性生殖和有性生殖階段[2,5]。具有感染性的孢子化卵囊含有兩個孢子囊,且每個孢子囊含有兩個子孢子[2,6]。
自Ashford[7]于1979年在巴布亞新幾內亞的腹瀉患者糞便中首次檢測到環孢子蟲卵囊,到目前包括非洲在內[8]的世界各地陸續有環孢子蟲感染的報道。最初,環孢子蟲被認為是球蟲樣或藍藻樣小體,隨后到1994年才確定其分類地位[6]。1990年之前環孢子蟲感染僅為散在的報道[1],自1996—1997年期間美國和加拿大有大規模環孢子蟲病的暴發,對其傳播來源追蹤調查發現,此次暴發主要是由于誤食從危地馬拉進口的木莓而引起[1-2];2000年德國環孢子蟲病暴發與法國和意大利南部農場出產的萵苣有關[9],這是歐洲首次對于環孢子蟲病暴發的報道;再到2013年環孢子蟲病在美國25 個州的暴發,造成了嚴重的危害[10],因此環孢子蟲病越來越受到重視和研究。
1 環孢子蟲的分類及遺傳特性
1.1分類
在分類上,環孢子蟲屬于頂復門孢子蟲綱球蟲亞綱艾美耳科環孢子蟲屬[2,6]。到目前為止,環孢子蟲已報道的有19 個種[11](Cyclospora glomericola、C. caryolytica、C. viperae、C. babaulti、C. scinci、C. tropidonoti、C. zamenis、Cyclospra sp.、C. niniae、C. talpae、C. megacephali、C. ashtabulensis、C. parascalopi、C. angimurinensis、C. cayetanensis、C. cercopitheci、C. colobi、C. papionis、C. schneideri n. sp),宿主包括嚙齒類、爬行類、非人靈長類和人類等,還發現哺乳動物的一些未定種[12-13]。
1.2遺傳特性研究
微生物基因組中的保守區和高變區域的特征已經被廣泛研究,進行相關的遺傳特性研究。利用分子生物學工具研究的環孢子蟲種只有從哺乳動物中獲得的5 種,包括寄生于人體的C. cayetanensis[2]、寄生于非人靈長類的C. cercopitheci、C. colobi、C. papionis[14-16]和寄生于奶牛的環孢子蟲[12]。
應當注意的是18S rRNA基因具有高度保守性,因此,18S rRNA基因對區分人環孢子蟲(C. cayetanensis)或其他環孢子蟲種的不同分離株之間的親緣關系十分有用。已經有研究者利用環孢子蟲18S rRNA基因區分環孢子蟲和其他的頂復門寄生蟲[17]。另外,分析來源于人和狒狒的環孢子蟲分離株的18S rRNA基因顯示有1.6%~1.7%的差異,然而人和狒狒環孢子蟲的分離株之間的差異分別有0.78%和0.73%[18]。在另一項研究中顯示,C. papionis、C. colobi和C. cercopitheci的18S rRNA基因與人分離株有0.3%~0.6%的序列差異[14]。針對其他哺乳動物的環孢子蟲的18S rRNA基因的研究也在進行,主要集中在非人靈長類和奶牛。高振永等[19]根據猴源環孢子蟲18S rRNA基因序列,設計保守引物,并進行了特異性和敏感性實驗。隨后,Li Wei等[20]對從肯尼亞捕獲的狒狒樣品中,擴增了18S rRNA基因的部分序列,并對其進行了分子種系發育分析。
由于18S rRNA基因的高度保守性,限制了其區分親緣關系較近物種的能力,因此要進行環孢子蟲屬內的鑒定,需要相對多態的序列作為靶基因。已經有運用高變異的ITS-1 基因區分了人環孢子蟲(C. cayetanensis)和狒狒環孢子蟲(C. papionis)。Olivier等[21]運用高變異的ITS-1區域序列區分人環孢子蟲(C. cayetanensis)和狒狒環孢子蟲(C. papionis),發現ITS-1序列為高度變異的區域,人環孢子蟲和狒狒環孢子蟲的ITS-1基因序列存在差異。考慮到C. cayetanensis分離株的ITS-1序列的變異性(0%~6.5%),內部轉錄間隔區(ITS)美國分離株(8.3%)比危地馬拉分離株(3.8%)序列變異大,但是序列和地理差異沒有相關性。從沒有國外旅游歷史的美國人獲得的樣品觀察到序列有高變異性顯示,環孢子蟲主要呈地方流行性。5 份1996年在美國暴發時獲得的分離株ITS-1序列相同,然而與在危地馬拉和秘魯分離株的ITS-1序列有差異。在所有的ITS-1基因序列中,共感染或多拷貝也許能解釋ITS-1區域的變異性較大的原因。人環孢子蟲(C. cayetanensis)和狒狒環孢子蟲(C. papionis)的5.8S rRNA基因已經測序完成,經過校正以后的序列顯示其高度的保守性。2013年,Sulaiman等[22]建立了一種基于HSP 70蛋白基因的快速檢測人環孢子蟲(C. cayetanensis)的方法,結果顯示HSP 70蛋白基因在不同分離株之間未發現存在多態性。
環孢子蟲卵囊需要在外界適當的條件下分化一段時間,才能發育為含有兩個子孢子的具有感染性的孢子化卵囊。在食物或是水中的環孢子蟲卵囊是否具有感染性,對于環孢子蟲的傳播感染是十分重要的。雖然聚合酶鏈式反應(polymerase chain reaction,PCR)能有效地在不同樣品中檢測環孢子蟲,但是不能區分孢子化和未孢子化卵囊。
2 環孢子蟲的流行性
2.1流行地區
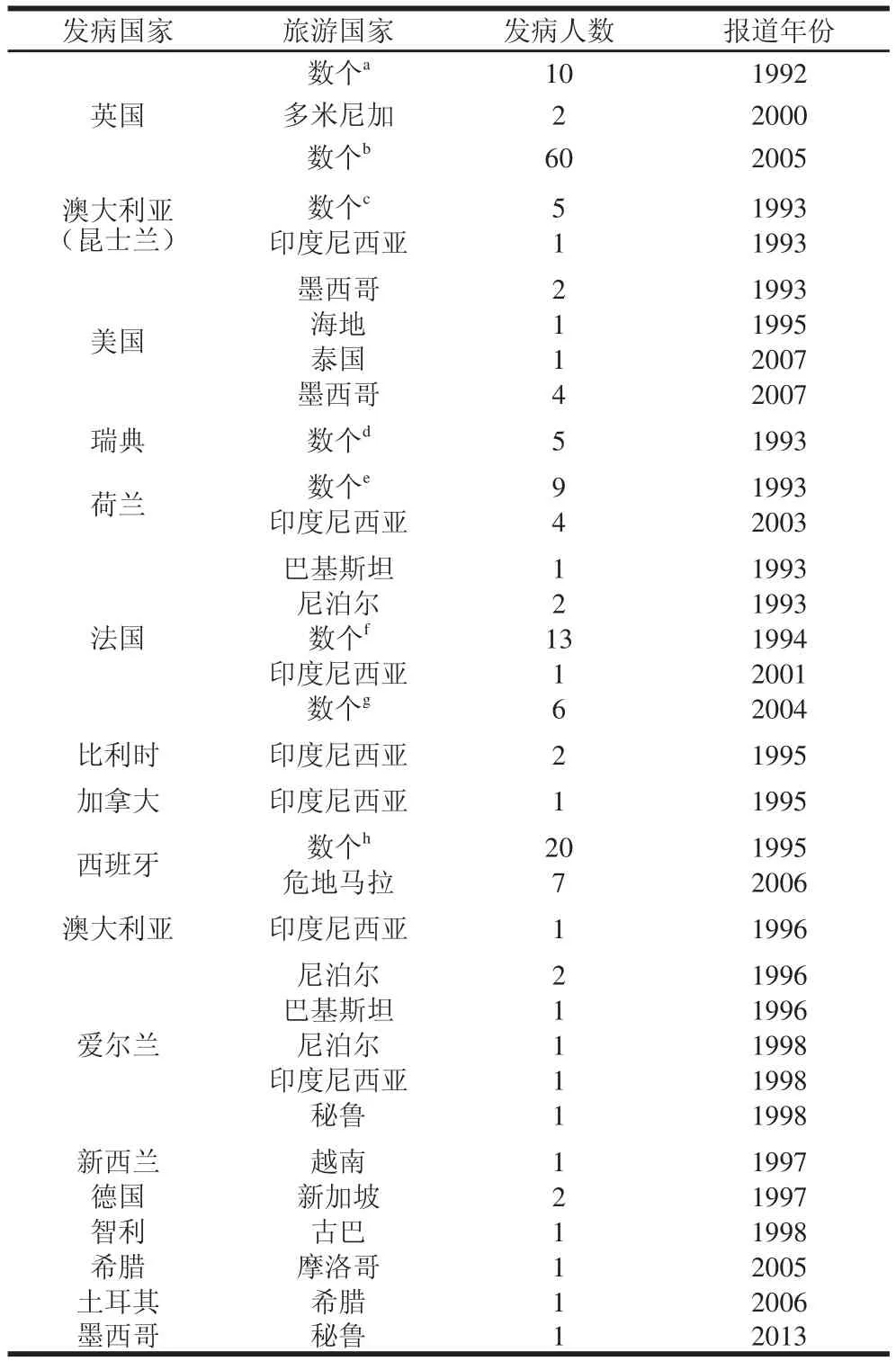
表1 旅游者感染環孢子蟲的報道[[22]]Table 1 Case reports of Cyclossppoorraa infection in returning travelers[[22]]
環孢子蟲的感染主要集中在旅游者(表1)、艾滋病人和呈地方流行(無旅游史)地區的居民(表2)。1995年之前僅有散在環孢子蟲感染的報道。1996—1997年間,美國和加拿大有大規模的環孢子蟲病暴發,共有2 944 個環孢子蟲感染病例[1]。自2000年以來,在美國、加拿大、英國、土耳其、哥倫比亞、南非等國家和地區相繼暴發,總共超過550 例確診環孢子蟲病病例[2,23]。2014年墨西哥又報道了一例從秘魯飛行回來的航空飛行員感染環孢子蟲的病例[24],環孢子蟲病越來越受到人們的重視。特別是2013年6月以來,截止9月20日,在美國包括紐約州在內的愛荷華州、內布拉斯加州和德克薩斯州等25 個州的643 例感染環孢子蟲的確診病例,有近8%的病例(49 例)由于嚴重腹瀉而住院,目前還沒有死亡的報道[10]。我國于1995年首次報道環孢子蟲感染病例,隨后浙江、安徽、云南等地均有環孢子蟲感染病例報告[23,25]。2011年,Zhou Yang等[3]報道了河南省住院病人的環孢子蟲感染情況。環孢子蟲的流行性越來越受到國內外學者的重視。可見,環孢子蟲病在世界范圍內流行,在無論是像我國一樣的發展中國家還是歐美發達國家都造成了嚴重的經濟損失,甚至危及人們的生命健康。
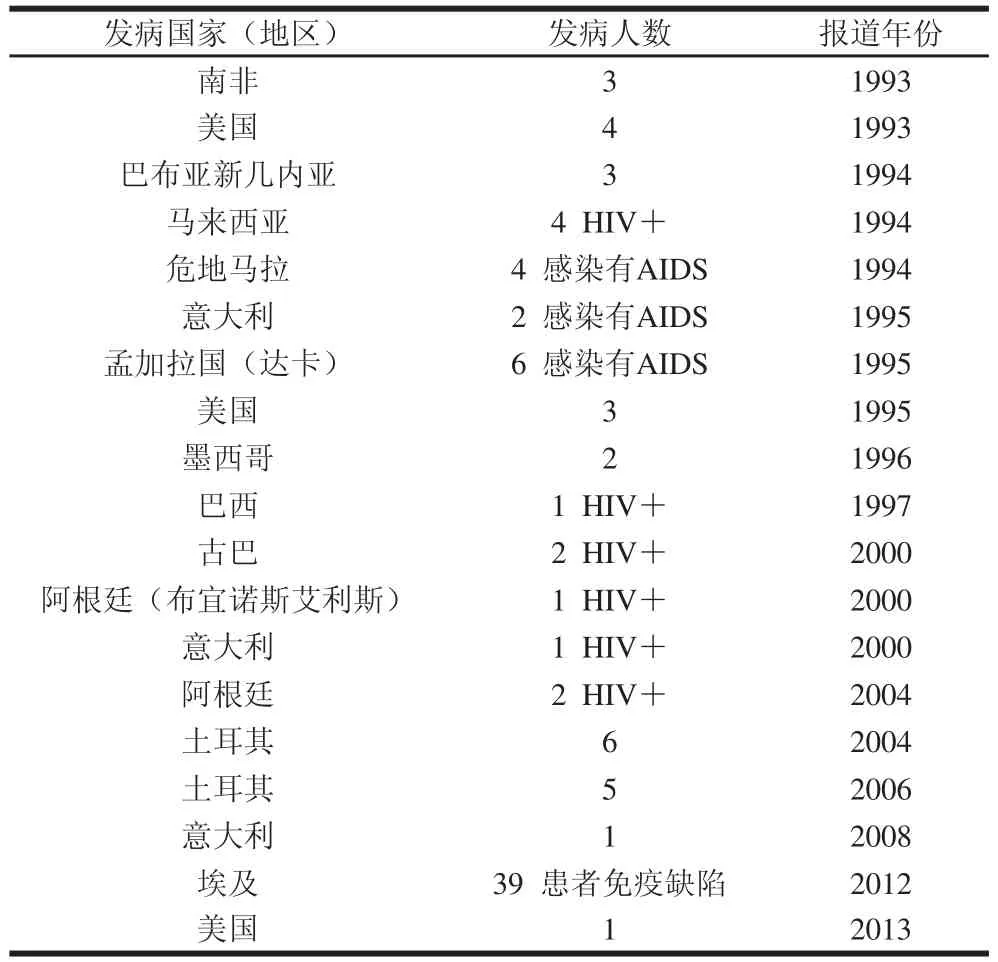
表2 無旅游史的環孢子蟲感染情況[[22]]Table 2 Case reports of individuals with Cyclossppoorraa infection and without traveling history[[22]]
2.2流行季節
環孢子蟲病的暴發具有明顯的季節性,多發生于溫暖多雨的夏秋季節,這可能與感染性的孢子化卵囊需要一定的溫度才能孢子化有關,又由于夏秋季節與水接觸頻繁而且有生食蔬菜和水果的習慣,同樣為環孢子蟲的傳播創造了條件。經過5 年在秘魯的調查結果表明,環孢子蟲病多發于1—7月,而發病高峰集中在4—6月。同樣有學者統計1995—1999年間美國和加拿大環孢子蟲病的暴發,其中97.8%的感染集中在晚春和初夏季節,而4—7月為發病高峰期[1]。Hoge等[26]調查發現尼泊爾的環孢子蟲感染主要發生在雨季,在危地馬拉Bern等[27]通過對糞便樣品的監測證實環 孢子蟲病流行高峰期在7月份。2006—2009年期間,Ozdamar等[28]在土耳其伊斯坦布爾進行了人環孢子蟲(C. cayetanensis)病流行病學調查,使用光學、熒光顯微鏡和改良抗酸染色的方法來檢查環孢子蟲卵囊,陽性樣品擴增基因組的ITS-1區域進行確認,調查發現環孢子蟲病集中發病于7月份的15 d內。2009—2010年,Zhou Yang等[3]對河南鄭州和開封地區的臨床住院病人進行了為期一年的腸道寄生蟲調查,發現環孢子蟲感染率為0.70%(81/11 554),并且感染具有明顯的季節性,主要集中于夏秋季節(7—11月)。同樣,2013年美國環孢子蟲病的暴發,其感染者主要集中于6月中旬和7月中旬[10]。
2.3傳播途徑
目前盡管對環孢子蟲的傳播途徑仍不是很清楚,但有不少研究報告認為環孢子蟲主要通過食源性蔬菜或水果進行傳播。1996—1997年之間,美國和加拿大的環孢子蟲病暴發是由于食用從危地馬拉進口的木莓引起[1]。1999年夏天,美國密蘇里州環孢子蟲病暴發是通過食用受環孢子蟲卵囊污染的蔬菜沙拉而傳播[1]。2000年歐洲首次環孢子蟲病的暴發與從法國和意大利南部農場進口的萵苣有關[9]。2013年美國25 個州的環孢子蟲病暴發,到目前為止還沒有確定其感染來源,但存在以下可能,1)從墨西哥進口的農產品受到環孢子卵囊蟲污染,從德克薩斯州貨運到北部的愛荷華州、內布拉斯加州造成傳播;2)由泰勒農場的農作物受到環孢子蟲卵囊污染造成;3)大范圍的水源污染也可能導致農產品的污染[10]。其中,2003年,Dowd等[29]在危地馬拉市周圍的鄉村居民水源地檢測到人環孢子蟲的存在,這是首次在飲用水中發現環孢子蟲,表明環孢子蟲可能通過水源傳播。之后,無論是用于灌溉或是蔬菜加工的水中都檢測到了環孢子蟲卵囊[30]。
環孢子蟲感染者的糞便中含有大量卵囊,因而糞便為該病的傳染源[31]。然而大量的證據表明,環孢子蟲卵囊可能是直接污染蔬菜類草本植物或是通過含有環孢子蟲卵囊的水體被誤食而引起人體的感染。環孢子蟲卵囊在23~30 ℃的條件下貯藏7~15 d分化為含有兩個孢子囊的具有感染性的孢子化卵囊才具有傳染性,所以人與人之間是否能直接傳播還有待進一步研究。表3列出了1990年至今環孢子蟲食源性和水源性暴發流行的國家及地區、發病人數、發病傳播媒介及可能來源,顯示美國和加拿大的多個地區環孢子蟲病的暴發與蔬菜、水果、食物或水源有直接關系。
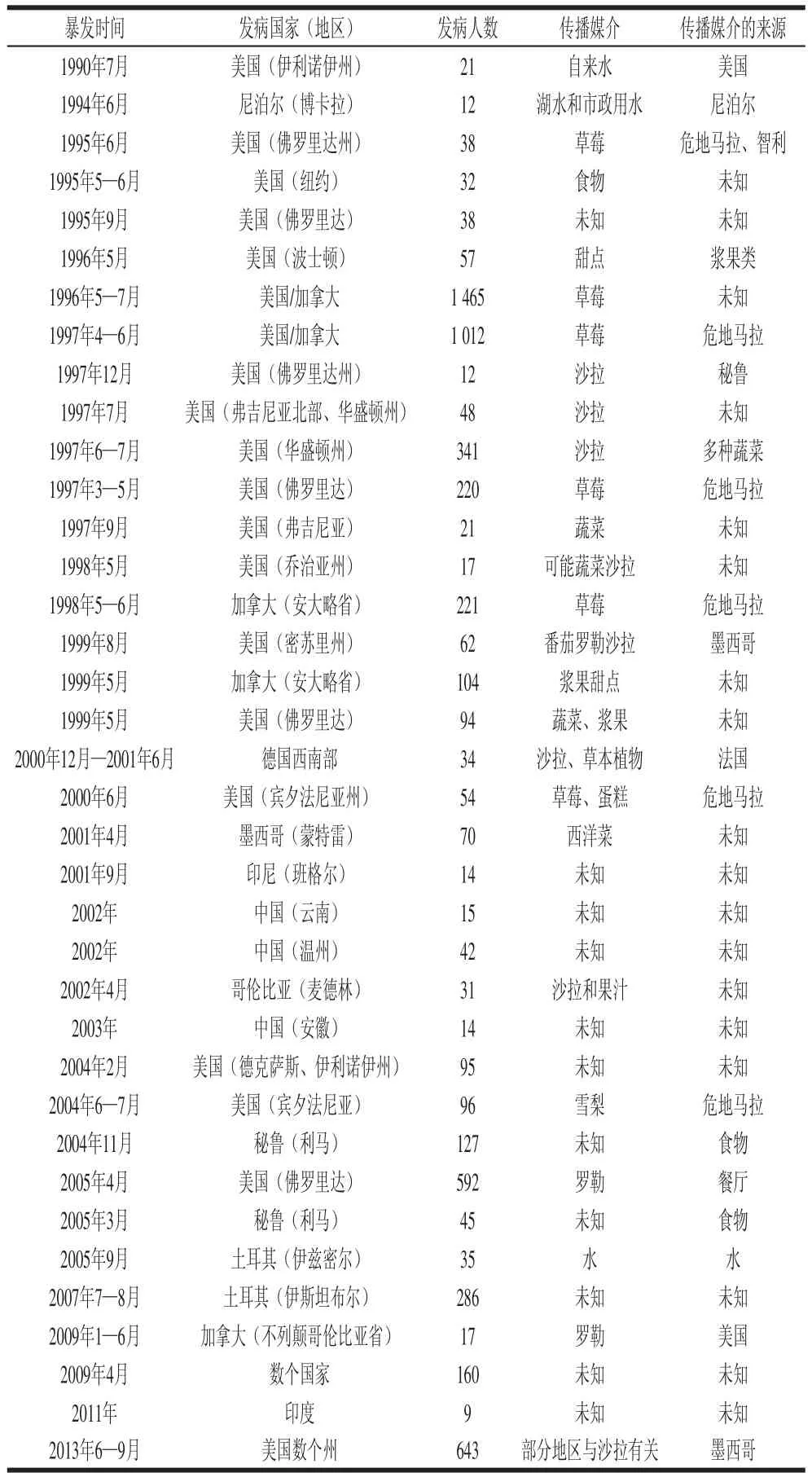
表3 食源性和水源性暴發的環孢子蟲感染情況[[22]]Table 3 Reported food- and water-borne Cyclossppoorraa outbreaks[[22]]
2.4易感年齡
2006年,Sancak等[32]報道了土耳其5 例年齡在27~67 歲之間,免疫功能正常的住院病人糞便中檢測到環孢子蟲卵囊;而王克霞等[33]對安徽省不同地區的環孢子蟲感染情況進行的調查發現,有腹瀉癥狀兒童的感染率為5.62%;2013年,Tandukar等[34]對尼泊爾的在校兒童的腸道寄生蟲的調查發現,環孢子蟲的感染率為1.6%,高于其他年齡段的環孢子蟲感染情況。2011年進行的在對河南省鄭州和開封兩地為期兩年的住院病人的腸道寄生蟲的感染情況調查顯示,環孢子蟲的感染率為0.70%,其中7~17 歲年齡組的環孢子蟲的檢出率最高為1.47%[3]。2013年美國環孢子蟲病大暴發,其感染年齡從不到1 歲至94 歲,平均年齡為52 歲[10]。可見環孢子蟲的感染主要集中在免疫力低下的小孩和老人,但是環孢子蟲在不同地區具有不同的流行傳播特點,其易感人群也有所不同。
3 檢 測技術
目前,研究者普遍懷疑環孢子蟲的感染是由于患者食入被環孢子蟲卵囊污染的羅勒、香菜、生菜、馬郁蘭和薄荷等草本植物類食物,或飲用被環孢子蟲卵囊污染的水源,但隨糞便排出的卵囊需在適宜的環境中數天至數周孢子化后才具有感染性。環孢子蟲的檢測對于環孢子蟲病的流行病學研究有著特殊而重要的意義,是環孢子蟲病防控的主要依據。
3.1常規檢測技術
環孢子蟲的常規檢測技術包括顯微鏡檢測、改良抗酸染色和孢子化實驗等方法。環孢子蟲在光學顯微鏡下卵囊是一個近似球形的折射體,中間是桑葚胚,卵囊直徑為8~10 μm,經改良抗酸染色多呈深紅色,孢子化卵囊含有兩個孢子囊,且每個孢子囊含有兩個子孢子(圖1)[3]。由于環孢子蟲卵囊通常在草本植物和飲水中的含有量較少,在使用常規顯微鏡檢測和改良抗酸染色檢測時,需要將植物或是水體中的環孢子蟲卵囊濃集,另外,傳統的卵囊檢測方法敏感性低、檢測時間長、易造成檢測人員眼疲勞、受到檢測人員知識水平限制,以及糞便中的雜質會造成假陽性或假陰性等影響檢測結果。

圖1 環孢子蟲卵囊形態結構(1 000×)[[33]]Fig.1 Cyclospora cayetanensis oocysts examined by microscope (1 000 ×)[3]
3.2流式細胞儀檢測技術
近年來出現了一種新的檢測環境中和臨床樣品中環孢子蟲卵囊的方法,即流式細胞術。在熒光顯微鏡下使用330~380 nm波長范圍的濾光器,環孢子蟲卵囊發藍光熒光[3],利用這個特性可以用于環孢子蟲的檢測和流行病學的調查。Dixon等[35]利用流式細胞計量術檢測人糞便中的環孢子蟲卵囊,李俊強等[36]建立了卡耶坦環孢子蟲的流式細胞儀檢測方法,結果顯示該方法的敏感性比顯微鏡檢查法高。由于糞便樣品的時間和貯藏條件會影響卵囊熒光的強度,可能會影響檢測結果。血清學篩選實驗同樣也可以用于環孢子蟲的檢測,有利于大范圍的環孢子蟲流行病學調查,但是由于目前還沒有針對環孢子蟲的特異性抗體,限制了其廣泛應用。
3.3分子生物學技術
分子生物學技術具有靈敏度高和特異性強的優點,微生物的基因組中的多變區域的特征已經被廣泛的研究,以了解它們在流行病學中的地位,環孢子蟲不同分離株之間的基因組學可以追蹤其傳染來源,在環孢子蟲病的分子流行病學調查和檢測研究中有重要的意義。
3.3.1 巢式PCR(nest-PCR)
2006年,Helmy等[37]對顯微鏡鏡檢和nest-PCR檢測環孢子蟲卵囊這兩種方法比較,結果顯示nest-PCR方法具有更高的特異性和敏感性。Orlandi等[38]基于18S rRNA基因部分序列成功擴增了木莓樣品中的環孢子蟲,靈敏度可達30 個卵囊/100 g;同樣利用PCR方法檢測木莓、羅勒、萵苣中的環孢子蟲(C. cayetsanensis)卵囊,靈敏度可分別達到40~100 個/100 g。針對其他哺乳動物的環孢子蟲的18S rRNA基因的研究也在進行,主要為奶牛環孢子蟲[12]和非人靈長類環孢子蟲[14-16]的感染報道和分子鑒定等方面。
由 于ITS基因轉錄但不編碼蛋白,因此它不具有結構功能的限制。長期以來,ITS基因已經用于植物基因組和進化的研究,同樣ITS基因也可以作為環孢子蟲分子鑒定的靶基因。針對ITS-1靶基因,許多學者擴增了多種環孢子蟲的ITS-1基因序列。2000年,Adam等[39]研究了與木霉進口有關的環孢子蟲暴發的病例分離株、危地馬拉和秘魯環孢子蟲病的分離株進行ITS-1基因序列比較分析,結果發現單克隆基因組的ITS-1區域存在多樣性。Ozdamar 等[28]在土耳其伊斯坦布爾進行了人環孢子蟲陽性樣品的ITS-1基因進行了擴增。ITS-1基因具有高的拷貝數,序列多變和長度適中等優點,致使這個基因成為基因分型的理想靶基因。
3.3.2 PCR-限制性片段長度多態性(PCR-restriction fragment length polymorphism,PCR-RFLP)
近年來,PCR-RFLP方法已被廣泛用于各類寄生蟲的分類與鑒定,該方法可有效地區分種間和種內差異,是研究親緣關系較近 物種之間和物種內遺傳結構的重要工具。2003年,Shields等[40]以18S rRNA基因為靶基因,并使用限制性內切酶AluⅠ,建立了一種檢測環境水中環孢子蟲卵囊的巢式PCR-RFLP方法,可以將環孢子蟲的目的基因序列與可能發生交叉反應的其他序列區別。2006年,肖淑敏等[12]以進化速度相對較慢的18S rRNA基因為靶基因,設計了兩對相對保守的引物利用巢式PCR進行擴增,并以KpnⅠ酶對PCR產物進行RFLP分析,結果顯示擴增的18S rRNA基因片段為501 bp,不具有KpnⅠ酶切位點,與反芻獸的艾美耳球蟲的酶切圖譜具有明顯的差別,進而將環孢子蟲與艾美耳球蟲區分。
3.3.3 PCR-寡核苷酸連接分析(PCR-oligonucleotide ligation assay,PCR-OLA)
Xiao Shumin等[41]建立了一種檢測臨床樣品中環孢子蟲卵囊的PCR-OLA,對牛源環孢子蟲進行了檢測,并且將PCR-OLA與常規PCR進行了比較,結果顯示該方法比常規的PCR方法敏感度高,并且能夠準確地檢測單個核苷酸的不同,而且PCR-OLA在對臨床上牛源環孢子蟲卵囊的檢測上,具有快速、簡單、準確及靈敏度高等優點。
3.3.4 多重PCR(multiplex PCR)
Orlandi等[42]于2003年利用多重PCR,根據18S rRNA基因的單核苷酸多態性(single-nucleotide polymorphisms)設計了一系列種屬特異性引物,對環孢子蟲與艾美耳球蟲進行了區分。2006年,Hussein[43]利用多重PCR對人環孢子蟲(C. cayetanensis)、長尾猴環孢子蟲(C. cercopitheci)、疣猴環孢子蟲(C. colobi)和狒狒環孢子蟲(C. papionis)進行了分子鑒定,與常規檢測方法和Nest-PCR進行比較,并對來自35 個患者體內環孢子蟲的18S rRNA基因的單核苷酸多態性進行分析,結果顯示多重PCR具有較高的特異性和靈敏性。2010年,Lee等[44]建立了一種簡單、快速、高效的多重PCR方法用于環孢子蟲的檢測,檢測限為101~102 個卵囊。隨后,Taniuchi等[45]檢測了多重PCR的特異性,表明其對于環孢子蟲暴發是有效的快速檢測方法。
3.3.5 實時熒光定量PCR(real-time quantitative PCR,qPCR)
2003年,Varma等[46]首次報道了qPCR技術在環孢子蟲卵囊檢測上的應用,其根據環孢子蟲18S rRNA基因序列設計了一對特異性引物和兩個熒光標記的雜交探針,結果顯示qPCR最少可檢測到5 μL反應體系中相當于單個環孢子蟲卵囊的DNA。此外,針對環孢子蟲的卵囊壁難于溶解和樣品中存在較多影響PCR結果的制約因素,新的改進方法不斷出現。2008年,Lalonde等[47]建立了一種敏感性高和特異性強的檢測環孢子蟲卵囊的PCR方法,該方法對水和羅勒洗滌液中不同數量級(分別為1 000、100、10、1)的卵囊進行DNA的反復提取,結果顯示水和羅勒洗滌液中的卵囊數量級越高,用于環孢子蟲PCR成功擴增所要提取的DNA次數就越少。
4 結 語
環孢子蟲病例經常在世界各地散發感染,但是1996年美國和加拿大的大規模暴發、2000年歐洲的首次暴發、以及2013年美國環孢子蟲的暴發,引起越來越多研究者的重視。我國有關環孢子蟲感染的報道也時有發生,但其來源還未完全清楚,其流行病學和檢測研究有待更進一步。因此,通過嚴格控制水源和食物源,避免環孢子蟲的污染;加強檢疫,建立方便可靠的檢測方法,避免 隨食品進口或長途運輸而傳播環孢子蟲,成為防治的重點。另一方面,根據環孢子蟲的流行病學特點和分子生物學手段追溯其來源也成為研究的熱點和防治的基礎。
參考文獻:
[1]HERWALDT B L. Cyclospora cayetanensis: a review, focusing on the outbreaks of cyclosporiasis in the 1990s[J]. Clinical Infectious Diseases, 2000, 31(4): 1040-1057.
[2]ORTEGA Y R, SANCHEZ R. Update on Cyclospora cayetanensis, a food-borne and waterborne parasite[J]. Clinical Microbiology Reviews, 2010, 23(1): 218-234.
[3]ZHOU Yang, LV Biao, WANG Qiang, et al. Prevalence and molecular characterization of Cyclospora cayetanensis, Henan, China[J]. Emerging Infectious Diseases, 2011, 17(10): 1887-1890.
[4]BERLIN O G W, PETER J B, GAGNE C, et al. Autofluorescence and the detection of Cyclospora oocysts[J]. Emerging Infectious Diseases, 1998, 4(1): 127-128.
[5]張曉麗, 張唯哲, 沈玉娟, 等. 卡耶塔環孢子蟲的生物 學和流行病學研究進展[J]. 中國寄生蟲學與寄生蟲病雜志, 2012, 30(4): 325-328.
[6]ORTEGA Y R, STERLING C R, GILMAN R H, et al. Cyclospra species-a new protozoan pathogen of human[J]. The New England Journal of Medicine, 1993, 328(18): 1308-1312.
[7]ASHFORD R W. Occurrence of an undescribed coccidian in man in Papua New Guinea[J]. Annals of Tropical Medicine and Parasitology, 1979, 73(5): 497-500.
[8]KARANJA R M, GATEI W, WAMAE N. Cyclosporiasis: an emerging public health concern around the world and in Africa[J]. African Health Sciences, 2007, 7(2): 62-67.
[9]D?LLER P C, DIETRICH K, FILIPP N, et al. Outbreak in Germany associated with the consumption of salad[J]. Emerging Infectious Diseases, 2002, 8(9): 992-994.
[10]Center for Disease Control and Prevention (CDC). Cyclosporiasis outbreak investigations: United States, 2013[EB/OL]. (2013-12-02) [2014-04-15]. http://www.cdc.gov/parasites/cyclosporiasis/outbreaks/investigation-2013.html.
[11]LAINSON R. The genus Cyclospora (Apicomplexa: Eimeriidae), with a description of Cyclospora sehneideri n. sp. in the snake Anilius scytale scytale (Aniliidae) from Amazonian Brazil: a review[J]. Memórias do Instituto Oswaldo Cruz, 2005, 100(2): 103-110.
[12]肖淑敏, 李國清, 周榮瓊, 等. 牛源環孢子蟲的發現與分子鑒定[J].中國預防獸醫學報, 2006, 28(4): 380-383.
[13]岳彩玲, 李國清, 顏超, 等. 犬源環孢子蟲的形態學與分子鑒定[J].中國人獸共患病學報, 2010, 26(2): 124-127.
[14]EBERHARD M L, da SILVA A J, LILLEY B G, et a1. Morphologic and molecular characterization of new Cyclospora species from Ethiopian monkeys: C. cercopitheci sp. n., C. colobi sp. n., and C. papionis sp. n.[J]. Emerging Infectious Diseases, 1999, 5(5): 651-658.
[15]ZHAO Guanghui, CONG Meimei, BIAN Qingqing, et al. Molecular characterization of Cyclospora-like organisms from golden snubnosed monkeys in qinling mountain in Shaanxi province, northwestern China[J]. PLoS One, 2013, 8(2): e58216. doi: 10.1371/journal. pone.0058216.
[16]YE Jianbin, XIAO Lihua, LI Jian, et al. Occurrence of humanpathogenic Enterocytozoon bieneusi, Giardia duodenalis and Cryptosporidium genotypes in laboratory macaques in Guangxi, China[J]. Parasitology International, 2014, 63(1): 132-137.
[17]RELMAN D A, SCHMIDT T M, GAJADHAR A, et al. Molecular phylogenetic analysis of Cyclospora, the human intestinal pathogen, suggests that it is closely related to Eimeria species[J]. The Journal of Infectious Diseases, 1996, 173(2): 440-445.
[18]LOPEZ F A, MANGLICMOT J, SCHMIDT T M, et al. Molecular characterization of Cyclospora-like organisms from baboons[J]. The Journal of Infectious Diseases, 1999, 179(3): 670-676.
[19]高振永, 李國清, 岳彩玲, 等. 猴源環孢子蟲巢式PCR檢測方法的建立[J]. 中國動物傳染病學報, 2010, 18(5): 32-36.
[20]LI Wei, KIULIA N M, MWENDA J M, et al. Cyclospora papionis, Cryptosporidium hominis, and human-pathogenic Enterocytozoon bieneusi in captive baboons in Kenya[J]. Journal of Clinical Microbiology, 2011, 49(12): 4326-4329.
[21]OLIVIER C, van de PAS S, LEPP P W, et al. Sequence variability in the first internal transcribed spacer region within and among Cyclospora species is consistent with polyparasitism[J]. International Journal for Parasitology, 2001, 31(13): 1475-1487.
[22]SULAIMAN I M, TORRES P, SIMPSON S, et al. Sequence characterization of heat shock protein gene of Cyclospora cayetanensis isolates from Nepal, Mexico, and Peru[J]. The Journal of Parasitology, 2013, 99(2): 379-382.
[23]周洋, 王強, 呂彪, 等. 環孢子蟲流行病學、分類及其遺傳特征的研究進展[J]. 中國人獸共患病學報, 2009, 25(3): 283-287.
[24]SáNCHEZ-VEGA J T, CABRERA-FUENTES H A, ROMEROOLMEDO A J, et al. Cyclospora cayetanensis: this emerging protozoan pathogen in Mexico[J]. The American Journal of Tropical Medicine and Hygiene, 2014, 90(2): 351-353.
[25]夏艷勛, 李國清. 環孢子蟲病的研究進展[J]. 中國人獸共患病雜志, 2004, 20(21): 1001-1003.
[26]HOGE C W, ECHEVERRIA P, RAJAH R, et al. Prevalence of Cyclospora species and other enteric pathogens among children less than 5 years of age in Nepal[J]. Journal of Clinical Microbiology, 1995, 33(11): 3058-3060.
[27]BERN C, HERNANDEZ B, LOPEZ M B, et al. Epidemiologic studies of Cyclospora cayetanensis in Guatemala[J]. Emerging Infectious Diseases, 1999, 5(6): 766-774.
[28]OZDAMAR M, HAKKO E, TURKOGLU S. High occurrence of cyclosporiasis in Istanbul, Turkey, during a dry and warm summer[J]. Parasites & Vectors, 2010, 3(3): 39.
[29]DOWD S E, JOHN D, ELIOPOLUS J, et al. Confirmed detection of Cyclospora cayetanesis, Encephalitozoon intestinalis and Cryptosporidium parvum in water used for drinking[J]. Journal of Water and Health, 2003, 1(3): 117-123.
[30]EKHLAS H, AZZA K, BASMA A, et al. Opportunistic parasites among immunosuppressed children in Minia District, Egypt[J]. The Korean journal of Parasitology, 2012, 50(1): 57-62.
[31]SWAMA S, MADHAVAN R, GOMATHI S, et al. Chronic diarrhea due to Cyclospora spp. infection[J]. Tropical Parasitology, 2013, 3(1): 85-86.
[32]SANACAK B, AKYON Y, ERGUVEN S. Case report Cyclospora infection in five immunocompetent patients in a Turkish university hospital[J]. Journal of Medical Microbiology, 2006, 55(4): 459-462.
[33]王克霞, 李朝品, 王健, 等. 安徽省部分地區不同人群中圓孢子蟲感染的初步調查[J]. 中華流行病學雜志, 2003, 24(2): 93.
[34]TANDUKAR S, ANSARI S, ADHIKARI N, et al. Intestinal parasitosis in school children of Lalitpur district of Nepal[J/OL]. BMC Research Notes, 2013, 6(1): 449. doi: 10.1186/1756-0500-6-449.
[35]DIXON B R, BUSSERY J M, PARRINGTON L J, et a1. Detection of Cyclospora cayetanensis oocysts in human fecal specimens by flow cytometry[J]. Journal of Clinical Microbiology, 2005, 43(5): 2375-2379.
[36]李俊強, 孫芳芳, 郅玉寶, 等. 卡耶坦環孢子蟲流式細胞儀檢測方法的建立[J]. 國際醫學寄生蟲病雜志, 2014, 41(1): 16-19.
[37]HELMY M M, RASHED L A, ABDEL-FARAH H S. Co-infection with Cryptosporidium parvum and Cyclospora cayetanensis in immunocompromised patients[J]. Journal of the Egyptian Society of Parasitology, 2006, 36(2): 613-627.
[38]ORLANDI P A, LAMPEL K A. Extraction-free, filter-based template preparation for rapid and sensitive PCR detection of pathogenic parasitic protozoa[J]. Journal of Clinical Microbiology, 2000, 38(6): 2271-2277.
[39]ADAM R D, ORTEGA Y R, GILMAN R H, et al. Intervening transcribed spacer region 1 variability in Cyclospora cayetanensis[J]. Journal of Clinical Microbiology, 2000, 38(6): 2339-2343.
[40]SHIELDS J M, OLSONB H. PCR-restriction fragment length polymorphism method for detection of Cyclospora cayetanensis in environmental waters without microscopic confirmation[J]. Applied and Environmental Microbiology, 2003, 69(8): 4662-4669.
[41]XIAO Shumin, LI Guoqing, ZHOU Rongqiang, et al. Combined PCR-oligonucleotide ligation assay for detection of dairy cattle-derived Cyclospora sp.[J]. Veterinary Parasitology, 2007, 149(3/4): 185-190.
[42]ORLANDI P A, CARTER L, BRINKER A M, et al. Targeting singlenucleotide polymorphisms in the 18S rRNA gene to differentiate Cyclospora species from Eimeria species by multiplex PCR[J]. Applied and Environmental Microbiology, 2003, 69(8): 4806-4813.
[43]HUSSEIN E M. Molecular identification of Cycospora spp. using multiplex PCR from diarrheic children compared to others conventional methods[J]. Journal of the Egyptian Society of Parasitology, 2007, 37(2): 585-598.
[44]LEE S H, JOUNG M, YOON S, et al. Multiplex PCR detection of waterborne intestinal protozoa: Microsporidia, Cyclospora, and Cryptosporidium[J]. The Korean Journal of Parasitology, 2010, 48(4): 297-301.
[45]TANIUCHI M, VERWEIJ J J, SETHABUTR O, et al. Multiplex PCR method to detect Cyclospora, Cystoisospora, and Microsporidia in stool samples[J]. Diagnostic Microbiology and Infectious Disease, 2011, 71(4): 386-390.
[46]VARMA M, HESTER J D, SCHAEFER F W, et al. Detection of Cyclospora cayetanensis using a quantitative real-time PCR assay[J]. Journal of Microbiological Methods, 2003, 53(1): 27-36.
[47]LALONDE L F, GAJADHAR A A. Highly sensitive and specific PCR assay for reliable detection of Cyclospora cayetanensis oocysts[J]. Applied and Environmental Microbiology, 2008, 74(14): 4354-4358.
Advances in Research on Food-Borne Infection and Detection Methods of Cyclospora
LI Junqiang, SUN Fangfang, WANG Rongjun, ZHANG Longxian*
(International Joint Research Laboratory for Zoonotic Diseases of Henan, College of Animal Science and Veterinary Medicine, Henan Agricultural University, Zhengzhou 450002, China)
Abstract:Cyclospora is a newly discovered protozoan parasite that can infect intestinal epithelial cells. The pathogen can be transmitted by consumption of vegetables or fruits contaminated with oocysts. It mainly parasitizes humans and rodents, reptiles, mammals including non-human primates, and other animals. Cyclosporiasis as a sporadic infection or outb reak can cause human and animal gastroenteritis and diarrhea, and even lead to death along with serious economic loss. This article summarizes Cyclospora classification, genetic characteristics, epidemiological status and commonly used detection techniques in recent years.
Key words:Cyclospora; food-borne infection; epidemiology; detection techniques
doi:10.7506/spkx1002-6630-201507048
中圖分類號:R382.3
文獻標志碼:A
文章編號:1002-6630(2015)07-0261-07
*通信作者:張龍現(1965—),男,教授,博士,研究方向為人獸共患原蟲生物學。E-mail:zhanglx8999@gmail.com
作者簡介:李俊強(1987—),男,博士研究生,研究方向為食源性病原生物學。E-mail:lijunqiangcool@126.com
基金項目:河南省高校人獸共患病病原生物學科研創新團隊項目(012IRTSTHN005);“十二五”國家科技重大專項(2012ZX10004-220;2008ZX10004-011)
收稿日期:2014-07-02

