重復(fù)經(jīng)顱磁刺激對(duì)痙攣型腦癱患兒痙攣及運(yùn)動(dòng)功能的影響
張麗華,郄淑燕,張黎明,王璐怡,馬全勝,汪杰
近年來(lái),各種因素導(dǎo)致腦癱的發(fā)病率卻逐年增高[1],其中痙攣型腦癱占60%~70%[2]。本研究旨在探討重復(fù)經(jīng)顱磁刺激(repetitive transcranial magnetic stimulation, rTMS)對(duì)痙攣型腦癱患兒痙攣和運(yùn)動(dòng)功能的影響。
1 資料與方法
1.1 一般資料 選取2012年6月~2014年10月就診于我院康復(fù)診療中心的痙攣型腦癱患兒40例,均符合腦癱診斷標(biāo)準(zhǔn)[2],粗大運(yùn)動(dòng)功能分級(jí)為I~I(xiàn)I級(jí),可以獨(dú)立行走或輔助下行走者。排除標(biāo)準(zhǔn):存在TMS治療禁忌癥;全身及顱內(nèi)出血性疾病的急性期;顱骨缺損金屬材料修補(bǔ)、顱內(nèi)感染、顱內(nèi)腫瘤等;安裝有心臟金屬膜和心臟起搏器;不能按規(guī)定實(shí)施治療措施,無(wú)法判斷療效;進(jìn)行其他治療影響本研究結(jié)果。患兒隨機(jī)分為2組各20例,①觀察組:男16例,女4例;年齡(7.00±1.59)歲;身高(1.18±0.14)m;體質(zhì)量(21.49±3.23)kg。②對(duì)照組:男13例,女7例;年齡(6.98±1.56)歲;身高(1.20±0.15)m;體質(zhì)量(21.30±3.20)kg。2組一般資料比較差異無(wú)統(tǒng)計(jì)學(xué)意義。
1.2 方法 對(duì)照組:根據(jù)患兒病情,制定個(gè)體化的治療方案,接受常規(guī)康復(fù)治療,包括Bobath療法、關(guān)節(jié)活動(dòng)度訓(xùn)練、牽伸訓(xùn)練、肌力訓(xùn)練、平衡訓(xùn)練等,每次30min,每天2次,每周5d,連續(xù)治療4周。觀察組:在對(duì)照組基礎(chǔ)上,采用Magstim公司生產(chǎn)的快速磁刺激器治療。治療時(shí)間均選擇在周一至周五上午8:00~10:00,患兒取坐位姿勢(shì),選擇"8"字線(xiàn)圈刺激雙側(cè)運(yùn)動(dòng)皮層。于上肢的拇短展肌肌腹處記錄運(yùn)動(dòng)誘發(fā)電位,10次刺激中,至少5次能引起對(duì)側(cè)拇短展肌≥50μV運(yùn)動(dòng)電位的最小刺激強(qiáng)度為運(yùn)動(dòng)閾值(Motor Threshold,MT)。頻率為5Hz,強(qiáng)度為90%運(yùn)動(dòng)閾值,每次持續(xù)2s,間隔28s,累計(jì)治療20min,每周5次,連續(xù)治療4周。
1.3 評(píng)定標(biāo)準(zhǔn) 2組均于治療前、治療2周及4周后進(jìn)行評(píng)定。①Ashworth痙攣量表評(píng)定:主要選擇雙側(cè)小腿三頭肌評(píng)定。②踝關(guān)節(jié)活動(dòng)度測(cè)量:采用量角器測(cè)量,被檢查者坐位,膝關(guān)節(jié)屈曲90°,量角器軸心置于第五跖骨與小腿縱軸延長(zhǎng)線(xiàn)在足底的交點(diǎn),固定臂為腓骨小腿與外踝的連線(xiàn),移動(dòng)臂為第五跖骨長(zhǎng)軸。③88項(xiàng)粗大運(yùn)動(dòng)功能量表(Gross Motor Function Measure-88, GMFM-88)評(píng)定[3]:D區(qū)評(píng)定站立,包括13個(gè)項(xiàng)目(39分);E區(qū)評(píng)定走、跑和跳,包括24個(gè)項(xiàng)目(72分)。
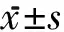
2 結(jié)果
治療后,2組患兒小腿三頭肌Ashworth分級(jí)組內(nèi)治療前后及組間比較差異均無(wú)統(tǒng)計(jì)學(xué)意義。治療2周及4周后,觀察組踝關(guān)節(jié)背屈活動(dòng)度逐漸提高(P<0.01),對(duì)照組踝關(guān)節(jié)活動(dòng)度變化差異無(wú)統(tǒng)計(jì)學(xué)意義,2組治療2周后差異無(wú)統(tǒng)計(jì)學(xué)意義,到治療4周后比較差異才有統(tǒng)計(jì)學(xué)意義(P<0.01)。觀察組治療2周與治療前比較,GMFM-88評(píng)定中D區(qū)和E區(qū)得分差異無(wú)統(tǒng)計(jì)學(xué)意義,治療4周與治療2周后明顯提高(P<0.05);對(duì)照組治療前后比較差異均無(wú)統(tǒng)計(jì)學(xué)意義,2組治療2周后,D區(qū)和E區(qū)得分差異無(wú)統(tǒng)計(jì)學(xué)意義,4周后比較差異有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表1~3。所有患兒在治療過(guò)程中均未出現(xiàn)不良反應(yīng)。

表1 2組治療前后Ashworth分級(jí)比較 例


組別n治療前治療2周治療4周觀察組20-1.00±4.47 0±4.59a5.25±4.44abc對(duì)照組20-0.75±4.38-1.00±5.032.25±4.43
與治療前比較,aP<0.01;與治療2周后比較,bP<0.01;與同期對(duì)照組比較,cP<0.01
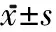
表3 2組GMFM-88評(píng)定D區(qū)、E區(qū)評(píng)分治療前后比較 分,
與治療前、治療2周后及同期對(duì)照組比較,aP<0.01
3 討論
腦癱兒童痙攣?zhàn)畛@奂暗南轮∪獍ㄐ⊥热^肌、腘繩肌、股直肌、內(nèi)收肌和腰大肌[4]。運(yùn)動(dòng)時(shí)痙攣會(huì)干擾隨意運(yùn)動(dòng)的控制,并增加能量消耗,并會(huì)阻礙生長(zhǎng)發(fā)育過(guò)程中肌肉的正常生長(zhǎng),從而導(dǎo)致繼發(fā)性性肌肉和軟組織攣縮和骨骼畸形[5]。行走時(shí)因肌肉攣縮和骨骼畸形可以產(chǎn)生異常的扭轉(zhuǎn)力矩,導(dǎo)致異常運(yùn)動(dòng)。因此,有人認(rèn)為所以痙攣是影響腦癱患者生活質(zhì)量的重要因素[6]。
根據(jù)痙攣的病理生理機(jī)制,我們假設(shè)腦癱患者運(yùn)動(dòng)皮層活性的增加會(huì)通過(guò)增強(qiáng)對(duì)皮質(zhì)脊髓束的抑制進(jìn)而起到降低γ和α神經(jīng)元活動(dòng)的作用[7]。非侵入性腦部刺激如TMS的出現(xiàn)實(shí)現(xiàn)了通過(guò)非侵入性刺激改變運(yùn)動(dòng)皮層的局部調(diào)節(jié)。本研究應(yīng)用的“8”字形絕緣線(xiàn)圈,繼發(fā)型的電流可使神經(jīng)細(xì)胞發(fā)生去極化,產(chǎn)生興奮或抑制作用[8]。低頻(≤1Hz)刺激通常會(huì)降低刺激部位皮層的興奮性,主要表現(xiàn)為運(yùn)動(dòng)閾值的增高,而高頻(≥5Hz)刺激被認(rèn)為會(huì)提高神經(jīng)元的興奮性。我們的研究選擇5Hz rTMS,結(jié)果表明可能對(duì)緩解腦癱患兒的痙攣有幫助,表現(xiàn)為被動(dòng)關(guān)節(jié)活動(dòng)度的改善,但痙攣評(píng)分無(wú)顯著改善,認(rèn)為影響該結(jié)果的因素有:樣本量較小;所選研究對(duì)象的運(yùn)動(dòng)功能水平相對(duì)較高,痙攣程度的基線(xiàn)水平本來(lái)就比較低;Ashworth分級(jí)屬于半定量評(píng)估,即使治療前后均由同一人進(jìn)行評(píng)估,也很難排除主觀因素的影響。本研究結(jié)果與Valle等[9]的研究結(jié)果一致,認(rèn)為高頻rTMS可以通過(guò)提高運(yùn)動(dòng)皮層的興奮性,增強(qiáng)皮質(zhì)脊髓束對(duì)脊髓的抑制達(dá)到緩解痙攣的目的,但尚缺乏神經(jīng)電生理的證據(jù)支持該結(jié)論,這也是下一步研究的重點(diǎn)。
本研究的另一個(gè)結(jié)論是,rTMS結(jié)合常規(guī)運(yùn)動(dòng)療法可以顯著提高痙攣型腦癱患兒的粗大運(yùn)動(dòng)功能,認(rèn)為其原因有二:第一,觀察組患兒肌肉痙攣有所減輕,小腿三頭肌痙攣減輕從一定程度上改善了踝關(guān)節(jié)屈伸肌群的平衡,從而達(dá)到提高站立及行走功能的目的。第二,有研究發(fā)現(xiàn)腦癱患兒肢體在皮層的代表區(qū)、皮層運(yùn)動(dòng)纖維的投射形式存在異常[10-11],因此認(rèn)為本研究可能通過(guò)作用于運(yùn)動(dòng)皮層及皮層下運(yùn)動(dòng)纖維,提高其可塑性,進(jìn)而達(dá)到改善運(yùn)動(dòng)功能的作用。張玉瓊等[12]應(yīng)用TMS治療腦癱也發(fā)現(xiàn)常規(guī)腦癱康復(fù)治療的基礎(chǔ)上加用TMS能更有效地提高腦癱患兒的粗大運(yùn)動(dòng)功能,本研究與其一致,但均缺乏電生理方面的依據(jù),這將是下一步的研究?jī)?nèi)容。目前關(guān)于rTMS在神經(jīng)和精神系統(tǒng)疾病治療時(shí)間或治療周期的問(wèn)題目前還沒(méi)形成固定的模式,均處于探索階段[12-13],但是,基本均認(rèn)為治療效果可以維持至治療結(jié)束后1個(gè)月,本研究中治療2周雖然粗大運(yùn)動(dòng)功能有所改善,但無(wú)統(tǒng)計(jì)學(xué)差異,但治療4周后發(fā)現(xiàn)對(duì)粗大運(yùn)動(dòng)功能有顯著改善的作用,但本研究樣本量較小,時(shí)間較短,所以還需要進(jìn)行深入細(xì)致的研究以確定治療時(shí)間對(duì)粗大運(yùn)動(dòng)功能的確切作用。
此外,本研究中所有患兒均未發(fā)生癲癇等不良反應(yīng),提示5Hz的重復(fù)經(jīng)顱磁刺激對(duì)腦癱患兒是相對(duì)安全的。
[1] 周曉玉,錢(qián)家萍,許植之,等.?huà)雰耗X性癱瘓的病因與防治探討(附128例分析)[J].中國(guó)當(dāng)代兒科雜志,2001,3(2): 186-188.
[2] 陳秀潔,李樹(shù)春.小兒腦性癱瘓的定義分型和診斷條件[J].中華物理醫(yī)學(xué)與康復(fù)雜志,2007,29(5): 309-309.
[3] 史惟, 廖元貴, 楊紅, 等.粗大運(yùn)動(dòng)功能測(cè)試量表與Peabody粗大運(yùn)動(dòng)發(fā)育量表在腦性癱瘓康復(fù)療效評(píng)估中的應(yīng)用[J].中國(guó)康復(fù)理論與實(shí)踐,2004,10(7):423-424.
[4] Klingels KI, Demeyere E, Jaspers, et al. Upper limb impairments and their impact on activity measures in children with unilateral cerebral palsy[J]. European Journal of Paediatric Neurology, 2012, 16(5):475-484.
[5] Lynn Bar-On, Guy Molenaers, Erwin Aertbelien, et al. Spasticity and Its Contribution to Hypertonia in Cerebral Palsy[J].Biomed Res Int,2015(11):1-10.
[6] Flett PJ. Rehabilitation of spasticity and related problems in childhood cerebral palsy[J]. Paediatr Child Health,2003,39(1): 6-14.
[7] Valero-Cabre A, Oliveri M, Gangitano M, et al. Modulation of spinal cord excitability by subthreshold repetitive transcranial magnetic stimulation of the primary motor cortex in humans[J]. Neuroreport,2001, 12(17) :3845-3848.
[8] Mark S George.Noninvasive techniques for probing neurocircuitry and treating illness: vagus nerve stimulation (VNS), transcranial magnetic stimulation (TMS) and transcranial direct current stimulation (tDCS)[J].Neuropsychopharmacology,2010,35(1):301-316.
[9] Valle AC, Dionisio K, Pitskel NB, et al. Low and high frequency repetitive transcranial magnetic stimulation for the treatment of spasticity[J]. Dev Med Child Neurol,2007,49(7):534-538.
[10] Eyre JA, Taylor JP, Villagra F, et al. Evidence of activity-dependent withdrawal of corticospinal projections during human development[J]. Neurology,2001,57(9):1543-154.
[11] Holmstrom L, Vollmer B, Tedroff K, et al. Hand function in relation to brain lesions and corticomotor-projection pattern in children with unilateral cerebral palsy[J]. DevMed Child Neurol,2010,52(52):145-152.
[12] 張玉瓊,丁建英.經(jīng)顱磁刺激對(duì)腦性癱瘓患兒粗大運(yùn)動(dòng)功能的影響[J].中國(guó)康復(fù)理論與實(shí)踐,2012,18(6):515-517.
[13] Hamada M, Ugawa Y, Tsuji S. Effectiveness of rTMS on Parkinson's Disease Study Group, Japan. High-frequency rTMS over the supplementary motor area improves bradykinesia in Parkinson's disease: subanalysis of double-blind sham-controlled study[J].Neurol Sci,2009,28(7): 143-146.

