垂體腺瘤組織中NF-κB、MMP-9、MICA的表達變化及意義
陳正,常映薇,李珍珠,孫其凱,王清波,李澤福(濱州醫學院附屬醫院,山東濱州56600;濱州醫學院煙臺校區)
?
·論著·
垂體腺瘤組織中NF-κB、MMP-9、MICA的表達變化及意義
陳正1,常映薇2,李珍珠1,孫其凱1,王清波1,李澤福1(1濱州醫學院附屬醫院,山東濱州256600;2濱州醫學院煙臺校區)
摘要:目的觀察垂體腺瘤組織中NF-κB、基質金屬蛋白酶9(MMP-9)、MHC-Ⅰ類鏈分子相關抗原A(MICA)的表達變化,并探討其意義。方法采用免疫組化法對垂體腺瘤組織和正常腦組織中的NF-κB蛋白、MMP-9蛋白及MICA蛋白進行檢測;采用qRT-PCR法對垂體腺瘤組織及正常腦組織中的NF-κB mRNA、MMP-9 mRNA、MICA mRNA進行檢測。結果 垂體腺瘤與正常腦組織中NF-κB蛋白陽性表達率分別為100%(40/40)、30%(6/20),MMP-9蛋白陽性表達率分別為100%(40/40)、15%(3/20),MICA蛋白陽性表達率分別為100%(40/40)、0;兩組比較,P均<0.01。垂體腺瘤與正常腦組織中NF-κB mRNA相對表達量分別為13.045±6.200、2.040±2.067,MMP-9 mRNA相對表達量分別為28.770±7.661、2.369±1.460,MICA mRNA相對表達量分別為231.817±41.046、5.062±3.849;兩組比較,P均<0.05。NF-κB蛋白與MICA蛋白、MMP-9蛋白表達均呈正相關(r分別為0.368、0.345,P均<0.05)。結論NF-κB、MMP-9及MICA在垂體腺瘤組織中高表達,NF-κB可能通過促進MMP-9及MICA表達而促進垂體腺瘤發生、發展。
關鍵詞:垂體瘤;MHC-Ⅰ類鏈分子相關抗原A;基質金屬蛋白酶9;核轉錄因子-κB
垂體腺瘤來源于上皮腫瘤,其發生發展與機體的免疫狀態密切相關,是一個涉及多基因、多階段的復雜變化過程。NF-κB是重要的一種核轉錄因子,作為信號傳導途徑的中樞,參與炎癥、免疫、細胞增殖及凋亡等多種過程的基因調控[1],可上調包括MHC-Ⅰ類鏈分子相關抗原A (MICA)、基質金屬蛋白酶-9(MMP-9)等在內的多種蛋白表達。MICA作為非經典HLAⅠ類分子, 在多數上皮性腫瘤細胞表面表達[2],MICA蛋白在體內有兩種存在形式,即位于細胞膜表面的膜型MICA蛋白(mMICA)和被分泌入腫瘤微環境及血液中的分泌型MICA蛋白(sMICA)[3]。sMICA可由基質金屬蛋白酶(MMPs)水解mMICA產生[4]。mMICA與NKG2D結合可介導免疫系統對腫瘤細胞產生細胞毒作用,而sMICA與NKG2D結合可抑制NKG2D在NK細胞的表達,不僅降低了NK細胞的細胞毒活性,還導致NK細胞分泌細胞因子的能力降低,從而使腫瘤發生免疫逃逸[5]。MMP-9是MMPs家族的一種重要明膠酶,是降解細胞外基質的關鍵酶[6],同時MMP-9參與MICA-NKG2D的腫瘤免疫逃逸過程。本研究觀察了垂體腺瘤組織中NF-κB、MMP-9、MICA的表達變化,并探討其意義。現將結果報告如下。
1資料與方法
1.1臨床資料2011年6月~2013年12月濱州醫學院附屬醫院神經外科收治的垂體腺瘤患者40例(觀察組),男24例、女16例,年齡25~78歲。患者均無免疫相關性疾病,術前未使用免疫抑制類藥物。均經病理檢查確診。組織學類型為泌乳素型垂體腺瘤。40例患者均接受手術切除并留取腫瘤組織。另取10例高血壓腦水腫患者因腦出血需顱內減壓手術的正常腦組織作為對照組。該研究征得濱州醫學院附屬醫院倫理委員會同意。
1.2NF-κB、MMP-9、MICA蛋白檢測方法采用免疫組化法。兔抗人NF-κB(Cell Signaling),兔抗人MICA(abcam),兔抗人MMP-9(abcam),羊抗兔二抗(武漢博士德公司)。RNA提取試劑,逆轉錄酶,dNTP,Taq DNA聚合酶(TAKARA公司)。所有標本用10%甲醛固定,石蠟包埋,4 μm厚連續切片,經常規脫蠟至水后,室溫下,3%過氧化氫滅活內源性過氧化物酶10 min,蒸餾水洗3次,0.01 mol/L檸檬酸鈉(pH 6.0)抗原修復液微波修復抗原,冷卻至室溫,PBS洗2次。滴加5%BSA封閉液,室溫20 min,然后滴加兔抗人NF-κB抗體(1∶800),MICA(1∶100),4 ℃過夜。按兔IgG免疫組化試劑盒SABC即用型滴加生物素化山羊抗兔IgG,37 ℃、30 min,PBS洗3次。滴加SABC,37 ℃、20 min,PBS洗4次。最后DAB顯色,蘇木精輕度復染,脫水,透明,封片。顯微鏡下觀察。用已知陽性片作為陽性對照,PBS 代替一抗作為陰性對照。MICA蛋白染色陽性信號位于胞膜和胞質,NF-κB蛋白定位于胞質和胞核,MMP-9蛋白主要定位于細胞質。免疫組化染色分級標準以陽性細胞的百分比和著色強度評分:無著色為0分,淡黃色為1分,棕黃色或褐黃色為2分。陽性細胞百分比評分:陽性細胞<5%為0分,5%~25%為1分,26%~50%為2分,>50%為3分。兩個分值相加為免疫組化染色的最終評分,并按下述標準分級:0分為陰性(-),2分為弱陽性(+),3~4分為中度陽性(++),5分為強陽性(+++),+、++、+++判為陽性。
1.3NF-κB、MMP-9、MICA mRNA檢測方法采用qRT-PCR法。按TRIzol試劑說明書提取組織中的總RNA。cDNA合成逆轉錄反應體系10 μL。NF-κB(p65)引物擴增產物110 bp,上游引物5′-ACCCCTCCCTACGCAGAC-3′,下游引物5′-TTTCTCCTCAATCCGGTGAC-3′;MICA引物擴增產物98 bp,上游引物:5′-AACCCTGACTGCACAGATCC-3′,下游引物:5′-ATCTTCCCTTTTGCACCTCC-3′;MMP-9引物擴增產物166 bp,上游引物5′-ACGGCAGAGAGCATTGTGTA-3′,下游引物5′-CCTGTAGCGTAAGAGCCAGAG-3′;β-actin引物擴增產物135 bp,上游引物:5′-CCAACTGGGACGACAT-3′,下游引物:5′-TCTGGGTCATCTTCTCG-3′(上海生工)。進行熒光定量PCR反應,反應體系20 μL,兩步法PCR擴增標準程序:95 ℃預變性30 s。PCR反應:95 ℃、5 s,60 ℃、20 s,融解曲線分析。以β-actin為內參照,計算NF-κB、MMP-9、MICA mRNA相對表達量。
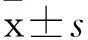
2結果
2.1兩組NF-κB蛋白、MMP-9蛋白、MICA蛋白表達比較NF-κB(p65)蛋白主要表達于細胞的胞質,少量的細胞會有核染色,觀察組與對照組NF-κB(p65)蛋白陽性表達率分別為100%(40/40)、30%(6/20),MICA蛋白表達于胞質和胞膜,MMP-9蛋白陽性表達率分別為100%(40/40)、15%(3/20),MICA蛋白表達于胞質和胞膜,MICA蛋白陽性表達率分別為100%(40/40)、0;兩組比較,P均<0.01。
2.2兩組NF-κB、MMP-9、MICA mRNA表達比較觀察組與對照組NF-κB mRNA相對表達量分別為13.045±6.200、2.040±2.067,MMP-9 mRNA相對表達量分別為28.770±7.661、2.369±1.460,MICA mRNA相對表達量分別為231.817±41.046、5.062±3.849;兩組比較,P均<0.05。
2.3NF-κB蛋白、MICA蛋白與MMP-9蛋白表達的關系NF-κB蛋白與MICA蛋白、MMP-9蛋白表達均呈正相關(r分別為0.368、0.345,P均<0.05)。
3討論

NF-κB是由Rel/NF-κB家族的多肽成員組成的一組轉錄因子。當細胞受到外信號刺激后,IκB激酶復合體(IκB kinase IKK)活化將IκB磷酸化,使NF-κB暴露核定為位點。游離的NF-κB迅速移位至細胞核,與特異性κB序列結合,誘導相關基因轉錄[10]。近年來研究[11]表明,NF-κB與腫瘤的發生發展密切相關。NF-κB可以上調多種細胞因子表達,如腫瘤壞死因子[12]、基質金屬蛋白酶[13]、血管內皮生長因子[14]等。Lin等[15]發現,通過腫瘤壞死因子可上調人內皮細胞表面的免疫配體MICA,這種激活上調被控制在轉錄水平,是由130 bp MICA轉錄起始位點上游的一個位點控制,這個位點能使NF-κB通路和熱休克通路在NF-κB蛋白活化時對細胞表面的MICA產生強烈影響。另外,Molinero等[1]研究表明,MICA基因第1內含子含有轉錄因子NF-κB結合位點,Hela細胞轉染NF-κB基因后能上調MICA蛋白表達,而NF-κB抑制劑PDTC能抑制MICA蛋白表達,這說明MICA可能是NF-κB的下游基因。另外,研究[1,16]發現,MAPK通路、DNA損傷反應通路均能調控MICA基因表達,而這些通路的活化都能激活NF-κB表達,這表明NF-κB可能通過多條通路對MICA基因表達進行調控。本研究中,垂體腺瘤組織中的NF-κB陽性表達率明顯高于正常腦組織。提示NF-κB可能是垂體腺瘤發生、發展的重要機制之一。有關NF-κB在垂體腺瘤中的作用機制尚不清楚,目前研究顯示NF-κB可能通過調控MICA及MMP-9對垂體腺瘤產生影響。
基質金屬蛋白酶(MMPs)是蛋白水解酶中最重要的金屬酶之一,通過對細胞外基質的降解促進腫瘤細胞向周圍組織侵襲,能促進腫瘤細胞增殖,抑制凋亡等[17]。MMP-9在其啟動子區含有轉錄因子NF-κB的結合位點,是NF-κB的下游基因,與組織發生、傷口愈合及腫瘤的侵潤轉移密切相關[18]。Turner等[19]發現,在侵襲性垂體腺瘤中MMP-9的表達明顯高于非侵襲性垂體腺瘤,推測MMP-9表達可能與垂體腺瘤的復發跟侵襲性有關。近年研究證實,在口腔鱗癌[20]、人骨肉瘤[21]以及結腸癌[22]等腫瘤細胞中,MMP-9能使MICA蛋白脫落水解形成sMICA,從而使腫瘤進行免疫逃逸,說明MMPs對MICA蛋白的水解脫落起重要作用。MICA蛋白在體內有兩種存在形式,即位于細胞膜表面的模型MICA蛋白(mMICA)和被分泌入腫瘤微環境及血液中的分泌型MICA蛋白(sMICA)。在多數腫瘤中,雖然總的MICA(包括mMICA與sMICA)表達上調,但其固有免疫仍處于抑制狀態。其原因在于mMICA脫落成為sMICA,并且sMICA與NKG2D結合后抑制了NKG2D在NK細胞的表達,不僅降低了NK細胞的細胞毒活性,還導致分泌細胞因子的能力降低,促使腫瘤發生免疫逃逸。本研究中,MMP-9在垂體腺瘤的表達明顯高于正常組織,垂體腺瘤患者外周血清中MMP-9、sMICA水平明顯高于正常人。我們推測在垂體腺瘤中MMP-9可促進MICA蛋白水解脫落為sMICA,并且MICA與MMP-9均是受NF-κB調控的靶基因,垂體腺瘤中的MICA、MMP-9表達可能也受NF-κB的調控。本研究結果顯示,NF-κB表達與MMP-9表達與有明顯的正相關性,NF-κB表達與MICA的表達呈明顯正相關,我們推測在垂體腺瘤中,NF-κB的活化一方面促使MICA蛋白高表達,一方面誘導MMP-9高表達來水解MICA蛋白,使其脫落為sMICA,促進腫瘤細胞的免疫逃逸。NF-κB、MMP-9、MICA三者的共同作用對垂體腺瘤的發展起到重要作用。MICA-NKG2D在機體抗腫瘤免疫中起到了重要作用,如何提高免疫效應細胞表面的NKG2D受體密度及提高腫瘤細胞表面MICA蛋白的表達,并且抑制MICA蛋白脫落形成sMICA成為避免腫瘤細胞免疫逃逸的一條新路徑。本研究為NF-κB可能對垂體腺瘤中MICA蛋白的表達及脫落的調控作用這一設想提供了組織學基礎,我們將繼續在細胞水平對這一設想進行驗證。
參考文獻:
[1] Molinero LL, Fuertes MB, Girart MV, et al. NF-κB regulates expression of the MHC class I-related chain A gene in activated T lymphocytes[J]. J Immunol, 2004,173(9):5583-5590.
[2] Ling Y, Yang Y, Lu N, et al. Endostar, a novel recombinant human endostatin, exerts antiangiogenic effect via blocking VEGF-induced tyrosine phosphorylation of KDR/Flk-1 of endothelial cells[J]. Biochem Biophys Res Commun, 2007,361(1):79-84.
[3] Waldhauer I, Goehlsdorf D, Gieseke F, et al. Tumor-associated MICA is shed by ADAM proteases [J]. Cancer Research, 2008,68(15):6368-6376.
[4] Sun D, Wang X, Zhang H, et al. MMP9 mediates MICA shedding in human osteosarcomas[J]. Cell Biol Int, 2011,35(6):569-574.
[5] Carbone E, Neri P, Mesuraca M, et al. HLA class I, NKG2D, and natural cytotoxicity receptors regulate multiple myeloma cell recognition by natural killer cells [J]. Blood, 2005,105(1):251-258.
[6] Liu Y, Yin H, Zhao M, et al. TLR2 and TLR4 in Autoimmune Diseases: a Comprehensive Review[J]. Clin Rev Allergy Immunol, 2014,47(2):136-147.
[7] Molitch ME, Russell EJ. The pituitary incidentaloma [J]. Ann Intern Med, 1990,112(12):925-931.
[8] Ma L, Li G, Su Y, et al. The soluble major histocompatibility complex class I-related chain A protein reduced NKG2D expression on natural killer and T cells from patients with prolactinoma and non-secreting pituitary adenoma [J]. J Clin Neurosci, 2010,17(2):241-247.
[9] Hayakawa Y. Targeting NKG2D in tumor surveillance [J]. Expert Opin Ther Targets, 2012,16(6):587-599.
[10] Molinero LL, Fuertes MB, Girart MV, et al. NF-κB regulates expression of the MHC class I-related chain A gene in activated T lymphocytes [J]. J Immunol, 2004,173(9): 5583-5590.
[11] Karin M. Nuclear factor-κB in cancer development and progression [J]. Nature, 2006,441(7092):431-436.
[12] Luo JL, Maeda S, Hsu LC, et al. Inhibition of NF-κB in cancer cells converts inflammation-induced tumor growth mediated by TNFα to TRAIL-mediated tumor regression[J]. Cancer cell, 2004,6(3):297-305.
[13] Sánchez AJ, Puerta C, Ballester S, et al. Rolipram impairs NF-κB activity and MMP-9 expression in experimental autoimmune encephalomyelitis [J]. J Neuroimmunol, 2005,168(1):13-20.
[14] Grosjean J, Kiriakidis S, Reilly K, et al. Vascular endothelial growth factor signalling in endothelial cell survival: a role for NFκB [J]. Biochem Biophys Res Commun, 2006,340(3):984-994.
[15] Lin D, Lavender H, Soilleux EJ, et al. NF-κB regulates MICA gene transcription in endothelial cell through a genetically inhibitable control site [J]. J Biol Chem, 2012,287(6):4299-4310.
[16] Gasser S, Orsulic S, Brown EJ, et al. The DNA damage pathway regulates innate immune system ligands of the NKG2D receptor [J]. Nature, 2005,436(7054):1186-1190.
[17] Abdallah MW, Pearce BD, Larsen N, et al. Amniotic Fluid MMP-9 and Neurotrophins in Autism Spectrum Disorders: An Exploratory Study[J]. Autism Research, 2012,5(6):428-433.
[18] Meyer E, Vollmer JY, Bovey R, et al. Matrix metalloproteinases 9 and 10 inhibit protein kinase C-potentiated, p53-mediated apoptosis[J]. Cancer research, 2005,65(10):4261-4272.
[19] Turner HE, Nagy ZS, Esiri MM, et al. Role of matrix metalloproteinase 9 in pituitary tumor behavior[J]. J Clin Endocrinol Metab, 2000,85(8):2931-2935.
[20] Lee BK, Kim MJ, Jang HS, et al. A high concentration of MMP-2/gelatinase A and MMP-9/gelatinase B reduce NK cell-mediated cytotoxicity against an oral squamous cell carcinoma cell line [J]. In Vivo, 2008,22(5):593-597.
[21] Sun D, Wang X, Zhang H, et al. MMP9 mediates MICA shedding in human osteosarcomas [J]. Cell Biol Int, 2011,35(6):569-574.
[22] 周太成,楊劭宇,羅宏圖,等.MMP-9介導結腸癌細胞sMICA蛋白脫落的研究[J].嶺南現代臨床外科,2013,13(4):315-317.
Expression and significance of NF-kappa B, MMP-9, MICA in pituitary adenoma tissues
CHENZheng1, CHANG Ying-wei, LI Zhen-zhu, SUN Qi-kai, WANG Qing-bo, LI Ze-fu
(1AffiliatedHospitalofBinzhouMedicalCollege,Binzhou256600)
Abstract:Objective The aim of this study was to examine the expression levels of NF-κB, MMP-9, and MICA and to explore its significance. MethodsWe examined the association between NF-κB, MMP-9, and MICA by immunohistochemical staining, Quantitative real-time PCR. ResultsThe positive rate of NF-κB were 100%(40/40), 30%(6/20)in pituitary adenomas and normal brain tissue. The positive rate of MMP-9 were 100%(40/40),15%(3/20)in pituitary adenomas and normal brain tissue. The positive rate of MICA were 100%(40/40), 0 in pituitary adenomas and normal brain tissues(P<0.05). Relative to express the NF-κB mRNA were 13.045±6.2, 2.04±2.067 in pituitary adenomas and normal brain tissues. Relative to express the MMP-9 mRNA were 28.77±7.661, 2.369±1.46 in pituitary adenomas and normal brain tissues. Relative to express the MICA mRNA were 231.817±41.046, 5.062±3.849 in pituitary adenomas and normal brain tissues(P<0.05). The expression levels of NF-κB, MMP-9, and MICA were positively related in patients with pituitary adenomas (r=0.368,0.345,P<0.05). ConclusionsNF-κB, MMP-9, and MICA are highly expressed in pituitary adenomas tissues. High levels of NF-κB by promoting the expression of MMP-9 and MICA promote the development of pituitary adenomas.
Key words:Pituitary adenomas;MHC- Ⅰ kind of chain molecules related antigen A;matrix metalloproteinase 9;nuclear transcription-κB
(收稿日期:2014-10-21)
通信作者簡介:李澤福(1969-),男,主任醫師,研究方向為垂體瘤的免疫治療。E-mail:lizefu163@163.com
作者簡介:第一陳正(1988-),男,在讀研究生,研究方向為垂體瘤的免疫治療。E-mail:wide6087235@163.com
基金項目:國家自然科學基金資助項目(81171119)。
中圖分類號:R736.4
文獻標志碼:A
文章編號:1002-266X(2015)03-0001-04
doi:10.3969/j.issn.1002-266X.2015.03.001

