HIF-1α、ET-1和ADM在低壓低氧性肺動脈高壓大鼠肺血管的表達及意義
徐嬌陽,是文輝,付 勇,李建瑛,劉江偉,桂俊豪,余伍忠*
(1.石河子大學醫學院;2.蘭州軍區烏魯木齊總醫院 a.臨床醫學研究所 b.動物實驗科 c.病理科,新疆 烏魯木齊 830000)
HIF-1α、ET-1和ADM在低壓低氧性肺動脈高壓大鼠肺血管的表達及意義
徐嬌陽1,2a,是文輝2b,付勇2c,李建瑛2b,劉江偉2b,桂俊豪2a*,余伍忠1,2a*
(1.石河子大學醫學院;2.蘭州軍區烏魯木齊總醫院 a.臨床醫學研究所 b.動物實驗科 c.病理科,新疆 烏魯木齊 830000)
摘要:目的模擬6,000米海拔高度,建立低壓低氧性肺動脈高壓(HPH)大鼠模型,研究HPH大鼠肺組織中低氧誘導因子-1α(HIF-1α)、內皮素-1(ET-1)和腎上腺髓質素(ADM)的表達及其變化規律。方法將120只SD大鼠隨機分為五組,模擬6 000米海拔大氣壓和氧分壓,分別進行低壓低氧暴露4天、7天、10天、14天和21天處理,同時設相應時間點對照組(對照組所處海拔為900米),低壓低氧暴露時間為24小時/天。于計劃的暴露終點采集各組大鼠肺組織標本,HE染色后觀察大鼠肺組織的病理學變化,免疫組化法檢測肺組織中HIF-1α、ET-1和ADM的表達。結果低壓低氧條件分別暴露10天、14天和21天后SD大鼠的平均肺動脈壓(mPAP)及肺小動脈血管壁中層壁厚占外徑比值(MT%)較同時點相應對照組顯著升高(P<0.01);HPH大鼠肺組織中HIF-1α自低壓低氧暴露4天后表達即增高,14天后下降,至21天時表達與對照組無顯著差異;ET-1在低壓低氧10天、14天和21天時其表達較對照組顯著升高(P<0.05);ADM在低壓低氧4天、7天和10天時表達增加,隨后表達降低。結論HPH大鼠模型肺組織中HIF-1α、ET-1和ADM表達均呈正相關,三種因子可能共同參與了大鼠HPH發生與發展。
關鍵詞:低壓低氧;肺動脈高壓;缺氧誘導因子-1α;內皮素-1;腎上腺髓質素
(ChinJLabDiagn,2015,19:1996)
低氧性肺動脈高壓(Hypoxic Pulmonary Hypertension,HPH)以肺血管阻力及肺動脈壓力增高為特征,是多種高原性心、肺疾病的病理基礎。本研究通過模擬6 000米海拔低壓低氧暴露,建立低壓低氧性肺動脈高壓大鼠模型,觀察不同低壓低氧暴露時點大鼠肺組織中低氧誘導因子-1α(HIF-1α)、內皮素-1(ET-1)和腎上腺髓質素(ADM)的表達變化規律及其相互關系,為進一步研究HPH的分子機制奠定基礎。
1材料與方法
1.1實驗動物與分組
6周齡清潔級SD雄性大鼠120只(體重為200±20 g),購自新疆醫科大學實驗動物中心。隨機數字表法分為低氧4天、7天、10天、14天和21天組,每組12只。同時各組設常氧對照組。
1.2主要試劑與儀器
1.2.1試劑HIF-1α兔抗鼠多克隆抗體、ADM兔抗鼠多克隆抗體、兔IgG兩步法免疫組化試劑盒(SV0002)及DAB顯色試劑盒均購自武漢博士德生物有限公司;ET-1兔抗鼠多克隆抗體由北京博奧森生物公司提供。
1.2.2主要儀器西北特殊環境人工實驗艙(蘭州軍區烏魯木齊總醫院)、多道生理記錄儀及壓力傳感器(成都儀器設備有限公司)、光學顯微鏡(OLYMPUS公司)和千屏醫學圖文報告系統。
1.3動物模型的建立
1.3.1人工氣候艙參數設定模擬海拔高度為6 000 m(相對氧濃度約為11.3%);降壓速度5.0 m/s;新風量需求設定50 m3/h,使艙內壓力達47.3 KPa;溫度22℃;濕度23.4%RH。
1.3.2低壓低氧處理將低壓低氧暴露組SD大鼠置于人工氣候艙內,運行時間為24 h/天,晝夜比12 h∶12 h,保證其水及飼料充足,低氧組大鼠每2天開艙半小時為其更換飼料、水以及墊料。同日齡對照組除低壓低氧條件外,其他飼養條件均同低氧組。分別于相應時間點取出各組大鼠,進行相關指標的檢測。
1.4HPH模型指標檢測
1.4.1肺動脈壓力檢測各低壓低氧組及相應對照組大鼠在出艙后立即進行肺動脈壓力檢測:大鼠經麻醉、固定后,氣管插管行機械通氣(呼吸頻率60次/min,潮氣量6 ml,呼吸比3∶2)。開胸后用7號針頭在肺動脈根部1 cm處逆血流方向刺入肺動脈,針頭另一端連接壓力傳感器及生理信號記錄儀記錄平均肺動脈壓力(mPAP)。
1.4.2肺小動脈形態學檢測大鼠經測壓后處死,迅速切取大鼠左肺組織置10%多聚甲醛溶液固定一周,常規石蠟包埋切片及HE染色后光鏡下觀察肺小動脈變化情況。選取直徑約為100 μm的肺小動脈,測定并計算肺小動脈中層壁厚/肺小動脈外徑(MT%),作為衡量肺血管重塑的指標。
1.5肺組織HIF-1α、ET-1、ADM表達的檢測
1.5.1免疫組化方法參照說明書,對大鼠肺組織標本進行常規石蠟包埋切片后,經過脫蠟至水,3%H2O2室溫10 min滅活內源性酶,抗原熱修復;滴加封閉液室溫10 min,分別滴加HIF-1α抗體(工作濃度1∶50)、ADM抗體(工作濃度1∶100)以及ET-1抗體(工作濃度1∶250),4℃過夜,PBS洗5 min×3次;滴加聚合HRP標記抗兔IgG,37℃孵育30 min,PBS洗5 min×3次;經過DAB顯色,蘇木素復染,封片后顯微鏡下觀察三種抗體的定位及表達。
1.5.2陽性對照及陰性對照以已知HIF-1α、ET-1和ADM抗體陽性的切片為陽性對照,PBS代替一抗作為陰性對照。
1.5.3結果判讀采用單盲法進行閱片,細胞內出現棕黃色顆粒為陽性,隨機觀察10個視野進行計分,積分標準參考文獻[1,2]并稍作修改,根據每個視野陽性細胞占全部細胞總數的比例:陽性細胞<1%(-),1%-33%(+),34%-64%(++),65%-100%(+++),分別記為0,1,2,3分;免疫染色強度分為:輕度著色(+),中度著色(++),深度著色(+++),分別記為1,2,3分;計算兩者相加作為最終分級:1級(1-2分),2級(3-4分),3級(5-6分)。
1.6統計方法
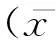
2結果
2.1不同暴露時點大鼠肺動脈壓(PAP)及肺血管形態的變化
2.1.1不同暴露時點大鼠肺動脈壓(PAP)的比較低壓低氧暴露10、14、21d組大鼠mPAP較同時點對照組顯著升高(P<0.01);而低氧4d、7d組與相應對照組無顯著差異(P>0.05)(圖1)。

注:*P<0.01 vs對照組,▽P<0.01 vs 10 d組
2.1.2肺小動脈變化情況低壓低氧暴露10d、14d、21d組大鼠MT%較相應對照組顯著升高(P<0.05);而低氧4d、7d組與對照組差異無統計學意義(P>0.05)(圖2)。光鏡下可見:缺氧10d組大鼠肺小動脈中膜較對照組略有增厚;缺氧14d組及21d組大鼠肺組織局部實變,肺小動脈中膜平滑肌層顯著增厚,管腔明顯狹窄,其中21d組比14d組程度更加嚴重(圖3)。
2.2大鼠肺組織中HIF-1α、ET-1和ADM的表達
2.2.1HIF-1α、ET-1和ADM表達的分布情況低氧組大鼠肺組織中HIF-1α、ET-1、ADM分級的總體分布情況與對照組均不相同(HIF-1α:Z=-5.633,P<0.01;ET-1:Z=-4.968,P<0.01;ADM:Z=-4.507,P<0.01。)其中,HIF-1α陽性表達部位位于肺動脈內皮細胞、肺血管平滑肌細胞及肺泡上皮細胞;ET-1陽性表達主要位于肺動脈內皮細胞、平滑肌細胞以及肺小血管,ADM陽性部位主要為肺內皮細胞和平滑肌細胞(圖4)。

注:*P<0.05vs對照組,▽P<0.01vs10d組,ΔP<0.05vs14d組
圖2不同低氧時間大鼠MT%變化情況

A:對照組;B:低壓低氧10 d組;C:低壓低氧21 d組(HE染色,×400)

A:低氧7 d組(HIF-1α);B:低氧14 d組(ET-1);C:低氧10 d組(ADM); D:對照組(HIF-1α);E:對照組(ET-1);F:對照組(ADM)
2.2.2HIF-1α、ET-1、ADM免疫組化分級情況根據免疫組化分級結果:HIF-1α在對照組大鼠基本呈陰性或弱陽性表達,低氧4天-10天表達明顯增高,低氧14天表達稍有下降,隨低氧時間延長至21天,表達與對照組無顯著差異;ET-1在10天-21天低氧組大鼠表達較對照組明顯增強;而ADM在低氧4、7、10天時表達增強,隨后其表達與對照組無顯著性差異,見表1-3。

表1 不同低氧時間大鼠肺HIF-1α表達分級情況的比較
注:各組各時點的樣本均為12只大鼠,但低氧21天組2只大鼠死亡,n=10。下同

表2 不同低氧時間大鼠肺ET-1表達分級情況的比較

表3 不同低氧時間大鼠肺ADM表達分級情況的比較
2.3相關性分析
spearman相關分析顯示:HIF-1α與mPAP及MT%正相關(r值分別為0.530、0.551,P值均<0.01),與ET-1和ADM亦呈正相關關系(r值分別為0.840、0.218,P值均<0.05);ET-1與mPAP及MT%正相關(r值分別為0.620、0.727,P值均<0.01);而ADM與mPAP及MT%均無相關關系(P>0.05),與ET-1亦無顯著相關性(P>0.05)。
3討論
低壓低氧是誘發HPH的重要因素。一方面,低氧導致肺動脈平滑肌細胞肥大,管腔狹窄;另一方面,低氧誘發多種內源性因子分泌失調,進而導致持續性肺血管收縮,細胞外基質重建,肺血管管腔進一步被“鎖定”在狹窄狀態[3]。本研究通過模擬6000米海拔不同時程持續低壓低氧建立大鼠HPH模型,結果顯示,低氧10天mPAP即可升高,低氧14天mPAP達到高峰,提示模型建立成功;而大鼠肺組織HE染色結果顯示,低氧后的大鼠肺小動脈中膜明顯增厚,管腔狹窄,MT%在低氧10天時較對照組明顯增加,并隨低氧時間延長而增長,說明此時已形成了低氧性肺血管重建,并呈逐漸加重的趨勢。
HPH發生的分子機制極其復雜。其中,HIF-1α是機體應對缺氧的核心調控因子,常氧狀態下經泛素-蛋白酶體途徑降解,因此體內表達量很低,在低氧狀態下活化并進一步激活其下游靶基因轉錄,引發一系列的低氧應激反應,被稱為是“低氧調節的總開關”[4]。本研究顯示:HIF-1α在低氧4天大鼠中表達即較對照組明顯升高,并且隨后其表達的增長與mPAP及MT%呈正相關趨勢,提示HIF-1α作為低氧的主要應答因子參與了HPH的病理生理過程,這與文獻報道一致[5]。另外,ADM和ET-1是參與血壓調控的重要因子[6],ET-1是由內皮細胞分泌的具有強烈縮血管效應的生物活性肽,能夠引起血管內皮細胞、平滑肌細胞及成纖維細胞增殖和收縮[7],ADM則是ET-1的拮抗物質,具有舒血管作用,肺是其合成和代謝的主要場所;ADM主要由內皮細胞和平滑肌細胞分泌[8];正常情況下,縮血管肽和舒血管肽在體內處于動態平衡的狀態,共同調控血管的舒縮功能;另一方面,二者均為HIF-1α的下游靶基因,在低氧狀態下由HIF-1α誘導分泌增加,舒縮因子分泌失衡,進而導致HPH的發生與發展[9]。
以往研究表明[10]:內皮細胞中的HIF-1α是受氧濃度控制的最重要的調控因子,它調控著包括ET-1和ADM在內的數百種基因的表達,其中,ET-1和ADM在低氧時分別增長了1.9倍和4.2倍。Li等[11]研究發現,HIF-1α與ET-1之間可能形成了正反饋循環回路,進而能持續的促進平滑肌細胞收縮及增生,最終加劇了肺動脈高壓的進程。本研究結果表明,ET-1在低壓低氧10 d,14 d及21 d時表達較對照組升高,且與mPAP及MT%呈正相關趨勢,提示其參與了HPH的形成過程,并在肺動脈高壓及肺血管重塑過程中發揮作用,與Takahashi等[1]的研究結果相符合,且ET-1與HIF-1α的表達亦為正相關關系,這也間接驗證了Li等[11]和Pisarcik等[12]的結果。作為HIF-1α的下游基因,ET-1通過與位于血管平滑肌細胞的特異性受體ETA結合,介導其收縮,并促進其增殖,參與肺血管重建;而ADM則通過旁分泌或自分泌的方式對肺血管平滑肌抑制其收縮及增殖,在HPH過程中發揮代償作用[13]。我們發現,ADM在低氧4、7、10天時表達即有升高,而隨低氧時間的延長,14天及21天時其表達又降低(與對照組無顯著性差異),這可能是因為ADM是HPH的保護性因子,在低氧程度較輕時受HIF-1的調控表達上調,從而拮抗ET-1的縮血管作用,因此此時段mPAP較之對照組并未升高;當低氧時間延長,內皮細胞損傷隨之增加,由于ADM主要是由肺組織內皮細胞分泌,肺組織內ADM水平進而逐漸減低。
綜上,模擬海拔6000米高原環境大鼠在低氧14天時mPAP及MT%顯著升高,此時肺組織內HIF-1α表達水平增高,并且其表達與ET-1、ADM的表達水平呈正相關;HIF-1α與ET-1均與mPAP、MT%呈正相關關系,藉此推測二者均促進了HPH的發生發展;而ADM的表達與HIF-1α正相關但與mPAP、MT%無相關關系,說明ADM的表達一定程度上受HIF-1α的調控,其在HPH早期表達增加,這可能是HPH前期發揮的代償作用,即肺組織雖有一定程度缺氧但mPAP、MT%并未升高的原因之一。總之,HIF-1α作為低氧的調控因子參與了HPH的形成與發展,而其下游靶基因ET-1和ADM作為調節血管舒縮平衡的活性肽亦在此過程中發揮重要作用。
參考文獻:
[1]Takahashi H,Soma S,Muramatsu M,et al.Upregulation of ET-1 and its receptors and remodeling in small pulmonary veins under hypoxic conditions[J].Am J Physiol Lung Cell Mol Physiol,2001,280(6):L1104.
[2]王建榮,周英,桑葵,等.缺氧性肺動脈高壓新生大鼠肺血管重塑與肺血管HIF-1α、ET-1、iNOS表達的相關性研究[J].中國當代兒科雜志,2013(02):138.
[3]Ball M K,Waypa G B,Mungai P T,et al.Regulation of hypoxia-induced pulmonary hypertension by vascular smooth muscle hypoxia-inducible factor-1alpha[J].Am J Respir Crit Care Med,2014,189(3):314.
[4]Semenza GL.Hydroxylation of HIF-1:oxygen sensing at the molecular level[J].Physiology (Bethesda),2004.19:p.176.
[5]Lai YL,Law TC.Chronic hypoxia- and monocrotaline-induced elevation of hypoxia-inducible factor-1 alpha levels and pulmonary hypertension[J].J Biomed Sci,2004.11(3):315.
[6]Vogt S,Winkler E,Hermsen D,et al.Endothelin-1 and adrenomedullin plasma levels after exposure to fludrocortisone,dexamethasone,and spironolactone[J].Clin Exp Hypertens,2012,34(8):582.
[7]Van Hung T,Emoto N,Vignon-Zellweger N,et al.Inhibition of vascular endothelial growth factor receptor under hypoxia causes severe,human-like pulmonary arterial hypertension in mice:Potential roles of interleukin-6 and endothelin[J].Life Sci,2014,118(2):313.
[8]Fontes-Sousa A P,Pires A L,Carneiro C S,et al.Effects of adrenomedullin on systolic and diastolic myocardial function[J].Peptides,2009,30(4):796.
[9]Wang L,Zhou Y,Li M,et al.Expression of hypoxia-inducible factor-1alpha,endothelin-1 and adrenomedullin in newborn rats with hypoxia-induced pulmonary hypertension[J].Exp Ther Med,2014,8(1):335.
[10]Manalo D J,Rowan A,Lavoie T,et al.Transcriptional regulation of vascular endothelial cell responses to hypoxia by HIF-1[J].Blood,2005,105(2):659.
[11]Li M,Liu Y,Jin F,et al.Endothelin-1 induces hypoxia inducible factor 1alpha expression in pulmonary artery smooth muscle cells[J].FEBS Lett,2012,586(21):3888.
[12]Pisarcik S,Maylor J,Lu W,et al.Activation of hypoxia-inducible factor-1 in pulmonary arterial smooth muscle cells by endothelin-1[J].Am J Physiol Lung Cell Mol Physiol,2013,304(8):L549.
[13]徐平,戴愛國,周厚德,低氧性肺動脈高壓大鼠肺內腎上腺髓質素及受體表達研究[J].中華結核和呼吸雜志,2002(8):20.
The expression and significance of HIF-1α,ET-1 and ADM in lung vessel of rats with hypobaric hypoxic-induced pulmonary hypertensionXUJiao-yang,SHIWen-hui,FUYong,etal.(ShiheziUniversitySchoolofMedicine,Urumqi830000,China)
Abstract:ObjectiveTo study the expression and variation of HIF-1α,ET-1 and ADM in lung tissue,by exposing rats to simulated 6000m altitude to establish hypobaric hypoxia-induced pulmonary hypertension (HPH) animal model.Methods120 SD rats were placed into a large artificial climate cabin (simulated 6000m altitude circumstance,24h/day) after they were randomly divided into hypoxic groups for 4 days,7 days,10 days,14 days,21 days and control groups(900m altitude above the sea level) of each corresponding time points;pulmonary tissue samples were analyzed by pathology images analyze software after HE staining;the expression of HIF-1α,ET-1and ADM in lung tissues were detected by immunohistochemistry.ResultsThe mPAP and MT% of SD rats of hypobaric hypoxic for 10 days,14 days,21 days groups were significantly higher than the corresponding control groups;the expression of HIF-1α in HPH rats were increased since hypoxic for 4 days,and were no significant difference compared with the control groups until hypoxic for 21 days after they were undergone a decrease in 14 days hypoxic group;the expression of ET-1 in hypoxic 10 days,14 days,21 days groups were increased significantly compared with the normoxia groups;while the expression of ADM was increased in hypoxic 4 days,7 days,10 days groups,then the expression undergone a reduction afterwards.ConclusionThe expression of HIF-1α in HPH rats lung tissues showed a positive correlation between that of ET-1 and ADM,and the three factors were involved in the occurrence and development of HPH rats.
Key words:Hypobaric hypoxia;Pulmonary hypertension;Hypoxia-inducible factor-1α;Endothelin-1;Adrenomedullin
(收稿日期:2014-08-25)
作者簡介:徐嬌陽(1989-),女,碩士研究生,研究方向:分子生物學檢驗診斷。
文獻標識碼:A
中圖分類號:R544.1
文章編號:1007-4287(2015)12-1996-05
*通訊作者
基金項目:蘭州軍區醫藥衛生科研計劃課題(CLZ12JA12);新疆自治區青年科技人才專項科研課題(2013QK016);醫院博士返院后續課題(2013ZY001)

