夜香樹葉正丁醇提取物中流份C6 和C7 對人胃癌細胞SGC7901增殖和凋亡作用的影響Δ
吳登攀,廖 文,黃金蘭,陳文雅,何育爐,張晟瑞,鐘振國#(.徐州醫學院藥學院,江蘇 徐州 004;.廣西中醫藥大學新藥研究開發中心,南寧 53000)
惡性腫瘤嚴重威脅人類健康,給人類帶來了巨大的精神壓力和經濟負擔。隨著現代技術的發展,抗腫瘤中草藥的發掘和篩選成為抗腫瘤的主要發展方向之一。夜香樹又名夜來香,主要分布于我國南方地區,為茄科夜香樹屬植物(Cestrum nocturnum,Linn.,簡稱CN)。CN 性溫、味辛,具行氣止痛、鎮定之功效,民間用于治療胃脘痛。研究報道,CN 提取物具有鎮痛、中樞抑制、局部麻醉[1]和抗糖尿病[2]作用。然而,其抗腫瘤方面的研究卻鮮見報道。研究發現,CN 花、葉及嫩枝具有良好的抗腫瘤作用[3-4],且其活性部位主要在正丁醇部位[5-6]。為進一步研究CN正丁醇部位抗腫瘤作用的有效組分,筆者采用不同比例氯仿-甲醇(1 ∶9、1 ∶7)梯度洗脫正丁醇提取物得到流份C6 和C7,并選用人胃癌SGC7901 細胞為受試細胞,通過體外試驗研究流份C6和C7的抗腫瘤活性,為開發CN的抗腫瘤功效提供依據。
1 材料
1.1 儀器
381型CO2培養箱(美國Life Technologies 公司);TE2000-U 型倒置熒光顯微鏡(日本尼康株式會社);Sunrise 型酶標儀(美國Biocell Technology公司)。
1.2 藥材與試劑
CN葉采自廣西境內,經廣西中醫藥大學藥用植物教研室劉壽養教授鑒定為茄科夜香樹屬植物夜香樹Cestrum nocturnum,Linn.的葉;胚胎牛血清(FBS)、RPMI1640 培養基(美國Life Technologies 公司);MTT、碘化丙啶(PI)、Hoechst 33258染液(美國Sigma-Aldrich 公司,批號:080521、P-4170、23491-45-4,純度:98%、94%、98%);其余試劑均為國產分析純。
1.3 細胞株
人胃癌SGC7901細胞株購自上海細胞生物研究所。
2 方法
2.1 細胞培養
人胃癌SGC7901細胞株用含10%FBS的RPMI 1640培養液于37 ℃、5%CO2培養箱中培養,0.25%胰蛋白酶消化傳代,取對數生長期細胞用于試驗。
2.2 CN葉正丁醇部位流份C6、C7的提取
CN 葉經日曬干燥后分別用95%、50%乙醇滲漉提取,并將兩部分浸膏合并得乙醇總浸膏。乙醇總浸膏用硅膠拌勻后,用水飽和正丁醇回流提取,得正丁醇部位浸膏,將浸膏烘干至恒質量,精密稱定,計算浸膏得率:浸膏得率(%)=浸膏質量/藥材總質量×100%。經計算,正丁醇部位浸膏得率為1.25%。將正丁醇部位浸膏加無水乙醇溶解后用100~200目的硅膠拌樣并裝柱,依次用1 ∶9、1 ∶7(V/V)的氯仿-甲醇進行梯度洗脫,分別獲得流份C6、C7。
2.3 分組及干預方法
將對數生長期細胞分為空白組和給藥組。前期MTT試驗結果顯示,流份C6、C7 在20 μg/ml 時對SGC7901 細胞的增殖抑制率分別為59.2%和55.5%。為進一步探討其對SGC7901細胞的增殖抑制作用,筆者在本次MTT 試驗中將給藥組C6、C7 質量濃度均設置為5、10、20、40、80 μg/ml;在集落形成試驗、瑞氏-姬姆薩混染試驗和Hoechst33258/PI染色試驗中給藥組C6、C7 的質量濃度均為10 μg/ml。上述試驗中的空白對照組則加入等體積的培養液。
2.4 MTT法測定流份C6、C7對SGC7901細胞的增殖抑制率
在96 孔培養板中按1 000 個細胞/孔加入200 μl 含10%FBS的RPMI 1640培養液。將細胞置于培養箱中培養24 h,待細胞貼壁后,分別加入不同質量濃度的C6、C7,置于培養箱中培養72 h。培養結束前4 h棄去上清液,按200 μl/孔加入新鮮制備的含0.2 mg/ml MTT的無血清培養液,37 ℃繼續培養4 h,棄去上清液,按200 μl/孔加入二甲基亞砜,振蕩混勻后,在酶標儀上以波長為450 nm 測定光密度(OD450)值。按以下公式計算藥物對腫瘤細胞增殖的抑制率:增殖抑制率(%)=(1-試驗組OD450值/空白對照組OD450值)×100%;用SPSS 11.5 軟件計算半數抑制濃度(IC50)。試驗重復3次。
2.5 集落形成試驗
取對數生長期的細胞制成單個分散細胞懸液,活細胞計數,用含10% FBS 的RPMI 1640 培養液配成細胞密度為100 ml-1的細胞懸液,于35 mm培養皿中分別加入含和不含藥物的細胞懸液2 ml,置于培養箱中培養7 d,棄去培養液,先用瑞氏染色液染色5 min,然后用姬姆薩染液與Sorensen 磷鉬酸緩沖液以1 ∶9 混合成工作液(現配現用)染色10 min,流水沖洗、晾干,在20倍的顯微鏡下計數含50個細胞以上的集落。空白對照組以培養液代替受試藥物,結果以集落形成率和集落形成抑制率表示。集落形成率(%)=集落數/接種細胞數×100%,集落形成抑制率(%)=1-集落數/空白對照組集落數×100%。試驗重復3次。
2.6 瑞氏-姬姆薩混染法觀察細胞形態
取對數生長期細胞,用含10% FBS 的PRMI1640 培養液配成1×105ml-1的細胞懸液,接種在35 mm 的培養皿中,細胞貼壁后,分別加入含和不含藥物的培養液2 ml,置于培養箱中培養72 h。培養結束后,棄培養液,用甲醇固定10 min。染色操作同“2.5”項下方法。流水沖洗、晾干,鏡檢。
2.7 Hoechst33258/PI染色法觀察細胞形態
細胞的接種、培養同“2.6”項下方法。培養結束后,棄去培養液用PBS 洗1 次,加入2 mmol/L Hoechst 33258 2 μl 和50 μg/ml PI染色液20 μl。37 ℃下染色15 min,滴加封片液,在倒置熒光顯微鏡下紫外光激發,40倍物鏡觀察。
2.8 統計學方法
3 結果
3.1 流份C6、C7對SGC7901細胞增殖的影響
隨著C6 和C7 質量濃度增加,對SGC7901 細胞增殖的抑制作用也增加,5 μg/ml C6 和C7 對SGC7901 細胞增殖的抑制率分別為22.1%和19.6%;當C6和C7質量濃度增加至80 μg/ml時,細胞增殖的抑制率分別達到80%和79.7%,表明流份C6和C7對SGC7901細胞增殖的抑制作用呈濃度依賴性。流份C6、C7對SGC7901細胞的IC50分別為16.14、18.05 μg/ml,結果詳見表1。
表1 細胞增殖抑制率測定結果(,n=3)Tab 1 Results of inhibitory rate of cells(,n=3)
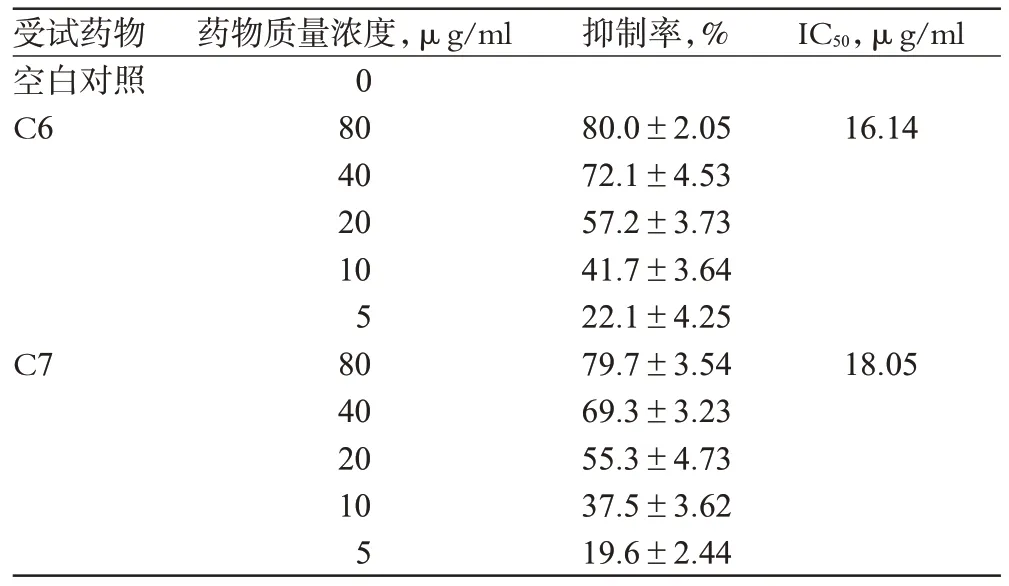
表1 細胞增殖抑制率測定結果(,n=3)Tab 1 Results of inhibitory rate of cells(,n=3)
3.2 流份C6和C7 對SGC7901細胞集落形成的影響
與空白對照組比較,流份C6、C7組(10 μg/ml)SGC7901細胞集落數、集落形成率降低,差異有統計學意義(P<0.05);C6、C7 組(10 μg/ml)細胞集落形成抑制率分別為55.26%和50.00%,結果詳見表2。
表2 細胞集落形成率測定結果(,n=3)Tab 2 Results of colony formation rate of cells(,n=3)

表2 細胞集落形成率測定結果(,n=3)Tab 2 Results of colony formation rate of cells(,n=3)
注:與空白對照比較,*P<0.05Note:vs.blank control,*P<0.05
3.3 流份C6、C7對SGC7901細胞形態的影響
瑞氏-姬姆薩混染法染色結果顯示,空白對照組細胞的細胞膜較完整、胞質透明、核膜完整、核大而圓;而C6和C7組的細胞均出現凋亡而變圓變小、核質固縮,詳見圖1A。
Hoechst33258/PI 染色結果顯示,由于正常細胞對染料有拒染性,故空白對照組細胞藍色和紅色的熒光較少;C6 和C7組均出現呈強藍色熒光的凋亡細胞及呈弱藍色、強紅色熒光的死細胞,詳見圖1B。
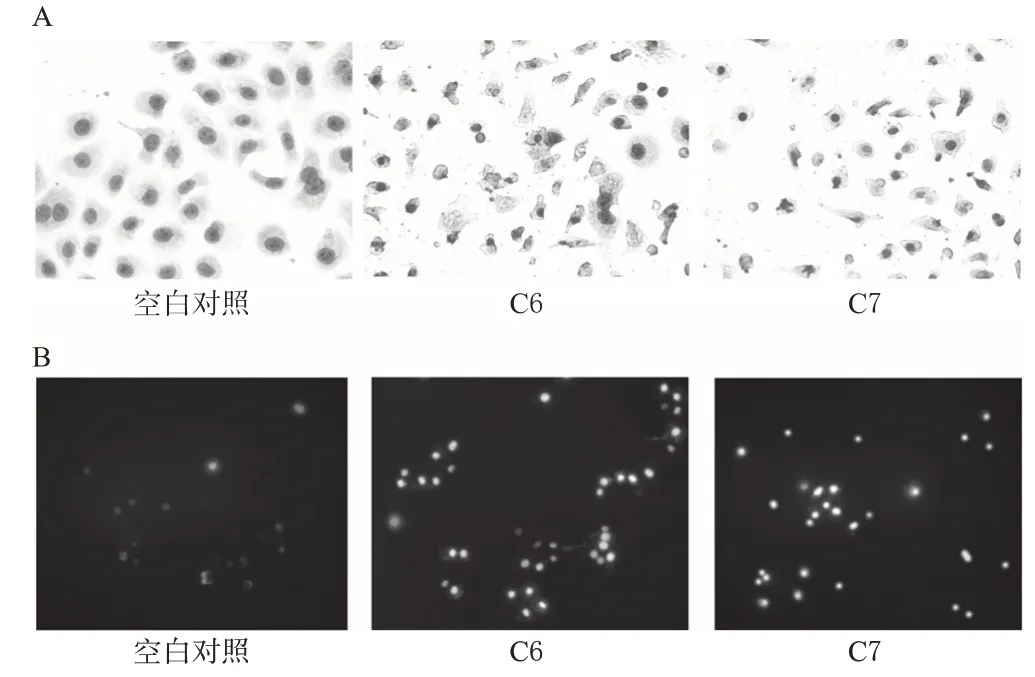
圖1 細胞形態學觀察結果Fig 1 Morphology of cells
4 討論
利用MTT 和集落形成法,以抑制腫瘤細胞增殖為活性指標,是目前一種經濟、快速、簡便的藥物篩選方法。MTT 法可通過溶解于二甲基亞砜中甲臜結晶顏色的深淺來反映活細胞的生長能力[7];而集落形成法可反映腫瘤細胞中具有增殖活性的干細胞的增殖能力[8]。細胞集落形成率下降說明腫瘤細胞群體中干細胞比例減少,對腫瘤細胞增殖產生抑制作用[9]。本試驗首先對流份C6 和C7 進行MTT 試驗,結果表明,流份C6和C7對SGC7901細胞的增殖有明顯的抑制作用,且抑制作用呈濃度依賴性(見表1);然后采用集落形成法進一步評價流份C6 和C7 對SGC7901 細胞增殖的影響,結果表明,流份C6 和C7在質量濃度為10 μg/ml時即可顯著抑制SGC7901細胞的集落形成,且集落形成率與空白對照組相比有顯著性差異(P<0.05)。上述結果提示,流份C6 和C7 可顯著抑制SGC7901 細胞增殖。
抗腫瘤藥物的抗腫瘤作用除了體現在抑制腫瘤細胞增殖以外,還包括促進腫瘤細胞壞死或凋亡[10]。腫瘤細胞發生凋亡時,由于不斷脫水,會出現細胞質不斷濃縮、細胞體積減少、細胞核裂解產生凋亡小體等細胞形態學改變[11]。因此,本試驗首先采用瑞氏-姬姆薩混染法觀察藥物作用后SGC7901 細胞的形態學變化。結果表明,給藥組出現細胞變圓、體積變小、核質固縮等典型的凋亡特征(圖1A)。此外,筆者還采用Hoechst33258/PI 染色法觀察藥物對SGC7901 細胞凋亡形態的影響。PI可使壞死細胞著色,呈強紅色熒光;而Hoechst 33258可滲透過細胞膜,使活細胞染成紅色熒光,凋亡細胞染成藍色熒光[12]。由圖1B 可觀察到,給藥組可觀察到很多強藍色熒光的調亡細胞和呈弱藍色、強紅色熒光的死細胞,而空白對照組這兩種細胞少見。這些結果表明,CN 正丁醇提取物C6 和C7 可誘導SGC7901細胞凋亡。
綜上,CN 葉正丁醇提取物中流份C6 和C7 可顯著抑制SGC7901細胞增殖并可誘導其凋亡,具有很好的抗腫瘤作用,但其抗腫瘤作用的確切機制以及體內抗腫瘤活性還需進一步研究。此外,對篩選出的活性流份還需進一步分離純化,以明確具有抗腫瘤活性的單體化合物。本試驗為CN 葉的進一步研究提供了依據。
[1]呂金燕,白蕊,鐘振國.夜香樹的化學成分與藥理作用研究進展[J].廣西中醫學院學報,2012,15(2):62.
[2]Kamboj A,Kumar S,Kumar V.Evaluation of antidiabetic activity of hydroalcoholic extract of cestrum nocturnum leaves in streptozotocin-induced diabetic rats[J].Adv Pharmacol Sci,2013,doi:10.1155/2013/150401.
[3]趙世元,黃之虎,葉海洪,等.夜香樹花甾體皂苷誘導K562細胞凋亡機制研究[J].中成藥,2013,35(3):445.
[4]羅發軍,鐘振國,趙華平,等.夜香樹提取物對小鼠白血病L1210細胞生長的抑制作用[J].時珍國醫國藥,2009,20(2):335.
[5]鐘振國,趙世元,呂金燕,等.夜香樹提取物體內抗腫瘤作用的實驗研究[J].中藥材,2008,31(11):1 709.
[6]盧紅梅,鐘振國,趙世元,等.夜香樹花提取物體外抗腫瘤作用的實驗研究[J].時珍國醫國藥,2010,21(7):1 704.
[7]Angius F,Floris A.Liposomes and MTT cell viability assay:an incompatible affair[J].Toxicol In Vitro,2015,29(2):314.
[8]Masuda H,Asahara T.Clonogenic assay of endothelial progenitor cells[J].Trends Cardiovasc Med,2013,23(4):99.
[9]Joo HJ,Seo HR,Jeong HE,et al.Smooth muscle progenitor cells from peripheral blood promote the neovascularization of endothelial colony-forming cells[J].Biochem Biophys Res Commun,2014,449(4):405.
[10]Droin N,Guery L,Benikhlef N,et al.Targeting apoptosis proteins in hematological malignancies[J].Cancer Letters,2011,332(2):325.
[11]Jendrossek V.Targeting apoptosis pathways by celecoxib in cancer[J].Cancer Letters,2013,332(2):321.
[12]Cai L,Chen ZZ,Dong XM,et al.Silica nanoparticles based label-free aptamer hybridization for ATP detection using hoechst33258 as the signal reporter[J].Biosens Bioelectron,2011,29(1):46.

