鹽酸埃克替尼對人肺腺癌細胞系PC-9作用的比較蛋白質組學研究
劉曉麗 李 維 孟 夏 張玉萍
明宗娟 史紅陽 石 婕 鐘玉潔
王 薇 楊拴盈
?
·論著·
鹽酸埃克替尼對人肺腺癌細胞系PC-9作用的比較蛋白質組學研究
劉曉麗李維孟夏張玉萍
明宗娟史紅陽石婕鐘玉潔
王薇楊拴盈
【摘要】目的應用比較蛋白質組學方法分析鹽酸埃克替尼作用前后人肺腺癌細胞系PC-9細胞相關蛋白的變化,從蛋白質水平探討埃克替尼的作用機制。方法應用人類EGFR基因突變檢測試劑盒和實時定量PCR儀檢測PC-9細胞EGFR突變;應用MTT法檢測埃克替尼對PC-9細胞增殖的影響;應用雙向凝膠電泳(2-DE)技術分別對未經干預的PC-9細胞總蛋白和經埃克替尼作用的PC-9細胞總蛋白進行分離,獲得蛋白質表達譜;應用基質輔助激光解吸電離飛行時間質譜(MALDI-TOF-MS)結合生物信息學進行蛋白質鑒定。結果PC-9細胞的EGFR基因存在第19外顯子缺失突變;在10-4-10-9M濃度范圍內,埃克替尼明顯抑制PC-9細胞的生長,且呈濃度依賴;埃克替尼誘導前后表達水平≥1.5倍的蛋白點共有56個。選取差異≥1.7倍的29個蛋白點進行MALDI-TOF-MS分析,最終鑒定出16種蛋白質。根據功能,這些蛋白可分為代謝酶類、細胞骨架類、分子伴侶、信號傳導分子、轉錄及翻譯相關蛋白。結論應用比較蛋白質組學方法初步鑒定了16種蛋白質,這些蛋白質與埃克替尼作用機制密切相關,部分可能成為新的分子治療靶點。
【關鍵詞】PC-9細胞;埃克替尼;比較蛋白質組學;生物信息學
肺癌是目前發病率及病死率最高的惡性腫瘤[1-2]。非小細胞肺癌(non-small cell lung cancer, NSCLC)約占肺癌發病總數的80%以上。其5年生存率僅15%。對于早期NSCLC,目前首選手術治療,晚期NSCLC的治療是以化療為主的綜合治療。然而傳統的化療和放療雖然可暫時緩解癥狀,使腫瘤縮小,但并不能有效提高生存期,且常因放化療的毒副反應,使患者無法耐受治療。表皮生長因子受體酪氨酸激酶抑制劑(epidermal growth factor receptor tyrosine inhibitor, EGFR-TKI)是目前抗癌藥研究中最受矚目的領域[3]。埃克替尼是一種小分子EGFR-TKI,由浙江貝達藥業有限公司自主研發。對于EGFR基因突變的患者,鹽酸埃克替尼具有明顯的抗腫瘤作用[4]。目前針對該藥作用機制的研究多集中在PI3K/AKT、Ras/Raf/MEK/MAPK、JAK/STAT3信號通路,其它作用機制尚不明確。比較蛋白質組學是蛋白質組學的重要組成部分,它不僅在探討發病機制、早期診斷等方面發揮巨大的作用,而且可以通過研究藥物處理前后蛋白的差異變化,深入探討藥物作用機制,并發現新的、潛在的藥物作用靶點。本研究通過比較蛋白質組學方法觀察埃克替尼作用前后相關蛋白變化,以期從蛋白質水平探討埃克替尼作用機制,并為開發新靶向治療藥物的提供理論依據。
材料與方法
一、實驗材料
1. 細胞: 人肺腺癌細胞系PC-9細胞購自上海復祥生物科技有限公司,用含10%胎牛血清的DMEM高糖培養基進行傳代培養。
2. 主要儀器: 細胞培養箱(美國Thermo公司);超凈工作臺(天津泰斯特儀器有限公司);倒置顯微鏡(日本Nikon公司);超聲細胞破碎儀(浙江新芝生物科技有限公司);PowerWave XS 酶標儀(Bio-tek公司);ABl7500實時定量PCR儀(美國應用生物系統公司):Ettan IPGphor Isoelectric Focusing System(GE Amersham公司);光密度掃描儀GS-710(美國Bio-Rad公司);凝膠圖像分析軟件Image Master(GE Amersham公司);4800 MALDI-TOF質譜儀(AB SCIEX);UMax Powerlook 2100XL掃描儀(GE Amersham公司);Hofer SE 600(GE Amersham)。
3. 試劑: 鹽酸埃克替尼由浙江省貝達藥業有限公司饋贈;DMEM高糖培養基、胎牛血清、胰蛋白酶溶液均購自美國Hyclone公司;MTT、DMSO均購自美國Sigma公司;Amoy Dx試劑盒購自廈門艾德生物醫藥科技有限公司;DNA提取試劑盒購自日本Takara公司;PH3-10非線性膠條、PH3-10L IPG Buffer均購自美國Pharmacia公司;考馬斯亮藍G-250/R-350、Urea、CHAPS、DTT、IAA、Tris均購自美國GE Amersham公司;Bradford蛋白定量試劑盒、SDS、APS、TEMED、甘氨酸、甘油均購自美國Bio-Rad公司;Cocktail酶抑制劑購自美國Roche公司;氯化鈉、氯化鉀、十二水合磷酸氫二鈉、磷酸氫二鉀、乙醇、乙酸、戊二醛、甲醛、檸檬酸均為國產分析純試劑。
二、實驗方法
1. 細胞EGFR基因突變檢測: 將處于對數生長期的細胞,胰酶消化,離心重懸后提取DNA,所有步驟按培養貼壁細胞DNA提取操作說明;利用人類EGFR基因突變檢測試劑盒(Amoy Dx)和實時定量PCR儀檢測突變基因。
2. 細胞增殖抑制率測定: 取生長狀態穩定、對數生長期的細胞,接種至96孔板中,使每孔細胞數為5 000個左右。過夜細胞貼壁后,更換培養液,加入鹽酸埃克替尼,使各標記孔內藥物濃度分別為100 μmol/L、10 μmol/L、1 μmol/L、0.1 μmol/L、0.01 μmol/L、0.001 μmol/L,每個濃度組設6個復孔,對照組加入等量培養液。繼續孵育72 h,每孔加5 mg/ml的MTT溶液20 μl,孵育4 h棄上清,每孔加入二甲基亞砜(dimethyl sulfoxide, DMSO) 150 μl,振蕩10 min,使結晶物充分溶解;將培養板放入酶聯免疫檢測儀,測量并記錄各孔的光吸收值。癌細胞存活率由下式計算:細胞存活率=(實驗組光吸收值/對照組光吸收值)×100%,通過SPSS12.0統計軟件,將實驗組與對照組作t檢驗。確定埃克替尼作用PC-9細胞72 h的半抑制濃度(IC50);以抑制率為縱坐標、藥物濃度為橫坐標繪制曲線圖。
3. 細胞總蛋白的提取: PC-9細胞生長至對數生長期后,更換培養基,使實驗組細胞暴露于IC50的埃克替尼中,繼續孵育72 h。吸出兩組細胞的培養液,用預冷的PBS緩沖液清洗三遍,將PBS吸除干凈,加入250 μl細胞裂解液,每10 min充分混勻一次,于冰上裂解細胞1 h,用刮刀收集細胞。冰浴超聲裂解(80 w,5次,每次10 s,間隔15 s,冰上完成),超聲后離心(12 000×g、45 min),4 ℃,取上清;Bradford法蛋白定量,分裝,-80 ℃冰箱保存。
4. 2-DE: 將樣品100 μg與重泡漲液充分混合,低速離心后,加入持膠槽,將IPG干膠條(PH3-10L,13 cm)去保護膜,膠面朝下從一端放入持膠槽中,使重泡漲液浸潤整個膠條,用礦物油覆蓋,操作過程中注意不要產生氣泡;水化和等電聚焦在20 ℃自動進行,設置參數如下:30 v 12 hrs,500 v 1 hrs,1 000 v 1 hrs,8 000 v 8hrs,500v 4hrs;將膠條進行兩步平衡后,移至12.5%分離膠的上端,進行十二烷基磺酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfatepolyacrylamide gelelectrophoresis, SDS-PAGE)。電泳完成后,按蛋白質銀染試劑盒的操作手冊進行銀染。
5. 凝膠圖像分析: 兩組樣品常規各跑3次雙向凝膠電泳,GS-710光密度掃描儀對染色后的膠圖進行掃描,通過Image-Master軟件對兩組圖像進行背景消減、蛋白點檢測、匹配、量化及數據分析。應用SPSS12.0軟件進行統計學分析,采用t檢驗。選取差異1.7倍以上的蛋白質點進行質譜分析。
6. 質譜分析: 將銀染蛋白點進行膠內酶切,脫色,還原,烷基化,酶解,萃取,凍干。將制備好的樣品用串聯飛行時間質譜儀(4 800 Plus MALDI TOF/TOFTM Analyzer)進行測試分析,激光源波長為355 nm,離子源加速電壓為2 kV,采用正離子模式和自動獲取數據的模式采集數據,MS掃描范圍為800~4 000 Da,選擇信噪比大于50的母離子進行MS/MS分析,每個樣品點上選擇8個母離子,二級質譜(MS/MS)累計疊加2 500次,碰撞能量2 kV,CID關閉;質譜測試原始文件用Mascot2.2軟件檢索相應數據庫,最后得到鑒定的蛋白質結果。
7. 生物信息學分析: 利用NCBI數據庫對差異表達明顯且與腫瘤密切相關蛋白進行mRNA、蛋白質序列進行檢索,在此基礎上利用ProtParam、SOPMA、TMpred、PSORT、SWISS-MODEL、SMART、STRING、KEGG等工具對它們的理化性質、二級結構、跨膜結構域、亞細胞定位、三維結構、功能結構域、蛋白相互作用、信號通路等進行初步分析。
結果
一、EGFR基因表達情況
采用ADx-ARMS法對人肺腺癌細胞系PC-9細胞的EGFR基因18、19、20、21外顯子進行突變檢測。結果顯示PC-9細胞的EGFR基因存在第19外現在缺失突變。
二、細胞增殖抑制率
藥物干預72 h后通過倒置顯微鏡可觀察到貼壁細胞生長速度減慢,形態改變,出現細小顆粒,并可見細胞碎片。不同濃度埃克替尼作用于PC-9細胞72 h后,MTT法檢測細胞OD值并計算抑制率。結果發現在10-4-10-9M濃度范圍內,埃克替尼明顯抑制PC-9細胞的生長,且呈濃度依賴性,72 h IC50約為80 nmol/L,見圖1。
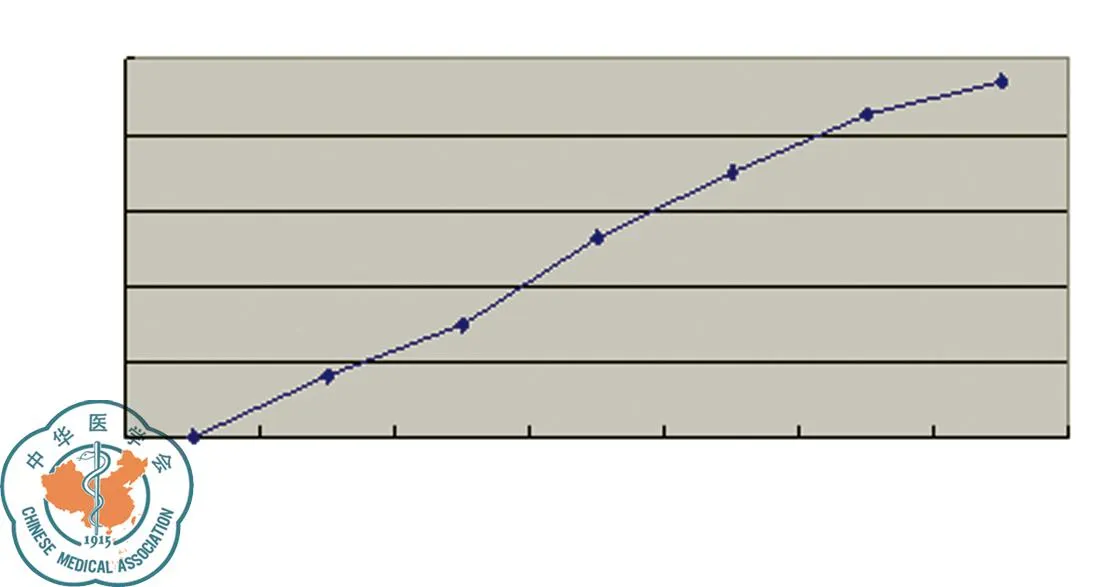
圖1 不同濃度埃克替尼對PC-9細胞生長的影響
三、2-DE凝膠圖譜
每組蛋白常規跑3次電泳,用GS-710光密度掃描儀對膠圖進行掃描,采用Image-master軟件進行分析,結果顯示對照組3塊膠的平均蛋白斑點數為1 410±52,平均匹配率為63.45%;實驗組的平均蛋白斑點數為1 480±52,平均匹配率為66.61%。對照組和實驗組間蛋白差異≥1.5倍的點共有56個。圖2為對照組和實驗組間蛋白差異點。

圖2 對照組和實驗組間蛋白差異點凝膠圖譜
四、質譜分析結果
選取差異≥1.7倍的29個蛋白點進行MALDI-TOF-MS分析,最終成功獲得16種蛋白的PMF,其中埃克替尼干預后下調的蛋白有13種,分別為細胞角蛋白9(cytokeratin9, CK9)、吡咯琳-5-羧酸還原酶(pyrroline-5-carboxylate reductase, PYCR)、ran特異性GTP酶活化蛋白(ran-specific GTPase-activating protein, RANBP1)、腫瘤蛋白18(stathmin1/oncoprotein18, STMN1)、NEM1-NEM2 蛋白、rasGTP酶激活蛋白結合蛋白1(ras GTPase-activating protein-binding protein1, G3BP1)、泛素結合酶E2D3(ubiquitin-conjugating enzyme E2D3, UBE2D3)、微管蛋白α-1A鏈亞型2(tubulin alpha-1A chain isoform2, TUBA1A isoform2)、 視黃醇脫氫酶(retinol dehydrogenase, RDH)、熱休克蛋白40(DnaJ homolog, subfamily B, member1, DNAJB1)、不均一核糖核蛋白A/B(heterogeneous nuclear ribonucleoprotein A/B, hnRNPA/B)、電壓依賴性陰離子選擇性通道蛋白1(voltage-dependent anion-selective channel protein1, VDAC1)、真核翻譯起始因子3亞組1(eukaryotic translation initiation factor 3 subunit1, EIF31);加藥后上調的蛋白點有3種:層黏連蛋白結合蛋白(laminin-binding protein, RPSA)、葡萄糖-6-磷酸脫氫酶(glucose-6-phosphate dehydrogenase, G6PD)、果糖-1,6二磷酸酶(fructose-1,6-bisphosphatase, FBPase),見表1,圖3。
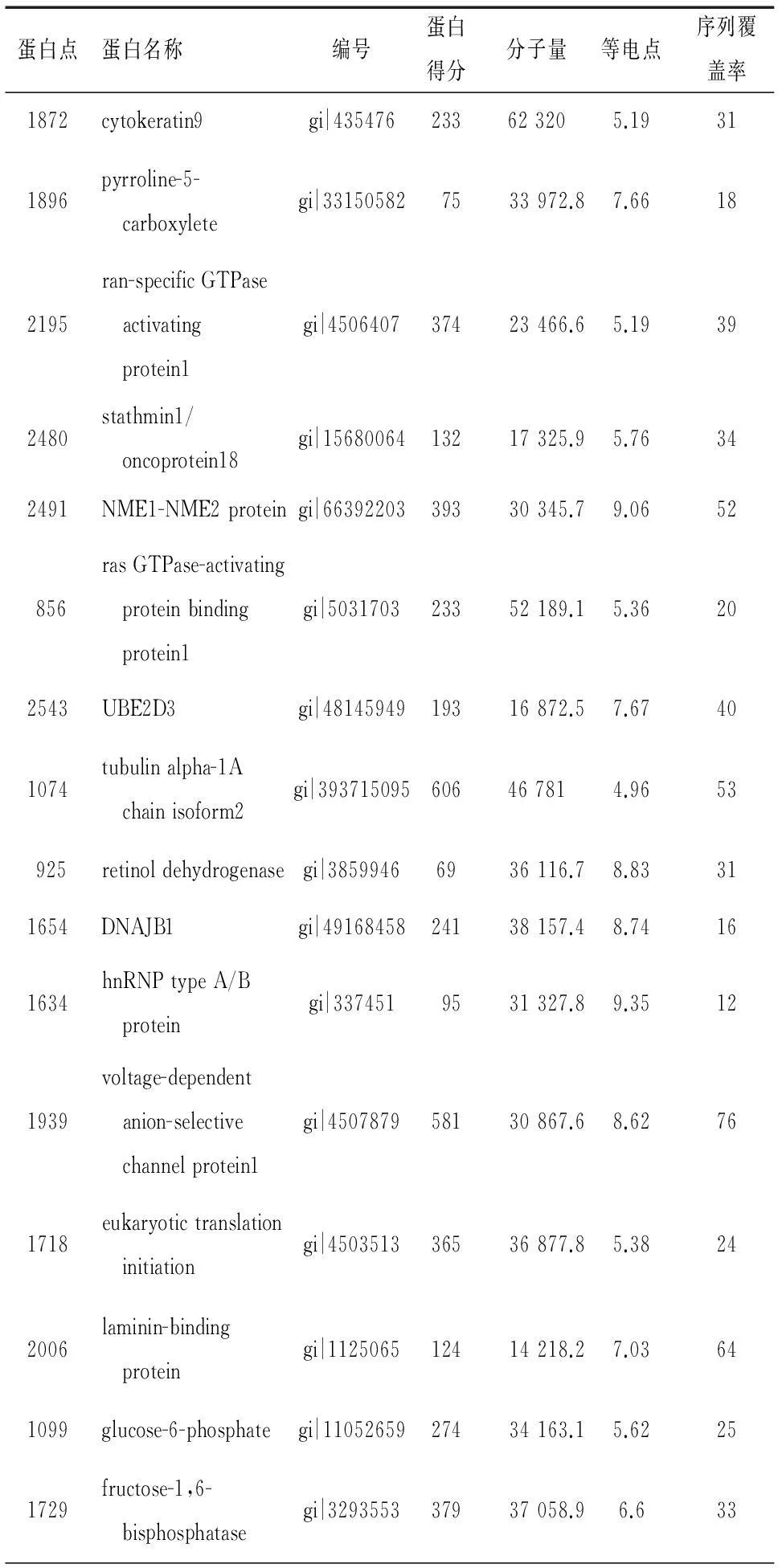
表1 差異表達蛋白質譜分析結果
圖3 1872點的一級肽質量指紋圖譜
五、生物信息學結果
查閱相關文獻,對差異表達明顯且與腫瘤密切相關的NME1-NME2、STMN1、G3BP1蛋白進行生物信息學分析。NME1-NME2蛋白由267個氨基酸構成,相對分子質量約為3 0137.0,理論等電點9.06,是一種可溶性、親水性蛋白質;其二級結構主要有α-螺旋(37.83%)和無規則卷曲(26.97%);TMpred結構域分析軟件顯示NME1-NME2蛋白有2個可能的跨膜結構域;SMART數據庫搜索結果提示該蛋白有2個NDK結構域;亞細胞定位結果顯示NME1-NME2可能存在于細胞質中;圖4為NME1-NME2蛋白質的三維結構圖;STRING庫預測所得與NME1-NME2相互作用蛋白得分高的主要有KCNN4、CCND1、PAPD4、ACLY、MYC、CNOT8、HSP72、NME1、EEF1A1,另外,NME1-NME2可能與STAT3通路有一定的關聯(圖5)。
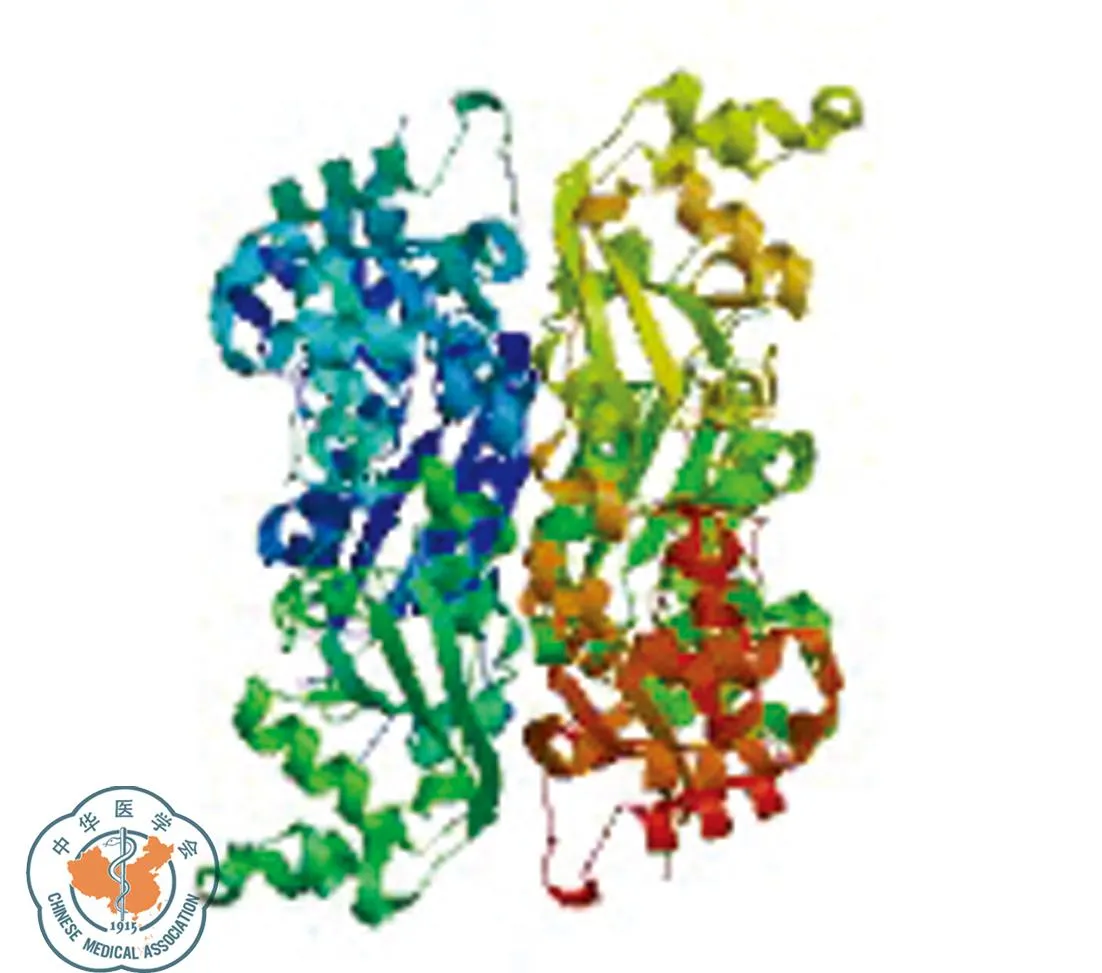
圖4 NME1-NME2蛋白的三維結構圖
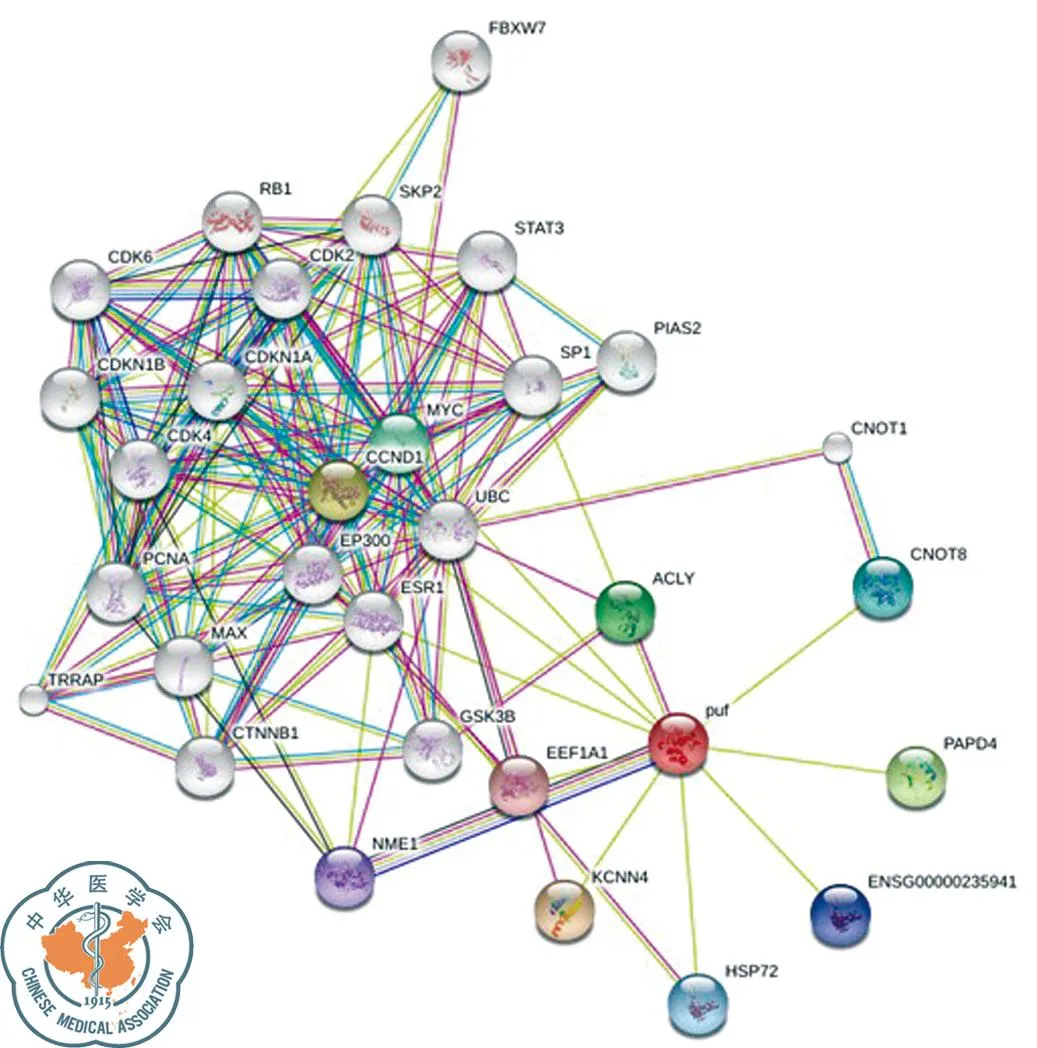
圖5 STRING數據庫:NME1-NME2相互作用蛋白預測結果
STMN1基因有四個mRNA轉錄變本,轉錄變本1、2、3翻譯合成同一種蛋白質stathmin亞型a,轉錄變本4翻譯合成stathmin亞型b;stathmin亞型a由149個氨基酸組成,相對分子質量為17 302.5,理論等電點5.75;stathmin亞型b由174個氨基酸組成,相對分子質量為19 823.5,理論等電點為6.52;兩種蛋白均為可溶性、親水性蛋白;stathmin亞型a二級結構主要有α-螺旋(78.52%)和無規則卷曲(18.79%);stathmin亞型b二級結構主要由a螺旋(71.84%)和無規則卷曲(21.84%)構成;TMpred軟件顯示stathmin亞型a多肽鏈可能并不存在跨膜結構域,stathmin亞型b有1個可能的跨膜結構域; stathmin亞型a和亞型b均含有一個stathmin結構域;亞細胞定位顯示STMN1存在于細胞質和細胞骨架中;圖6為STMN1蛋白的三維結構圖;與STMN1蛋白相互作用密切的有AURKB、MAPK3、MAPK13、CDK1、TP53、MAPK1、CAMK2B、CAMK2G、NACA、ADCYAP1,可見其參與MAKP信號通路、細胞周期調控,并與TP53密切相關(圖7)。

圖6 STMN1蛋白的三維結構圖
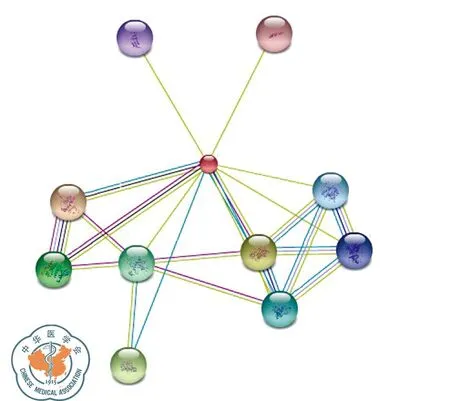
圖7 STRING數據庫:STMN1相互作用蛋白預測結果
G3BP1:該蛋白質由466個氨基酸構成,相對分子質量為52 164.2,理論等電點為5.36;二級結構主要有a-螺旋(23.82%)和無規則卷曲(55.79%);沒有跨膜結構域,是親水性、可溶性蛋白;G3BP1蛋白含有NTF2和RRM結構域;G3BP1分布廣范,主要存在于細胞質中;圖8為G3BP1蛋白質的三維結構;與G3BP1蛋白相互作用密切的主要有CAPRIN1、USP10、EIF4G1、RASA1、CSK、HDAC6、OGFOD1、PRMT1、STYXL1、ALPP,是ras信號轉導通路中的一個重要元素(圖9)。

圖8 G3BP1蛋白的三維結構圖
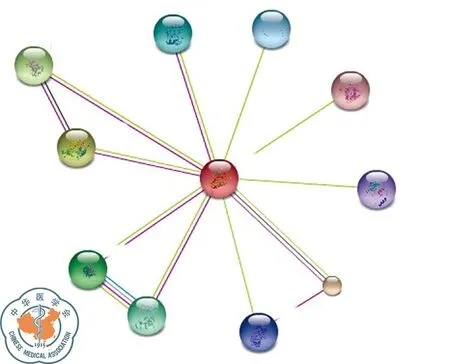
圖9 STRING數據庫:G3BP1相互作用蛋白預測結果
討論
肺癌的發生、發展是一個多基因參與,多分子調控的復雜過程,且早期缺乏特異性癥狀,發病機制不明,容易發生遠處轉移,預后極差。EGFR-TKI能特異性、競爭性地結合在EGFR激酶功能區的ATP結合位點,抑制其激酶活性從而阻斷癌細胞增殖、轉移等相關信號傳導通路,已成為肺癌治療研究中的熱點。國外上市的EGFR-TKI包括吉非替尼和厄洛替尼,其主要適應癥為二線或三線用于其它抗癌藥物治療失敗的晚期NSCLC患者和用于EGFR基因突變的NSCLC患者的一線治療。鹽酸埃克替尼是我國自主設計、合成、篩選出的具有自主知識產權的EGFR-TKI。大量臨床前及臨床數據表明埃克替尼能夠明顯抑制腫瘤細胞的生長,且毒副作用較易瑞沙、特羅凱明顯減少。
EGFR基因敏感突變是EGFR-TKI分子靶向治療發揮療效的關鍵預測因素。常見敏感突變主要有G719X、Exon19 deletions、L858R、L861Q、S768I突變,耐藥突變包括單獨的T790M突變和外顯子20插入突變等。人肺腺癌細胞系PC-9經ADx-ARMS法檢測提示存在exon19 deletion突變,其余exon 18(G719X)、exon 20(S768I、Insertion、T790M)、exon 21(L858R、L861Q)突變陰性,是對EGFR-TKI敏感的細胞系。本研究提示低濃度的鹽酸埃克替尼就能明顯抑制PC-9細胞的生長,其72 h IC50為80 nmol/L。既往研究表明吉非替尼72 h IC50接近50 nmol/L[5-6]。由此可見,埃克替尼IC50較吉非替尼IC50相近,是一種對NSCLC有治療潛力的藥物。
比較蛋白質組學技術已廣泛應用于腫瘤發病機制、早期診斷及治療的各個方面。目前對鹽酸埃克替尼的研究多集中在PI3K/AKT、Ras/Raf/MEK/MAPK、JAK/STAT3信號通路方面,其它作用機制尚不明確。PC-9細胞系存在EGFR酪氨酸激酶區19外顯子突變(E746-A750缺失),是目前對EGFR突變與肺癌的分子機制研究采用的主要細胞系之一。我們應用比較蛋白質組學方法,通過比較埃克替尼作用前后PC-9細胞蛋白差異表達的變化,發現了16種蛋白。根據功能,這些蛋白可分為代謝酶類、細胞骨架類、分子伴侶、信號傳導分子、轉錄及翻譯相關蛋白。
細胞結構的完整性和機械穩定性依賴于細胞骨架蛋白家族的維系。該蛋白家族包括微絲、中間絲及微管蛋白。角蛋白是中間絲家族的主要成員,表達于正常上皮細胞、部分非上皮細胞及上皮源性惡性腫瘤中。CK可分為Ⅰ型CK(酸性細胞角蛋白,CK9-20)和Ⅱ型(堿性細胞角蛋白,CK1-8),其結構由頭、桿、尾三部分組成,桿部位于中間,其始端、末端均為高保守序列。所有上皮細胞至少表達一種Ⅰ型和一種Ⅱ型角蛋白單體(CK19例外),以獨特的成對方式存在于真核細胞,并具有組織特異性。在腫瘤發生和轉移時,腫瘤細胞多保留起源細胞的CK類型,對上皮組織的定性具有獨特意義。細胞角蛋白在骨髓、血液及淋巴結中不表達,因此,被認為是檢測循環癌細胞的敏感標記物[7],其中細胞角蛋白19片段已廣泛應用于NSCLC的診斷及預后判斷。既往研究表明CK7、CK8、CK20、CK18、CK19等與腫瘤發生、發展密切相關,而并未發現CK9與人類惡性腫瘤的特殊關聯[8]。在本研究中,我們發現CK9在埃克替尼處理后的人肺腺癌細胞系PC-9中表達呈下調狀態。另外,Fu等[9]應用差異蛋白質組學方法進行肝癌患者血清篩查時發現CK9在肝內轉移的肝癌組血清CK9的表達水平也是上調的,提示CK9可能參與了埃克替尼抑制腫瘤細胞生長的過程。
自從1920年Warburg[10]發現腫瘤細胞即使在正常的氧氣供應情況下,糖酵解依然增加并伴隨大量乳酸生成,線粒體呼吸大幅減少這一現象后,人們普遍意識到代謝途經改變是細胞惡性轉化必不可少的因素之一。研究證實脯氨酸代謝與血脯氨酸過多癥、精神分裂癥、皮膚松弛癥及腫瘤有密切聯系。在后者中,腫瘤細胞傾向于依賴脯氨酸的生物合成,其主要合成途經有兩條:一條途徑為以谷氨酸為底物合成脯氨酸,另一條途徑為以鳥氨酸為底物合成脯氨酸。谷氨酸在吡咯琳合成酶作用下生成吡咯琳-5-羧酸,然后在PYCR作用下還原為脯氨酸。鳥氨酸在鳥氨酸轉氨酶(ornithine aminotransferase, OAT)、PYCR作用下還原為脯氨酸。人類PYCR有三種同工酶:PYCR1位于染色體17q25.3;PYCR2定位于1q42.12;PYCRL基因定位于8q24.3。目前已證實PYCR在原發性及轉移性肺腫瘤中明顯升高[11],PYCR1參與乳腺腫瘤的發生,而對PYCR2、PYCRL的研究較少[12]。De Ingeniis等[13]通過13C同位素標記對黑素瘤細胞進行觀察,首次提出PYCR1、PYCR2主要存在于線粒體中,介導谷氨酸轉化為脯氨酸,而PYCRL存在于胞質中,參與鳥氨酸轉化為脯氨酸的過程。
G蛋白作為一種信號蛋白,實質是一種GTP水解酶,可根據其為單體還是多聚體分為異三聚體G蛋白和小G蛋白[14]。異三聚體G蛋白由α、β、γ亞基組成,β、γ亞基以二聚體形式錨鏈于細胞質膜上,其可結合或解離α亞基。當α亞基結合GTP后,其構象發生改變,從二聚體上解離下來,與下游效應分子結合,從而控制相關信號通路。真核生物的小G蛋白是單體蛋白分子,又可以分為5個家族:Ras、Rab,Rho,Arf和Ran。Ran是小G蛋白的一個亞族,具有GTP水解酶活性,分子量約為(20~30)×103,與其它小G蛋白一樣,在信號傳導通路中起“分子開關”的作用。Ran蛋白活性主要受Ran鳥苷酸交換因子(Ran guanine exchang factor, RanGEF)RCC1、Ran結合蛋白(Ran binding proteins, RanBPs)、RanGTPase激活蛋白(RanGTPase activator protein, RanGAP)調控。RANBP1位于細胞質中,它可以抑制RCC1活性,間接促進RanGTP水解為RanGDP的過程,在細胞的核質運輸、紡錘體組裝、細胞周期、控制有絲分裂和有絲分裂后的核重組中有一定的調節作用[15]。
抑微管裝配蛋白(Stathmin 1, STMN1),又被稱為p17, p18, p19, 19K, 腫瘤蛋白18(oncoprotein18, Op18)及LAP18,是一種分子量為19kDa,存在于細胞質中的微管不穩定蛋白。它主要調節微管聚合、解聚的動態過程,促使微管在細胞周期的間期及有絲分裂后期解聚。在細胞周期進展的不同階段Stathmin通過自身磷酸化水平調節細胞微管系統的動力學平衡,并以此改變細胞的增殖、分化、活性等生物學行為[16]。研究發現,Stathmin為多種細胞信號傳導通路的中繼站,在人類肺癌、急性白血病、前列腺癌、乳腺癌等惡性腫瘤均可檢測到Stathmin的高表達[17-21]。另外,其mRNA的高表達水平亦與紫杉醇、長春瑞濱耐藥性密切相關[22]。由此可見,stathmin有望成為治療惡性腫瘤的新藥物作用靶點[23]。
NM23基因(non-metastatic 23,也稱為NME基因)是人類發現的第一個抑制腫瘤轉移的基因,其表達與多種腫瘤轉移潛能病理學指標、淋巴結浸潤及不良預后密切相關[24]。目前已發現NME基因家族中有10個成員,根據基因組結構及磷酸轉移酶活性不同可分為兩組:Ⅰ組和Ⅱ組,Ⅰ組主要包括NME1,NME2,NME3,NME4基因(亦即NM23-H1~H4),這些基因具有較高的同源性,分別編碼具有二磷酸核苷激酶(nucleoside diphosphate kinase, NDK)活性蛋白NDPK-A~D;Ⅱ組成員為NME5、NME6、NME7、NME8、NME9基因,編碼不具有或具有較低NDPK活性的蛋白質。其中NME10的分組目前仍頗受爭議[25]。在NME10個家族成員中,NME1、NME2亞型與腫瘤發展、轉移相關性最為密切。另有相關研究表明,NME1、NME2與肺癌轉移呈負相關[26]。
G3BP是一個在真核生物進化過程中高度保守的RasGAP(ras GTPase-activating protein) 結合蛋白[27]。它是由3.3kb的mRNA編碼,分子量為68×103的蛋白質,主要定位于細胞質中。寧鈞宇等[28]通過原核表達G3BP蛋白誘導免疫制備抗G3BP單克隆抗體,應用ELISA、蛋白免疫印跡、免疫組化等方法進行抗體鑒定和腫瘤檢測,發現在結腸癌、肺癌、胃癌、乳腺癌組織中,G3BP均明顯表達。另外還發現,G3BP2的過表達在原位癌形成的早期就已經出現[29];G3BP可通過與p53 C-端結合,致使p53不能形成多聚體,阻礙p53活性位點的轉錄后修飾,影響其活性,導致p53不能發揮正常功能[27];G3BP與抑癌基因PTEN的表達量相反,G3BP高表達引起的PTEN表達下調可能是腫瘤發生的機制之一[30]。已有研究表明G3BP N-端單克隆抗體具有良好的抗腫瘤效應。由此可見,G3BP與腫瘤的發生、發展、侵潤及轉移等關系密切,G3BP有望成為腫瘤治療的新靶點。
泛素(Ubiquitin)是一種高度保守的小蛋白,存在于大多數真核細胞中,其主要功能為標記需要分解掉的蛋白質。參與泛素化過程的酶類主要有三種:泛素激活酶(ubiquitin-activating enzymes, E1s)、泛素結合酶(ubiquitin-conjugating enzymes, E2s)、泛素蛋白連接酶(ubiquitin-protein ligases, E3s)。泛素通過三種酶相互作用與目標蛋白結合,引起靶蛋白的降解。在惡性腫瘤中,泛素-蛋白酶體途經發生異常是細胞獲得無限增殖性及永生性的重要原因,一些癌基因產物、腫瘤抑制因子p53、細胞周期蛋白等均通過此途經降解[31]。本研究顯示UBE2D3在埃克替尼作用后PC-9細胞中下調,說明埃克替尼可能通過UBE2D3促進肺腺癌細胞凋亡、抑制其增殖。
微管是真核生物細胞骨架的重要組成成分,由α、β微管蛋白異源二聚體及微管輔助蛋白組成,參與維持細胞形態、有絲分裂、染色體分離、細胞內物質轉運等過程,其不斷延伸和縮短的特有動力學,在細胞有絲分裂和染色體分離中起關鍵的作用[32]。當微管蛋白與紫杉醇、長春瑞濱、多西他賽結合后,微管動力學受到影響,使有絲分裂的紡錘體形成障礙,并啟動細胞固有死亡程序,從而抑制腫瘤的生長。TUBA1A亞型2是由TUBA1A基因的轉錄變體3翻譯合成的。目前關于NSCLC與微管蛋白的研究較多的為βⅢ-tubulin,a-tubulin研究較少。Chen等[33]應用免疫組織化學法對158例原發NSCLC和30例癌旁組織中的微管蛋白α進行檢測,發現微管蛋白α的表達率高達65.2%,而癌旁組織未見表達。另外,在腫瘤進展期,其表達量亦逐漸增加,在Ⅲ-Ⅳ期肺癌患者和低分化腫瘤中明顯升高。在體外研究中發現a-tubulin表達參與紫杉醇耐藥機制。Han等[34]對紫杉醇耐藥的H460/T800細胞系進行觀察,發現降低a-tubulin的表達能夠明顯增強細胞系對紫杉醇等抗紡錘體藥物的敏感性。由此可見a-tubulin是影響化療耐藥的因素之一。
維甲酸(retinoic acid, RA)或全反式維甲酸(all-trans retinoic acid, atRA)是人體內重要的具有“激素樣”生理功能的物質,它是維持胚胎發育中器官及正常結構形成的重要物質,并在抑制細胞生長、增殖,誘導細胞分化、凋亡及調節免疫等方面具有廣泛的生物學效應。維甲酸受體目前認為主要有兩種:RAR和RXR,其作用機制主要通過與核內受體結合影響轉錄來實現。動物實驗研究中發現在致癌因素作用下,維甲類能夠阻止動物模型皮膚、口腔、肺、膀胱腫瘤的發生[35-38]。另外,大量實驗及臨床研究亦發現維甲酸可阻止或逆轉人類細胞、組織的惡性轉化,如血液系統惡性腫瘤及肝臟、皮膚、肺臟、乳腺等原位癌[39-40]。維生素A也稱為視黃醇,經過兩步生物化學反應生成維甲酸,其中視黃醇脫氫酶為限速酶,顯示出較強的視黃醇氧化和視黃醛還原活性。本實驗中,視黃醇脫氫酶明顯下調。綜上所述,維甲酸及視黃醇脫氫酶可能成為極具潛力的靶標。
熱休克蛋白(heat shock proteins, HSPs),是一類分布廣泛的在進化過程中高度保守的蛋白質,它在細胞新陳代謝、免疫過程、細胞周期調節、轉錄激活及信號傳導等方面發揮重要作用。根據分子量大小,HSPs被分為6個主要家族:HSP100、HSP90、HSP70、HSP60、HSP40和小分子HSPs(如HSP27)[41]。已經證實HSP27、HSP70、HSP90均參與了腫瘤的發生、發展。HSP40/DNAJ家族共有41種蛋白質,分布在細胞內不同的位置,可分為DNAJA、DNAJB、DNAJC亞族,大部分成員含有保守的J結構域,能夠與抗凋亡分子伴侶HSP70結合,調節ATP酶活性,從而參與蛋白的翻譯、折疊、異位等過程。目前對其研究仍較少,生理功能仍不明確,在既往研究中表明HSP40可通過泛素途經調節角蛋白數量[42];少數成員與腫瘤進展及轉移相關,如DNAJB4(HLJ1)、DNAJA3(Tid1)、DNAJB6(MRJ)、DNAJC12(JDP1)、DNAJA1(HDJ2)[43]。本研究中DNAJB1在埃克替尼作用的肺腺癌細胞系PC-9中下調2.04倍。我們推測DNAJB1可能同其它熱休克蛋白一樣,參與了腫瘤的發生、發展。
應用生物信息學方法對NME1-NME2、STMN1、G3BP1三種蛋白進行分析,初步了解了它們的跨膜結構域、理化性質、亞細胞定位等生物學特征。NME1-NME2和stathmin亞型α均存在跨膜結構域,而G3BP1和stathmin亞型β無跨膜結構域,說明NME1-NME2、stathmin亞基α具有錨鏈于膜上的能力。結構域分析顯示NME1-NME2具有兩個核苷二磷酸激酶(NDK)序列,它催化二磷酸核苷向三磷酸核苷的轉化,在信號傳導等方面發揮重要作用;stathmin亞型α、β均含有一個stathmin樣結構域,主要參與微管的解聚活性,可調控細胞周期;G3BP1具有核轉運因子2結構域(nuclear transport factor 2, NTF2)和RNA識別基序的結構域(RRM),在真核生物基因表達調控中發揮重要作用。亞細胞定位分析提示NME1-NME2主要存在于細胞質中,推測可能參與了胞質內信號過程;STMN1主要存在于細胞質和細胞骨架中,與其調節微管系統的動力學功能相吻合;G3BP1分布廣泛,主要存在于細胞質中,與Ras-GTPase激活蛋白結合活化Ras通路;STRING庫預測所得與NME1-NME2相互作用蛋白得分高的主要有KCNN4、CCND1、PAPD4、ACLY、MYC、CNOT8、HSP72、NME1、EEF1A1,另外,NME1-NME2可能與STAT3通路有一定的關聯;與STMN1蛋白相互作用密切的有AURKB、MAPK3、MAPK13、CDK1、TP53、MAPK1、CAMK2B、CAMK2G、NACA、ADCYAP1,可見其參與MAKP信號通路、細胞周期調控,并與TP53密切相關,相關研究表明p53可能是通過調節STMN1的表達,將細胞周期阻滯于G2/M期[44];與G3BP1蛋白相互作用密切的主要有CAPRIN1、USP10、EIF4G1、RASA1、CSK、HDAC6、OGFOD1、PRMT1、STYXL1、ALPP,是ras信號轉導通路中的一個重要元素,參與腫瘤進展和轉移過程[45]。
綜上所述,本研究首次應用蛋白質組學方法研究了EGFR-TKI類藥物的作用機制,目前尚未見相關報道。應用2-DE/MALDI-MS方法對埃克替尼作用前后的PC-9細胞進行了比較蛋白質組學研究,初步鑒定了16種蛋白質,這些蛋白質與埃克替尼作用機制密切相關,部分有可能成為新的分子治療靶點。
參考文獻
1錢桂生. 肺癌不同病理類型發病率的變化情況及原因[J/CD]. 中華肺部疾病雜志:電子版,2011,4(1):1-6.
2Torre A, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
3Ciardiello F, Tortora G. A novel approach in the treatment of cancer:
targeting the epidermal growth factor receptor[J]. Clin Cancer Res, 2001, 7 (10): 2958-2970.
4Guan YS, He Q, Li M. Icotinib: activity and clinical application in Chinese patients with lung cancer[J]. Expert Opin Pharmacother, 2014, 15(5): 717-728.
5鄭靜嫻, 張為民, 謝波, 等. 多西他賽與吉非替尼不同時序應用對人肺腺癌細胞的作用[J]. 臨床腫瘤學雜志, 2012, 17(5): 385-391.
6Xuan X, An C, Zhou C. The mechanism of gefitinib resistance induced by hepatocyte growth factor in sensitive non-small cell lung cancer cells in vitro[J]. Zhongguo Fei Ai Za Zhi, 2013, 16(1): 1-6.
7Moll R, Franke WW, Schiller DL, et al. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cultured cells[J]. Cell, 1982, 31(1): 11-24.
8侯秀麗. 細胞角蛋白與腫瘤的關系[J]. 國際腫瘤學雜志,2009,36 (11):4.
9Fu BS, Liu W, Zhang JW, et al. [Serum proteomic analysis on metastasis-associated proteins of hepatocellular carcinoma][J]. Nan Fang Yi Ke Da Xue Xue Bao, 2009, 29 (9): 1775-1778.
10Warburg O. On respiratory impairment in cancer cells[J]. Science, 1956, 124(3215): 269-270.
11Greengard O, Herzfeld A. The undifferentiated enzymic composition of human fetal lung and pulmonary tumors[J]. Cancer Res, 1977, 37(3): 884-891.
12Possemato R, Marks KM, Shaul YD, et al. Functional genomics reveal that the serine synthesis pathway is essential in breast cancer[J]. Nature, 2011, 476(7360): 346-350.
13De Ingeniis J, Ratnikov B, Richardson AD, et al. Functional specialization
in proline biosynthesis of melanoma[J]. PLoS One, 2012, 7(9): e45190.
14Hepler JR, Gilman AG. G proteins[J]. Trends Biochem Sci, 1992,
17(10): 383-387.
15曾曉, 孫露霜, 楊立琳, 等. Ran調節因子RanBP1的生物學作用[J]. 東北農業大學學報,2010,41(3):150-153.
16Mistry SJ, Atweh GF. Role of stathmin in the regulation of the mitotic spindle: potential applications in cancer therapy[J]. Mt Sinai J Med, 2002, 69(5): 299-304.
17Curmi PA, Nogues C, Lachkar S, et al. Overexpression of stathmin in breast carcinomas points out to highly proliferative tumours[J]. Br J Cancer, 2000, 82(1): 142-150.
18Ocak S, Friedman DB, Chen H, et al. Discovery of new membrane-associated proteins overexpressed in small cell lung cancer[J]. J Thorac Oncol, 2014, 9(3): 324-336.
19Machado-Neto JA, de Melo Campos P, Favaro P, et al. Stathmin1 is involved in the highly proliferative phenotype of high-risk myelodysplastic syndromes and acute leukemia cells[J]. Leuk Res, 2014, 38(2): 251-257.
20Sabherwal Y, Mahajan N, Helseth DL, et al. PDEF downregulates stathmin expression in prostate cancer[J]. Int J Oncol, 2012, 40(6): 1889-1899.
21Brattsand G. Correlation of oncoprotein 18/stathmin expression in human breast cancer with established prognostic factors[J]. Br J Cancer, 2000, 83(3): 311-318.
22Seve P, Dumontet C. Chemoresistance in non-small cell lung cancer[J]. Curr Med Chem Anticancer Agents, 2005, 5(1): 73-88.
23Rana S, Maples PB, Senzer N, et al. Stathmin1: a novel therapeutic
target for anticancer activity[J]. Expert Rev Anticancer Ther, 2008, 8(9): 1461-1470.
24Li Y, Tong Y, Wong YH. Regulatory functions of Nm23-H2 in tumorigenesis: insights from biochemical to clinical perspectives[J]. Naunyn Schmiedebergs Arch Pharmacol, 2015, 388(2): 243-256.
25Desvignes T, Pontarotti P, Fauvel C, et al. Nme protein family evolutionary history, a vertebrate perspective[J]. BMC Evol Biol, 2009, 9: 256.
26Salerno M, Ouatas T, Palmieri D, et al. Inhibition of signal transduction
by the nm23 metastasis suppressor: possible mechanisms[J]. Clin Exp Metastasis, 2003, 20(1): 3-10.
27張浩, 邵榮光. G3bp:一個潛在的腫瘤治療靶點[J]. 藥學學報,2010,45(8):945-951.
28寧鈞宇, 由江峰, 裴斐, 等. G3bp單克隆抗體制備及g3bp在腫瘤組織中表達的檢測[J].中國病理學雜志,2005,34(4):5.
29French J, Stirling R, Walsh M, et al. The expression of Ras-GTPase activating protein SH3 domain-binding proteins, G3BPs, in human breast cancers[J]. Histochem J, 2002, 34(5): 223-231.
30Huang Y, Wernyj RP, Norton DD, et al. Modulation of specific protein expression levels by PTEN: identification of AKAP121, DHFR, G3BP, Rap1, and RCC1 as potential targets of PTEN[J]. Oncogene, 2005, 24(23): 3819-3829.
31Popovic D, Vucic D, Dikic I. Ubiquitination in disease pathogenesis
and treatment[J]. Nat Med, 2014, 20(11): 1242-1253.
32Margolis RL, Wilson L. Opposite end assembly and disassembly of microtubules at steady state in vitro[J]. Cell, 1978, 13(1): 1-8.
33Chen QY, Jiang ZY, Wu LJ, et al. [Expression of alpha-tubulin and MDR1 and their correlation with the biological features of non-small cell lung carcinoma][J]. Zhonghua Zhong Liu Za Zhi, 2010, 32(4): 278-282.
34Han EK, Gehrke L, Tahir SK, et al. Modulation of drug resistance by alpha-tubulin in paclitaxel-resistant human lung cancer cell lines[J]. Eur J Cancer, 2000, 36(12): 1565-1571.
35Winslow S, Leandersson K, Larsson C. Regulation of PMP22 mRNA
by G3BP1 affects cell proliferation in breast cancer cells[J]. Mol Cancer, 2014, 12(1): 156.
36Wang Y, Wen W, Yi Y, et al. Preventive effects of bexarotene and budesonide in a genetically engineered mouse model of small cell lung cancer[J]. Cancer Prev Res (Phila), 2009, 2(12): 1059-1064.
37Shah RK, Valdez TA, Wang Z, et al. Pulsed-dye laser and retinoic acid delay progression of oral squamous cell carcinoma: a murine model[J]. Laryngoscope, 2001, 111(7): 1203-1208.
38Moon RC, Kelloff GJ, Detrisac CJ, et al. Chemoprevention of OH-BBN-induced bladder cancer in mice by oltipraz, alone and in combination with 4-HPR and DFMO[J]. Anticancer Res, 1994, 14(1A): 5-11.
39Okuno M, Kojima S, Matsushima-Nishiwaki R, et al. Retinoids in cancer chemoprevention[J]. Curr Cancer Drug Targets, 2004, 4(3): 285-298.
40Edelman MJ, Smith R, Hausner P, et al. Phase Ⅱ trial of the novel retinoid, bexarotene, and gemcitabine plus carboplatin in advanced non-small-cell lung cancer[J]. J Clin Oncol, 2005, 23(24): 5774-5778.
41Kampinga HH. Chaperones in preventing protein denaturation in living
cells and protecting against cellular stress[J]. Handb Exp Pharmacol, 2006, (172): 1-42.
42Yamazaki S, Uchiumi A, Katagata Y. Hsp40 regulates the amount of keratin proteins via ubiquitin-proteasome pathway in cultured human cells[J]. Int J Mol Med, 2012, 29(2): 165-168.
43Mitra A, Shevde LA, Samant RS. Multi-faceted role of HSP40 in cancer[J]. Clin Exp Metastasis, 2009, 26(6): 559-567.
44Lu Y, Liu C, Cheng H, et al. Stathmin, interacting with NF-κ B, promotes tumor growth and predicts poor prognosis of pancreatic cancer[J]. Curr Mol Med, 2014, 14(3): 328-339.
45Giehl K. Oncogenic Ras in tumour progression and metastasis[J]. Biol Chem, 2005, 386 (3):193-205.
(本文編輯:黃紅稷)
劉曉麗,李維,孟夏,等. 鹽酸埃克替尼對人肺腺癌細胞系PC-9作用的比較蛋白質組學研究[J/CD]. 中華肺部疾病雜志: 電子版, 2015, 8(6): 674-683.
Comparative proteomics on mechanisms of lung adenocarcinoma cell line PC-9 induced by icotinib
LiuXiaoli,LiWei,MengXia,ZhangYuping,MingZhongjuan,Shihongyan,ShiJie,ZhongYnjie,WangWei,YangShanying.DepartmentofRespiratoryMedicine,theSecondAffiliatedHospital,MedicalSchoolofXi′anJiaotongUniversity,Xi′an710004,China
Correspondingauthor:YangShanying,Email:yangshuanying66@163.com
【Abstract】ObjectiveTo analyze icotinib-associated proteins of PC-9 cell with comparative proteomics and bioinformatics technique to discuss molecule mechanism of icotinib. MethodsAmoy Dx and real-time PCR were used to detect the EGFR mutation in PC-9 cells gene. MTT was used to investigate theproliferationinhibition oficotinibon PC-9 cells. Two dimensional gel electrophoresis (2-DE) was used to separate totally soluble proteins extracted from PC-9 cells either exposed to or not exposed to icotinib, and differentially expressed proteins were analyzed and identified by matrix-assisted laser desorption/ionization time of flight mass spectrometry (MALDI-TOF-MS). Proteins were identified by blasting NCBI or SWISS PORT database with Mascot software. ResultsThere was a deletion mutation located in exon 19.In the 10-4-10-9M concentration range,icotiib significantly concentration-dependent inhibited the growth of the PC-9 cells. 56 differentially expressed protein spots(Ratio≥1.5)were found. We finally selected 29 obviously differential protein spots (Ratio≥1.7) to analyze by MALDI-TOF-TOF-MS and got 16 proteins successfully. They can be classified into 5 categories based on their functions: enzymes related to cell metabolism, cytoskeleton proteins, signal transduction molecules, chaperone, proteins related to transcription and translation. Conclusions16 icotinib-related proteins are identified by comparative proteomics. These proteins may be associated with anti-tumor mechanism of icotinib and some of them may become potential drug targets.
【Key words】PC-9 cell;Icotinib;Lung cancer;Comparative proteomics;Bioinformatics
(收稿日期:2015-11-06)
中圖法分類號:R563,R743
文獻標識碼:A
通訊作者:楊拴盈,Email: yangshuanying66@163.com
基金項目:國家自然科學基金資助(81172234)
作者單位: 710004 陜西,西安交通大學第二附屬醫院呼吸內科
DOI:10.3877/cma.j.issn.1674-6902.2015.06.002

