辣根過氧化物酶標記JWA抗體及其在免疫檢測反應中的應用*
李愛萍,朱麗雯,張 娟,周建偉**
1南京醫科大學公共衛生學院,南京 211166;2南京博天科智生物技術有限公司,南京 211100
辣根過氧化物酶標記JWA抗體及其在免疫檢測反應中的應用*
李愛萍1,朱麗雯1,張 娟2,周建偉1**
1南京醫科大學公共衛生學院,南京 211166;2南京博天科智生物技術有限公司,南京 211100
目的:運用辣根過氧化物酶標記JWA單克隆抗體,并且將標記的抗體應用于ELISA法和Western blot等免疫檢測反應中。方法:運用高碘酸鹽-四氫硼化鈉氧化還原體系活化辣根過氧化物酶,活化的辣根過氧化物酶按1∶1標記JWA單克隆抗體;將HRP標記的抗體分別運用直接和雙夾心ELISA測試;同時將標記單克隆抗體運用于Western blot檢測。結果:辣根過氧化物酶成功標記JWA單克隆抗體。其中HRP-JWA(4C9)抗體在直接法ELISA試驗中和多肽的結合能力高于HRP-JWA(7C3);其在450 nm處的最大吸光度值為0.96。雙夾心ELISA實驗中,預先包被JWA(4C9)單抗,檢測抗體使用HRP-JWA(7C3)可以得到較好的實驗結果,在450 nm處的最大吸光度值為1.30。在Western blot實驗HRP-JWA抗體濃度1.0 μg·mL-1可以檢測出SGC7901細胞中目的蛋白。結論:運用氧化還原方法成功標記JWA單克隆抗體,并可以初步應用于免疫反應的檢測。
JWA抗體;辣根過氧化物酶;ELISA;免疫印跡
JWA是一種新的微管結合蛋白,不僅參與全反式維甲酸(ATRA)誘導的細胞分化調節,而且與多種細胞分化、凋亡誘導劑如佛波酯(TPA)、N-(4羥基苯基)維生素甲酰胺(4HPR)和As2O3等的生物學作用有關,涉及相應的信號通路。JWA可以調節白血病細胞的分化[1-2],還可以通過絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路調節腫瘤(如宮頸癌、乳腺癌、肝癌等)細胞的遷移[3]。JWA還活躍地參與細胞對應激刺激(如冷應激、熱應激和化學物誘導的氧化應激等)的應答[4-5]。氧化應激激活核因子 (nuclear factor 1,NF1)和JWA近端啟動子結合,從而調節JWA的轉錄水平。JWA可以調節堿基切除修復通路中很多蛋白,如正調控 X射線損傷修復交叉互補基因1(X-ray Re-pair Cross Complementing 1,XRCC1)和負調控多聚ADP核糖聚合酶-1[Poly(ADP-ribose)polymerase-1,PARP-1]的表達,從而保護氧化應激誘導的DNA單鏈損傷[6]。對1800例胃癌組織芯片免疫組織化學染色發現,JWA和XRCC1蛋白表達水平與患者生存、預后有很好的相關性[7-8]。由于免疫組織化學染色難以準確定量,而酶聯免疫吸附試驗(ELISA)可以對血液、組織樣本進行高通量快速定量分析。為建立快速檢測組織中JWA表達水平的ELISA方法,本研究基于實驗室已經成功篩選和純化出兩株JWA單克隆抗體[11],運用經典的高碘酸標記抗體技術[12]獲得可以用于ELISA檢測的HRP標記的JWA抗體。初步完成運用標記JWA單抗進行直接和雙夾心ELISA試驗的方法。
1 材料和方法
1.1 實驗材料
用前期篩選建立的、能分泌JWA特異性單克隆抗體的兩種雜交瘤細胞株,分別經小鼠腹腔注射,產生腹水后將收集的腹水經親和層析法分離純化,獲得JWA單抗:JWA(4C9)和JWA(7C3)。
SGC7901細胞株購自中科院上海細胞庫;辣根過氧化物酶 (HRP,Sigma公司);JWA多肽(DR-FARPDFRDISK)委托吉爾生化(上海)有限公司合成;透析袋直徑37 mm(Spectrum Lab公司);96孔高吸附酶標板 (Corning公司);紫外-熒光酶標儀(TECAN公司)。其他化學試劑均為國產分析純。
1.2 實驗方法
1.2.1 辣根過氧化物酶標記JWA單克隆抗體
1.2.1.1 JWA抗體透析脫鹽:將透析袋用雙蒸水或0.05 mol·L-1碳酸鹽(pH 7.3)透析液煮沸10 min。蒸餾水沖洗后,雙蒸水洗凈。取1 mg抗體溶于1 mL的PBS緩沖液,加入透析袋中,兩端扎緊,透析袋放入0.05 mol·L-1碳酸鹽(pH 7.3)透析液中,4℃,透析過夜,中途換液3次,以充分確保抗體中鹽脫去。1.2.1.2 辣根過氧化物酶的活化:稱取5 mg辣根過氧化物酶溶于1 mL雙蒸水中,溶液呈淺棕黃色。在上述溶液中加入1 mL新鮮配制的13 mg·mL-1的高碘酸溶液,4℃,避光混合30 min,活化的HRP溶液呈現淺綠色。取9 μL的乙二醇加入1 mL雙蒸水中混勻。在活化的HRP溶液中加入0.5 mL乙二醇混勻,室溫避光放置30 min,此時溶液呈現棕色。
1.2.1.3 標記JWA單克隆抗體:按照酶∶抗體(1∶1)在1 mL抗體中加入等體積1 mg·mL-1辣根過氧化物酶,將此混合物加入透析袋中,在0.05 mol·L-1的碳酸鹽透析液中,4℃透析過夜,中途換液3次。次日,加入0.1 mL新鮮配制的4 mg·mL-1NaBH4。室溫,靜置4 h。
1.2.1.4 標記后的抗體脫鹽:將上述液體裝入透析液袋中,4℃透析過夜。在透析好的抗體溶液中逐滴滴加等體積的飽和硫酸銨,4℃,靜置1 h,4℃,5000 r· min-1離心30 min。棄上清液,沉淀溶于1 mL的PBS緩沖液中,將上述溶液裝入透析袋中透析過夜。即得到標記好的JWA單克隆抗體。
1.2.2 直接ELISA法檢測HRP標記的JWA抗體和抗原的結合能力 用PBS將JWA多肽稀釋成1 μg·mL-1,按照每孔加入100 μL至96孔酶標板中。37℃孵育2 h。甩去孔內液體,用PBS洗3次,250 μL/孔,拍干。分別將HRP標記JWA單克隆抗體HRP-JWA(4C9)和HRP-JWA(7C3)用0.5%BSA的PBS稀釋成0、0.2、0.4、0.8、1.6、3.2 μg·mL-1,每孔加入100 μL,每個濃度3平行,37℃孵育1 h。甩去孔內液體,用PBS洗3次,拍干。預熱TMB底物于室溫,同時開啟酶標儀預熱。每孔加入四甲基聯苯胺(TMB)底物A(將TMB粉溶于DMSO中,使終濃度為11 mg·mL-1,再加入1/10體積的甘油)、B液(pH 5.5,0.2 mol·L-1磷酸氫二鈉與0.1 mol·L-1檸檬酸緩沖液配制過氧化脲素濃度為0.74 mg·mL-1)各加50 μL,37℃顯色20 min,發現孔變成藍色后加入終止液(1 mol·L-1硫酸)50 μL,此時藍色變為淺黃色。運用酶標儀在450 nm處讀取吸光度值。
1.2.3 雙夾心法檢測單克隆抗體的結合能力 分別按 0、0.125、0.25、0.5、1.0、2.0 μg·mL-1運用 PBS稀釋單克隆抗體JWA-4C9和JWA-7C3,在96孔酶標板中每孔分別包被100 μL上述抗體,每個濃度3平行。4℃過夜。次日,甩去孔內液體,用PBS洗3次,拍干。每孔包被1 μg·mL-1JWA多肽100 μL,37℃、孵育2 h。甩去孔內液體,用PBS洗3次,每次5 min,拍干。運用HRP標記的1 μg·mL-1JWA抗體37℃孵育1 h(包被JWA-4C9抗體的酶標板,應用HRP-JWA7C3孵育檢測;包被JWA-7C3抗體,應用HRP-JWA4C9孵育檢測)。甩去孔內液體,用PBS洗3次,每次5 min,拍干。預熱TMB底物至室溫,同時開啟酶標儀預熱。每孔加入TMB底物A、B各加50 μL。37℃,顯色20 min,發現變成藍色后加入終止液50 μL/孔,運用用酶標儀在450 nm處讀取吸光度值。
1.2.4 HRP標記的JWA抗體在Western blot技術中直接檢測JWA蛋白在胃癌細胞SGC7901中表達
制備12.5%的SDS-PAGE分離膠。裂解、離心后收取SGC7901全蛋白。分別按照50 μg/孔的上樣量上樣。90 V穩壓電泳后,運用200 mA恒流半干式電轉移1 h。封閉液于室溫封閉1 h,PBST(0.5%tween PBS)洗滌5次,每次5 min。加入1∶1000稀釋的HRP-JWA抗體,4℃孵育過夜。PBST洗滌5次。增強型化學發光法(ECL)檢測目的條帶。
2 結 果
2.1 辣根過氧化物酶標記JWA單克隆抗體
辣根過氧化物酶經過高碘酸活化、乙二醇還原反應后,可以觀察到辣根過氧化物酶水溶液的顏色由原來的棕黃色變成淺綠色,再變為棕黃色。見圖1。這個顏色的明顯變化過程說明酶活化是成功的。在JWA單克隆抗體分別和活化的辣根過氧化物酶等比例結合,并經過NaBH4還原反應后,原來的淺綠色溶液又變成棕黃色。再經過飽和硫酸銨沉淀、離心,獲得棕色沉淀,初步得到了HRP標記的JWA抗體沉淀,該沉淀經過PBS緩沖液溶解、透析、脫鹽。最終得到HRP標記的JWA單克隆抗體。分裝后-20℃保存備用。
2.2 直接ELISA法檢測HRP標記的JWA抗體和抗原的結合能力
在酶標板中包被1 μg·mL-1JWA多肽100 μL,運用HRP-標記的JWA單抗結合、洗脫,經過TMB染色和終止液終止顯色后,在酶標儀450 nm吸光度值顯示。兩種標記的抗體均可以和JWA多肽反應。但是,HRP-JWA(4C9)吸光度值的變化趨勢比HRP-JWA(7C3)更明顯,在0.4~1.6 μg·mL-1濃度范圍變化最明顯。在3.2 μg·mL-1濃度時吸光度為0.96。HRP-JWA(7C3)在吸光度在其濃度范圍0~0.8 μg·mL-1變化最明顯。在濃度大于0.8 μg·mL-1,吸光度為0.40后出現平臺,不再隨著標記抗體濃度的增加而升高。因此,結果顯示HRP-JWA(4C9)和JWA多肽的結合能力更強。也顯示JWA多肽與兩種JWA單抗的結合力有差異。見圖2。

圖1 辣根過氧化物酶的氧化還原活化過程
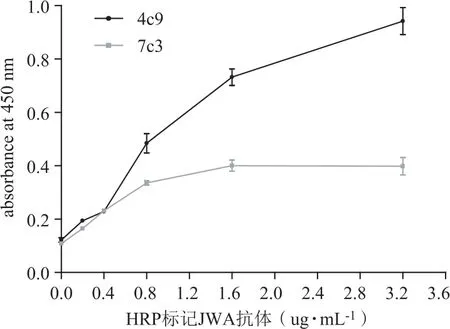
圖2 直接法檢測單克隆抗體和抗原的結合能力
2.3 雙夾心法檢測單克隆抗體的結合能力
在96孔酶標板中預先包被不同濃度兩種JWA單抗后,結合JWA多肽。再分別運用HRP標記的JWA抗體檢測。圖3結果顯示,預先使用JWA(4C9)單克隆抗體包被,后用HRP-JWA(7C3)檢測有較好的反應曲線(見圖3中黑色曲線)。其中當包被的濃度為0.25~0.5 μg·mL-1范圍有最明顯的變化趨勢,在包被濃度大于1.0 μg·mL-1以后,吸光度值趨于平穩,不再隨著包被濃度的升高而增加。預先包被JWA(4C9)單克隆抗體,吸光度沒有隨著包被濃度的升高而增加(見圖3灰色曲線)。結果提示,可以預先使用JWA(4C9)包被,運用HRP-JWA(7C3)檢測的雙夾心法進行以后的實驗探索。
2.4 HRP標記JWA抗體直接檢測JWA蛋白在胃癌細胞SGC7901中表達
運用Western blot實驗技術對胃癌細胞進行電泳、電轉移后,直接用HRP標記的JWA抗體按1∶1000稀釋后,檢測發現在23 kD位置有一條明顯條帶(見圖4),這和JWA的分子量一致;在更小的約15 kD位置上也有一條條帶,這可能是JWA有相似片段的一個雜蛋白,目前未知。這些結果進一步驗證了用辣根過氧化物酶酶標記的JWA單克隆抗體的檢測效能。
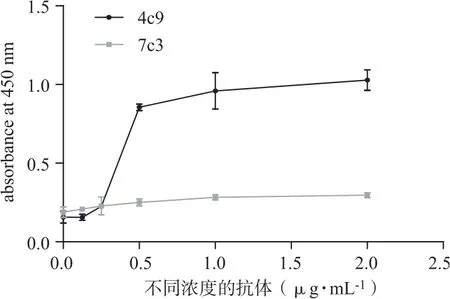
圖3 雙夾心法檢測標記抗體的結合能力
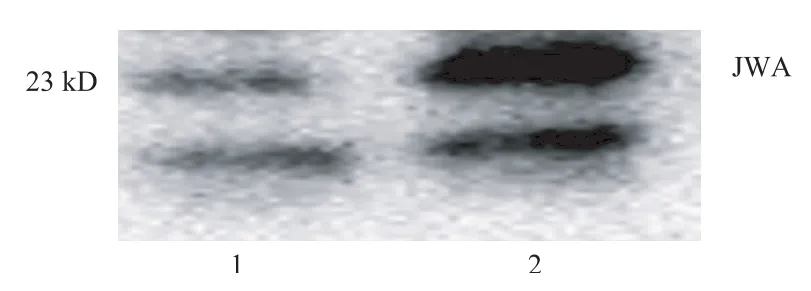
圖4 免疫印跡檢測SGC7901細胞中JWA蛋白表達上樣量:(1)20 μg;(2)50 μg
3 討 論
JWA也稱ADP-核糖基化相關因子6連接蛋白5(ARL6ip5,GenBank:AF070523,1998),是一種新的微管相關蛋白及環境應答蛋白。前期的研究結果發現,JWA-76G/C基因多態性阻礙了其環境應答作用,增大了中國人群患胃癌的風險[13]。回顧性胃癌隊列研究結果也顯示,相對于對應的正常組織,癌中JWA表達明顯降低;癌組織中JWA表達與淋巴結轉移、遠處轉移及TNM分期顯著負相關;癌中JWA低表達預示患者不良的預后,而且是預測胃癌患者預后的獨立危險因素[8]。對于組織樣本中該蛋白的檢測仍然是Western blot和免疫組織化學實驗方法。前兩者實驗技術工作量大,同時受實驗條件限制,每次檢測的樣本有限,難以在臨床研究中得到應用。本實驗首次建立辣根過氧化物酶標記的JWA抗體,并首次建立其直接和雙夾心ELISA實驗方法,為臨床檢測該蛋白進行了有益的探索。
本研究抗體的標記選用過碘酸鈉法,通常標記抗體和HRP的比例為1∶2,但實際操作中很難完全避免HRP的過度交聯,因此本研究中選擇抗體和HRP的比例在1∶1。同時需要注意的是,制備HRP酶標抗體的關鍵在于防止酶的過度醛化而影響其活性及酶的自身交聯,從而導致過度標記[12,14]。由于HRP酶分子中含有鐵葉琳,在酶溶液中加入過碘酸鈉,立即出現灰綠色,加入乙二醇后綠色變成橙黃色,過碘酸氧化乙二醇極為迅速,這樣終止了過碘酸對酶的繼續氧化[14]。
本研究初步完成HRP標記JWA抗體并將它應用于ELISA檢測,還須要進一步完善方法的穩定性和提高其靈敏度。
[1] Huang S,Shen Q,Mao WG,et al.JWA,a novel sig-naling molecule,involved in the induction of differenti-ation of human myeloid leukemia cells[J].Biochem Biophys Res Commun,2006,341(2):440-50.
[2] Huang S,Shen Q,Mao WG,et al.JWA,a novel sig-naling molecule,involved in all-trans retinoic acid in-duced differentiation of HL-60 cells[J].J Biomed Sci, 2006,13(3):357-71.
[3] Chen H,Bai J,Ye J,et al.JWA as a functional molecule to regulate cancer cells migration via MAPK cascades and F-actin cytoskeleton[J].Cell Signal,2007, 19(6):1315-27.
[4] Zhu T,Chen R,Li A,et al.JWA as a novel molecule involved in oxidative stress-associated signal pathway in myelogenous leukemia cells[J].J Toxicol Environ Health A,2006,69(15):1399-411.
[5] Zhu T,Chen R,Li AP,et al.Regulation of a novel cell differentiation-associated gene,JWA during oxida-tive damage in K562 and MCF-7 cells[J].J Biomed Sci,2005,12(1):219-27.
[6] Chen R,Qiu W,Liu Z,et al.Identification of JWA as a novel functional gene responsive to environmental ox-idative stress induced by benzo[a]pyrene and hydrogen peroxide[J].Free Radic Biol Med,2007,42(11):1704-14.
[7] Wang S,Gong Z,Chen R,et al.JWA regulates XR-CC1 and functionsasa novelbase excision repair protein in oxidative-stress-induced DNA single-strand breaks[J].Nucleic Acids Res,2009,37(6):1936-50.
[8] Wang S,Wu X,Chen Y,et al.Prognostic and predic-tive role of JWA and XRCC1 expressions in gastric cancer[J].Clin Cancer Res,2012,18(10):2987-96.
[9] 李紅梅,陳 佳,徐 斐,等.ELISA測定中TMB顯色體系的優化及其穩定性研究[J].生物技術通報,2010,(2):126-30.
[10] 李 萍,馬亞茹,陸 儉,等.Pfs25蛋白單克隆抗體的制備及雙抗體夾心ELISA的建立[J].細胞與分子免疫學雜志,2011,27(12):1330-5.
[11] 李愛萍,陳敏娟,王稀琛,等.小鼠腹水JWA單克隆抗體的制備鑒定[J].藥物生物技術,2014,21(2):111-4.
[12] 徐晶晶,李 迪,曹永生,等.辣根過氧化物酶標記兔抗絲狀噬菌體衣殼蛋白抗體的制備與初步應用 [J].動物保健品,2013,(3):114-6.
[13] Li CP,Zhu YJ,Chen R,et al.Functional polymor-phisms of JWA gene are associated with risk of blad-der cancer[J].J Toxicol Environ Health A,2007,70 (11):876-84.
[14] 駱加里,宋光承,陳彩云,等.過碘酸鈉氧化辣根過氧化物酶 (HRP)中的若干問題及高效果的標記方法[J].
生物化學與生物物理學報,1984,16(6):650-6.
Preparation and Immuno Application of the Monoclonal Antibody of JWA Labeled with Horseradish Peroxidase*
LI Ai-ping1,ZHU Li-wen1,ZHANG Juan2,ZHOU Jian-wei1**
1School of Public Health,Nanjing Medical University,Nanjing 211166;2Nanjing Botianzhike Biotechnical Company,Nanjing 211100
Objective:To label JWA monoclonal antibody with horseradish peroxidase (HRP)and apply it in ELISA and Western blot immune detection.Methods:Using sodium periodate and sodium borohydride redox reaction,HRP was activated;The activated HRP was used to mark JWA monoclonal antibody in tubes;The HRP labeled antibody was respectively applied in direct,sandwich ELISA and Western blot de-tection.Results:HRP was successfully labeled on JWA monoclonal antibodies.In the direct method of ELISA test,HRP-JWA (4c9)antibodies combined polypeptide better than the combination of HRP-JWA (7c3);Its max OD450was 0.96.While in double sandwich ELISA experiment,pre-coated by JWA(4c9)an-tibody,using the HRP-JWA(7c3)antibody as detected antibody could get good results,the max OD450was 1.30. HRP-JWA could also identify the target protein in SGC7901 cells in Western blot experiments. Conclusion:JWA antibody has been successfully marked with HRP,which could be used preliminarily in ELISA and Western blot.
JWA antibody;Horseradish peroxidase;ELISA;Western blot
Q81;R967
A
1673-7806(2015)02-137-04
國家自然科學基金重點項目(30930080);江蘇省優勢學科建設工程資助項目(環境衛生與預防醫學)
李愛萍,女,實驗師 E-mail:aplinj@126.com
* *通訊作者周建偉,男,教授 E-mail:drjwzhou@126.com
2015-01-06
2015-02-05

