小鼠卵胞漿內單精子顯微注射改良技術在輔助生殖技術應用中的價值
吳成勇+楊滿+林梅+蔡敏生+王錦華+溫雪珍
[摘要] 目的 研究鼠卵胞漿內單精子顯微注射(ICSI)改良技術在人類輔助生殖技術應用中的價值。 方法 將小鼠分為兩組:采用固定人卵子的固定針組(C-ICSI組)和改良的喇叭型固定針組(N-ICSI組),觀察兩組ICSI操作后卵子存活數、卵裂情況。 結果 N-ICSI組卵子存活率為77.4%,明顯高于C-ICSI組的7.8%,差異有高度統計學意義(χ2=483.183,P < 0.01);兩組正常受精率及異常受精率比較,差異均無統計學意義(P > 0.05)。N-ICSI組卵裂數為97.3%,明顯高于C-ICSI組的80.0%,差異有高度統計學意義(χ2=18.399,P < 0.01),桑葚胚、囊胚和孵化的胚胎比例差異無統計學意義(P > 0.05)。 結論 改良的小鼠ICSI技術,可以明顯提高操作時卵子的存活率,這將為人類實驗室ICSI技術的質量控制和研究提供保障,同時,該項研究成果可以分析人精子激活卵母細胞的能力和人精子的核型,因此有重要的研究價值。
[關鍵詞] 昆明小鼠;卵胞漿內單精子顯微注射;存活率
[中圖分類號] R711.6 ? ? ? ? ?[文獻標識碼] A ? ? ? ? ?[文章編號] 1673-7210(2015)01(a)-0008-04
The value of improved ICSI technology in the mouse in the human assisted reproductive technology
WU Chengyong ? YANG Man ? LIN Mei ? CAI Minsheng ? WANG Jinhua ? WEN Xuezhen
Reproductive center, the People's Hospital of Meizhou City, Guangdong Province, Meizhou ? 514031, China
[Abstract] Objective To study the value of improved technology ICSI in the mouse in the human assisted reproductive technology. Methods The ICSI operation were divided into two groups: ICSI operation with holding pipette for holding human ova (C-ICSI group) and with improved holding pipette (N-ICSI group), ova survival and cleavage in the two groups were observed after ICSI operation. Results The rate of ova survival in the N-ICSI group was 77.4%, significantly higher than that in the C-ICSI group (7.8%), there was statistically significant (χ2=483.183, P < 0.01). About the normal fertilization rate and abnormal fertilization rate, there was no significant difference (P > 0.05). The number of cleavage in the N-ICSI group was 97.3%, significantly higher than that in the C-ICSI group (80.0%), there was statistically significant difference (χ2=18.399, P < 0.01). There was no significant difference about the morula, blastocyst and hatching embryo (P > 0.05). Conclusion The modified ICSI technique in the mouse can significantly improve the survival rate of ova, which will provide the guarantee for quality control and research of human laboratory of ICSI technology, at the same time, the research can analyze the ability of human sperm for oocyte activation and karyotype analysis of human sperm, therefore there is an important research value.
[Key words] Kunming mice; Intracytoplasmic sperm injection; Survival rate
近年來,不孕不育的患者呈現出逐年增加趨勢,據報道,我國的不孕發生率約為12.5%[1]。部分患者通過治療雖能懷孕,但仍有患者由于輸卵管堵塞、嚴重少弱畸精癥甚至無精子癥等需要輔助生殖技術治療,如體外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)、卵母細胞胞漿內單精子注射(intracytoplasmic sperm injection,ICSI)等。實驗室胚胎培養是直接關系著輔助生殖技術成功與否的關鍵環節,因此,做好實驗室質量控制,為配子發育與胚胎培養提供良好的環境顯得至關重要[2]。有文獻報道,昆明小鼠IVF-ET技術對實驗室的環境監測、耗材質控方面提供了重要的價值,為人類IVF-ET技術的不斷完善和臨床妊娠率的不斷提高作出了巨大貢獻[3]。但是尚無關于小鼠ICSI在實驗室質量管理和價值研究的報道。考慮由于人類卵子和小鼠卵子的差異,小鼠卵子通過人類ICSI操作系統難以順利完成,單精子注射時卵子極易崩解[4-5]。因此,本研究在不改變實驗室環境,ICSI操作系統的前提下,對細節部分進行改良,以期利用改良的小鼠ICSI技術能為人類ICSI技術的發展和實驗室ICSI技術的質量控制提供價值,現報道如下:
1 材料與方法
1.1 實驗動物
實驗動物清潔級昆明小鼠均購自廣東省實驗動物中心,其中4~6周齡雌鼠50只,8~12周齡雄鼠20只。
1.2 實驗試劑及設備
孕馬血清促性腺激素(PMSG)、注射用人絨毛膜促性腺激素(HCG)均購自寧波市三生藥業有限公司。取卵-胚胎處理液(G-MOPS)、洗精受精液(IVF)、卵裂胚培養液(G-1)、囊胚培養液(G-2)均購自瑞典vitrolife公司。培養皿、吸管購自美國Falcon公司。設備:丹麥IVF tech工作站、奧林巴斯(型號:LSZX10)及尼康(型號:SMZ1000)解剖顯微鏡、奧林巴斯導致顯微鏡(型號IX71)、Apendorf顯微操作系統、ASTEC三氣培養箱、CO2氣體檢測儀、溫度測定儀等。
1.3 實驗方法
1.3.1 促排卵及卵子準備 ?選擇4~6周齡雌性昆明小鼠,于17:00時腹腔注射PMSG 10 U,48 h后腹腔注射HCG 10 U,14~16 h后采集卵子。卵子準備具體步驟:①頸部脫臼處死昆明小鼠,腹部用75%酒精清潔消毒,逐層打開腹腔,取出卵巢與子宮之間的輸卵管組織,放入預恒溫的G-MOPS液中;②在解剖顯微鏡下找到輸卵管膨大的壺腹部(透亮),用1 mL注射器針頭劃破膨大部,流出卵丘復合物組織;③吸出卵丘復合物組織依次放入4孔板的IVF液體中,后保存于第4孔,放入CO2培養箱培養4 h;④準備4孔板,1孔中加入透明質酸酶0.5 mL(80 U/mL),2、3、4孔中加入0.6 mL IVF液體,均用石蠟油覆蓋,預溫2 h后,卵丘復合物放入1孔透明質酸酶中消化1 min,取出卵子周圍的顆粒細胞,后依次在2、3、4孔中洗滌,去除透明質酸酶,完成卵子準備工作。
1.3.2 精子準備 ?①選擇8~12周齡雄性昆明小鼠,頸部脫臼處死,腹部酒精清潔消毒,打開腹腔,取出附睪尾部組織,放入預恒溫的G-MOPS液中。②將附睪尾洗滌后,放入另一有G-MOPS的培養皿中,用1 mL注射器針頭刺破附睪尾部組織,放入CO2培養箱孵育15 min。③準備好15 mL離心管,加入2 mL濃度為80%的精子梯度離心液,吸出游離出精子的G-MOPS液,緩慢加入到精子梯度離心液上面,可見清晰的分層,300~600 g離心15 min。④吸出精子沉淀,用IVF液洗滌2次,完成精子制備。
1.3.3 卵母細胞胞漿內單精子注射操作步驟 ?①根據固定針的使用不同將ICSI操作分為兩組:傳統固定人類卵子的固定針組(C-ICSI組)和改良的固定針組(N-ICSI組)。C-ICSI組固定人卵的固定針通過商業化購買。N-ICSI組固定針通過自制完成:選擇外徑1.0 mm、內徑0.75 mm的玻璃管,通過拉針儀和鍛針儀拉制端口內徑為45~50 μm,開口呈喇叭形的固定針。注射針均選擇商業化的ICSI注射針。在顯微操作系統上裝好固定針和注射針。②ICSI操作皿的準備:取顯微操作皿,中心偏上部位做30 μL左右的沖洗滴,以皿的中心為中點做一豎條形的PVP操作滴,再接著以PVP操作滴為對稱軸分別在其兩側用G-MOPS做若干10 μL左右的卵子操作滴,覆蓋4 mL礦物油后移至桌面培養箱或溫箱中預熱2 h。③PVP操作滴加入1滴精子懸液,卵子操作滴中加入卵子(3~5個/滴)。④注射針對精子進行斷尾,吸取精子頭,固定針固定卵子,使紡錘體位于6點鐘位置,注射針3點鐘處注射精子進入卵子內。⑤操作結束后,用IVF液洗滌卵子后,放入37℃ CO2培養箱培養。
1.4 觀察指標
注射后7 h左右觀察雙原核情況,記錄存活卵子數、正常受精卵子、異常受精卵子,24 h后觀察卵裂情況,72 h觀察桑葚胚,96 h觀察囊胚發育、囊胚孵化情況。正常受精比例=正常受精卵子數/存活卵子數×100%;異常受精比例=異常受精卵子數/存活卵子數×100%。
1.5 統計學方法
采用SPSS 13.0統計學軟件進行數據分析,計數資料用率表示,組間比較采用χ2檢驗,以P < 0.05為差異有統計學意義。
2 結果
2.1 兩種卵母細胞胞漿內單精子注射操作方法
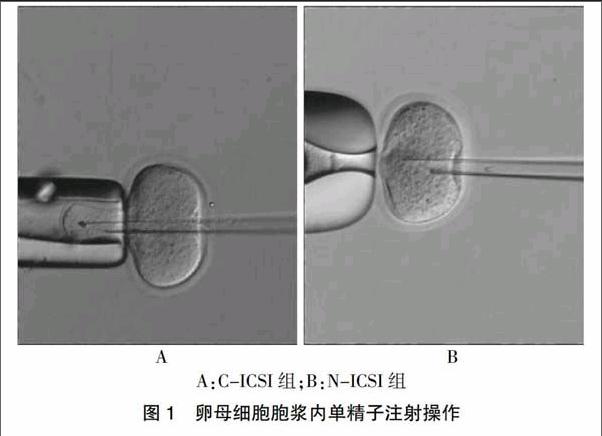
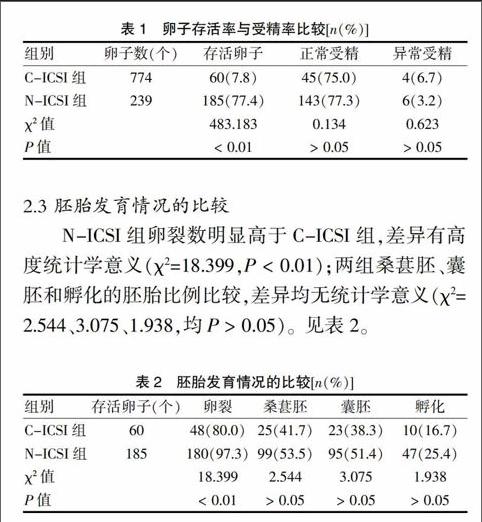
C-ICSI組采用固定人卵子的固定針進行ICSI操作。N-ICSI組采用自制完成的固定針進行操作:開口呈喇叭形。見圖1。
A:C-ICSI組;B:N-ICSI組
圖1 ? 卵母細胞胞漿內單精子注射操作
2.2 卵子存活率與受精率比較
N-ICSI組卵子存活率明顯高于C-ICSI組,差異有高度統計學意義(χ2=483.183,P < 0.01),而兩組正常受精率及異常受精率比較,差異無統計學意義(P > 0.05)。見表1。
表1 ? 卵子存活率與受精率比較[n(%)]
2.3 胚胎發育情況的比較
N-ICSI組卵裂數明顯高于C-ICSI組,差異有高度統計學意義(χ2=18.399,P < 0.01);兩組桑葚胚、囊胚和孵化的胚胎比例比較,差異均無統計學意義(χ2=2.544、3.075、1.938,均P > 0.05)。見表2。
表2 ? 胚胎發育情況的比較[n(%)]
3 討論
人類胚胎實驗室是精子、卵子受精和胚胎發育的體外培養場所。實驗室內與精子、卵子和胚胎接觸的環境直接影響著它們的發育和培養質量,直接關系著輔助生殖技術的成功,如實驗室的空氣質量、濕度和溫度;培養液的pH值、營養物質和滲透壓;培養皿的毒性和雜質;培養箱的CO2和O2濃度等的異常都可導致精卵體外受精失敗和胚胎發育障礙[6-7]。因此,加強胚胎實驗室監測和管理,創造一個適宜穩定的實驗室培養環境對提高輔助生殖技術,提高生殖中心整體水平具有重要的作用。有學者報道了小鼠IVF-ET技術可以用于檢測實驗室的質量,這為生殖醫學中心IVF-ET技術的環境穩定提供了保障[8-9]。但是,尚無文獻報道關于ICSI技術的實驗室質量控制。
ICSI技術從一開始就應用于人的臨床治療,未進行動物實驗研究,因此,對于ICSI應用于臨床治療的風險性尚無法得到有效評估[10]。ICSI操作時,是將人工制作的注射針穿刺卵細胞,可能對卵細胞的骨架結構、微絲微管結構造成損傷,并將這些損傷的缺陷傳給下一代[11-12]。再則,注射針注入的精子不像自然狀態下的受精過程,自然情況下精子通過陰道、宮頸、子宮、輸卵管等多個管道才能到達受精部位,這中間存在多個篩選屏障,只有質量足夠優良的精子才能越過這些屏障,因此,起到了優勝劣汰的作用。ICSI技術是通過注射針人為地挑選出表觀尚正常的精子注入進卵子內,這可能將有遺傳缺陷的精子注入卵細胞內[13]。因此,尋找研究ICSI技術及其質量控制的動物模型顯得十分必要。
小鼠動物模型價格便宜,且小鼠攜帶著豐富的遺傳信息,小鼠卵子容易獲得,因此是比較理想的ICSI模型,但是小鼠的卵子比人的卵子小,對外界損傷的刺激特別是穿刺刺激較敏感,容易崩解,因此臨床中對小鼠動物模型進行ICSI研究進展艱難[14-15]。鄧利[16]采用傳統ICSI方法進行小鼠實驗,發現注射后卵子存活率僅為22%,成囊率僅為20%。本研究中C-ICSI組的卵子存活率更低,僅為7.8%,其余大部分均由于注射后胞漿內物質流出細胞外死亡,成囊率為38.3%。表明用人的ICSI操作系統進行小鼠實驗,卵子損傷嚴重,注射部位的卵胞膜受損后,無法自然恢復,導致細胞破裂死亡。苗聰秀等[17]采用改良ICSI方法進行小鼠實驗,即使用自制的喇叭型固定針進行ICSI操作,結果卵子存活率達到83.7%,卵裂率達到91.1%。采用改良固定針,不改變實驗室的其他環境,與人類的ICSI技術非常相似,小鼠ICSI動物實驗成功率明顯提高。與傳統的ICSI技術相比,改良的ICSI技術能使受損的卵細胞膜有充足的時間修復,因此成活率大大提高。這種可靠的ICSI改良技術,可以廣泛用于生殖中心實驗室關于ICSI技術的質量控制和科學研究,不斷發展和提高人類ICSI技術。不僅如此,改良的ICSI技術還可以檢測精子的受精能力。例如,臨床中經常遇到一些不孕夫婦,取出的卵子數較多,且質量較好,但進行體外受精時無一卵子受精。這類患者可以采用改良的ICSI技術,將這類患者的精子注入進老鼠的卵細胞內,研究患者的精子激活鼠卵的能力,并對分裂的受精卵進行研究,分析人精子的核型異常情況[18]。
改良的小鼠ICSI技術,可以明顯提高操作時卵子的存活率,這將為輔助生殖技術的發展和研究和人類實驗室ICSI技術的質量控制提供保障,同時,可以利用該項研究成果,對人精子激活卵母細胞的能力進行研究,分析人精子的核型。因此,改良的小鼠ICSI技術對人類輔助生殖技術的不斷發展有著重要的價值,值得進一步研究和應用。
[參考文獻]
[1] ?曹逸,雷俊,戴嬋媛.不孕女性心理應激及測評工具研究進展[J].中華行為醫學和腦科學雜志,2014,23(1):86-88.
[2] ?沈肖方,張玉花,陳麗麗,等.利用廢棄胚胎進行體外受精實驗室質控的可行性探討[J].生殖與避孕,2013,22(2):97-100.
[3] ?侯文文,胡衛華,吳滿意.新建IVF實驗室使用前的生物學檢測[J].安徽醫學,2013,34(8):1062-1065.
[4] ?Ron EI R,Liu J,Nagy Z,et al. Intracytoplasmic sperm injection in the mouse [J]. Hum Reprod,1995,10(11):283l-2834.
[5] ?苗聰秀,燕志光,楊紅梅,等.精子脫尾溫育降低小鼠卵胞漿內單精子顯微注射的受精率[J].中國現代醫學雜志,2013,23(14):1-4.
[6] ?Brazil C,Swan SH,ToHenr CR,et al. Quality control of laboratory methods for semen evaluation in a multicenter research study [J]. J Androl,2004,25(4):645-656.
[7] ?李弘,袁彩霞,秦琴,等.小鼠胚胎實驗對新建人類體外受精實驗室質量控制的評價[J].中國醫藥,2013,8(Suppl):47-48.
[8] ?李小平,郝朝亮,高庭,等.鼠胚實驗在新建胚胎培養實驗室質量控制中的作用[J].中南醫學科學雜志,2013,41(1):21-23.
[9] ?Hughes PM,Morbeck DE,Hudson SB,et al. Peroxides in mineral oil used for in vitro fertilization: defining limits of standard quality control assays [J]. J Assist Reprod Genet,2010,27(2-3):87-92.
[10] ?李雷,金帆.單精子卵細胞質內注射安全性研究進展[J].國際遺傳學雜志,2010,33(1):51-64.
[11] ?Wen J,Jiang J,Ding C,et al. Birth defects in children conceived by in vitro fertilization and intracytoplasmic sperm injection:a meta-analysis [J]. Fertil Steril, 2012, 97(6):1331-1337.
[12] ?Derijck AA,van der Heijden GW,Ramos L,et al. Motile human normozoospermic and oligozoospermic semen samples show a difference in double-strand DNA break incidence [J]. Hum Reprod,2007,22(9):2368-2376.
[13] ?Kobayashi H,Sato A,Otsu E,et al. Aberrant DNA methylation of imprinted loci in sperm from oligospermic patients [J]. Hum Mol Genet,2007,16(21):2542-2551.
[14] ?鄧利,曾明,匡延平,等.小鼠卵子胞膜在顯微穿刺中存活的膜特性因素研究[J].生殖與避孕,2011,12(31):791-796.
[15] ?Cohen J. A step closer to developing a clinical ICSI model using mouse oocytes [J]. Reprod Biomed Online,2010,21(5):587-588.
[16] ?鄧利.小鼠ICSI技術改良及體外畸形孵化與囊胚內細胞團分裂風險關系的研究[D].長沙:中南大學,2010, 1-39.
[17] ?苗聰秀,燕志光,楊紅梅.一種非Piezo依賴的高卵子存活率小鼠顯微授精技術[J].上海交通大學學報,2012, 32(8):1020-1023.
[18] ?Araki Y,Yoshizawa M,Abe H,et al. Use of mouse oocytes to evaluate the ability of human sperm to activate oocytes after failure of activation by intracytoplasmic sperm injection [J]. Zygote,2004,12(2):111-116.
(收稿日期:2014-09-30 ?本文編輯:任 ?念)

