竹林土壤中纖維素降解菌的篩選及產酶條件優化
蔣玉儉,李新鑫,孫飛飛,余學軍
(浙江農林大學 亞熱帶森林培育國家重點實驗室培育基地,浙江 臨安 311300)
竹林土壤中纖維素降解菌的篩選及產酶條件優化
蔣玉儉,李新鑫,孫飛飛,余學軍
(浙江農林大學 亞熱帶森林培育國家重點實驗室培育基地,浙江 臨安 311300)
為了尋找較為高效的纖維素降解菌,以便更好利用纖維素資源,結合分析被剛果紅染色后形成的透明圈大小以及羧甲基纖維素酶活力強弱,從浙江省臨安市竹林土壤中分離篩選出1株高效纖維素降解菌J6-1。經形態學觀察初步鑒定該菌株屬于青霉屬Penicillium。對該菌株的液態發酵產酶條件和產酶穩定性進行研究。結果表明:最佳產酶條件是以15.0 g·L-1稻草粉作碳源、以3.0 g·L-1酵母膏為氮源,10%接種量,pH 5.0,40℃發酵培養5 d。經優化后菌株J6-1最高羧甲基纖維素鈉酶活和濾紙酶活分別達到了41.82×16.67 μkat·L-1和17.26×16.67 μkat·L-1,并且經5次傳代培養,酶活力仍得到保持。青霉J6-1可用作進一步實際應用研究的試驗菌株。圖3表3參34
森林微生物學;纖維素降解菌;篩選;產酶條件;優化
纖維素是自然界中分布最廣、儲量最豐富的可再生有機資源[1],占植物干質量的35%~50%[2],在碳循環中有著重要作用[3],其全球累積量為1012t·a-1以上[4-5]。然而,纖維素具有不溶于水和難以降解的特性,使得如此龐大的纖維素類資源并未被充分利用。目前,中國的纖維素類資源主要用于燃燒,能量利用率非常低(10%左右)[6]。另外,一些未及時處理的纖維類資源則變成固體垃圾,造成嚴重的環境污染。所以,如果使用適當處理方法將這些可再生的纖維素降解為便于利用的糖液,再進一步轉化為具有商業價值的產品,如乙醇[7]、單體蛋白[8-9]以及有機酸[10]等,這對解決人類所面臨的能源危機、食物短缺和環境污染等問題具有重大意義[11-12]。過去處理纖維素主要采用酸[13]、堿[14]以及蒸汽加熱[15]等方法,但這些方法存在一些缺點,例如條件要求高、產物回收率不高和廢棄物存在二次污染等。目前,較有效且接近自然的纖維素處理方法就是利用微生物產生的纖維素酶來降解纖維素,其具有反應條件溫和、產物產率高和無二次污染等優點。纖維素酶是一種能降解纖維素生成葡萄糖的復合酶,其完整酶系主要包括內切葡聚糖酶(EC 3.2.1.4),外切葡聚糖酶(EC 3.2.1.91),β-葡萄糖苷酶等3類酶[16],其中,內切葡聚糖酶用于降解纖維素分子內部β-1,4-糖苷鍵,形成大量小分子纖維;外切葡聚糖酶用于降解纖維素分子末端β-1,4-糖苷鍵,生成纖維二糖;β-葡萄糖苷酶用于降解纖維二糖生成葡萄糖。催化纖維素水解需要一個完整的纖維素酶系相互協同作用。因此,分離和篩選出具有較完整纖維素酶系的菌株非常重要。以往許多研究篩選的纖維素降解菌來自樹林土壤和動物腸道等,如劉清鋒等[17]從稻田腐爛秸稈中分離篩選出降解纖維素能力較強的青霉Penicillium T24-2;Sheng等[18]從暗黑鰓金龜Holotrichia parallela的腸道中篩選出1株高纖維素酶活力的假單胞菌Pseudomonas HP207,對從竹林土壤分離纖維素降解菌的研究較少。實際上,竹林土壤富含纖維素,生活著大量不同種類的纖維素降解菌,是高效纖維素降解菌的理想來源地。因此,本實驗從浙江省臨安市竹林中采集土樣,利用羧甲基纖維素選擇培養基分離篩選出1株纖維素降解能力較強的菌株J6-1,并對其進行了菌種的初步鑒定及產纖維素酶條件優化。
1 材料與方法
1.1 培養基
富集培養基(液體):羧甲基纖維素鈉(CMC-Na)15.0 g,磷酸二氫鉀(KH2PO4)1.0 g,氯化鈉(NaCl)0.1 g,硫酸鎂(MgSO4·7H2O)0.3 g,硝酸鈉(NaNO3)2.5 g,氯化鐵(FeCl3)0.01 g,氯化鈣(CaCl2)0.1 g;定容至1.0 L,自然pH值。
選擇培養基(固體):羧甲基纖維素鈉(CMC-Na)15.0 g,磷酸二氫鉀(KH2PO4)1.0 g,氯化鈉(NaCl)0.1 g,硫酸鎂(MgSO4·7H2O)0.3 g,硝酸鈉(NaNO3)2.5 g,氯化鐵(FeCl3)0.01 g,氯化鈣(CaCl2)0.1 g,瓊脂15 g;定容至1.0 L,自然pH值。
種子培養基:PDA培養基(馬鈴薯200.0 g,蔗糖20.0 g,瓊脂15.0 g,水1 000.0 mL,自然pH值)。
液體發酵培養基:羧甲基纖維素鈉(CMC-Na)15.0 g,磷酸二氫鉀(KH2PO4)1.0 g,氯化鈉(NaCl)0.1 g,硫酸鎂(MgSO4·7H2O)0.3 g,硝酸鈉(NaNO3)2.5 g,氯化鐵(FeCl3)0.01 g,氯化鈣(CaCl2)0.1 g;定容至1.0 L,自然pH值。
1.2 菌株的分離篩選
1.2.1 樣品采集 實驗樣品(不同程度腐爛的礱糠、稻草、竹葉以及土壤)來自杭州市余杭區和臨安市各村的竹林(雷竹Phyllostachys violascens林和毛竹Phyllostachys edulis林)。采用5點取樣法[19]取0~5 cm土壤混合樣品200.0 g,將采集的樣品裝到無菌袋中并編號,放入冰盒中帶回實驗室4℃保存。共采集到20個樣品。
1.2.2 富集培養 稱取10.0 g樣品加到90.0 mL富集培養基中,30℃,120 r·min-1培養3 d后取培養液以體積為5%的接種量接入新的富集培養基中,再反復富集2次[20]。
1.2.3 菌株的篩選分離 取1.0 mL富集菌液依次稀釋成比例梯度為10-1,10-2,10-3,10-4,10-5和10-6,再分別從中取0.1 mL涂布到羧甲基纖維素鈉培養基(CMC-Na平板)上,30℃恒溫箱培養3 d后,挑取單菌落分別點種3個CMC-Na平板上(即3次重復)于30℃恒溫箱培養6 d,用1.0 g·L-1剛果紅溶液對平板染色30 min,再用1.0 mol·L-1氯化鈉溶液浸洗2次(每次30 min),然后采用十字交叉法測量CMC-Na平板上透明圈直徑(D,mm)和菌落直徑(d,mm),選取Hc值(Hc=D/d,即透明圈直徑與菌落直徑的比值)較大且快速生長的菌落進行劃線分離純化并保存[18-21]。
1.3 粗酶液的制備
將篩選到的菌株分別接種到種子培養基中,30℃,150 r·min-1培養3 d,再以10%的接種量接入裝有50.0 mL發酵產酶培養基的250.0 mL三角瓶中,30℃,150 r·min-1下培養,5 d后,取5.0 mL發酵液,于4℃,5 000 r·min-1離心10 min,所得的上清即為粗酶液[22]。
1.4 酶活力測定方法
1.4.1 羧甲基纖維素酶活力(CMCase)的測定 取粗酶液0.1 mL加入1.9 mL質量分數為1%羧甲基纖維素鈉的檸檬酸緩沖液(pH 4.8,0.05 mol·L-1),以沸水浴滅活的粗酶液反應作為對照,50℃恒溫水浴30 min后,加入2.0 mL DNS顯色液,沸水浴顯色10 min后,冷水浴快速冷卻停止反應,然后定容至25 mL,于540 nm波長測定其吸光度D(λ)值。上述條件下,定義1 h 1.0 mL酶液催化底物水解生成1.0 μmol葡萄糖所需的酶量為1個酶活單位(U)[23](1 U=16.67 nkat)。
1.4.2 濾紙酶活力 (FPAase)的測定 取粗酶液0.1 mL加入50.0 mg(1.0 cm×6.0 cm)折疊成M型的Whatman濾紙條,再加入1.9 mL檸檬酸緩沖液(pH 4.8,0.05 mol·L-1),以沸水浴滅活的粗酶液反應作為對照,按DNS法測定還原糖。
1.5 菌株的初步鑒定
觀察菌落和菌體形態特征,參照《真菌鑒定手冊》[24]和《中國真菌志》[25]對菌株進行形態學鑒定。
1.6 產酶條件優化
以液體發酵培養基作為基礎配方,選擇不同氮源(酵母膏、尿素、硝酸鈉、硝酸銨、蛋白胨),碳源(羧甲基纖維素鈉、竹粉、濾紙、稻草粉、蔗糖、葡萄糖),接種量(1%,5%,10%,15%,20%),初始pH值(3.0,4.0,5.0,6.0,7.0,8.0,9.0),培養溫度(20,25,30,35,40,45,50℃),培養時間(1,2,3,4,5,6,7 d)進行單因素實驗,進而通過正交實驗確定目標菌株的最佳產酶條件。
2 結果與分析
2.1 纖維素降解菌的篩選
從竹林腐殖土壤中初步篩選獲得26株經剛果紅染色后能夠產生透明水解圈的菌株,再測定羧甲基纖維素酶活力進行復篩,5株較好菌株結果見表1,其中菌株C2-2擁有較大Hc值為2.96,其5 d發酵培養后的羧甲基纖維素酶活力僅4.43×16.67 μkat·L-1明顯低于菌株J6-1的6.87×16.67 μkat·L-1,故確定最佳纖維素降解菌株為J6-1。
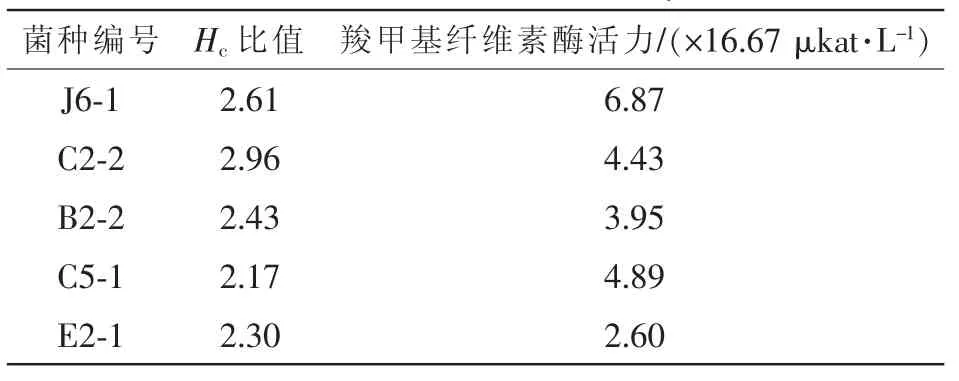
表1 5株菌的Hc值及羧甲基纖維素酶活力大小Table1 Hcvalues and cellulase activity of 5 strains
2.2 菌株J6-1的生物學特征
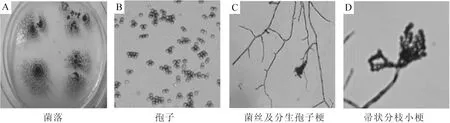
圖1 菌株J6-1的形態學特征Figure 1 Morphological characteristic of strain J6-1
菌體形態特征見圖1,菌株J6-1在羧甲基纖維素固體培養基上生長時,菌落呈絮狀,中心臍狀突起邊緣整齊,初期為淺綠色,后期呈灰綠色,在40倍顯微鏡下觀察到該菌株的分生孢子近球形,分生孢子梗從菌絲垂直長出,排列成掃帚狀的間枝著生于其頂端。可初步判斷該菌株為青霉屬Penicillium。
2.3 菌株J6-1發酵條件優化
2.3.1 氮源對菌株產酶活力的影響 分別以酵母膏、尿素、硝酸鈉、硝酸銨、蛋白胨為氮源進行發酵實驗。結果如圖2A所示:氮源對菌株的產酶能力的影響較大,使用有機氮時的酶活明顯高于使用無機氮。這表明菌株J6-1能較好利用有機氮。當用酵母膏作氮源時,菌株J6-1纖維素酶活力最高,羧甲基纖維素酶活力達到16.62×16.67 μkat·L-1,濾紙酶活達到3.76×16.67 μkat·L-1。因此選用酵母膏作為最佳氮源。
2.3.2 碳源對菌株產酶活力的影響 分別以羧甲基纖維素鈉、竹粉、濾紙、稻草粉、蔗糖、葡萄糖為碳源進行發酵實驗。結果如圖2B所示:不同碳源條件下酶活力存在較大差異,當以稻草粉作唯一碳源時,菌株J6-1的羧甲基纖維素酶活與濾紙酶活均達到最大值,分別為20.73×16.67 μkat·L-1和8.20×16.67 μkat·L-1。當以濾紙作為碳源時,酶活力最低。稻草主要含有纖維素、半纖維素、果膠、木質素粗蛋白等物質,對菌株產酶有較好誘導作用[26]。故最佳碳源為稻草粉。
2.3.3 不同接種量對菌株產酶活力的影響 在最優碳源、氮源條件下,分別接種1%,5%,10%,15%和20%種子液進行發酵實驗。結果如圖2C所示:接種量不同對酶活力有較大影響。當接種量為10%時,羧甲基纖維素酶活力最高;當接種量增加到20%時,酶活力明顯下降;這表明接種量過大,菌體大量生長,占用更多空間和資源,導致菌株產酶減少,最終選定最適接種量為10%。
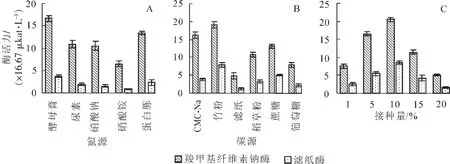
圖2 氮源(A),碳源(B),接種量(C)對菌株J6-1產酶活力的影響Figure 2 Effect of different nitrogen sources,carbon sources and inoculation quantity on cellulase activity of strain J6-1
2.3.4 不同pH值對菌株酶活力的影響 在最優碳源、氮源條件下,調整初始pH值分別為pH 3.0,4.0,5.0,6.0,7.0,8.0和9.0接種10%種子液進行發酵實驗。結果如圖3A所示:培養基pH值對菌株J6-1酶活力影響較大,濾紙酶活變化趨勢與羧甲基纖維素酶活變化趨勢保持一致;隨著pH值升高,菌株J6-1酶活力呈現先增大后減小趨勢。當pH值從pH 3.0升高到pH 5.0時,羧甲基纖維素酶活力由8.85×16.67 μkat·L-1快速增加到最大酶活25.39×16.67 μkat·L-1,濾紙酶活從3.15×16.67 μkat·L-1增加到10.41×16.67 μkat·L-1;之后再升高pH值,羧甲基纖維素酶活和濾紙酶活力均降低。在pH 5.0時,羧甲基纖維素酶活和濾紙酶活均表現出最佳酶活力,說明菌株最佳發酵培養的酸堿度為pH 5.0。
2.3.5 不同溫度對菌株產酶活力的影響 在最優碳源、氮源、pH 5.0條件下,調整培養溫度分別為20,25,30,35,40,45和50℃接種10%種子液進行發酵實驗。結果如圖3B所示:隨著溫度升高,菌株酶活力先增大后急劇下降,說明培養溫度對菌株J6-1發酵產酶影響較大,較低或較高溫度均不利于產酶,在40℃的培養溫度下,羧甲基纖維素酶活最大為34.57×16.67 μkat·L-1;然而,當溫度為35℃時,濾紙酶活達到最高為14.36×16.67 μkat·L-1,因此,菌株J6-1最佳培養溫度范圍為35~40℃。
2.3.6 培養時間對菌株產酶活力的影響 在最優碳源、氮源、pH 5.0,40℃條件下,接種10%種子液進行發酵實驗,分別取1~7 d發酵液進行酶活力測定。結果如圖3C所示:濾紙酶活變化趨勢與羧甲基纖維素酶活變化趨勢保持一致;菌株J6-1經過2 d發酵培養后,酶活迅速提高;當發酵培養5 d時,菌株J6-1的羧甲基纖維素酶活和濾紙酶活均達到最大值,分別為36.57×16.67 μkat·L-1和15.42×16.67 μkat·L-1;繼續加長培養時間,可能由于菌株生物量達到飽和營養供應不足,菌株J6-1產酶酶活逐漸減弱。因此,最佳取樣時間為5 d。
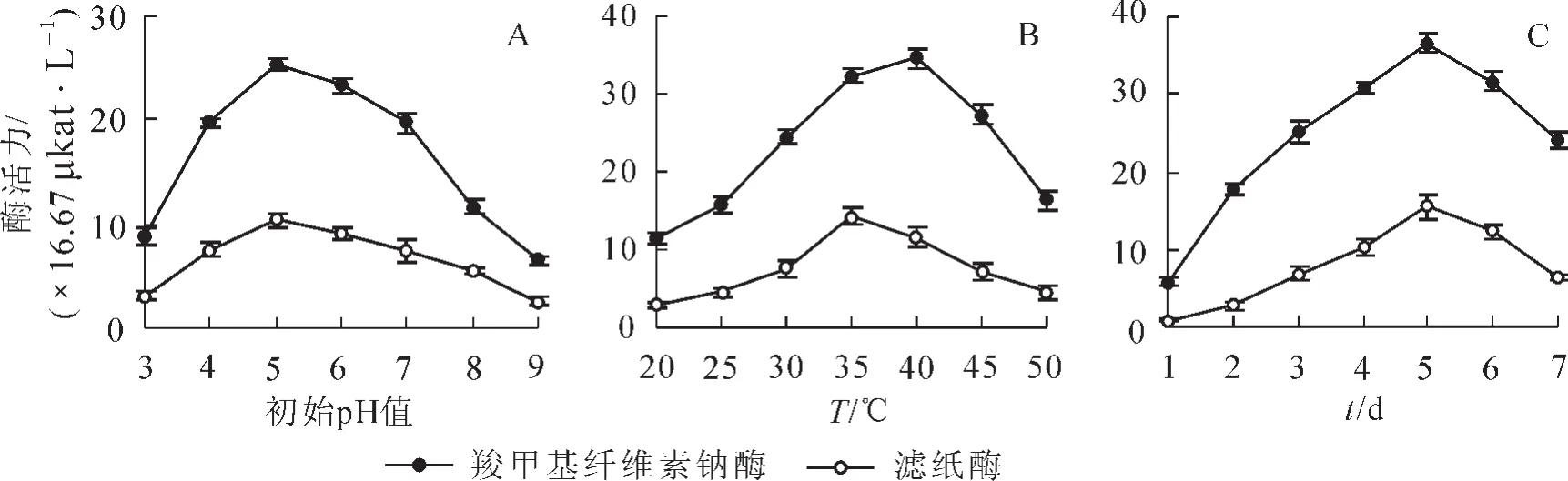
圖3 初始pH(A),培養溫度(B)和培養時間(C)對菌株J6-1產酶活力的影響Figure 3 Effect of initial pH,temperature and time on cellulase activity of strain J6-1
2.3.7 正交優化菌株J6-1產酶條件 根據以上單因素實驗結果,采用正交法去確定菌株J6-1最佳培養條件。選擇稻草粉量、酵母膏量、培養溫度、培養時間4個因素,每個因素取3個水平進行L9(34)正交實驗,培養條件為10%接種量、初始pH 5.0,150 r·min-1液體搖瓶發酵。實驗結果如表2所示:各因素對菌株J6-1產酶影響大小依次是稻草粉量、酵母膏量、培養時間、培養溫度,在6號實驗條件下,其羧甲基纖維素酶活力和濾紙酶活力分別為40.59×16.67 μkat·L-1和16.43×16.67 μkat·L-1。正交實驗表明最佳培養條件為A2B3C2D2,即15.0 g·L-1稻草粉、3.0 g·L-1酵母膏、40℃培養5 d。
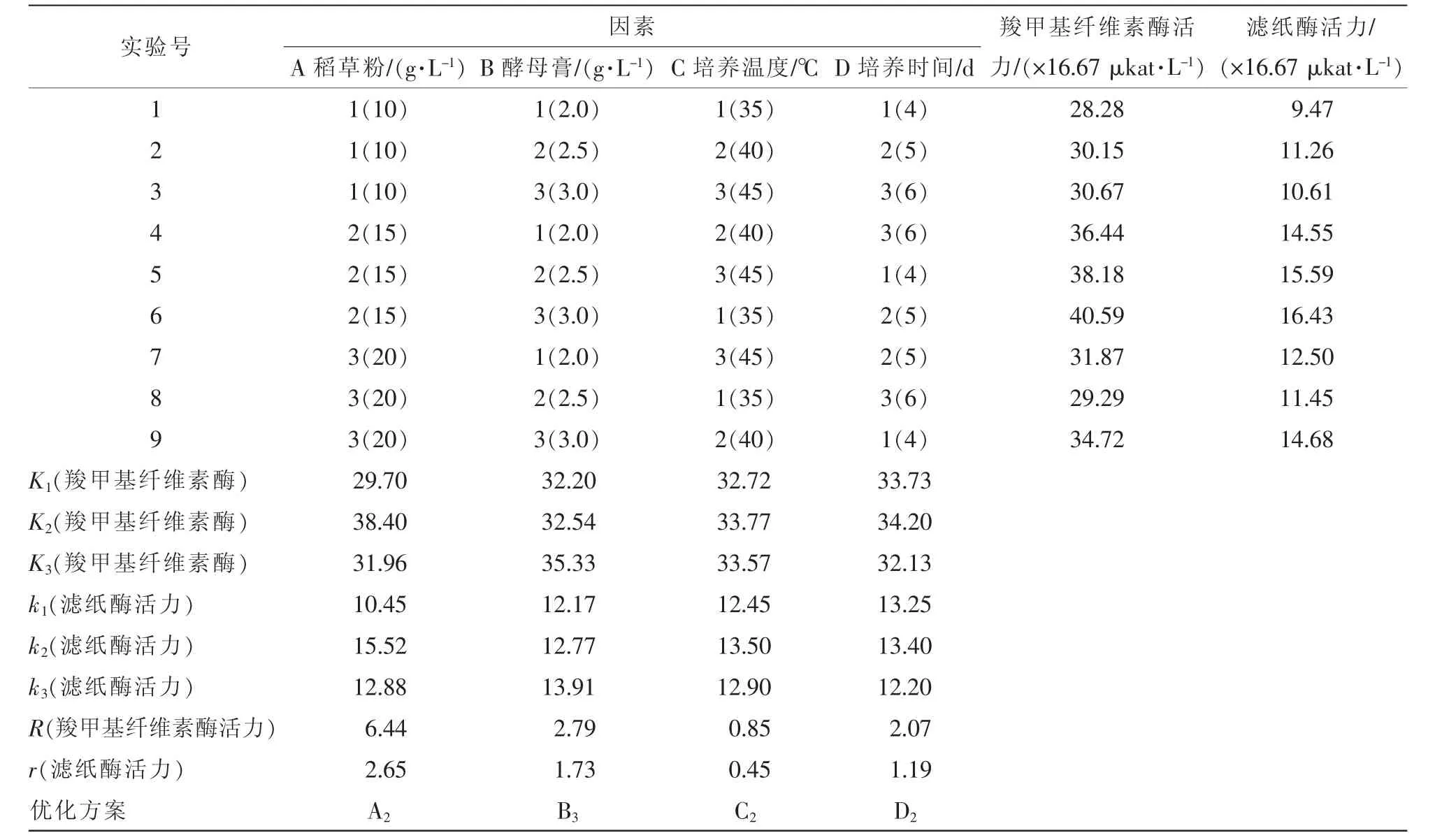
表2 L9(34)正交實驗設計及分析Table2 Design and results analysis of L9(34)orthogonal test
2.4 菌株J6-1酶活穩定性研究
將已篩選到的菌株J6-1進行連續5代傳代培養,然后最佳條件發酵培養測定其每代菌株羧甲基纖維素酶活力和濾紙酶活力。結果如表3所示:各子代菌株均能較好延續原代菌株酶活力,羧甲基纖維素酶活力和濾紙酶活力分別維持在41.82×16.67 μkat·L-1和17.26×16.67 μkat·L-1左右。
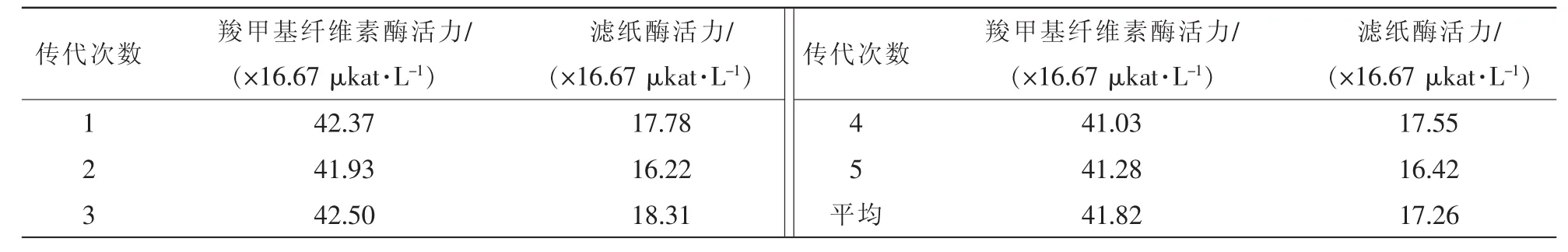
表3 菌株J6-1傳代酶活力Table3 Cellulase activity of Strain J6-1 passage
3 討論與結論
本研究采用透明圈初篩、酶活測定復篩的方法,從竹林土壤中分離出1株高效纖維素降解真菌,通過生物學觀察初步鑒定該菌株為青霉菌屬Penicillium。然后測定了該菌株的羧甲基纖維素酶活和濾紙酶活,并進一步對該菌株的發酵產酶條件進行了優化;結果表明:在添加15 g·L-1稻草粉、3 g·L-1酵母膏作碳源和氮源,10%接種量,pH 5.0,40℃,150 r·min-1發酵培養5 d條件下,該菌株獲得最佳羧甲基纖維素酶活和濾紙酶活,分別為41.82×16.67 μkat·L-1和17.26×16.67 μkat·L-1。
目前,已經篩選出不同種類降解纖維素的細菌[27]、放線菌[28]和真菌[29]。這些篩選到的降解纖維素材料的活性微生物普遍被應用于生物質能源發酵工藝(替代能源的生產)[30]、飼料生產[31]和秸稈還田土壤培肥[32]等方面。本研究篩選到的菌株來自竹林土壤,不僅可應用于以上研究,在竹林土壤生長環境也具有獨特優勢[33],更適合用于制作促竹林有機物降解菌制劑,不會引入外來菌株而造成二次污染。
在纖維素酶活的研究中,濾紙酶活通常被用來表征3種酶組分協同作用后的總酶活[34]。本實驗篩選到的青霉菌J6-1經優化后其濾紙酶活力可到達17.26×16.67 μkat·L-1,高于可曉等[22]從雷竹林土壤中篩選到的青霉菌2.1(濾紙酶活為11.19×16.67 μkat·L-1),對纖維素降解效果更好。其次,該菌株最佳產酶pH 5.0,溫度為40℃,表現出一定的耐酸能力,能適應自然界高溫環境,這對于其實際應用具有重大意義。
[1] LYND L R,WYMAN C E,GERNGROSS T U.Biocommodity engineering[J].Biotechnol Prog,1999,15(5):779-793.
[2] LYND L R,WEIMER P J,van ZYL W H,et al.Microbial cellulose utilization:fundamental and biotechnology[J].Microbiol Biol Rev,2002,66(3):506-577.
[3] DOI R H,KOSUGI A.Cellulosomes:plant-cell-wall-degrading enzyme complexed[J].Nat Rev Microbiol,2004,2(7):541-551.
[4] JARVIS M.Cellulose stacks up[J].Science,2003,426(6967):611-612.
[5] ZHANG Y H P,LYND L R.Toward an aggregated understanding of enzymatic hydrolysis of cellulose:noncomplexed cellulase systems[J].Biotechnol Bioeng,2004,88(7):797-824.
[6] 陳洪章,李佐虎.纖維素原料微生物與生物量全利用[J].化工科技市場,2001(5):17-20.
CHEN Hongzhang,LI Zuohu.Ligncellulosical microorganisms and biomass total utilization[J].Chem Technol Mark, 2001(5):17-20.
[7] BEGUIN P,AUBERT J P.The biological degradation of cellulose[J].FEMS Microbiol Rev,1994,13(1):25-58.
[8] KUZMANOVA S,VANDESKA E,DIMITROVSKI A.Production of mycelial protein and cellulolytic enzymes from food wastes[J].J Ind Microbilol,1991,7(4):257-261.
[9] MOO-YOUWG M,CHAHAL D S,SWAN J E,et al.SCP production by chaetomium cellulolyticum,a new thermotolerant cellulolytic fungus[J].Biotechnol Bioeng,1997,19(4):527-538.
[10] ANDREN R K,MANDELS M F H,MODEIROS J E.Production of sugar from waste cellulose by enzymatic hydrolysis:primary evaluation of substrates[J].Process Biochem,1976,11:2-11.
[11] 徐昶,龍敏南,烏小兵,等.高產纖維素酶菌株的篩選及產酶條件研究[J].廈門大學學報:自然科學版,2005,44(1):107-111.
XU Chang,LONG Minnan,WU Xiaobing,et al.Screening and characterization of a high cellulase producing strain Aspergillus glaucus XC9[J].J Xiamen Univ Nat Sci,2005,44(1):107-111.
[12] LUTZEN N W,NIELSEN M H,OXENBOELL K M,et al.Cellulases and their applications in the conversion of lignocellulose to fermentable sugars[J].Phil Trans Royal Soc B,1983,300(1100):283-291.
[13] HAN Y W,GALLIHAN C D.Collulose fementation:effect of substrate pretreatment on microbial growth[J].Appl Microbiol,1974,27(1):159-165.
[14] CHAHAL D S.Solid-state fermentation with Trichoderma reesei for cellulase production[J].Appl Environ Microbiol, 1985,49(1):205-210.
[15] BELTRAME P L,CARNITI P,VISCIGLIO A,et al.Fractionation and bioconversion of steam-exploded wheat straw[J].Bioresour Technol,1992,39(2):165-171.
[16] KANSOH A L,ESSAM S A,ZEINAT A N.Biodegradation and utilization of bagasse with Trichoderma reesie[J].Polym Degradation Stab,1999,63(2):273-278.
[17] 劉清鋒,支曉鵬,徐慧娟,等.纖維素降解菌青霉T24-2的分離及產酶特性[J].工業微生物,2007,37(3):16-19.
LIU Qingfeng,ZHI Xiaopeng,XU Huijuan,et al.Screening and characterization of cellulase-producing Penicillium sp.T24-2[J].Ind Microbiol,2007,37(3):16-19.
[18] SHENG Ping,HUANG Shengwei,WANG Qi,et al.Isolation,screening,and optimization of the fermentation conditions of highly cellulolytic bacteria from the hindgut of Holotrichia parallela larvae (Coleoptera:Scarabaeidae)[J].Appl Biochem Biotechnol,2012,167(2):270-284.
[19] 王愛軍,柴兆祥,李金花,等.馬鈴薯干腐病菌和黑痣病菌拮抗芽胞桿菌的篩選及鑒定[J].中國生物防治學報, 2013,29(4):586-594.
WANG Aijun,CHAI Zhaoxiang,LI Jinhua,et al.Screening and identification of antagonistic Bacillus strains against pathogens of fusarium dry rot and black scurf in potato[J].Chin J Biol Control,2013,29(4):586-594.
[20] 高小鵬,楊晗,袁茂林,等.纖維素降解菌的篩選及酶活力測定[J].湖北農業科學,2011,50(15):3072-3073.
GAO Xiaopeng,YANG Han,YUAN Maolin,et al.Isolation of cellulose-degrading strains and emzyme activity determination[J].Hubei Agric Sci,2011,50(15):3072-3073.
[21] 王洪媛,范丙全.3株高效秸稈纖維素降解真菌的篩選及其降解效果[J].微生物學報,2010,50(7):870-875.
WANG Hanyuan,FAN Bingquan.Screening of three traw-cellulose degrading microorganism[J].Acta Microbiol Sin, 2010,50(7):870-875.
[22] 郭成栓,歐陽蒲月,崔堂兵,等.1株堿性纖維素酶產生菌的分離、鑒定及酶譜分析[J].生物技術,2011,21(1): 57-59.
GUO Chengshuan,OUYANG Puyue,CUI Tangbing,et al.Isolation,identification,and zymographic analysis of a high alkaline cellulase-producing strain H12[J].Biotechnology,2011,21(1):57-59.
[23] 可曉,陳雙林,張小平,等.雷竹林存留有機覆蓋物高效降解菌株分離及產酶條件優化[J].浙江農林大學學報, 2012,29(2):244-250.
KE Xiao,CHEN Shuanglin,ZHANG Xiaoping,et al.Selection of strains used to degrade organic mulching materials from Phyllostachys violascens forest and optimization of its enzyme production[J].J Zhejiang A&F Univ,2012,29(2):244-250.
[24] 魏景超.真菌鑒定手冊[M].上海:上海科學技術出版社,1979.
[25] 孔華忠.中國真菌志:青霉屬及其相關有性型屬[M].北京:科學出版社,2007.
[26] 李新華,富艷鑫,鄭煜焱.米糠蛋白提取工藝條件的優化[J].食品科學,2010,31(22):251-254.
LI Xinhua,FU Yanxin,ZHENG Yuyan.Optimization of extraction conditions for rice bran protein[J].Food Sci, 2010,31(22):251-254.
[27] 黃寧珍,付傳明,何金祥,等.纖維素降解真菌分離篩選、產酶特性及高效水解菌系的初步構建 [J].西南農業學報,2010,23(5):1489-1496.
HUANG Ningzhen,FU Zhuanming,HE Jinxiang,et al.Isolation of cellulose-degradation fungi their zymogenic characteristics and preliminary design of high effect complex microbial communities[J].Southwest China J Agric Sci, 2010,23(5):1489-1496.
[28] 吳翔,陳強,徐麗華,等.1株降解纖維素的高溫放線菌的篩選及其產酶條件研究[J].農業環境科學學報,2007, 26(增刊):101-104.
WU Xiang,CHEN Qiang,XU Lihua,et al.Screening of a cellulose-decomposing thermoactinomuces strain and its enzyme-producing conditions[J].J Agro-Environ Sci,2007,26(supp):101-104.
[29] 韓立榮,張雙璽,祝傳書,等.高效纖維素降解真菌的篩選和鑒定[J].西北農林科技大學學報:自然科學版, 2008,36(9):169-174.
HAN Lirong,ZHANG Shuangxi,ZHU Chuanshu,et al.Screening and identification of superior fungus degraded cellulose[J].J Northwest A&F Univ Nat Sci Ed,2008,36(9):169-174.
[30] 奚立民,曹樹勇,柯中爐.木質纖維素類生物質制備燃料乙醇的微生物研究進展[J].化工進展,2009,28(11): 2003-2008.
XI Limin,CAO Shuyong,KE Zhonglu.Research progress in microorganisms for the conversion of lignocellulosic biomass to fuel ethanol[J].Chem Ind Eng Prog,2009,28(11):2003-2008.
[31] 刁治民,張雄偉,熊亞,等.微生物纖維素酶在飼料工業中的生產現狀及應用[J].青海草業,2006,15(3):15-20.
DIAO Zhimin,ZHANG Xiongwei,XIONG Ya,et al.The research on the productive status and applied of microbial cellulase[J].Qinghai Pratac,2006,15(3):15-20.
[32] 肖春玲,徐常新.微生物纖維素酶的應用研究[J].微生物學雜志,2002,22(2):33-35.
XIAO Chunling,XU Changxin.Application study on microbial cellulase[J].J Microbiol,2002,22(2):33-35.
[33] 徐有權,顧文杰,王立群,等.酸性半纖維素降解細菌的篩選與鑒定[J].微生物學雜志,2012,32(2):36-40.
XU Youquan,GU Wenjie,WANG Liqun,et al.Screening and characterization of acidic hemicellulose-degrading bacteria[J].J Microbiol,2012,32(2):36-40.
[34] 黃容姿,萬金泉,馬邕文,等.廢水處理系統中纖維素酶的誘導形成及調節控制[J].造紙科學與技術,2011,30(2):52-56.
HUANG Rongzi,WAN Jinquan,MA Yongwen,et al.Induction and regulation of cellulase formation in a wastewater biotreatment process[J].Paper Sci Technol,2011,30(2):52-56.
Screening of a cellulose-decomposing strain from bamboo stand soils and optimization of its cellulase production
JIANG Yujian,LI Xinxin,SUN Feifei,YU Xuejun
(The Nurturing Station for the State Key Laboratory of Subtropical Silviculture,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
Cellulose,the most extensive and abundant renewable resource in nature with an annual worldwide accumulation of photosynthetic plant cellulose materials of 1012t of which an estimate of 89%has been used unreasonably (such as in direct burning),should be produced by more effective cellulolytic microorganisms to transform these renewable resources into available energy.At present,although important research about screening cellulolytic microorganisms has been conducted,few studies on isolating and screening cellulose-decomposing microorganisms from bamboo stand soils have been described.This research isolated and screened efficient cellulolytic microorganisms from bamboo stand soils based on the size of transparent circles and the activity of carboxymethyl-cellulase (CMCase).An efficient cellulose-decomposing fungus,J6-1,was obtained and preliminary morphological observation identified it as Penicillium(Strain J6-1).On the basis of single-factor experiments,the orthogonal experiment of 4 factors at 3 levels was then taken to optimize the liquid fermentation conditions conditions of cellulase production.And the hereditary stability of cellulase produced Strain J6-1 was evaluated by the cellulase activity analysis of 5 consecutive generations.Experimental results showed that the optimum conditions for cellulase production were as follows:15.0 g·L-1straw powder as carbon, 3.0 g·L-1yeast extract as a nitrogen source,a 10%inoculation quantity,fermentation at 40℃,and an initial pH of 5.0 for 5 d.After optimization of strain J6-1,the highest activity of carboxymethyl-cellulase(CMCase)was 41.82×16.67 μkat·L-1and filter paper enzyme activity(FPAase)was 17.26×16.67 μkat·L-1.Thus,these characteristics of high cellulose activity could be subcultured serially,and strain J6-1 could be used for furtherpractical application.[Ch,3 fig.3 tab.34 ref.]
forest microbiology;cellulose-decomposing microorganisms;screen;enzyme production;optimization
S718.8
A
2095-0756(2015)07-0821-08
浙 江 農 林 大 學 學 報,2015,32(6):821-828
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2015.06.001
2015-01-08;
2015-03-09
浙江省科學技術重點項目(2012T201-05)
蔣玉儉,從事竹林培育與利用研究。E-mail:jiangyujian.2009@163.com。通信作者:余學軍,副研究員,從事竹子栽培與利用研究。E-mail:yuxj@zafu.edu.cn

