超臨界CO2萃取法提取棘托竹蓀中的活性物質及其抑菌效果研究
藍蔚青,曹 奕,陳 燕,潘迎捷,孫曉紅
上海海洋大學食品學院 上海水產品加工及貯藏工程技術研究中心,上海 201306
棘托竹蓀(Dictyophora echinovolvata)為擔子菌亞門、腹菌綱、鬼筆目、鬼筆科、竹蓀屬的一類藥食兩用真菌[1],主要分布于云南、貴州、四川、湖南等地,其中以四川綿陽出產的棘托竹蓀質量最好。竹蓀首次見于歷史文獻記載是唐代孟詵撰寫的《食療本草》,當時被稱為“蓐”。同時代的筆記小說《酉陽雜俎》在其編錄的植物卷中,首次對其子實體形態作了具體描述。棘托竹蓀營養豐富、滋味鮮美、香味濃郁,長期以來作為我國的珍貴特產之一,價等黃金,其子實體所含的粗蛋白比例達17.67%,人體所必需氨基酸總量達5.4 mg/100 g,約占氨基酸總量的1/3,且具有抗氧化、抗菌及抗腫瘤等多種功效[2]。此外,棘托竹蓀中還富含多種維生素與微量元素,營養價值遠遠高于日常所食用的蔬菜[3]。
近年來,國內相關科研工作者對棘托竹蓀中活性物質的提取與抑菌活性開展了部分研究工作。檀東飛等[4-6]通過石油醚、乙酸乙酯與正己烷對棘托竹蓀子實體浸提,采用水蒸氣蒸餾法對棘托竹蓀揮發油進行提取,用牛津杯法測定其抑菌活性,并分析了多種提取物的化學成分。梁鳴等[7]在研究棘托竹蓀丙酮提取物化學組成的同時,還比較了丙酮、乙醇與蒸餾水等溶劑獲得提取物的抑菌活性。盧惠妮等[8]采用水提法獲得棘托竹蓀的抑菌物質,并通過瓊脂平板打孔法測定其抑菌活性。結果得出,棘托竹蓀提取物在中性至偏堿性條件下能保持其抑菌活性,且熱穩定性好。國外在棘托竹蓀中活性物質的提取與抑菌研究方面還鮮有研究。
目前,國內主要采用溶劑萃取與水蒸氣蒸餾法提取竹蓀中的抑菌物質。通常情況下,溶劑提取法所得提取物抑菌效果不佳,水蒸氣蒸餾法所得的揮發油抑菌效果雖好,但萃取時間過長,且得率偏低。超臨界CO2萃取技術作為一種新型提取技術,相對于傳統提取工藝,其具有萃取工藝簡單易行,且有大工業生產的設備,生產周期短等優點,現已被證明能提取出多種植物中的抑菌物質[9,10],但用于提取竹蓀中抑菌物質的研究還未有文獻報道。本文通過L16(43)正交實驗,選取萃取壓力、萃取溫度與萃取時間為主要影響因素,通過超臨界CO2萃取法,以活性物質對單增李斯特菌和副溶血性弧菌的最小抑菌濃度(MIC)與抑菌率作為提取效果指標,設計棘托竹蓀抑菌活性物質的最佳提取條件,為今后開展竹蓀等天然產物提取與利用研究提供理論參考。
1 材料與方法
1.1 實驗原料
棘托竹蓀子實體,購自四川綿陽食用菌所,保存于干燥避光處;單增李斯特菌(Listeria monocytogenes,菌株編號:ATCC19115),副溶血性弧菌(Vibrio parahaemolyticus,菌株編號:ATCC33847)均購自中國普通微生物菌種保藏管理中心。
1.2 實驗試劑
胰蛋白胨大豆瓊脂(TSA),胰蛋白胨大豆肉湯(TSB),NaCl 等均購自北京陸橋有限責任公司。
1.3 主要儀器設備
SB-02 多功能粉碎機(上海市普恒信息科技有限公司),超臨界CO2萃取裝置(美國FOSS 公司),Bio-Tek 酶標儀(美國伯騰儀器有限公司),QB9006微孔板快速振蕩器(江蘇省金壇市醫療儀器廠),ESCO 超凈工作臺(美國Airstream 公司),3799 型96微孔板(美國康寧公司)。
1.4 實驗方法
1.4.1 超臨界CO2提取抑菌物質的正交實驗設計
將供試棘托竹蓀子實體烘干(37 ℃烘箱中靜置20 min),用多功能粉碎機粉碎2 min,將粉碎后的竹蓀過40 目篩,裝入萃取釜內,等待萃取。通過預實驗,設計三因素四水平L16(43)的正交實驗,以萃取壓力、萃取溫度和萃取時間等因素對所得物質的抑菌效果進行研究,正交實驗因素水平表見表1。
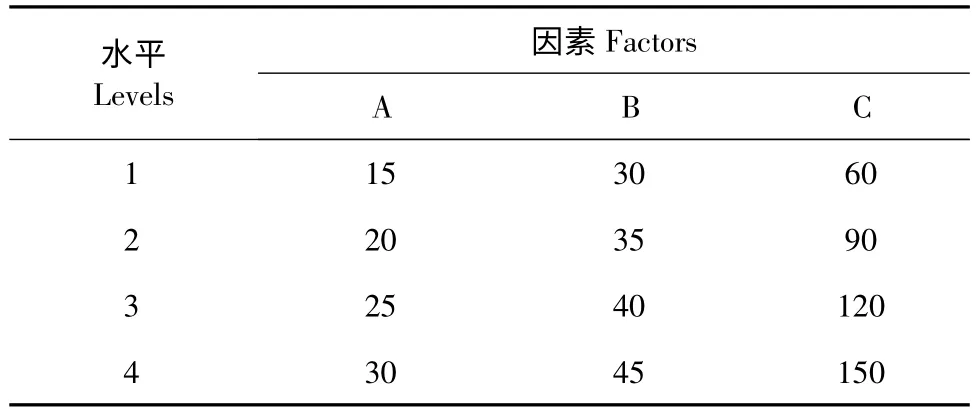
表1 正交實驗因素水平表Table 1 Factors and levels of orthogonal experiments
1.4.2 棘托竹蓀活性物質的提取工藝
開啟機器,安放裝有50.0 g 竹蓀的萃取釜,外加密封圈。打開加熱開關、設定所需的萃取溫度,打開進氣閥,使CO2壓進萃取釜內。開啟高壓泵,設定所需的萃取壓力,進行靜態萃取過程60 min。隨后動態萃取,并將收集管放在餾出口收集萃取物質。到達所需萃取時間后,取下收集管,調節高壓泵,使萃取裝置中的壓力降低,關閉進氣閥,打開出氣閥。取下萃取釜清洗,并關閉機器,最終獲得棘托竹蓀活性物質。
1.4.3 棘托竹蓀提取物對兩種菌的MIC
取甘油管保藏的兩種菌株,其中分別用滅菌后的TSB 進行兩種菌的活化(副溶血性弧菌用含3%NaCl 的TSB)。取10 μL 菌液加入10 mL TSB 中稀釋(副溶血性弧菌用含3% NaCl 的TSB),使菌液濃度達106CFU/mL,作為供試菌液備用。該過程與活性物質提取實驗同步進行。采用微量孔板法,通過倍比稀釋法用無菌水對棘托竹蓀提取物依次進行梯度稀釋。其中
實驗組:100μL 106CFU/mL 菌液+100μL 倍比稀釋提取液
對照組1:100μL 倍比稀釋的提取液+100μL TSB
對照組2:100μL 106CFU/mL 菌液+100μL TSB
陰性對照組:200μL TSB
加樣前先涂布平板確認兩種菌的初始菌液濃度,加樣后于微孔板振蕩器37 ℃培養24h,取出觀察濁度變化,判定其MIC 值,繼而進行平板計數實驗驗證結果精確性。每個處理樣2 個平行,每次實驗重復3 次。當活菌數在106CFU/mL,細菌生長受到明顯抑制的棘托竹蓀提取物最低濃度為其MIC值。
1.4.4 微孔板法測定棘托竹蓀對兩種菌的抑菌率
向96 微孔板中每孔加入100 μL 制備的菌液,將所得各組提取物質用0.1% Tween-20 增溶稀釋,將其濃度稀釋至兩種菌的MIC。取100 μL 加入孔中與菌液充分混合,將加有單增李斯特菌和副溶血性弧菌菌液的微孔板置于37 ℃微孔板振蕩器中培養12 h 后,放入酶標儀測定其OD600,由公式1[11]得其抑菌率。

式中:ODR為對照孔吸光值;OD 為樣品孔吸光值;ODB為空白孔吸光值
1.5 數據處理
實驗數據均為3 次重復實驗的均值,數據用Excel2010 進行處理,使用Origin 8.0 進行繪圖,均值間的差異顯著性通過統計軟件SPSS17.0 進行檢驗。
2 結果與討論
2.1 超臨界CO2萃取法所得棘托竹蓀提取物對兩種菌的MIC
由微量孔板法結合平板計數法得到棘托竹蓀提取物對單增李斯特菌與副溶血性弧菌的最小抑菌濃度為15.0 mg/mL。盧惠妮等[8]采用瓊脂平板打孔法進行長裙竹蓀子實體的抑菌活性研究,得到棘托竹蓀浸提液對單增李斯特菌的MIC 為25.0 mg/mL,對副溶血性弧菌的MIC 為12.5 mg/mL。羅勝蓮等[12]對棘托竹蓀乙酸乙酯浸膏水溶液采用濾紙片擴散法進行了抑菌作用研究,得出棘托竹蓀提取物對細菌的抑制作用效果明顯,其對各類細菌的MIC 在50~100 mg/mL。楊威等[13]研究了不同輔助手段獲得棘托竹蓀菌絲體提取物對6 種常見食品腐敗菌的效果,結果發現酶解水提法效果最佳,其對大腸桿菌與金黃色葡萄球菌等的MIC 為3.125 mg/mL。
由此可見,雖然對棘托竹蓀提取物MIC 的測定方法不同,但其對同類細菌的MIC 值基本相近。然而,棘托竹蓀的提取部位與提取方法不同,其對不同種類細菌的抑制效果也存在著一定差異。
2.2 不同提取條件下棘托竹蓀提取物抑菌正交實驗結果
采用超臨界CO2萃取法,通過改變不同提取條件獲得棘托竹蓀子實體提取物,并對提取物濃度在MIC 時對單增李斯特菌和副溶血性弧菌的抑制效果進行分析。同時,還進行不同組別樣品在37 ℃24 h 條件下作微孔振蕩培養處理,由平板計數加以驗證,結果如表2 所示。
根據對上表結果的綜合分析,得出對單增李斯特菌與副溶血性弧菌抑菌效果的最優組合均為A2B2C3,各影響因子的強弱依次為是RC> RB>RA。即得提取因素對兩種菌抑菌效果的影響程度順序依次為:萃取時間>萃取溫度>萃取壓力。范巧寧等[14]通過響應面法優化了熱水浸提法提取棘托竹蓀菌蓋多糖的提取工藝,結果得出因素的顯著性影響排序為:料液比>提取次數>提取時間>提取溫度。田甜[15]采用響應面法優化了棘托竹蓀的菌蓋多糖分離制備工藝,結果發現料液比、提取次數與提取時間均達到極顯著,提取溫度為顯著。在對菌蓋多糖的生物活性研究中,發現棘托竹蓀多糖具有良好的還原能力和自由基清除能力,對細菌、酵母菌與霉菌具有一定的抑制作用。可見,棘托竹蓀多糖提取率的高低對提取物的抑菌效果好壞有直接影響。本次研究結果的顯著性分析與上述結論基本相似,萃取時間與萃取溫度對棘托竹蓀提取物抑菌率的影響高于萃取壓力。
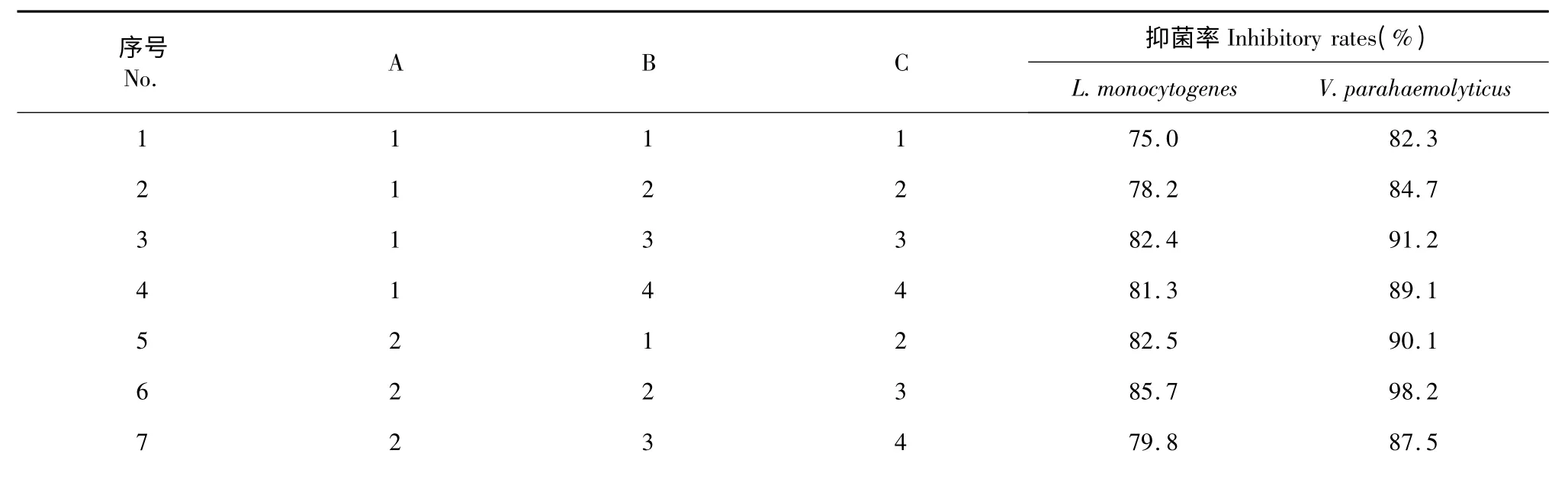
表2 不同提取條件下所得棘托竹蓀提取物對單增李斯特菌與副溶血性弧菌的抑菌率Table 2 Inhibitory rates of different D.echinovolvata extracts on L.monocytogenes and V.parahaemolyticus
2.3 不同提取條件對所得物質抑菌效果的比較分析
通過對所得數據的方差分析,以抑菌率為單因變量,以工藝參數為多因素。方差分析結果如表3與表4 所示。

表3 活性物質對單增李斯特菌抑菌率的方差分析Table 3 Analysis of variance with the results of inhibitory rates on L.monocytogenes

表4 活性物質對副溶血性弧菌抑菌率的方差分析Table 4 Analysis of variance with the results of inhibitory rates on V.parahaemolyticus

結果表明:棘托竹蓀提取物對單增李斯特菌與副溶血性弧菌抑菌率的重復數據無顯著性差異。A因素(萃取壓力)與B 因素(萃取溫度)間的差異不顯著,說明其對單增李斯特菌的抑菌率影響雖不明顯,但其重要程度要高于C 因素(萃取時間),萃取時間才是決定對兩種菌抑菌率高低的關鍵因素。該結果與極差法所得結論保持一致。
2.4 最佳提取條件的篩選
通過對數據多因素多水平的比較分析,獲得竹蓀提取物對單增李斯特菌與副溶血性弧菌抑菌率的邊際均值圖(圖1a 與圖1b)。通過對邊際均值的多重比較,可衡量不同組合對兩種菌的抑菌率高低。從圖1a 可以看出,A2與C3對單增李斯特菌的抑菌效果好,而B2至B4的邊際均值較為相近。通過在A2B3C3和A2B4C3工藝參數下進行提取實驗,結果測得兩種條件的提取率分別為83.8%與84.7%,均低于正交實驗所得的最優組合A2B2C3的85.7%,故確定A2B2C3為最優組合。從圖1b 中可看出A2B2C3為最優組合,抑菌率為98.2%。因此,超臨界CO2萃取法提取棘托竹蓀活性物質的最優提取工藝參數為:20MPa,35 ℃,120min。

圖1 棘托竹蓀提取物抑菌率的多重比較圖Fig.1 Multiple comparisons with the results of inhibitory rates for active substances from D.echinovolvata
3 結論
本文嘗試應用超臨界CO2萃取技術提取棘托竹蓀中的抑菌物質,根據抑菌率高低衡量其提取效果,并優化了提取工藝參數。結果得出:超臨界CO2萃取法所得的棘托竹蓀提取物對單增李斯特菌和副溶血性弧菌均具較好的抑制作用。抑菌物質提取的最佳工藝參數為:萃取壓力20 MPa,萃取溫度35℃,萃取時間120 min。棘托竹蓀活性物質對兩種菌的最小抑菌濃度(MIC)均為15.0 mg/mL。處理后24 h 后,其對單增李斯特菌與副溶血性弧菌的最佳抑菌率分別為85.7%和98.2%。
1 Liu ZX(劉振祥),Zhang S(張勝).Edible Fungus Cultivation Technology.Beijing:Chemical Industry Press,2007,07:122-127.
2 Cao M (曹萌),Lin CQ (林陳強),Lin RB (林戎斌),et al.Study on extraction and analysis of protein from Dictyophora echinovolvata Pileus.Nat Prod Res Dev(天然產物研究與開發),2014,26:475-479.
3 Sun YM(孫遠明),Yu QL(余群力).Food Nutrition.Beijing:China Agricultural University Press,2005.67-69.
4 Tang DF(檀東飛),Liang M(梁鳴),Wu RJ(吳若菁),et al.Chemical compositions of Dictyophora echinovolvata extracted with ethyl acetate.Nat Prod Res Dev(天然產物研究與開發),2003,15:34-37.
5 Tang DF(檀東飛),Du ZH(杜崢輝),Wu RJ(吳若菁),et al.Studies on antimicrobial activity of Dictyophora echinovolvata extracted with N-hexane.Strait Pharm J(海峽藥物),2003,15:61-63.
6 Tang DF(檀東飛),Huang RZ(黃儒珠),Lu Z(盧真),et al.Chemical compositions and antimicrobial activity of the volatile oil and petroleum ether extract from the fresh carpophore of Dictyophora echinovolvata.J Fujian Norm Univ,Nat Sci(福建師范大學學報,自科版),2010,26:100-105.
7 Liang M(梁鳴),Tang DF(檀東飛).Chemical compositions in Dictyophora echinovolvata extracted with acetone and the antibacterial activity extracted with acetone,ethanol and water.Mycosystema(菌物學報),2005,24:197-201.
8 Lu HN(盧惠妮),Pan YJ(潘迎捷),Sun XH(孫曉紅),et al.Antibacterial activity of water extract of Dictyophora echinovolvata Fruitbod.Food Sci (食品科學),2009,30:120-123.
9 Al-Burtamani SK,Fatope MO,Marwah RG et al.Chemical composition,antibacterial and antifungal activities of the essential oil of Haplophyllum tuberculatum from Oman.J Ethnopharmacol,2005,96:107-112.
10 Zhang QP(張慶平).Study on the flavone in Sophora flavescens with supercritical CO2extraction and its antimicrobial effect.Strait Pharm J(海峽藥物),2009 21(7):46-48.
11 Luo JM(駱健美),Wang M(王敏),Liu F(劉峰),et al.A method that micro plate bioassay method for rapidly detecting the antibacterial activity,China,invention,200810153179.9,2009.4.22
12 Luo SL(羅勝蓮),You X(游霞),Ding CC(丁聰聰),et al.Antimicrobial activities and chemical compositions of Dictyophora indusia fisscher and Dictyophora echinovolvata.Sci Tech Food Ind (食品工業科技),2012,21:70-73.
13 Yang W(楊威),Wu SR(吳素蕊),Fan J(樊建),et al.Study on the antimicrobial effect of Dictyophora echinovolvata Mycelium.Edible Fungi China (中國食用菌),2008,27(6):34-37.
14 Fan QN (范巧寧),Zhang WG (張偉剛),Zhao P (趙珮),et al.Extraction and antioxidant activity in vitro of polysaccharides from Pileus of Dictyophora echinovolvata.Sci Tech Food Ind (食品工業科技),2013,23:112-117.
15 Tian T(田甜).Separation preparation and biological activity research of polysaccharide from Dicyophora echinovolvata volva.Xi’an:Shaanxi Normal University (陜西師范大學),MSc.2012.

