EGCG 對衰老小鼠腦組織NF-κB 蛋白表達的影響
王曉博 ,杜 陽,謝耀光,高明川,李海蘭,王 波,姜 濤*
1大連醫科大學生物技術系;2 大連醫科大學病理學教研室,大連 116044
表沒食子兒茶素沒食子酸酯(Epigallocatechin gallate,EGCG)是綠茶中的主要成分,是茶多酚中含量最多的單體物質。EGCG 是特定的黃烷醇類化合物,具有較強的抗氧化活性。細胞內超氧化物(,H2O2等)在代謝過程中堆積過多,不能及時清除是細胞衰老機制之一[1-3]。EGCG 是否可以通過它的抗氧化活性來抑制機體衰老過程,這是本研究需要探討的問題。另外,細胞衰老與體內衰老相關的基因表達調控相關,其中包括炎癥相關的轉錄因子NF-κB (nuclear factor kappaB,NF-κB)[4,5]。NF-κB 是一種具有轉錄激活功能的蛋白質,其與細胞凋亡的關系密切[6,7],但最近研究發現NF-κB 的激活與細胞衰老也密切相關。2013 年,發表在Nature 上的一篇文章表明:隨著小鼠的衰老,下丘腦區域的NF-κB 逐漸被激活,證實了衰老與NF-κB 信號途徑的相關性[8]。本研究擬通過分析EGCG 的抗衰老作用以及對衰老小鼠腦組織NF-κB 及相關分子的表達的影響,確定EGCG 與炎癥相關信號通路之間的關系,為進一步研究EGCG 復雜的生物學效應提供線索。
1 材料與方法
1.1 實驗動物及分組
3~4 月齡清潔級雄性昆明小鼠20 只,體重50±10 g,由大連醫科大學SPF 實驗動物中心提供。隨機分為2 組,模型組和對照組。其中模型組15只,按照50 mg/(kg·d)頸背部皮下注射5%D-半乳糖生理鹽水溶液,對照組5 只小鼠,按照1 mL/(kg·d)頸背部皮下注射生理鹽水溶液,連續注射9 w。建模成功后,將模型組小鼠隨機分為二組,衰老組和EGCG 處理組。衰老組5 只,按照1 mL/(kg·d)頸背部皮下注射生理鹽水;EGCG 處理組10 只,以1 mg/(kg·d)皮下注射EGCG 生理鹽水溶液,連續注射5 w;另領取3~4 月齡清潔級雄性昆明小鼠5 只設為年輕組。因此,最后利用年輕組小鼠5 只、衰老組小鼠5 只以及EGCG 處理組小鼠10 只進行研究。
1.2 主要試劑
EGCG(純度99.5%)購自浙江乾盛康藥業有限公司;超氧化物歧化酶(SOD)活性檢測試劑盒(批號:20101109)系南京建成生物工程研究所產品;β-半乳糖苷酶活性檢測試劑盒為碧云天生物試劑公司產品,抗鼠β-actin 抗體,抗鼠NF-κB-P65,抗鼠IκBα(Y42)抗體以及辣根過氧化物酶標記的抗兔IgG 購自巴傲德生物科技公司。
1.3 行為學實驗
模型組小鼠和對照組小鼠每10 d 進行體重監測;并在第9 w 對小鼠進行記憶能力訓練和檢測。在設定的迷宮中對兩組小鼠進行為期5 d,每天10次的訓練,記錄50 次中的正確次數。記憶能力測試主要根據逃避到安全區的時間賦分,直接逃避到安全區給予2 分,受擊后再進行逃避給予1 分,否則為0 分,以總分作為記憶成績[9]。
1.4 小鼠外周血SOD 活性檢測
采用斷尾取血的方法收集各組小鼠外周血,3500 rpm 離心10 min,收集血清。利用SOD 活性檢測試劑盒,在酶標儀的589 nm 波長下檢測后進行數據處理。
1.5 小鼠海馬區神經元的SA-β-Gal 活性分析
當EGCG 處理模型組小鼠4 w 時,利用10%水合氯醛腹腔注射分別麻醉年輕組、衰老組以及EGCG 處理組小鼠各1 只,斷頭取出腦組織后立即投入4%多聚甲醛固定液中固定24 h,進行冰凍切片,利用SA-β-Gal 染色試劑盒對病理切片進行洗脫、固定、染色、脫色、封片處理,最后在高倍顯微鏡下觀察海馬區神經元染色比率。
1.6 小鼠腦組織NF-κB 和IκBα 蛋白表達變化分析
EGCG 處理模型組小鼠5 w 后,分別取年輕組(n=4)、衰老組(n=4)以及EGCG 處理組(n=8)小鼠腦組織50 mg 于液氮研磨后置于EP 管中,加入蛋白裂解液200 μL 于4 ℃裂解30 min,同時每10 min 震蕩一次,每次30 s,4 ℃,12000 rpm 離心10 min,取上清,考馬斯亮藍G250 對蛋白進行定量后進行Western blotting 分析,以β-actin 為內參照檢測NF-κB-P65 和IκBα(Y42)蛋白表達變化情況。
2 實驗結果
2.1 模型組小鼠的行為學變化及外周血SOD 活性測定
研究結果表明,與對照組相比,模型組小鼠30 d后體重增長緩慢(表1,圖1),且毛發較年輕組黃,進食量減少。與對照組相比,模型組小鼠正確逃避反應能力遲緩,正確次數明顯減少,記憶評分較低,均具有顯著性差異;模型組小鼠外周血中,SOD 活性也顯著性降低(表2)。

表1 D-半乳糖誘導小鼠衰老過程中的體重變化Table 1 The changes of weight for the mice treated by d-gal compared to control mice
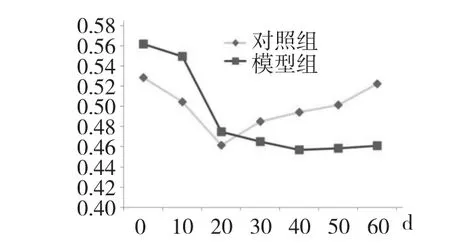
圖1 D-半乳糖誘導小鼠衰老過程中的體重變化趨勢圖Fig.1 The tendency of weight changes of mice during d-gal treatment
2.2 EGCG 的抗衰老作用研究
當EGCG 處理衰老模型小鼠4 w 時,進行小鼠外周血SOD 活性檢測和小鼠大腦病理切片SA-β-Gal 染色分析。結果發現:與衰老組相比,EGCG 處理組SOD 活性明顯升高,達到115.24 ±11.06(圖2)。小鼠大腦病理切片進行SA-β-Gal 染色分析檢測發現:衰老組小鼠海馬區細胞在一個視野下有20%~30%細胞膜被藍染,而年輕組小鼠海馬區細胞只有5%左右被藍染,EGCG 處理組,在多個視野下,只能觀察有5%細胞膜周圍被藍染現象,與年輕組小鼠海馬區染色結果相似(圖3)。因此,EGCG處理后海馬區衰老細胞明顯減少。

表2 模型組與對照組小鼠的記憶力及外周血SOD 活性比較Table 2 Comparison of memory capability and SOD activity in mice serum between model group and control group
2.3 EGCG 對小鼠腦組織中NF-κB 信號途徑相關蛋白表達的影響

圖2 年輕組、衰老組及EGCG 組小鼠外周血SOD 活性分析Fig.2 The changes of SOD activity for young group,aging group and EGCG treatment group

圖3 小鼠海馬區神經元病理切片的SA-β-Gal 染色分析(×400)Fig.3 SA-β-Gal staining of mice hippocampal neurons for young group,aging group and EGCG treatment group
小鼠腦組織NF-κB-P65 和IκBα(Y42)蛋白表達情況如圖4 所示。年輕組小鼠腦組織IκBα 蛋白表達較高,而NF-κB 蛋白表達較低,當利用D-半乳糖誘導衰老后,IκBα 蛋白表達受到明顯抑制(P<0.05);而NF-κB 蛋白表達被激活,與年輕組相比,NF-κB 表達升高了2.03 倍(P<0.05)。1 mg/(kg·d)的EGCG 處理衰老模型組小鼠5 w 后,與衰老組相比,IκBα 蛋白表達呈上調趨勢,NF-κB 蛋白表達被抑制。所以,EGCG 能阻滯衰老所引起的NFκB 蛋白的激活。
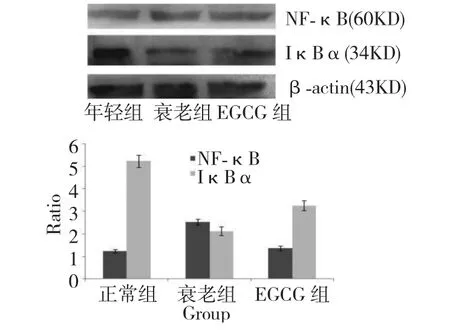
圖5 小鼠腦組織NF-κB 和IκBα 蛋白表達分析Fig.5 Protein expression changes of IκB-α and NF-κB of mice brain tissue for young group,aging group and EGCG treatment group
3 討論
細胞衰老(cellular aging)是一個極其復雜的生物學過程,主要指正常細胞在不能分裂后所進入的狀態。此時細胞仍然是存活的,但細胞的基因和蛋白的表達譜發生了很大改變,從而出現細胞形態、結構以及細胞內酶活性改變等一系列現象。目前,關于人體衰老機制研究主要包括兩大學說,即氧化損傷學說和端粒學說。其中氧化損傷學說及作用機制已經在不同研究中得到證明。過量氧自由基可以導致各種大分子如DNA,蛋白質的氧化損傷,從而造成基因表達紊亂和蛋白質的損傷,引起機體衰老[10]。D-半乳糖已被證明,在不同動物中均可以通過增加氧化強度,降低抗氧化酶的活性和線粒體的作用來加速衰老。所以,D-半乳糖被廣泛用于衰老模型的構建。本實驗中,連續9 w 每天于小鼠頸部皮下注射約250 μg 的D-半乳糖,經小鼠行為學檢測,外周血SOD 活性及腦組織海馬區SA-β-Gal 染色檢測發現D-半乳糖能顯著引起小鼠氧化損傷,從而成功建立小鼠衰老模型。
有研究表明,EGCG 處理人源性肝癌細胞系HCCLM6 后,能引起廣泛細胞凋亡的發生[11]。所以,EGCG 與炎癥發生和細胞凋亡存在密切關系。研究人員一直認為,炎癥不只是衰老發生的一個旁觀者,其很可能加快了衰老的進程,但具體分子機制報道較少。2013 年,美國一研究小組揭示:年輕小鼠下丘腦中NF-κB 幾乎不具有活性,隨著衰老的進程,下丘腦中的NF-κB 被逐漸激活[8]。所以,下丘腦中的炎癥有可能是整個身體衰老的根源,其與NF-κB 激活程度相關。本研究發現,EGCG 處理后,抑制了小鼠腦組織NF-κB 的表達,而IκBα 蛋白表達有上調趨勢。所以,EGCG 很可能通過阻礙NF-κB 的表達而延遲衰老進程。核轉錄因子NF-κB在細胞活動過程中是一個重要的調節因子,參與免疫反應,細胞增殖,分化和凋亡等相關400 多個基因轉錄的調控[4,12]。NF-κB 的激活涉及IκB 的磷酸化,而后者有賴于IKK(IκB 激酶)的調控。在哺乳動物中,IκB 蛋白是NF-κB 主要抑制劑,主要包括IκBα、IκBβ 和IκBγ 三種因子[13]。所以,EGCG 可能通過刺激IκBα 的表達而抑制NF-κB 的活化,進而延緩了衰老進程。但此推論還需要通過磷酸化IκBα 蛋白表達以及細胞核內磷酸化NF-κB-P65 的表達變化進一步得到驗證。因此,本研究發現EGCG 具有明顯抗衰老作用,其機制可能通過抑制NF-κB 的表達而阻礙了細胞衰老的進程。該研究結果為EGCG 相關的抗衰老保健品開發提供了一個新的方向。
1 Lan Z,Liu J,Chen L,et al.Danggui-Shaoyao-San amelio-rates cognition deficits and attenuates oxidative stress-related neuronal apoptosis in d-galactose-induced senescent mice.J Ethnopharmacol,2012,141:386-395.
2 Someya S,Prolla TA.Mitochondrial oxidative damage and apoptosis in age-related hearing loss.Mech Ageing Dev,2010,131:480-486.
3 Lopez-Burillo S,Tan DX,Mayo JC,et al.Melatonin,xanthurenic acid,resveratrol,EGCG,vitamin C and alpha-lipoic acid differentially reduce oxidative DNA damage induced by Fenton reagents:a study of their individual and synergistic actions.J Pineal Res,2003,34:269-277.
4 Karin M,Ben Neriah Y.Phosphorylation meets ubiquitination:the control of NF-κB activity.Annu Rev Immunol,2000,18:621-663.
5 Li Q,Verma IM.NF-κB regulation in the immune system.Nat Rev Immunol,2002,2:725-734.
6 Singh M,Singh R,Bhui K,et al.Tea polyphenols induce apoptosis through mitochondrial pathway and by inhibiting nuclear factor-kappaB and Akt activation in human cervical cancer cells.Oncol Res,2011,19:245-57.
7 Sriram N,Kalayarasan S,Sudhandiran G.Epigallocatechin-3-gallate augments antioxidant activities and inhibits inflammation during bleomycin-induced experimental pulmonary fibrosis through Nrf2-Keap1 signaling.Pulm Pharmacol Ther,2009b,22:221-236.
8 Zhang G,Li J,Purkayastha S,et al.Hypothalamic programming of systemic ageing involving IKK-beta,NF-kappaB and GnRH.Nature,2013a,497:211-216.
9 Sun MM(孫茂民),Liu J (劉珺),Chen EQ (陳爾齊),et al.Expression of P21WAF-1 of neuron in second-acute brain aging models.Lab Animal Comparative Med (實驗動物與比較醫學),2006,26:223-226.
10 Meng Q,Velalar CN,Ruan R,et al.Regulating the age-related oxidative damage,mitochondrial integrity,and antioxidative enzyme activity in Fischer 344 rats by supplementation of the antioxidant epigallocatechin-3-gallate.Rejuvenation Res,2008a,11:649-660.
11 Zhang Y,Owusu L,Duan W,et al.Anti-metastatic and differential effects on protein expression of epigallocatechin-3-gallate in HCCLM6 hepatocellular carcinoma cells.Int J Mol Med,2013,32:959-964.
12 Wang CY,Mayo MW,Baldwin AS,et al.TNF and cancer therapy-induced apoptosis:potentiation by inhibition of NFkappaB.Science,1996,274:784-787.
13 Tsuchiya Y,Asano T,Nakayama K.Nuclear IKKbeta is an adaptor protein for IkappaBalpha ubiquitination and degradation in UV-induced NF-kappa B activation.Mol Cell,2010,39:570-582.

