電解法處理有色有機廢水
——介紹一個物理化學綜合設計實驗
鄧媛
(武漢大學化學與分子科學學院 湖北武漢 430072)
電解法處理有色有機廢水
——介紹一個物理化學綜合設計實驗
鄧媛
(武漢大學化學與分子科學學院 湖北武漢 430072)
介紹電解法處理有色有機廢水這樣一個新的物理化學設計實驗,詳細闡述了實驗原理、實驗裝置的搭建和實驗操作方法,主要探討了電流密度、電解時間、輔助電解質濃度等技術參數對槽壓和有機物轉化率的影響,并介紹了該實驗的開設模式和實踐情況。
電催化氧化 槽壓 轉化率 物理化學設計實驗
在實驗教學中加入綜合性設計實驗,是適應現代創新型人才培養目標的必然舉措。然而,物理化學實驗因其本身的學科特點,需要較多地依賴于部分專用儀器與設備。而受到儀器設備臺套數少和學生人數多的限制,設計實驗的內容在創新和變革上存在較大的難度。選擇部分科技含量高、綜合實用性強且對實驗儀器設備要求較低的實驗作為設計實驗,是以上問題的有效解決途徑。電解法處理有色有機廢水是近年來廣泛應用于現代工業廢水處理的一項較為熱門的研究課題[1-3],該方法操作簡便、易于控制、無二次污染,且實驗材料與設備相對簡單,是一個適合在教學實驗室向大多數學生開設的綜合設計性實驗。
1 實驗目的
(1) 初步理解并掌握電催化氧化技術的基本原理與操作方法。
(2) 了解電解裝置的基本結構并掌握搭建電解裝置的基本方法。
(3)了解電解技術中的重要基本技術參數的意義,學習自主設計實驗方法測定參數,并探究各種不同因素對電解的影響。
2 實驗原理
電催化氧化法是工業上處理有機廢水的一種常用方法,其降解有機物的過程較為復雜,多數研究者認為[4-5],在該過程進行時,可在高析氧電位的陽極表面形成具有強氧化性的羥基自由基(·OH ),其標準電極電勢為2.80 V,氧化能力僅次于F2(2.87 V)。羥基自由基在反應中作為鏈引發劑,誘導自由基反應發生,將難降解的有機物氧化成CO2、H2O和其他產物,反應機理大致如圖1所示[6-9]。
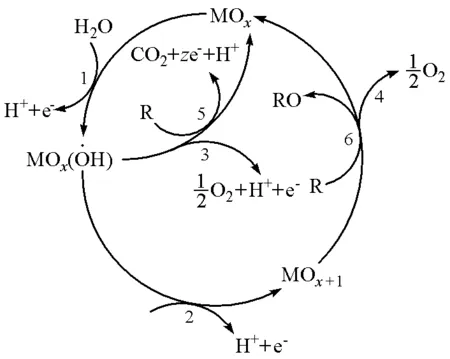
圖1 電催化氧化機理
該方法具有氧化能力強、操作簡便、易于控制、無二次污染等優點,在現代工業廢水處理中得到越來越廣泛的應用。
在電解技術中,影響電解效果的主要因素有電極材料、電極面積、電解時間、輔助電解質濃度等。電解效果通常通過槽壓、甲基橙的轉化率等技術指標來反映。
本實驗采用電催化氧化法處理甲基橙溶液,陽極采用氧化性極強的且具有高析氧電位的PbO2/Ti電極[10-12],主要探討電流密度、電解時間、輔助電解質濃度對電解槽壓和甲基橙轉化率的影響。本技術通常采用恒電流電解,電流密度可通過設備控制,槽壓可由直流穩壓電源實時監測。由于甲基橙為有色物質,在堿性條件下,于波長460 nm處有最大吸光度,故甲基橙的實時轉化率可采用分光光度法測定。計算公式如下:
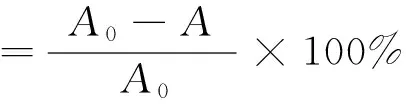
式中A0為電解前溶液的吸光度,A為電解過程中某時刻溶液的吸光度。
3 儀器與試劑
3.1 儀器
DH1718E-4型直流跟蹤雙路穩壓穩流電源(32 V/3 A)、SZCL-2A數顯智能控溫攪拌器、VIS-7220可見分光光度計、電子天平、電解槽(20 cm × 10 cm × 15 cm,容量1.0 L)、銅電極(9.0 cm × 4.5 cm × 0.30 cm)、PbO2/Ti電極(9.0 cm × 3.0 cm × 0.10 cm)、磁子、秒表。
3.2 試劑
無水硫酸鈉(分析純),0.0025 g/L甲基橙溶液。
4 實驗步驟
4.1 設計搭建電解裝置
按圖2搭建電解裝置,電極板陽極為PbO2/Ti電極,陰極板為銅電極。固定兩個電極板在電解槽中的橫向和縱向位置,以固定電極間的相互距離及電極浸入電解液的深度。加入1.0 L電解液,用直尺測定陽極板的浸入深度,計算陽極的有效面積。陰極的銅電極浸入深度應大于陽極。兩極板分別通過銅線接入直流電源的正負極。
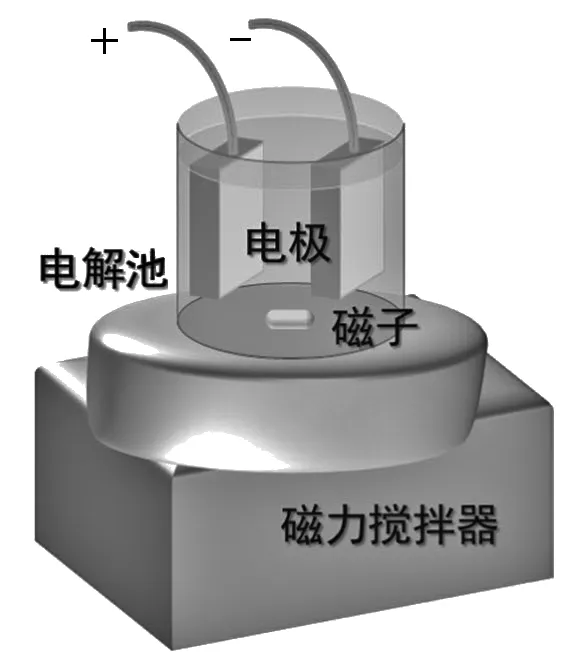
圖2 電解裝置示意圖
4.2 電解相關參數的測定
(1)打開磁力攪拌器和直流跟蹤雙路穩壓穩流電源開關,設置為恒流電解。向電解槽內加入1.0 L不含輔助電解質的0.0025 g/L甲基橙溶液為電解液,固定某個電流值不變,向電解液內定量加入無水硫酸鈉粉末,觀察并記錄穩壓穩流電源上顯示的槽壓數值,繪制槽壓與輔助電解質無水硫酸鈉濃度之間的關系曲線,確定輔助電解質的最佳加入量。
(2)重新向電解槽內加入1.0 L含輔助電解質的0.0025 g/L甲基橙溶液為電解液,設置不同電流密度值進行恒電流電解,記錄槽壓,并繪制電流密度與槽壓關系曲線。
(3)設置某個電解電流值,電解含輔助電解質的0.0025 g/L甲基橙溶液直至肉眼觀察電解液明顯退色或近似無色。在電解過程中,每隔3~5 min測定槽壓,并觀察溫度變化。繪制電解時間與槽壓的關系曲線。
(4)在電解前,從電解槽中取1.00 mL電解液,經過適當稀釋后,測定其吸光度。設置某個電流值進行電解,記錄時間,每電解5 min,從電解槽中取1.00 mL電解液,經過適當稀釋后,測定其吸光度;電解約30 min。然后改變電流值的大小,重復上述操作。根據上述結果,繪制甲基橙轉化率與電流密度、甲基橙轉化率與電解時間之間的關系曲線。
4.3 甲基橙溶液最大吸收波長的確定及工作曲線的繪制
(1)分別移取0.50 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL、5.00 mL、6.00 mL、7.00 mL、8.00 mL、9.00 mL的0.0025 g/L甲基橙溶液至25 mL容量瓶中,稀釋至刻度并搖勻。
(2)以蒸餾水為參比,使用分光光度計測量0.00050 g/L甲基橙溶液在不同波長入射光下的吸光度,確定最大吸收波長。
(3)在最大吸收波長下,測定按上述步驟配置的不同濃度甲基橙溶液的吸光度,并繪制工作曲線。
5 結果與討論
5.1 甲基橙溶液最大吸收波長及工作曲線
(1)甲基橙作為酸堿指示劑,在酸性條件下和堿性條件下顏色不同,因此最大吸收波長也會隨溶液pH不同而有所差別。本實驗電解液的溶劑為去離子水,輔助電解質為無水硫酸鈉,均為中性,pH在7左右,應顯堿式色。然而學生在實驗中發現,已電解較長時間的甲基橙溶液,其最大吸收波長相對于電解前有少量增大,這可能是因為在甲基橙的電解過程中會生成CO2,從而使電解液的pH減小;而pH越接近甲基橙的變色范圍,pH的少量變化引起的最大吸收波長變化越大。因此,可在測定吸光度前,向待測溶液中加入少量NaOH固體,使pH大于7。此條件下測得的最大吸收波長為460 nm。
(2)確定460 nm的最大吸收波長后,在此波長下,測量已經配制好的不同質量濃度甲基橙標準溶液的吸光度,可得如圖3所示的甲基橙工作曲線。由圖3可以看出,在460 nm下,甲基橙質量濃度與吸光度有良好的線性關系。
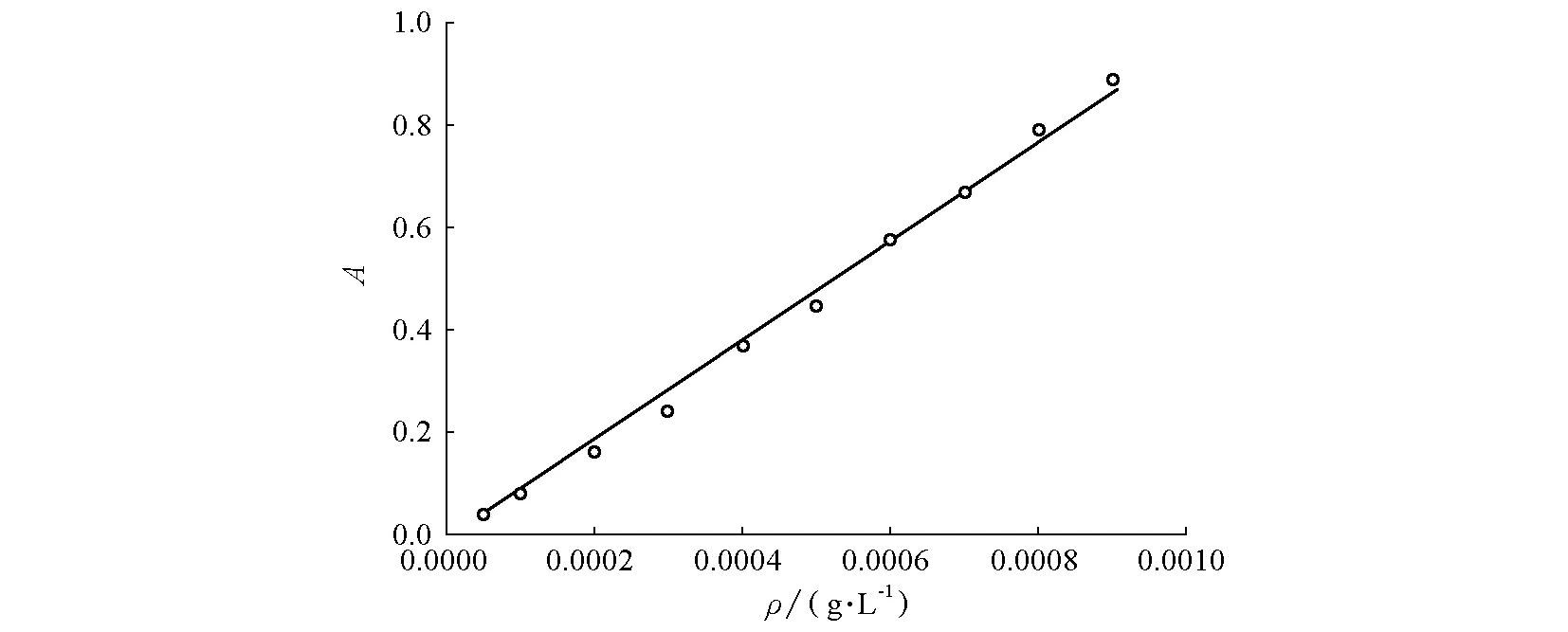
圖3 最大吸收波長(460 nm)下標準溶液質量濃度與吸光度關系圖(工作曲線)
5.2 輔助電解質濃度、電流密度和電解時間對槽壓的影響
5.2.1 輔助電解質濃度對槽壓的影響
改變電解槽中加入的輔助電解質Na2SO4的質量濃度,在電流密度一定的條件下進行恒流電解,記錄槽壓的變化,可得到如圖4所示的槽壓與輔助電解質質量濃度之間的關系曲線。
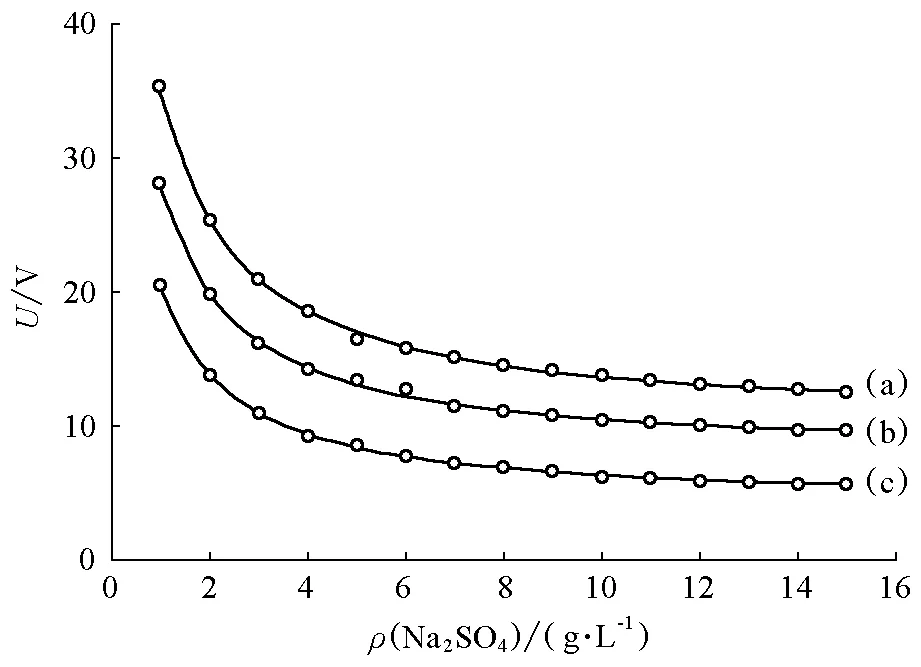
圖4 槽壓隨輔助電解質硫酸鈉質量濃度變化曲線電流密度為:(a)35 mA/cm2; (b)21 mA/cm2; (c)15mA/cm2
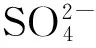
5.2.2 電流密度對槽壓的影響
保持輔助電解質濃度和電極面積一定,改變電流密度進行恒流電解,將得到如圖5所示的槽壓與電流密度關系圖。圖5顯示槽壓與電流密度呈線性關系,說明本實驗中的電解液內阻較大,電流密度的增加將導致槽壓顯著增大,而這將大大增加電解過程中的能耗,這也是該技術的一個缺陷。
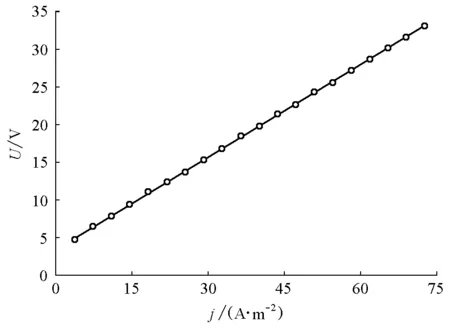
圖5 槽壓隨電流密度變化圖輔助電解質質量濃度為7.0 g/L
5.2.3 電解時間對槽壓的影響
保持電流密度值一定,電解一段時間至電解液顏色顯著變淺,測定槽壓隨時間變化的曲線。由于該步驟的實驗時間較長,學生在進行該步驟時為分組進行,綜合其實驗結果可得到如圖6所示的不同電流密度下槽壓隨電解時間變化曲線。
圖6 不同電流密度下槽壓隨電解時間變化曲線電流密度為: (a)43.5 mA/cm2; (b)52.8 mA/cm2; (c)68.2 mA/cm2; (d)75.4 mA/cm2
從初始狀態至甲基橙溶液顏色變淺,絕大多數學生的電解時間為40~60 min。從圖6可知,在電解過程中,槽壓均隨電解時間的推移而降低,且電流密度越大,槽壓下降得越明顯;另外,槽壓初始時降低得較快,在電解一段時間后,槽壓降低的速度變緩。槽壓隨時間降低的原因可能是: ① 在電解過程中,一部分水會被電解,通過對電解前后電解液體積的測量,經過40~60 min的電解過程,電解液體積減少了5~6 mL。水的電解導致電解液中輔助電解質濃度增大,電解液電阻率減小,槽壓下降。② 電解液溫度變化。由于電解液存在較大內阻,電解過程中一部分電能轉化為熱能損耗,導致電解液溫度有所上升,而使電解液內離子遷移率提高,從而提高了導電性,導致槽壓降低。溫度升高可能是槽壓降低的主要原因。在相同時間內,電流密度較大(大于50 mA/cm2)時,電解前后溫度升高較大(5~6 ℃);電流密度較小(小于50 mA/cm2)時,電解前后溫度升高較小(2~4 ℃)。因此,電流密度較大時,槽壓降低得較多。電解初期溫度上升較快,槽壓降低速度也較快;而溫度升高帶來散熱速度的加快,因此溫度上升速度的降低也導致槽壓降低速度的變緩。值得注意的一個現象是,每條曲線的最后1~2個點顯示出槽壓有加速降低的趨勢,這可能是因為在電解后期,電解液的顏色已經明顯變淡,即電解液內甲基橙的含量已顯著減少,因此電能有更多的部分被消耗于水的電解和產生熱量,從而導致槽壓進一步降低。
5.3 電流密度和電解時間對甲基橙轉化率的影響
5.3.1 電流密度對甲基橙轉化率的影響
在陽極電極板有效面積為13.8 cm2、Na2SO4輔助電解質的質量濃度為9.0 g/L條件下,使用不同電流密度進行恒流電解,比較甲基橙轉化率(圖7)。
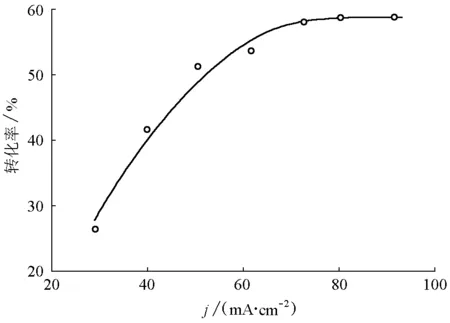
圖7 不同電流密度下的甲基橙轉化率
由圖7可知,甲基橙轉化率隨電流密度的增加而增加,但轉化率的增加速度隨電流密度的增大而減小,甚至在達到某一個值(j= 80 mA/cm2)后,甲基橙轉化率保持不變。此現象說明,該電解過程應是濃差極化為控制步驟的電化學反應。初期電流密度的增大,使單位時間單位面積內通過的電荷量較大,導致甲基橙轉化率提高。但隨著電流密度進一步增大,由于甲基橙分子在水中的擴散速度較慢,電極表面的電化學活性物質濃度明顯降低甚至耗盡,而使電解速度難以繼續增大并達到極值,此時再增大電流密度,電能將主要消耗在水的電解和熱能的散失上,顯然這將增大能耗,降低電流效率。因此電流密度應控制在合理的區間。在本實驗條件下,電流密度應小于80 mA/cm2。
5.3.2 電解時間對甲基橙轉化率的影響
保持輔助電解質濃度及電極板面積不變,在電流密度值一定時,恒電流電解一段時間,繪制不同電流密度下,甲基橙轉化率隨時間的變化圖(圖8)。
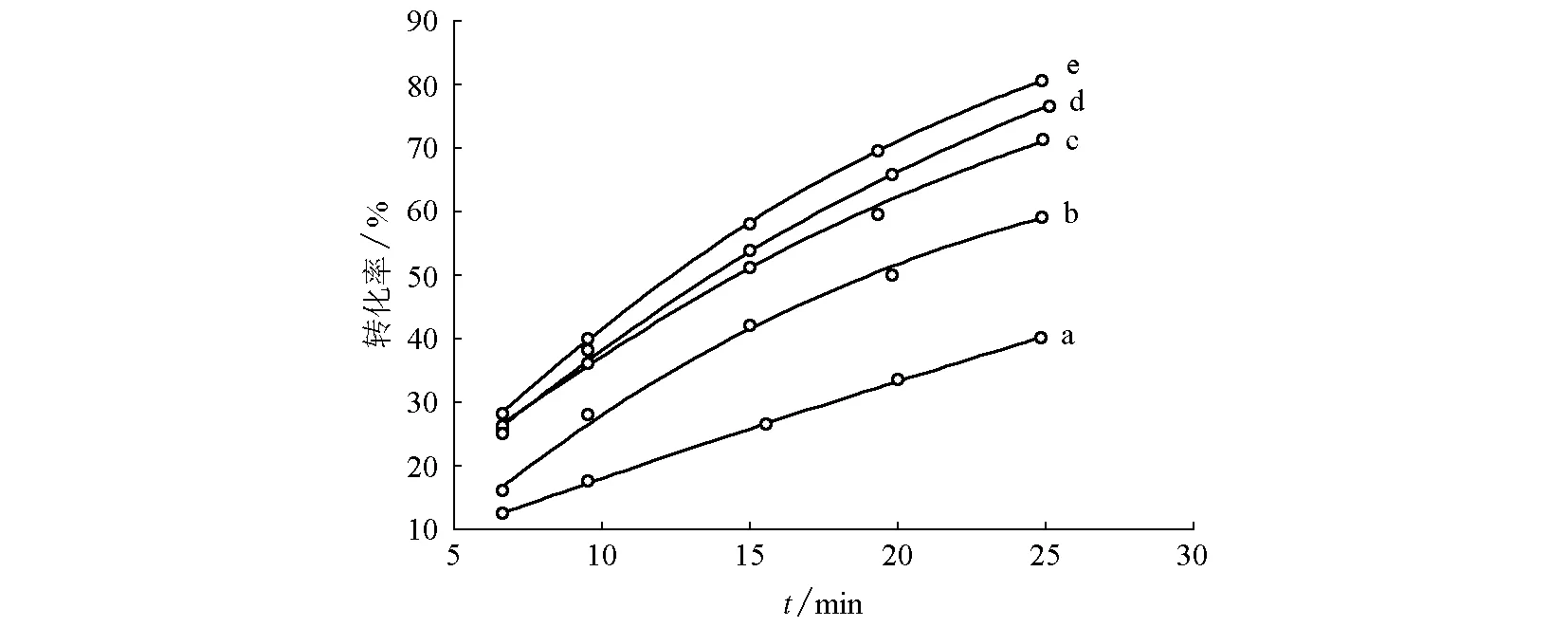
圖8 不同電流密度下甲基橙轉化率隨電解時間的變化曲線圖電流密度分別為: (a)29.0 mA/cm2; (b)40.0 mA/cm2; (c)50.8 mA/cm2; (d)61.2 mA/cm2; (e)72.4 mA/cm2
由圖8可知,甲基橙轉化率隨電解時間增加而增大,但增加的速度逐漸變緩,即甲基橙的電解速率隨時間降低,且電流密度越大時電解速率降低得越顯著,這是因為隨著電解時間延長,電解液中的甲基橙濃度降低,從而導致電解速率降低。
5.4 動力學機理的初步討論
圖9為-ln(c/c0)隨時間t的變化曲線,c為不同時刻電解槽中甲基橙濃度,c0為甲基橙初始濃度。
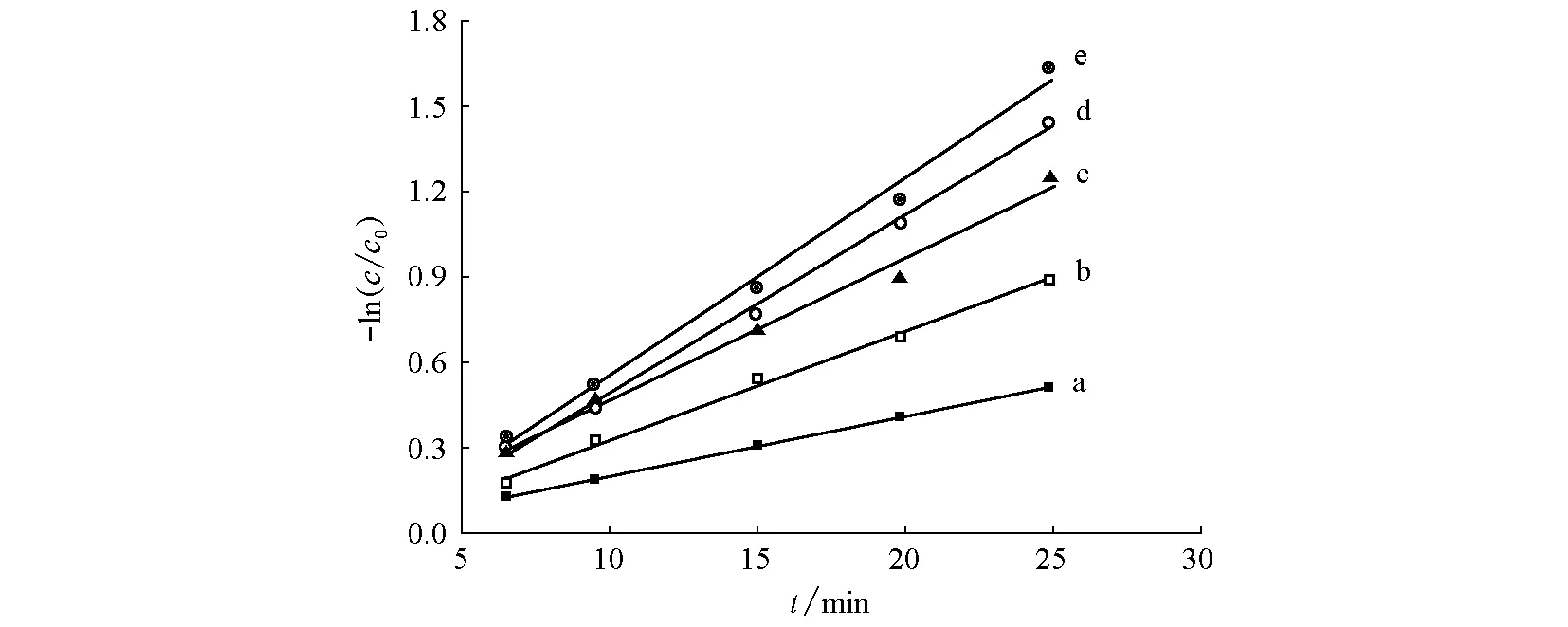
圖9 不同電流密度下的-ln(c/c0)-t關系圖
從圖9可以看出,-ln(c/c0)與時間t基本符合線性關系,而且在電流密度較小時,線性關系較好。當電流密度較大時,線性關系發生一定的偏離。因此可近似認為,在電流密度較小時,該電解反應為一級反應。
6 實驗運行模式及實踐情況
該電解法處理有機廢水的設計實驗為綜合性較強的設計實驗,實驗開設過程分以下3個環節完成:
(1)布置實驗題目“電解法處理有色有機廢水”,同時給出實驗室可以提供的試劑藥品、電極材料、電解槽、分析儀器等信息,要求學生通過查閱文獻,給出實驗方案。實驗方案中需要包括電解裝置的搭建,槽壓、反應物轉化率等重要因素的測定方法及其影響因素的探索步驟,時間為2周。
(2)學生提交方案,教師對學生方案進行審核和細化,并根據學生的實驗方案進行實驗試劑和器材的準備,時間為1周。
(3)學生進入實驗室進行實驗,在兩次實驗課的時間內完成,如果學生要求更多時間,可在開放實驗的時間內自主安排。
(4)學生分組撰寫科研論文形式的實驗報告和ppt報告,并組織全班學生與教師的討論會,由學生代表就“電解法處理有色有機廢水”課題的研究背景,實驗過程,遇到的問題和發展前景作口頭報告。
本實驗是根據本學院某課題組的一項在研科研課題設計而來的教學實驗,已在我院化學專業本科生中作為設計實驗開設一年,兩個年級約100名本科生參與實踐。通過這種科研前沿領域的研究課題轉化的設計實驗的實踐,使學生查閱資料、自主并獨立思考問題以及動手等綜合能力均得到很大提高。例如在搭建電解裝置時工作電極與對電極的放置不當,有的將兩電極放置距離過遠導致槽壓太大,有的讓對電極面積小于工作電極等,對于這些實驗中出現的問題,教師多以提供參考意見的方式向學生提出建議,主要由學生通過思考、討論和查閱資料等方式給出修改和解決方案。這樣可以使學生對電解的基礎技術問題有更深刻的了解。
學生對于此類實驗的興趣非常濃厚。本實驗安排的時間是兩次實驗課,但由于實驗內容較多,給學生布置題目時部分內容是必做,部分是選做。而80%的學生都主動申請在開放實驗的時間里另外增加實驗時間,全部完成必做和選做的內容。通過整個實驗教學過程,學生對該研究領域的了解比較深入,在實驗報告和分組口頭報告中,學生能夠清楚地闡述該課題的研究意義、核心問題和技術難點,并能對未來的發展方向提出自己的觀點。這為學生將來從事科研工作打下了一個良好的基礎。
7 結論和展望
本文介紹的電解法處理有色有機廢水實驗是第一個在我院物理化學教學實驗室開設的科研前沿實驗,是一項實驗教學改革的新舉措,目的是讓學生能夠初步了解一個新領域,學習一項新技能,以鍛煉和提高學生的創新能力和綜合能力。延續這樣的思路,更多的科研前沿實驗將會逐步開設,使物理化學實驗教學內容更加豐富,技術更加先進,從而使教學改革進程邁上一個新臺階。
[1] 李天成,朱慎林.電化學,2005,11(1):101
[2] 王勛華,張鐵明,童少華,等.電化學,2010,16(2):172
[3] Zhou M H, Wu Z C, Wang D H.ChemicalReactionEngineeringandTechnology, 2001,17(3):263
[4] Zhang L, Jia J, Ying D,etal.ResearchinMicrobiology, 2005,156(1):88
[5] Dai Qizhou, Zhou Minghua, Lei Lecheng,etal.ChineseScienceBulletin,2007,52(12):1724
[6] Comninellis Ch, Vercesi G P.JApplElctrochem,1991,21(4):335
[7] Comninellis Ch.ElectrochinActa,1994,39:1857
[8] Mohan N, Balasubramanian N, Basha C A.JournalofHazardousMaterials,2007,147:644
[9] 李少中.廣東化工,2012,39(2):119
[10] 宋小三,李艷紅,王三反.工業水處理,2013,33(12):11
[11] 申哲民,雷陽明,賈金平,等.高校化學工程學報,2004,18(1):105
[12] 楊建朝,潘會波.稀有金屬材料與工程,1994,23(1):50
Electrolysis for Colored Organic Wastewater Treatment*——Introduction of a Comprehensive Experiment of the Physical Chemistry Laboratory
Deng Yuan**Qin Jingjing Hu Xiaohong Xia Yan Gong Chuqing Deng Lizhi Xia Chunlan
(CollegeofChemistryandMolecularSciences,WuhanUniversity,Wuhan430072,Hubei,China)
In this paper, a new comprehensive and design experiment of the physical chemistry laboratory was introduced. And the principle, apparatus setup and the experimental procedure were discussed in detail. The effects of the current density, time of electrolysis, the concentration of the supporting electrolyte, and other technical parameters on the cell voltage and the conversion rate of organic matter were explored. In addition, the teaching mode and practice of the experiment were introduced.
Electrocatalytic oxidation; Cell voltage; Conversion rate; Comprehensive experiment of the physical chemistry laboratory
10.3866/pku.DXHX20150667
*通訊聯系人,E-mail:dengy@chem.whu.edu.cn 秦菁菁 胡曉宏 夏艷 龔楚清 鄧立志 夏春蘭
武漢大學實驗技術項目(No.WHU-2014-SYJS-09)
O646.51; G64

