超聲波協同流水凈化對克氏原螯蝦中菌落總數及菌相構成的影響
楊振泉,周海波,高 璐,饒勝其,尹永祺,方維明
(揚州大學食品科學與工程學院,江蘇 揚州 225127)
超聲波協同流水凈化對克氏原螯蝦中菌落總數及菌相構成的影響
楊振泉,周海波,高 璐,饒勝其,尹永祺,方維明
(揚州大學食品科學與工程學院,江蘇 揚州 225127)
目的:研究超聲波協同流水凈化對活體克氏原螯蝦攜帶的細菌數量及菌相構成的影響。方法:測定了凈化過程中克氏原螯蝦殼+肉、腮部和腸道部位菌落總數變化,并應用隨機擴增多態性DNA(random amplified polymorphic DNA,RAPD)指紋圖譜結合16S rDNA測序鑒定分析龍蝦在凈化處理前后不同部位的菌相構成。結果:超聲波協同流水處理能夠顯著減少蝦殼+肉、腮和腸道部位的細菌載量,降低量分別達到2.18、2.23、1.01(lg(CFU/g))。挑取的218個單菌落中存在21種不同的RAPD譜型,不同譜型的細菌屬于9個屬18個種,其中氣單胞菌屬、黃桿菌屬、嗜冷桿菌屬、希瓦氏菌屬和腸桿菌屬細菌為蝦殼肉和腮中的優勢菌群,凈化處理后蝦中分布的細菌種群數降低為6個屬9個種,其中溫和氣單胞菌(Aeromonas sobria)、陰溝腸桿菌(Enterobacter cloacae)、黃桿菌(Flavobacterium granuli)和腐敗希瓦氏菌(Shewanella putrefaciens)是殘留的優勢細菌種群。結論:超聲波協同流水凈化對活體克氏原螯蝦具有良好的減菌效果。
克氏原螯蝦;凈化;超聲波;菌群
克氏原螯蝦(Procambarus clarkii)俗稱小龍蝦,味道鮮美、風殊獨特,是一種低脂肪、高蛋白的優質水產食品,深受廣大消費者歡迎。克氏原螯蝦原產于北美洲,是我國目前養殖范圍最廣的淡水螯蝦種類。近年來,江浙滬地區大中城市的年小龍蝦消費量都在萬噸以上,僅江蘇地區小龍蝦產品(蝦仁和整肢龍蝦)出口量達5 500 t[1]。由于小龍蝦生長環境復雜但適應性強,其體內外會攜帶大量的微生物[2],其中包括一些重要的人獸共患病原如致病性嗜水氣單胞菌[3]、副溶血性弧菌[4]、致病性螺旋體[5]等,若控制不當,食用后會對人體健康產生危害并造成貿易障礙[6-7]。流水凈化系統是國外常見的蝦類凈化體系[8-9],原料蝦經過系統凈化1~2 d可以清除小龍蝦腸道消化食物,改善外觀,增加市場價值,并能夠降低去殼蝦仁的細菌數量[9]。但我國目前小龍蝦清洗凈化體系尚未形成工業化規模,清洗操作簡單,相關研究也很少,給小龍蝦及其產品的安全性和品質帶來隱患。隨著我國小龍蝦養殖和加工產業的不斷發展以及為保證消費者的食用安全,開展相關研究非常必要。近年來研究表明,超聲波在液體中的空化效應導致液體中產生瞬間高溫、高壓及其交變能夠在極短的時間內殺滅和破壞多種微生物[10],利用超聲波協同其他殺菌技術如熱處理、紫外線、化學殺菌劑量在食品加工和水處理中顯示廣闊的應用前景[11-12]。但超聲波協同流水凈化系統是否能夠實現活體小龍蝦中微生物有效減除目前國內外尚沒有相關研究報道。本實驗對克氏原螯蝦在超聲波協同流水凈化處理過程中殼肉、腮部和腸道部位的菌落總數變化進行了研究,并應用隨機擴增多態性DNA(random amplified polymorphic DNA,RAPD)指紋圖譜結合16S rDNA測序鑒定對菌相構成及變化進行了分析,旨在為原料克氏原螯蝦的減菌化處理和高效清洗和凈化體系建立奠定基礎。
1 材料與方法
1.1材料、培養基與試劑
克氏原螯蝦(Procambarus clarkii)樣品來源于揚州本地的生態農業有限公司,平均質量為(39.5±1.5)g/只。
營養肉湯瓊脂培養基和LB培養基 廣州環凱生物試劑有限公司;蛋白酶K、10×Buffer、dNTPs、Taq酶、DNA Marker、細菌16S rDNA擴增引物(8F:5’-AGAGTTTGATCCTGGCTCAG-3’和15R:5’-AAGGAG GTGATCCAGCCGCA-3’)、隨機引物(AP31:5’-AGGGGTCTTG-3’) 生工生物工程(上海)股份有限公司;其他化學試劑均為國產分析純。
1.2儀器與設備
BS210S型電子天平 北京賽多利斯天平有限公司;KQ5200超聲波洗滌器 昆山市超聲儀器有限公司;FSH-2型可調高速勻漿機 金壇市榮華儀器制造公司;UV-2401PC紫外分光光度計 日本島津公司;TG16-WS型臺式高速離心機 湘儀離心機儀器有限公司;SX-500型高壓蒸汽滅菌鍋 日本Tommy公司;DGX-9053B-2型生化培養箱 上海福瑪實驗有限公司;ABI2720熱循環儀 美國Life Technologies公司;DYYSB型穩壓穩流電泳儀 北京市六一儀器廠;凝膠成像系統 法國Vilber Lourmat公司。
1.3方法
1.3.1樣品采集
從捕撈不超過2 h的克氏原螯蝦中,挑選色澤均一、體格健碩、活力強的個體,加冰塊保藏并運送到實驗室后立即實驗。
1.3.2凈化處理
隨機選取10只克氏原螯蝦測定起始帶菌量,其余蝦隨機分成3組,每組30只放入3只容量10 L的超聲波洗滌器(40 kHz,160 W),將凈水器過濾的自來水接入洗滌池,調節水流量為45 L/h,凈化時間為12 h。處理組1不加超聲波處理;處理組2在2 h超聲處理1次,持續時間120 s;處理組3在2、6 h超聲處理2次,持續時間均為120 s,凈化過程中每隔4 h取樣1次,每次10只用于菌落總數測定。
1.3.3菌落總數測定
將克氏原螯蝦頭尾分開,無菌條件下分別取腮部,腸道以及尾部的殼與肉部分,將取下的三部分樣品分別稱質量后參考文獻[13]的方法與滅菌生理鹽水按1∶10(m/V)的比例混合并勻漿,無菌吸取勻漿1 mL用滅菌生理鹽水做10倍遞增稀釋。選擇5個連續稀釋度,每個稀釋度取250 ?L涂布營養肉湯瓊脂培養基,每個稀釋度涂布2個培養皿,倒置于37℃培養箱培養36 h,人工計數并計算菌落總數(CFU/g),實驗重復3次,取平均值表示樣品中的菌落總數。
1.3.4細菌分離
每個樣品選擇3個分離良好(菌落數在100~300 CFU/g之間,菌落無黏連)的菌落計數平板挑取單菌落,每個平板隨機挑取總菌落數的10%~15%,挑取的單菌落在營養肉湯瓊脂平板上劃線純化,挑取單菌落接種于LB液體培養基,37℃條件下培養24 h,培養物進行標號后加15%甘油于-70℃條件下凍存備用。
1.3.5細菌基因組DNA的提取
細菌基因組DNA的提取方法參照文獻[14]所述的十六烷基三甲基溴化銨(hexadecyltrimethy ammonium bromide,CTAB)法提取。
1.3.6 RAPD指紋圖譜擴增
菌株之間的基因型差異通過RAPD指紋圖譜鑒別。以細菌基因組DNA為模板,應用AP31隨機引物進行RAPD擴增。將DNA提取物用ddH2O稀釋至50 ng/μL,隨機引物濃度稀釋至10 pmol/μL,優化的聚合酶鏈式反應(polymerase chain reaction,PCR)體系為:模板2.0 ?L,dNTPs 0.5 ?L,隨機引物2.0 ?L,10×Buffer 2.5 ?L,MgCl22.5 ?L,Taq酶0.3 ?L,ddH2O 15.7 ?L;RAPD反應循環參數為:94℃預變性3 min,94℃變性1 min;36℃退火55 s;72℃延伸2 min,35個循環;72℃補充延伸10 min。取10 ?L產物在1.5%的瓊脂糖凝膠上進行電泳(電壓5 V/cm)1.5 h,EB染色20 min,凝膠成像系統拍照記錄,根據條帶清晰程度,彌散背景以及帶型強弱情況選擇穩定的指紋圖譜進行分析。
1.3.7指紋圖譜聚類分析
根據在指紋圖譜中同一遷移率位點上的擴增條帶的“有”和“無”進行數字化處理,用“1”表示“有”,“0”表示“無”,建立矩陣,應用DPS7.05數據處理系統中的0-1系統聚類分析程序,選擇Nei氏遺傳距離和類平均法進行聚類分析。
1.3.8 16S rDNA擴增及測序鑒定
以基因組DNA為模板進行16S rDNA的PCR擴增。PCR反應體系(50 ?L)包括:模板(50 ng/?L)2.0 ?L、dNTPs(10 mmol/L)2.0 ?L、25 pmol/?L引物8F和15R各2.0 ?L、10×Buffer 5.0 ?L、MgCl2(25 mmol/L)2.0 ?L、Taq酶(5 U/?L)0.3 ?L,最后加ddH2O補足至50 ?L。熱循環參數為:94℃預變性5 min;94℃變性1 min,50℃退火50 s,72℃延伸2.0 min,35次循環;72℃延伸10 min。取7.0 ?L PCR產物用1.0%的瓊脂糖凝膠電泳檢測片段大小,其余PCR產物委托生工生物工程(上海)有限公司測序,所得序列在GenBank(http∶// www. ncbi.nlm.nih.gov)數據庫中進行在線比對,序列同源性大于99%設為相同種。
2 結果與分析
2.1超聲波協同流水處理對克氏原螯蝦中菌落總數的影響
由圖1A可知,蝦殼+肉中的菌落總數為6.64(lg(CFU/g)),由圖1B、1C可知,腮部和腸腺中的菌落總數顯著高于蝦殼+肉,達到7.18、7.22(lg(CFU/g)),總體帶菌水平略低于李明彥[15]測定的結果(7.63~8.43(lg(CFU/g))),可能與蝦來源與養殖環境有關。通過流水凈化(處理組1)可以顯著降低不同部位的細菌含量,處理12 h后的蝦殼肉、腮部和腸腺中菌落總數比起始值分別降低了0.59、1.05、0.44(lg(CFU/g)),腮中的細菌在流水中比其他部位容易去除。超聲波處理能夠顯著促進凈化過程中的細菌減除,在2 h超聲處理120 s(處理組2),蝦殼+肉、腮部和腸腺中最終菌落總數比起始值分別降低了1.71、2.11、0.84(lg(CFU/g));處理組3在2 h和6 h各超聲處理120 s,最終菌落總數分別降低了2.18、2.23、1.01(lg(CFU/g)),處理組2和3中克氏原螯蝦的最終菌落總數水平均極顯著低于未加超聲波的處理組1(P<0.01),結果表明超聲波協同流水處理對克氏原螯蝦的蝦殼+肉和腮部具有良好的減菌效果。蝦死亡率是評價凈化工藝的重要指標[8-9],本實驗中在凈化中使用兩次超聲處理(間隔4 h,持續120 s),凈化結束后未出現克氏原螯蝦死亡,活力與未處理組也無明顯差別,表明在凈化中加入適當超聲波處理是可行的。
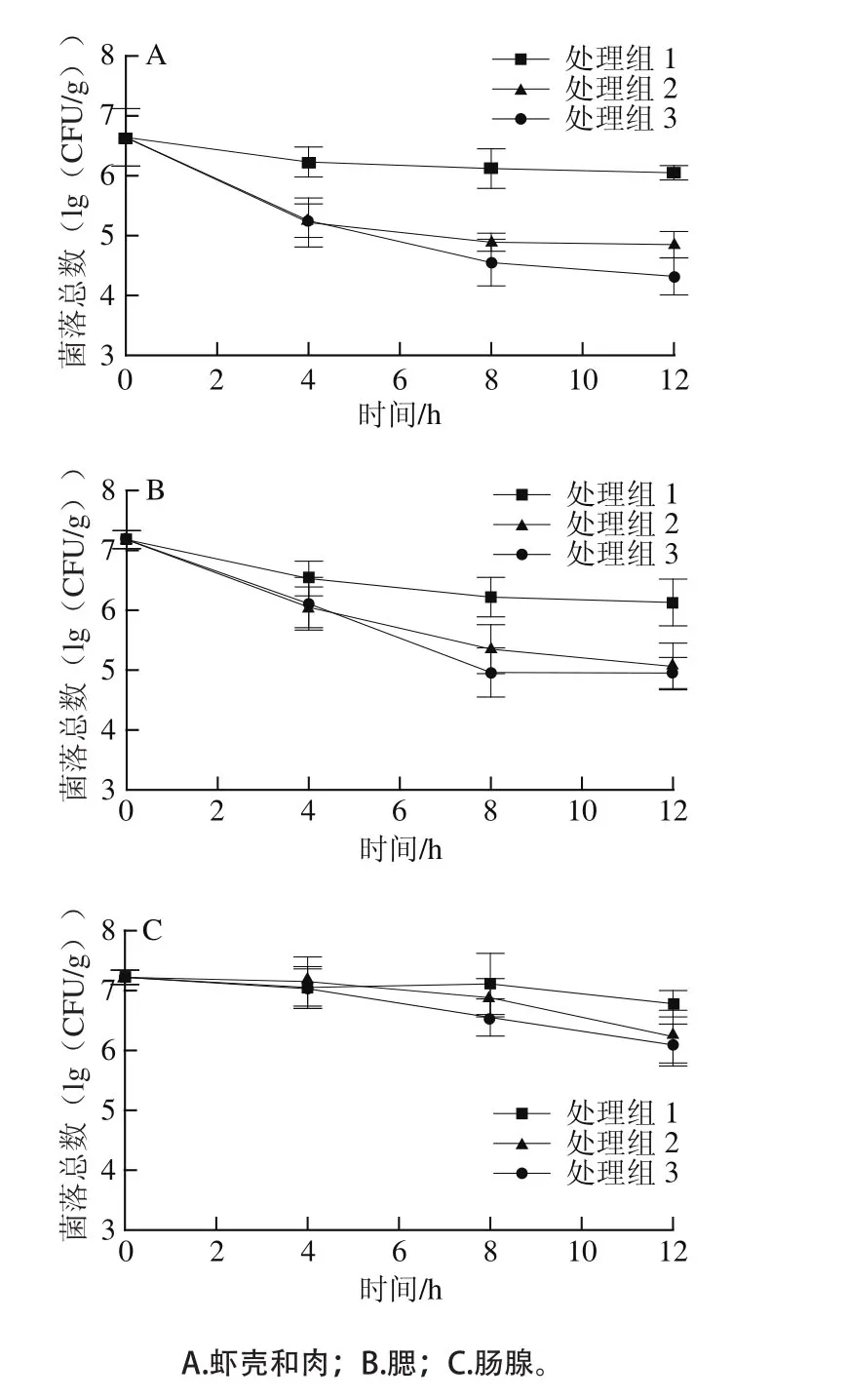
圖1 活體克氏原螯蝦在流水協同超聲波凈化過程中菌落總數變化Fig.1 Changes in total aerobic colony number in live crawfish during the purification process
2.2細菌分離
根據1.3.4節方法,共分離獲得218個分離株,其中凈化前分離菌落蝦殼+肉部分52個(編號為KR1-1~KR1-52),腮部分61個(編號為TS1-1~TS1-61);凈化后分離菌落蝦殼+肉部分49個(編號為KR3-1~KR3-49),腮部分56個(編號為TS3-1~TS3-56),所有菌落通過劃線純化后保種。
2.3指紋圖譜結果
將所有分離株提取基因組DNA,結果發現提取物OD260nm/OD280nm在1.86~2.28之間,定量結果顯示DNA質量濃度在157~475 ?g/mL,瓊脂糖凝膠電泳結果表明DNA完整,沒有斷裂和降解現象。以100 ng DNA作為模板進行RAPD指紋圖譜擴增,共獲得21個不同的指紋圖譜模式(A~U),表明所采用的隨機引物AP31和建立的體系具有較好的分型效率。克氏原螯蝦中主要好氧和兼性厭氧菌群顯示較高的分子多樣性,按不同指紋圖譜的相似性進行聚類分析,結果如圖2所示,在Nei’s遺傳距離50%處可以明顯分成5簇:Ⅰ(28%,包括A、B和N);Ⅱ(27%,包括H、O、R、Q、T、K和J);Ⅲ(27%,包括L、U、M和P);Ⅳ(1%,包括C);Ⅴ(17%,包括D、G、I、S、E和F)。其中指紋圖譜為N、P和J的菌株占47.7%,是克氏原螯蝦中的優勢菌群。RAPD技術快速、廉價、簡便,在微生物分子生態學研究中有著廣泛的應用[16],但分型效率與隨機引物序列密切相關,隨機引物AP31在前期研究中顯示了良好的種內分型能力[17],本研究結果表明常規培養結合AP31建立的RAPD體系可以實現克氏原螯蝦中菌群構成的快速分析。

圖2 細菌RAPD指紋圖譜擴增及聚類分析結果Fig.2 Cluster analysis of RAPD patterns of bacterial isolates
2.4 16S rDNA測序鑒定結果
研究表明RAPD指紋圖譜可以應用于鑒別種內差異[18],因此本研究將具有相同指紋圖譜模式的菌株認為具有相同種屬,選取代表菌株進行16S rDNA測序鑒定,結果應用引物8F和15R及建立的PCR方法能夠順利擴增出產物,片段大小為1 500 bp左右,將擴增產物委托生工生物工程(上海)股份有限公司測序,測序結果進行在線比對,結果如表1所示。結果表明21個譜型的細菌屬于9個屬18個種,其中不動桿菌屬(Acinetobactersp.)包括A型和B型菌株;氣單胞菌屬(Aeromonassp.)包括R、H、T、Q和O型菌株;芽孢桿菌屬(Bacillussp.)包括C型菌株;腸桿菌屬(Enterobactersp.)包括J型菌株;黃桿菌屬(Flavobacteriumsp.)包括N型菌株;假單胞菌屬(Pseudomonassp.)包括E和F型菌株;嗜冷桿菌屬(Psychrobactersp.)包括D、G、I和S型菌株;希瓦氏菌屬(Shewanellasp.)包括M、L、U和P型菌株;K型菌株屬于叢毛單胞菌屬(Comamonas jiangduensis)。Scott等[2]研究表明41%的淡水龍蝦血淋巴中攜帶不動桿菌屬、氣單胞菌屬、節細菌屬、芽孢桿菌屬、棒狀桿菌屬、黃桿菌屬、假單胞菌屬和弧菌屬的細菌,本研究中共分離9個屬細菌,其中的5個屬與Scott等研究一致,表明這些細菌是克氏原螯蝦普遍攜帶的菌群,另外分離到的4個屬(腸桿菌屬、嗜冷桿菌屬、希瓦氏菌屬、叢毛單胞菌屬)可能與本地克氏原螯蝦的養殖水體環境有關。

表1 不同基因型細菌分離株的16S rDNA測序鑒定結果Table1 16S rDNA sequencing identification results for different genotypes of bacterial isolates
2.5細菌種群變化
結合菌株指紋圖譜的分布和測序鑒定結果,對超聲波協同流水處理前后克氏原螯蝦攜帶菌群的構成進行分析,結果如表2所示。結果顯示超過50%的種群在凈化以后不能被檢測到,表明超聲波協同流水處理極大地減少了蝦殼肉和腮中攜帶的細菌種群數量,在蝦殼+肉部分,起始菌群中包括13個RAPD譜型,凈化以后能檢測到的只有6個RAPD型,分別屬于Pseudomonas putida、Psychrobacter glacincola、Shewanella baltica、Flavobacterium granuli、Shewanella putrefaciens、Aeromonas sobria6個種。在克氏原螯蝦的腮部起始菌群極具多樣性,能夠檢出18個RAPD型,凈化以后只能檢測到9個RAPD型,分別屬于Aeromonas piscicola、Aeromonas sobria、Aeromonas hydrophila、Pseudomonas putida、Psychrobacter glacincola、Enterobacter cloacae、Flavobacterium granuli、Shewanella putrefaciens8 個種,其中Aeromonas sobria、Enterobacter cloacae、Flavobacterium granuli和Shewanella putrefaciens是凈化以后克氏原螯蝦中殘留的優勢種群,這4種細菌廣泛分布于土壤和水體環境中,是魚類等水生動物疾病的重要病原菌[19-20],但對龍蝦的致病性尚未見報道,其中Aeromonas sobria和Enterobacter cloacae能夠產生毒素并對人類具有致病性[21-24],Flavobacterium granuli和Shewanella putrefaciens水產食品的重要腐敗菌[20,25],尤其Shewanella putrefaciens冷藏水產類的主要腐敗菌,其腐敗活性強,在低溫和低氧條件下能夠代謝產生腐敗效應[26],在克氏原螯蝦及其產品加工中應該針對這4種細菌采取抑菌措施,確保產品安全和衛生。

表2 超聲波協同流水凈化對克氏原螯蝦菌群構成的影響Table2 Effect of ultrasonic and running water treatments on bacterial community composition of crawfish
3 結 論
克氏原螯蝦攜帶高水平的好氧和兼性好氧細菌,殼+肉部分攜帶量為6.64(lg(CFU/g)),腮部和腸腺中達到7.18、7.22(lg(CFU/g)),流水凈化可以降低克氏原螯蝦中的細菌載量,處理12 h后,腮部細菌總數降低最多,達到1.05(lg(CFU/g))。超聲波處理能夠顯著促進流水凈化過程中的細菌減少,兩次超聲處理使蝦殼肉、腮部和腸道中細菌載量最終降低2.18、2.23、1.01(lg(CFU/g)),表明超聲波協同流水處理對活克氏原螯蝦的蝦殼+肉和腮部具有良好的減菌效果。
克氏原螯蝦攜帶菌群構成具有高度種屬和分子多樣性,主要包括不動桿菌屬、氣單胞菌屬、芽孢桿菌屬、腸桿菌屬、黃桿菌屬、假單胞菌屬、嗜冷桿菌屬、希瓦氏菌屬以及Comamonas屬,其中氣單胞菌屬、黃桿菌屬、嗜冷桿菌屬、希瓦氏菌屬和腸桿菌屬細菌為優勢菌群。超聲處理協同流水凈化能有效降低蝦殼肉和腮部攜帶的好氧和兼性好氧細菌種群數量,50%以上的種群在凈化以后不能被檢測到,但溫和氣單胞菌(Aeromonas sobria)、陰溝腸桿菌(Enterobacter cloacae)、黃桿菌(Flavobacterium granuli)和腐敗希瓦氏菌(Shewanella putrefaciens)仍然是凈化以后克氏原螯蝦中殘留的優勢種群,在后期加工中可以針對這4個屬種細菌采取抑菌措施。
[1] 沈毅. 江蘇省小龍蝦產業發展報告[J]. 中國水產, 2010(6)∶ 14-16.
[2] SCOTT J R, THUNE R L. Bacterial flora of hemolymph from red swamp crawfish, Procambarus clarkii (Girard), from commercial ponds[J]. Aquaculture, 1986, 58(3/4)∶ 161-165.
[3] 馬小榮, 薛暉, 唐建清. 克氏原螯蝦致病性嗜水氣單胞菌的分離鑒定及藥敏試驗[J]. 水產養殖, 2012, 33(8)∶ 45-47.
[4] 陳昌福, 劉遠高, 何廣文, 等. 克氏原螯蝦暴發病細菌性病原的研究[J].華中農業大學學報, 2009, 28(2)∶ 193-197.
[5] WANG Junhai, HUANG Hua, FENG Qi, et al. Enzyme-liked immunosorbent assay for the detection of pathogenic spiroplasma in commercially exploited crustaceans from China[J]. Aquaculture, 2009, 292(3/4)∶ 166-171.
[6] 陳秀開. 出口淡水小龍蝦產品風險分析研究[D]. 青島∶ 中國海洋大學, 2004∶ 6-14.
[7] 倪治明. 浙北地區餐飲業小龍蝦重點危害因子調查及風險評估[D].杭州∶ 浙江大學, 2013∶ 30-36.
[8] LAWSON T B, DRAPCHO C M. A comparison of three crawfish purging treatments[J]. Aquacultural Engineering, 1989, 8(5)∶ 339-347.
[9] MCCLAIN W R. Assessment of depuration system and duration on gut evacuation rate and mortality of red swamp crawfish[J]. Aquaculture, 2000, 186(3/4)∶ 267-278.
[10] COLLIS J, MANASSEH R, LIOVIC P, et al. Cavitation microstreaming and stress fields created by microbubbles[J]. Ultrasonics, 2010, 50(2)∶ 273-279.
[11] BROEKMAN S, POHLMANN O, BEARDWOOD E S, et al. Ultrasonic treatment for microbiological control of water systems[J]. Ultrasonics Sonochemistry, 2010, 17(6)∶ 1041-1048.
[12] 栗星, 包海蓉. 超聲波在食品殺菌中的研究現狀[J]. 農產品加工業, 2008(6)∶ 25-28.
[13] 食品安全國家標準. GB 4789.2—2010食品微生物學檢驗菌落總數測定[S]. 北京∶ 中國標準出版社, 2010.
[14] 奧斯伯. 精編分子生物學指南[M]. 5版. 北京∶ 科學出版社, 2008∶39-40.
[15] 李明彥. HACCP 體系在凍煮龍蝦仁生產中的應用研究[D]. 楊凌∶西北農林科技大學, 2008∶ 34-36.
[16] KWON G H, LEE H A, PARK J Y, et al. Development of a RAPDPCR method for identification of Bacillus species isolated from Cheonggukjang[J]. International Journal of Food Microbiology, 2009, 129(3)∶ 282-287.
[17] YANG Z Q, JIAO X A, ZHOU X H, et al. Isolation and molecular characterization of Vibrio parahaemolyticus from fresh, lowtemperature preserved, dried, and salted seafood products in two coastal areas of eastern China[J]. International Journal of Food Microbiology, 2008, 125(3)∶ 279-285.
[18] NANVAZADEH F, KHOSRAVI A D, ZOLFAGHARI M R, et al. Genotyping of Pseudomonas aeruginosa strains isolated from burn patients by RAPD-PCR[J]. Burns, 2013, 39(7)∶ 1409-1413.
[19] 姚東瑞, 邴旭文, 朱明, 等. 泥鰍(Misgurnus anguillicaudatus)病原溫和氣單胞菌(Aeromonas sobria)分子鑒定及耐藥性研究[J]. 海洋與湖沼, 2010, 41(5)∶ 756-762.
[20] ZAMORA L, VELAA I, SANCHEZ-PORRO C, et al. Characterization of flavobacteria possibly associated with fish and fish farm environment. Description of three novel Flavobacterium species∶Flavobacterium collinsii sp. nov., Flavobacterium branchiarum sp. nov., and Flavobacterium branchiicola sp. nov.[J]. Aquaculture, 2013, 416/417∶ 346-353.
[21] 李剛山, 王惠萱 王意銀, 等. 云南戰區部隊駐地腹瀉患者中首次檢出溫和氣單胞菌[J]. 中國熱帶醫學, 2012, 12(11)∶ 1317-1319.
[22] SANDER W E, SANDERS C C. Enterobacter spp.∶ pathogens poised to flourish at the turn of the century[J]. Clinical Microbiology Reviews, 1997, 10(2)∶ 220-241.
[23] 何海明, 劉金波. 陰溝腸桿菌感染的臨床特點及耐藥性分析[J]. 武警醫學院學報, 2010, 19(7)∶ 530-532.
[24] KROVACEK K, FARIS A, MANSSON I. Growth of and toxin production by Aeromonas hydrophila and Aeromonas sobria at low temperatures[J]. International Journal of Food Microbiology, 1991, 13(2)∶ 165-175.
[25] J?RGENSEN B R, HUSS H H. Growth and activity of Shewanella putrefaciens isolated from spoiling fish[J]. International of Journal Food Microbiology, 1989, 9(1)∶ 51-62.
[26] L?PEZ-CABALLERO M E, S?NCHEZ-FERN?NDEZ J A, MORAL A. Growth and metabolic activity of Shewanella putrefaciens maintained under different CO2and O2concentrations[J]. International Journal of Food Microbiology, 2001, 64(3)∶ 277-287.
Effect of Synergistic Purification with Ultrasonic and Running Water on Bacterial Load and Microflora in Crawfish (Procambarus clarkii)
YANG Zhenquan, ZHOU Haibo, GAO Lu, RAO Shengqi, YIN Yongqi, FANG Weiming
(College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China)
Objective∶ To examine the effect of synergistic purification with ultrasonic and running water on bacterial quantity and community composition in live crawfish (Procambarus clarkii). Methods∶ The bacterial colony numbers in the unshelled meat, grills and intestinal parts of crawfish were determined during the purification process and changes in bacterial community composition were analyzed using random amplified polymorphic DNA (RAPD) fingerprint technique combined with 16S rDNA sequencing identification.Results∶ The purification procedure by ultrasonic combined with running water significantly reduced the bacterial loads in the unshelled meat, grills and intestine of crawfish to 2.18, 2.23 and 1.01 (lg (CFU/g)), respectively. A total of 218 single colonies were collected from bacterial counting plates, fingerprint patterns of 21 colonies of which were obtained through RAPD analysis. The 16S rDNA sequencing identification showed that the isolates with different fingerprint patterns belonged to 9 bacterial genera including 18 species, among whichAeromonassp.,Flavobacteriumsp.,Pseudomonassp.,Shewanellasp. andEnterobactersp. were the predominant bacterial groups for crawfish shell, meat and gills. After being purified with ultrasonic and running water, the remaining bacterial groups were reduced to 9 species from 6 genera, among which,Aeromonas sobria,Enterobacter cloacae,Flavobacterium granuliandShewanella putrefacienswere the major residual bacteria species. Conclusion∶ The synergistic purification with ultrasonic and running water is highly effective in reducing bacterial level and species in live crawfish.
Procambarus clarkii; purification; ultrasonic; microflora
S986.1
1002-6630(2015)17-0173-06
10.7506/spkx1002-6630-201517033
2014-11-24
蘇北科技發展計劃項目(BC2013438);江蘇省科技支撐計劃項目(BE2013733);江蘇省青藍工程資助項目
楊振泉(1975—),男,副教授,博士,主要從事食品微生物資源開發與利用研究。E-mail:yangzq@yzu.edu.cn

