干燥方式對桑葉降糖活性成分含量的影響
秦櫻瑞,曾藝濤,楊 娟,丁曉雯,黃先智*
(1.西南大學食品科學學院,重慶市農產品加工及貯藏重點實驗室,重慶 400716;2.西南大學食品科學學院,家蠶基因組生物學國家重點實驗室,重慶 400716)
干燥方式對桑葉降糖活性成分含量的影響
秦櫻瑞1,曾藝濤1,楊 娟1,丁曉雯1,黃先智2,*
(1.西南大學食品科學學院,重慶市農產品加工及貯藏重點實驗室,重慶 400716;2.西南大學食品科學學院,家蠶基因組生物學國家重點實驗室,重慶 400716)
本實驗探討了冷凍干燥、真空干燥、微波干燥和熱風干燥4種不同干燥方式對桑葉降糖活性成分的影響。采用高效液相色譜法測定桑葉1-脫氧野尻霉素(1-deoxynojirimycin,DNJ)含量、苯酚-硫酸法測桑葉多糖含量、亞硝酸鈉法測定桑葉總黃酮含量。結果表明:冷凍干燥法制備的桑葉色澤最好,與新鮮桑葉最為接近,但DNJ和總黃酮的含量都較低;真空干燥法制備的桑葉DNJ和多糖含量最低,且桑葉的色澤也最差;微波干燥對桑葉的降糖成分和色澤影響較小,當功率為140 W處理10 min時,其DNJ和多糖的含量最高,分別為(297.15±6.35)mg/100 g和(11.71±0.01)%;熱風干燥的時間較短,對桑葉的顏色影響也較小,當干燥溫度為75℃,干燥時間為60 min,所得桑葉的DNJ、總黃酮、多糖的含量都較高,分別為(227.47±5.79)mg/100 g、(49.51±1.18)mg/g和(11.29±0.01)%。因此熱風干燥更適合于工業化生產中大批量桑葉的干燥。同時測定對α-葡萄糖苷酶和α-淀粉酶的抑制作用可知干燥后桑葉降糖物質結構未發生改變,降糖效果依然存在。
桑葉;干燥;1-脫氧野尻霉素;黃酮;多糖
桑葉為桑科(Moraceae)植物桑(Morus albaL.)的葉,又名鐵扇子,味苦、甘,性寒,歸肺、肝經,具有疏風清熱、平肝明目的功效[1]。歷代中醫藥書籍如《本草綱目》、《神農本草經》等均記載桑葉能夠治療消渴癥,現代藥理研究也表明桑葉具有降血糖[2]、降血脂[3]、降血壓[4]、抗炎、抗腫瘤[5]及預防冠心病[6]等多種藥理活性,我國衛生部將其列為藥食兩用中藥材之一[7]。
目前,糖尿病已成為威脅人類健康的主要疾病之一,而桑葉中的降糖物質能夠有效降低患者的血糖水平,促進其恢復健康[8]。國內外學者對桑葉降糖的功能和作用機理進行了一些研究報道,Jeszka-Skowron等[9]將桑葉醇提物混合到高脂飼料中,再給予經過鏈脲霉素誘導的糖尿病大鼠,發現桑葉醇提物能夠有效降低糖尿病大鼠的血糖,促進胰島素分泌。Chung等[10]對50個健康受試者分別給予不同劑量的桑葉水提物,發現桑葉水提物能夠有效抑制受試者正餐后血糖水平升高。
桑葉中的降糖物質主要是生物堿、黃酮、多糖等[11-12]。盛琳波等[13]通過對1-脫氧野尻霉素(1-deoxynojirimycin,DNJ)含量的影響因素及穩定性進行研究發現桑樹乳汁在常溫、4、-20℃條件下短時間(28 d內)保存的DNJ含量相對穩定,其粗提液中的DNJ則容易降解。張軍等[14]研究了不同溫度下乙醇對桑葉黃酮浸提效果的影響,發現60、70℃左右時,黃酮的得率最高,85℃時左右下降。劉凡等[15]通過對桑葉多糖、黃酮、生物堿聯合提取工藝條件的研究發現當水溶液的提取溫度達到80℃時,桑葉的多糖和黃酮達到峰值。為了在桑葉的干燥過程中更多地保留這些降糖成分,本實驗采用不同的方法干燥桑葉,比較干燥前后桑葉降糖成分的變化,以選擇最優的干燥方法,為桑葉產品的開發利用提供一條理想的干燥路線,以期達到更好的降糖效果。
1 材料與方法
1.1材料與試劑
桑葉(勝利大葉),采摘于重慶市蠶業科學技術研究院。
DNJ標準品(純度≥98%) 北京德威鈉生物技術有限公司;蘆丁(純度≥98%) 中國藥品生物制品檢定所;芴甲氧羰酰氯(9-fluorenylmethyl chloroformate,FMOC-Cl)、甘氨酸 美國Sigma公司;乙腈、醋酸、D-葡萄糖、苯酚、濃硫酸、甲醇等常用試劑均為分析純。
1.2儀器與設備
Agilent 1260高效液相色譜儀 美國安捷倫公司;S22分光光度計 上海棱光技術有限公司;GZX-9140MBE電熱鼓風干燥箱 上海博訊實業有限公司;5810型臺式高速離心機 德國Eppendor公司;WD700(MG-5033M)LG微波爐 天津樂金電子電器有限公司;DZF-6021真空干燥箱 上海齊欣科學儀器有限公司;SCANLAF Coolsafe55-4真空冷凍干燥機 香港基因有限公司;KQ5200DB超聲波清洗機 昆山市超聲儀器有限公司。
1.3方法
1.3.1桑葉的前處理
桑葉去柄、清洗、瀝干表面水分,切為5 cm×5 cm左右的葉片,備用。為了更好地保存桑葉,延長其貯藏期,使其干燥后水分含量在安全水分14%以下[16]。
1.3.2桑葉的干燥處理
1.3.2.1熱風干燥
稱取桑葉30 g左右平鋪于托盤中,于鼓風干燥箱中干燥。干燥條件分別為65℃、100 min,75℃、60 min,85℃、50 min。將干燥后的桑葉粉碎測定相關指標。
1.3.2.2微波干燥
稱取桑葉30 g左右平鋪于玻璃盤中,于微波爐中干燥。干燥條件分別為微波功率140 W、10 min,280 W、8 min,420 W、6 min。將干燥后的桑葉粉碎測定相關指標。
1.3.2.3冷凍干燥
稱取桑葉30 g左右,采用桑葉直接凍干、桑葉85℃燙漂3 min后凍干、桑葉打漿后凍干、桑葉85℃燙漂3 min打漿后凍干4種方式處理。凍干條件:在-80℃預凍6 h,再進行真空冷凍干燥,冷阱溫度-50℃左右,真空度0.025 MPa,干燥6 h。將干燥后的桑葉粉碎測定相關指標。
1.3.2.4真空干燥
稱取桑葉30 g左右,平鋪于托盤中,于真空干燥機中干燥。干燥條件分別為65℃、0.07 MPa、4 h,75℃、0.08 MPa、2.5 h,85℃、0.09 MPa、1.5 h。將干燥后的桑葉粉碎測定相關指標。
1.3.3桑葉水分含量的測定
按照國標GB 5009.3—2010《食品安全國家標準 食品中水分的測定》中的直接干燥法[17]。
1.3.4桑葉降糖成分的測定
1.3.4.1 DNJ含量的測定
按照參考文獻[18-19]的方法略加修改進行測定。測試樣品的制備:稱取干燥好的桑葉粉0.5 g,加入35 mL超純水,80℃水浴浸提2 h(每20 min搖勻一次),抽濾,濾渣再加15 mL超純水重復提取1次,合并2次濾液用超純水定容至50 mL,即得樣品提取液。
DNJ的衍生化:取DNJ提取液(或標準液)300μL于10.0 mL離心管中,加入0.4 mol/L的硼酸鉀緩沖溶液(pH 8.5)300μL,再加入5 mmol/L的FMOC-Cl(溶于乙腈中)300μL,混勻,25℃水浴20 min。加入1 mol/L的甘氨酸300μL中和剩余的FMOC-Cl以終止反應,加入體積分數為1%的醋酸液300μL及超純水1 200μL稀釋,6 000 r/min離心10 min,再以0.45μm微孔濾膜過濾器過濾,收集濾液備用。
高效液相色譜(high performance liquid chromatography,HPLC)條件:色譜柱:C18柱(150 mm×4.6 mm,5μm);流動相:乙腈-0.1%醋酸(50∶50,V/V);流速1.0 mL/min;柱溫25℃;進樣量10μL;紫外檢測器,檢測波長254 nm。
標準曲線繪制:對不同質量濃度的DNJ標準溶液進行測定,以DNJ質量濃度為橫坐標,峰面積為縱座標繪制標準曲線,得到回歸方程為y=2.335 9x-0.005 5(R2=0.999 8)。
1.3.4.2桑葉總黃酮含量的測定
按照參考文獻[20]的方法略加修改進行測定。稱取干燥好的桑葉粉1 g左右,加入30 mL甲醇,60℃水浴浸提1 h,抽濾,濾渣再重復提取2次,合并濾液,以甲醇定容至100 mL,得到供試液。取供試液1.0 mL于25 mL的容量瓶中,加入蒸餾水5.0 mL,5%的亞硝酸鈉溶液1.0 mL,混勻,放置5 min,加1 mol/L NaOH溶液10 mL,甲醇定容至25 mL,于508 nm波長處測定吸光度。
按照以上方法測定不同質量蘆丁標準溶液的吸光度,以蘆丁質量濃度為橫坐標,吸光度為縱坐標繪制標準曲線,得到回歸方程為y=0.465 1x+0.017 8(R2=0.999 5)。
1.3.4.3桑葉多糖含量的測定
按照參考文獻[21]的方法略加修改進行測定。稱取干燥好的桑葉粉0.25 g左右于藍蓋瓶中,加入25 mL的沸蒸餾水于超聲波清洗機中在功率100 W,55℃條件下超聲提取20 min,將提取液搖勻后抽濾,定容至25 mL。取1.0 mL濾液于50 mL容量瓶中,用蒸餾水定容后取2.0 mL至20 mL具塞試管中,加入1.0 mL 5%的苯酚溶液,再立即加入5.0 mL濃硫酸,靜置30 min后于490 nm波長處測定吸光度。
按照以上方法測定不同質量的葡萄糖標準溶液的吸光度,以葡萄糖質量濃度為橫坐標,吸光度為縱坐標繪制標準曲線,得到回歸方程為y=0.009 7x-0.002 7(R2=0.999 5)。
1.3.5桑葉粉顏色評定
組織經過訓練的5人評定小組對桑葉粉的顏色進行感官評價。以最接近新鮮桑葉者得分最高,采用1~5分評分法,褐綠色(1分),深綠色(2分),黃綠色(3分),綠色(4分),翠綠色(5分),色澤位于兩者之間的酌情給分。1.3.6桑葉粉提取物對α-葡萄糖苷酶的抑制作用
參照文獻[22-23]的方法加以改進而得。選取熱風75℃干燥60 min、含水量為(4.87±0.21)%的桑葉粉按照1.3.4.1節的方法制備提取液A。在37℃反應體系中依次加入磷酸鹽緩沖溶液(0.1 mol/L,pH 6.8)3.0 mL、5 U/mL的α-葡萄糖苷酶液20μL(0.1 mol/L pH 6.8的磷酸鹽緩沖溶液配制),樣品制備液A 100μL,且每次測試的總體積為3.12 mL。以上試液混勻后放入37℃恒溫水浴中平衡15 min,然后加入100μL2.5 mmol/L的4-硝基苯-α-D-吡喃葡糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG,0.1 mol/L pH 6.8的磷酸鹽緩沖溶液配制)啟動反應,恒溫反應15 min后,加入5 mL 1 mol/L的Na2CO3終止反應,于400 nm波長處測定吸光度。同時做相同體系下的樣品空白組(蒸餾水代替樣品,加入Na2CO3后再加入PNPG)、樣品對照組(蒸餾水代替樣品,加入PNPG后再加入Na2CO3)、樣品顏色干擾組(樣品,加入Na2CO3后再加入PNPG)。α-葡萄糖苷酶抑制率計算公式如下。
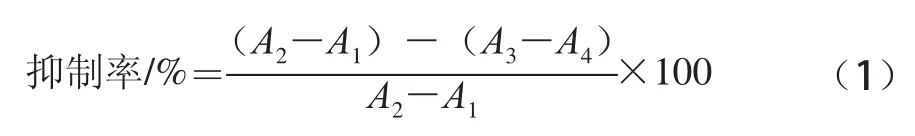
式中:A1為樣品空白組吸光度;A2為樣品對照組吸光度;A3為樣品組吸光度;A4為樣品顏色干擾組吸光度。1.3.7桑葉粉提取物對α-淀粉酶的抑制作用
參照文獻[24-26]的方法加以改進而得。在37℃反應體系中依次加入125 U/mLα-淀粉酶液200μL(0.1 mol/L pH 6.8的磷酸鹽緩沖溶液配制),樣品制備液A 100μL,放入37℃恒溫水浴中平衡5 min,然后加入1%可溶性淀粉500μL啟動反應,恒溫反應5 min后加入500μL3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS)顯色劑,沸水浴5 min顯色,然后立即加入冰水浴冷卻,定容至25 mL后于540 nm波長處測定吸光度。同時做相同體系下的樣品空白組(蒸餾水代替樣品),樣品顏色干擾組(蒸餾水代替酶液)。
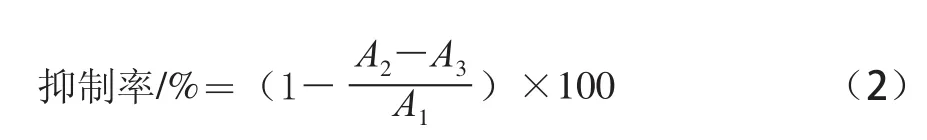
式中:A1為樣品空白組吸光度;A2為樣品組吸光度;A3為樣品顏色干擾組吸光度。
1.4數據統計
每項實驗均重復3次以上,實驗結果以表示,采用Excel 2003、SPSS 17.0進行數據分析。
2 結果與分析
2.1不同干燥方法對桑葉水分及降糖成分的影響
2.1.1熱風干燥法對桑葉中水分及降糖成分的影響

表1 熱風干燥對桑葉中水分及降糖成分的影響Table1 Effect of hot air drying on the contents of moisture and hypoglycemic components in mulberry leaves
由表1可知,熱風干燥的桑葉含水量在4.34%~4.87%之間,遠遠低于14%,有利于桑葉長期保存。當干燥溫度為75℃時,桑葉中DNJ和多糖的含量分別為(227.47±5.79)mg/100 g和(11.29±0.01)%,與85℃時DNJ和多糖含量相比無顯著性差異(P>0.05);而75℃時桑葉總黃酮的含量為(49.51±1.18)mg/100 g,與85℃時相比顯著增加(P<0.05)。因此,75℃的干燥方式優于85℃。當干燥溫度為65℃時,雖然總黃酮的含量與75℃時相比無顯著性差異(P>0.05),但是此溫度下DNJ
和多糖的含量分別為(196.13±16.34)mg/100 g和(11.07±0.01)%,均顯著低于75℃時所得桑葉中這兩種物質的含量(P<0.05)。因此,75℃的干燥方式也優于65℃。隨著干燥溫度的升高,DNJ的含量隨之上升,這可能是因為干燥溫度越高,干燥的時間就越短,對DNJ的破壞較小,而總黃酮的含量反而下降,可能是因為黃酮屬于熱敏性物質,溫度越高對黃酮的破壞程度越大,黃酮的損失就越大。對桑葉粉的顏色評價表明,熱風干燥后的桑葉粉均呈綠色,對顏色的影響較小。從干燥后所得桑葉粉顏色、各降糖成分的含量高低綜合考慮,熱風干燥選擇75℃干燥60 min為宜。
2.1.2微波干燥對桑葉中水分及降糖成分的影響
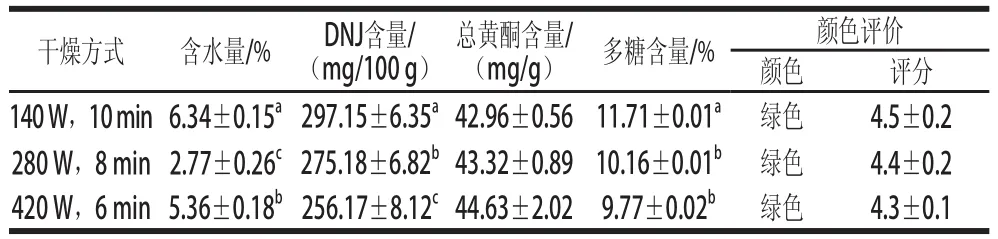
表2 微波干燥對桑葉中水分及降糖成分的影響Table2 Effect of microwave drying method on the contents of moisture and hypoglycemic components in mulberry
由表2可知,微波干燥桑葉所需的時間非常短,均在10 min內,且桑葉的含水量較低,在2.77%~6.34%之間,遠遠低于14%,有利于桑葉長期保存。當微波功率為420 W干燥6 min時,桑葉DNJ的含量最低為(256.17±8.12)mg/100 g,多糖的含量也最低為(9.77±0.02)%。這可能是因為功率越大對DNJ的破壞越大,同時桑葉中的多糖發生焦糖化反應等原因造成的。當干燥功率為140 W時,桑葉中DNJ的含量最高為(297.15±6.35)mg/100 g,多糖含量也最高為(11.71±0.01)%,且總黃酮的含量與420 W時干燥比較無顯著性差異(P>0.05)。通過對桑葉粉的顏色評價表明,微波干燥的桑葉顏色與新鮮桑葉較為接近,均呈現綠色。從干燥后桑葉粉的顏色、各降糖成分的含量綜合考慮,微波干燥選擇140 W干燥10 min最好。
2.1.3冷凍干燥對桑葉中水分及降糖成分的影響

表3 冷凍干燥對桑葉中水分及降糖成分的影響Table3 Effect of freeze drying method on the contents of moisture and hypoglycemic components in mulberry-leavess
由表3可知,通過不同方式前處理的桑葉,在同樣的冷凍干燥條件下干燥后,含水量相差較大,但都在6%以下,遠遠低于14%,有利于桑葉長期保存。未燙漂直接冷凍干燥得到的桑葉粉,DNJ的含量為(177.71±15.18)mg/100 g,總黃酮含量最高為(40.23±0.55)mg/g,多糖含量為(11.16±0.04)%。黃酮在低溫下更穩定,但隨著干燥時間的增加黃酮的損失也會加大[27]。桑葉先在-80℃預凍6 h,再在-50℃干燥6 h,干燥時間較長,造成黃酮損失較大。所以冷凍干燥下,總黃酮的含量反而更低。桑葉燙漂后直接進行冷凍干燥得到的桑葉粉,DNJ的含量最低為(150.27±1.33)mg/100 g,總黃酮含量也最低為(21.68±0.21)mg/g,但多糖含量最高為(11.46±0.01)%。桑葉打漿后直接進行干燥得到的桑葉粉,DNJ的含量為(193.33±4.10)mg/100 g,與桑葉燙漂打漿后進行冷凍干燥的桑葉相比無顯著性差異(P>0.05),總黃酮含量為(40.19±0.83)mg/g,多糖含量為(11.46±0.01)%。桑葉燙漂后在打漿進行冷凍干燥,桑葉粉DNJ的含量為(200.71±10.78)mg/100 g,多糖含量為(10.23±0.05)%,總黃酮含量為(22.41±0.65)mg/g,但顯著低于未燙漂直接進行干燥和桑葉打漿后直接進行干燥的桑葉粉的總黃酮含量(P<0.05),這可能時因為黃酮易溶于熱水,在85℃燙漂的過程中,桑葉中的黃酮溶于熱水受到了一定的損失造成[28],因此桑葉不宜進行燙漂。通過對桑葉粉的顏色評價表明,冷凍干燥的桑葉顏色呈翠綠色,與新鮮桑葉最為接近。綜合考慮,在所采用的4種冷凍干燥方式中,以桑葉打漿后再冷凍干燥6 h的方式最為適宜。
2.1.4真空干燥對桑葉中水分及降糖成分的影響
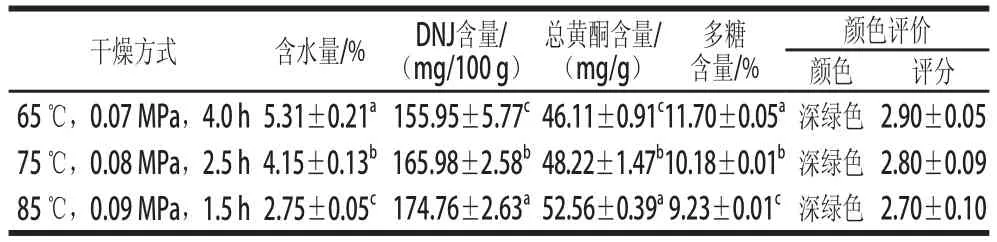
表4 真空干燥對桑葉中水分及降糖成分的影響Table4 Effect of hot air and vacuum method on the contents of moisture and hypoglycemic components in mulberry leaves
由表4可知,使用真空干燥得到的桑葉粉含水量在2.75%~5.31%之間,遠遠低于14%,有利于桑葉長期保存。桑葉經真空干燥處理后,DNJ的含量均較低,當干燥溫度為85℃時,DNJ與總黃酮的含量分別為(174.76±2.63)mg/100 g和(52.56±0.39)mg/g,顯著高于65、75℃兩種干燥方式中DNJ和總黃酮的含量(P<0.05),而85℃時多糖的含量最低為(9.23±0.01)%。但DNJ與黃酮的降糖效果要優于多糖[10],主要考慮DNJ和總黃酮的含量。真空干燥處理所得桑葉粉的顏色為深綠色,評分較低。綜合考慮真空干燥桑葉的3種方式,選擇85℃,0.09 MPa,干燥1.5 h為宜。
2.24種干燥方法的綜合比較
通過對以上4種干燥方式的分析比較,各選取其中最好的干燥方式進行比較。桑葉中DNJ的降糖效果要優于黃酮和多糖,因此以DNJ的含量作為最主要的考核指標,其次為黃酮[29]。通過對4種較優干燥方式的比較分析可知,冷凍干燥雖然能使桑葉保持與新鮮桑葉最接近的顏色,但是卻使桑葉中DNJ含量較低為(193.33±4.10)mg/100 g,且總黃酮的含量也最低為(40.19±0.83)mg/g;同時冷凍干燥所用的時間最長達6 h,能耗較多,成本高。因此從降糖物質保存和生產成本考慮,桑葉不適用于冷凍干燥。
真空干燥桑葉的時間較長,D N J的含量最低為(174.76±2.63)mg/100 g,與冷凍干燥相比顯著降低(P<0.05),同時其多糖含量也最低為(9.23±0.01)%,顏色呈現深綠色,感官品質最差。因此,從各降糖成分的含量和生產成本考慮,桑葉也不適于采用真空干燥。
微波干燥的時間最短,當干燥功率為140 W時干燥時間僅為10 min,且DNJ的含量最高為(297.15±6.35)mg/100 g,顯著高于其他3種干燥方式處理桑葉的DNJ含量(P<0.05),多糖的含量也最高為(11.71±0.01)%,總黃酮的含量為(42.96±0.56)mg/g。微波干燥后的桑葉均呈現綠色,干燥過程中也未出現燒焦、發泡等現象。雖然微波干燥所用的時間短,但是微波干燥的載物量對其干燥速度的影響較大,隨著載物量的增加,干燥時間會相應延長[30]。當大批量干燥時成本將增大,因此微波干燥不適于大批量桑葉的干燥。
熱風干燥的時間也較短,當溫度為75℃時,干燥時間為60 min,DNJ的含量為(227.47±5.79)mg/100 g,與冷凍干燥和真空干燥相比顯著升高(P<0.05),總黃酮和多糖的含量也較高,分別為(49.51±1.18)mg/g和(11.29±0.01)%。熱風干燥后桑葉的顏色為綠色,與新鮮桑葉也比較接近。熱風干燥是目前采用最多、最為經濟的干燥方法,因此熱風干燥是大量干燥桑葉較為理想的干燥方法。
2.3桑葉粉提取液對α-葡萄糖苷酶的抑制作用
抑制α-葡萄糖苷酶的活性可減緩葡萄糖的生成及吸收,調整血糖水平,降低餐后血糖峰值,降低高血糖對胰腺的刺激,提高胰島素敏感性,從而保護胰腺功能[31]。通過對不同劑量桑葉粉提取液進行實驗,結果如圖1所示。
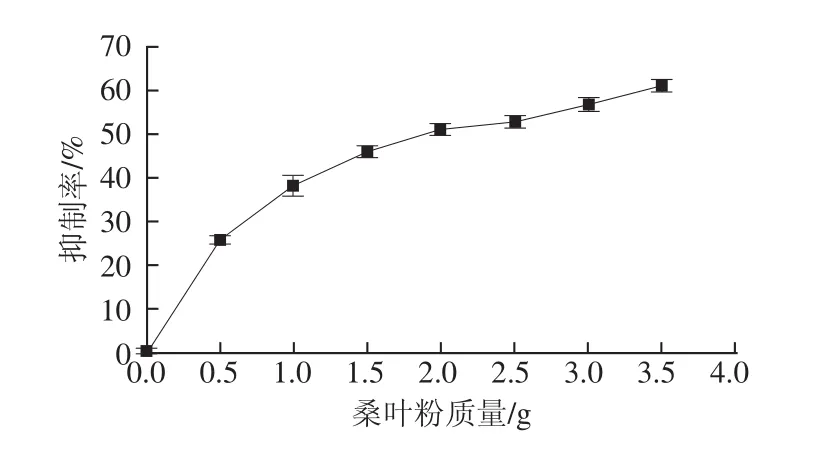
圖1 不同劑量的桑葉粉對α-葡萄糖苷酶活性的影響Fig.1 Effects of different doses of mulberry-leaf powder on alphaglycosidase enzymes activity
由圖1可知,隨著桑葉粉劑量的增加,對α-葡萄糖苷酶的抑制作用也逐漸增加。當桑葉粉劑量在0~3.5 g之間時,存在明顯的劑量依賴關系,隨著劑量的增加,抑制效果也顯著增加。由此可知,桑葉粉提取物對α-葡萄糖苷酶有較明顯的抑制作用。
2.4桑葉粉提取液對α-淀粉酶的抑制作用
α-淀粉酶是一種糖苷水解酶,抑制α-淀粉酶能夠有效抑制腸道內唾液及胰淀粉酶的活性,從而降低血糖和血脂的含量[32]。通過對不同劑量桑葉粉提取液進行實驗,結果如圖2所示。
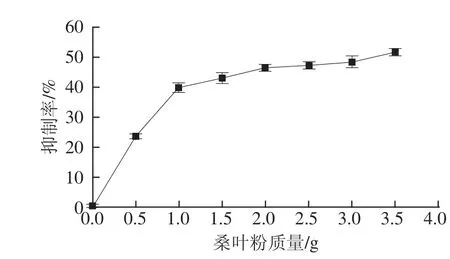
圖2 不同劑量的桑葉粉對α-淀粉酶活性的影響Fig.2 Inhibitory effects of different doses of mulberry leaf powder on alpha-amylase activity
由圖2可知,隨著桑葉粉劑量的增加,對α-淀粉酶的抑制作用也逐漸增加,劑量在0~1.0 g之間時桑葉粉與抑制率之間存在明顯的劑量依賴關系。隨著桑葉粉劑量的增加,抑制率也增加,但當劑量在1.0~3.5 g之間時,抑制率的增加呈逐漸變緩的趨勢,當桑葉粉的劑量為3.5 g時,α-淀粉酶的抑制率為51.72%。由此可以得出桑葉粉提取物對α-淀粉酶活性有很明顯的抑制作用。
3 結 論
通過對以上4種干燥方式的比較和綜合分析,熱風干燥溫度為75℃,干燥60 min,所得桑葉粉的色澤較好,含水量為(4.45±0.15)%,DNJ、總黃酮、多糖的含量分別為(227.47±5.79)mg/100 g、(49.51±1.18)mg/g和(11.29±0.01)%,普遍高于其他3種處理方法,同時熱風干燥后桑葉品質也較好,均呈現嫩綠色。因此熱風干燥是大批量工業化生產桑葉較為理想的干燥方法。同時通過測定桑葉粉對α-葡萄糖苷酶和α-葡萄糖苷酶的抑制作用可知,干燥后桑葉粉未失去降糖作用。
[1] 原愛紅, 黃哲, 馬駿. 桑葉黃酮的提取及降糖作用的研究[J]. 中草藥, 2004, 35(11)∶ 1242-1243.
[2] VICHASILP C, NAKAGAWA K, SOOKWONG P, et al. Development of high 1-deoxynojirimycin (DNJ) content mulberry tea and use of response surface methodology to optimize tea-making conditions or highest DNJ extraction[J]. LWT-Food Science and Technology, 2012, 45(2)∶ 226-232.
[3] KIM J Y, CHOI B G, JUNG M J, et al. Mulberry leaf water extract ameliorates insulin sensitivity in high fat or high sucrose diet induced overweight rats[J]. Journal of the Korean Society for Applied Biological Chemistry, 2011, 54(4)∶ 612-618.
[4] YANG N C, JHOU K Y, TSENG C Y. Antihypertensive effect of mulberry leaf aqueous extract containing γ-aminobutyric acid in spontaneously hypertensive rats[J]. Food Chemistry, 2012, 132(4)∶1796-1801.
[5] LIM H H, YANG S J, KIM Y, et al. Combined treatment of mulberry leaf and fruit extract ameliorates obesity-related inflammation and oxidative stress in high fat diet-induced obese mice[J]. Journal of Medicinal Food, 2013, 16(8)∶ 673-680.
[6] CHAN K C, HO H H, PENG C H, et al. Polyphenol-rich extract from mulberry leaf inhibits vascular smooth muscle cell proliferation involving upregulation of p53 and inhibition of cyclin-dependent kinase[J]. Journal of Agricultural and Food Chemistry, 2010, 58(4)∶2536-2542.
[7] 宋喜云. 新型復合桑業茶的研制進展[J]. 濰坊高等職業教育, 2010, 6(4)∶ 23-27.
[8] 玄光善, 潘士佳, 南姬. 桑葉有效成分降糖作用研究[J]. 食品科學, 2011, 32(7)∶ 323-326.
[9] JESZKA-SKOWRON M, FLACZYK E, JESZKA J, et al. Mulberry leaf extract intake reduces hyperglycaemia in streptozotocin (STZ)-induced diabetic rats fed high-fat diet[J]. Journal of Functional Foods, 2014, 8∶ 9-17.
[10] CHUNG H I, KIM J, KIM J Y, et al. Acute intake of mulberry leaf aqueous extract affects postprandial glucose response after maltose loading∶ randomized double-blind placebo-controlled pilot study[J]. Journal of Functional Foods, 2013, 5(3)∶ 1502-1506.
[11] 南京中醫藥大學. 中藥大辭典[M]. 上海∶ 上海科學技術出版社, 1997∶ 2741-2742.
[12] 丁盈, 蔣梅香, 周應軍, 等. 桑葉降糖活性成分研究[J]. 中國藥物化學雜志, 2007, 17(6)∶ 386-389.
[13] 盛琳波, 李昭良, 蘇超, 等. 桑樹乳汁中1-脫氧野尻霉素含量的影響因素及穩定性[J]. 蠶業科學, 2014, 40(4)∶ 712-717.
[14] 張軍, 穆莉, 檀華蓉, 等. 桑葉中黃酮化合物的提取工藝及不同品種不同時期的含量變化[J]. 蠶業科學, 2006, 32(1)∶ 142-145.
[15] 劉凡, 黃勇, 廖森泰, 等. 應用響應面法優化桑葉多糖、黃酮和生物堿聯合提取工藝[J]. 蠶業科學, 2013, 39(3)∶ 568-575.
[16] 盧林英. 快速干燥苜蓿草增值的重要措施[J]. 中國牧業通訊, 2003(21)∶ 55-56.
[17] 中華人民共和國衛生部. GB 5009.3—2010食品中水分的測定[S].北京∶ 中國標準出版社, 2010.
[18] 耿鵬, 朱元元, 楊洋, 等. 桑樹資源中1-脫氧野尻霉素的測定及其生物活性分析[J]. 中草藥, 2005, 36(8)∶ 1151-1154.
[19] 肖洪, 沈以紅, 黃先智, 等. 發酵桑葉茶生物活性成分變化研究[J]. 食品科學, 2013, 34(19)∶ 176-180. doi∶ 10.7506/spkx1002-6630-201319037.
[20] 黃健, 閔星, 陸春燕. 主要桑品種桑葉黃酮化合物含量的比較分析[J].江蘇蠶業, 2013, 35(2)∶ 12-14.
[21] 劉樹興, 王維, 魏麗娜. 桑葉多糖提取工藝研究[J]. 現代食品科技, 2006, 22(2)∶ 154-155.
[22] YU Zhipeng, YIN Yongguang, ZHAO Wenzhu, et al. Anti-diabetic activity peptides from albumin against alpha-glucosidase and alphaamylase[J]. Food Chemistry, 2012, 135(3)∶ 2078-2085.
[23] 朱文佳, 寇自農 張曦, 等. α-葡萄糖苷酶抑制劑體外篩選方法的研究[J]. 食品研究與開發, 2012, 33(8)∶ 171-175.
[24] THILAGAM E, PARIMALADEVI B, KUMARAPPAN C, et al. α-Glucosidase and α-amylase inhibitory activity of Senna surattensis[J]. Journal of Acupuncture and Meridian Studies, 2013, 6(1)∶ 24-30.
[25] 程秀麗. α-淀粉酶抑制劑的活性測定[J]. 中國新醫藥, 2004, 3(4)∶ 71-72.
[26] 趙修南, 賈啟燕, 單俊杰. α-淀粉酶抑制劑篩選方法的優化[J]. 國際藥學研究雜志, 2008, 35(5)∶ 321-324.
[27] 趙晶, 張慶鋼, 趙瑜, 等. 凍藏溫度和時間對沙棘果中類黃酮含量的影響[J]. 食品工業, 2008(5)∶ 7-9.
[28] HARTONEN K, PARSHINTSEV J, SANDBERG K, et al. Isolation of flavonoids from aspen knotwood by pressurized hot water extraction and comparison with other extraction techniques[J]. Talanta, 2007, 74(1)∶ 32-38.
[29] DROUZAS A E, SCHUBERT H. Microwave application in vacuum drying of fruits[J]. Journal of Food Engineering, 1996, 28(2)∶ 203-209.
[30] 唐小俊, 池建偉, 張名位, 等. 苦瓜微波干燥工藝優化[J]. 農業機械學報, 2008, 39(1)∶ 68-73.
[31] 李憲璀, 范曉 韓麗君, 等. 海藻提取物中α-葡萄糖苷酶抑制劑的初步篩選[J]. 中國海洋藥物, 2002(2)∶ 8-11.
[32] 黃紹華, 胡曉波, 王震宙. 山藥多糖對α-淀粉酶活力的抑制作用[J].食品工業科技, 2006, 27(9)∶ 94-95.
Effects of Drying Methods on the Contents of Hypoglycemic Components in Mulberry Leaves (Morus alba L.)
QIN Yingrui1, ZENG Yitao1, YANG Juan1, DING Xiaowen1, HUANG Xianzhi2,*
(1. Chongqing Key Laboratory of Agricultural Products Processingand Store, College of Food Science, Southwest University, Chongqing 400716, China; 2. State Key Laboratory of Mulberry Silkworm Genome Biology, College of Food Science, Southwest University, Chongqing 400716, China)
The effects of different drying methods on the contents of hypoglycemic components in mulberry leaves (Morus albaL.) were explored to find the most appropriate drying method for in-depth development of mulberry leaves. 1-Deoxynojirimycin (DNJ) inmulberry leaves was quantified by high performance liquid chromatography (HPLC), polysaccharide content was measured by phenol-sulfuric acid method, and the content of flavonoids was assayed by sodium nitrite method. The results showed that freeze dried mulberry leaves presented the best quality but lower contents of DNJ and flavonoids. Vacuum drying provided the lowest contents of DNJ and polysaccharide as well as the worst color in dried mulberry leaves. Microwave drying had little effect on the hypoglycemic components and color of mulberry leaves; the highest contents of DNJ and polysaccharide of (297.15±6.35) mg/100 g and (11.71±0.01)%, respectively, were obtained by microwave drying at 140 W for 10 min. Hot air drying was time saving and only slightly affected the color of mulberry leaves, leading to higher contents of DNJ, flavones and polysaccharide of (227.47±5.79) mg/100 g, (49.51±1.18) mg/g and (11.29±0.01)%, respectively, in dried mulberry leaves. Thus, hot air drying is more suitable for industrial processing of mulberry leaves. At the same time, during the drying process no structural change was observed for the hypoglycemic components and they were still effective against alpha glycosidase and alpha amylase suggesting that the hypoglycemic activity was retained.
mulberry leaf; drying; 1-deoxynojirimycin; flavonoids;polysaccharide
TS201.1
1002-6630(2015)17-0071-06
10.7506/spkx1002-6630-201517014
2014-10-31
國家現代農業(桑蠶)產業技術體系建設專項(CARS-22-ZJ0503)
秦櫻瑞(1989—),女,碩士研究生,研究方向為食品安全與質量控制。E-mail:594745844@qq.com
*通信作者:黃先智(1965—),男,副教授,博士,研究方向為桑樹資源利用。E-mail:404409425@qq.com

