D-阿洛酮糖3-差向異構酶基因在枯草芽孢桿菌中的表達
賈 敏, 沐萬孟, 張 濤, 江 波*
(1.食品科學與技術國家重點實驗室,江南大學,江蘇 無錫 214122;2.江南大學 食品學院,江蘇 無錫 214122)
D-阿洛酮糖是稀有糖的一種,是D-果糖C-3位的差向異構體。D-阿洛酮糖不僅是一種無熱量的甜味劑[1],而且可作為其他稀有糖生產的重要原料[2]。D-阿洛酮糖具有多種獨特的營養學和生理學功能,受到越來越多研究者的注意。D-阿洛酮糖零能量,可預防肥胖[3];能降低血糖[4],可作為II型糖尿病人的輔助治療劑、膳食補充劑和甜味劑;可降低血脂,減少脂肪合成酶活性,抑制腹腔內脂肪堆積[5];有抗氧化活性,具有較強的活性氧(ROS)清除功能[6];具有神經保護作用[7]。鑒于D-阿洛酮糖良好的理化性質,美國食品及藥品管理局于2011年對D-阿洛酮糖的安全性進行確認,并正式批準其為GRAS(一般認為安全,Generally Recognized as Safe)食品,允許應用于食品,膳食補充劑和醫藥制劑中,具有巨大的市場前景[8]。
D-阿洛酮糖在自然界中存在極少,利用化學方法合成D-阿洛酮糖雜質多且不易分離。利用D-阿洛酮糖 3-差向異構酶 (D-psicose 3-epimerase,DPE,EC 5.3.1.-),通過催化D-果糖C3位的差向異構化獲得D-阿洛酮糖。作者所在實驗室已成功構建大腸桿菌工程菌株BL21(DE3)/pET22b-cbdte表達DPE酶[9]。但由于大腸桿菌宿主安全性的問題,使其所表達的DPE重組蛋白不適宜應用于D-阿洛酮糖的工業化生產中。而枯草芽孢桿菌是食品級微生物,屬于GRAS級微生物,不存在內毒素等食品安全問題,被廣泛應用于各種工業酶制劑中[10-11]。
本研究旨在利用食品級微生物枯草芽孢桿菌作為宿主菌,構建DPE酶枯草芽孢桿基因工程菌,實現DPE酶在枯草芽孢桿菌中的表達,為D-阿洛酮糖的工業化生物酶法生產奠定理論基礎。
1 材料與方法
1.1 實驗儀器與試劑
Authorized Thermal Cycler PCR儀:購自德國Eppendorf;垂直板蛋白電泳系統:購自PowerPac Universal;凝膠成像系統Gel DocXR:購自美國Bio-Rad公司;高效液相色譜儀Agilent 1260:購自美國Agilent公司;紫外可見分光光度計UV2102PC:購自上海尤尼柯儀器有限公司;全自動高壓滅菌鍋CL-40M:購自日本ALP公司;超凈工作臺SW-CJIFD:購自蘇凈安泰空氣技術有限公司;高速冷凍離心機Centrifuge 5804R:購自德國Eppendorf公司。
Premix TaqDNA聚合酶、限制性內切酶、T4 DNA連接酶:購自TaKaRa公司;質粒DNA提取試劑盒及DNA膠回收試劑盒:購自上海生工生物工程有限公司;D-阿洛酮糖標準品:購自Sigma公司;其他常規試劑:進口分裝或國產分析純;引物合成及DNA測序:由上海生工生物工程有限公司完成。質 粒 pET22b-cbdpe, 質 粒 pMA5, 宿 主 菌Escherichia coli DH5α和宿主菌 Bacillus subtilis WB800:由作者所在實驗室保藏。
1.2 培養基制備
種子(LB)培養基(組分 g/L):胰蛋白胨 10.0,酵母提取物 5.0,NaCl 10.0;pH 7.0。
發酵培養基(組分g/L):酵母抽提物 15.0,葡萄糖 5.0,NaCl 8.0,MgSO4·7H2O 1.0,Na2HPO4·12H2O 1.0;自然pH。滅菌后加入抗生素。
1.3 DPE基因的克隆
以大腸桿菌質粒pET22b-cbdpe為模板,通過PCR的方法進行DPE基因擴增。為便于分離純化,設計引物時將pET22b質粒上帶有的His-tag標簽引入目的基因中,并在該基因的兩端分別引入兩個酶切位點,Nde I和BamH I,設計一對引物如下:
PMA1:5'-CGCCATATGAAATATGGTATTTATT TTGCT-3'
PMA2:5'-CGCGGATCCTTGTTAGCCGGATCTC-3'
PCR反應程序如下:94℃預變性10 min,94℃變性 1 min,56℃退火 1 min,72℃延伸 1 min,35個循環,72℃延伸10 min,4℃保存。PCR產物經1.0 g/dL瓊脂糖凝膠回收預期大小的片段。與pMD-T-19載體連接,轉化大腸桿菌DH5α感受態細胞,涂布在含有氨芐青霉素(100 μg/mL)的LB平板上,挑取陽性克隆,提取質粒進行測序,得到pMD19-T-cbdpe。
1.4 枯草芽孢桿菌重組表達質粒的構建
將獲得的pMD19-T-cbdpe和pMA5質粒,用Nde I和BamH I進行雙酶切,回收基因片段,經T4連接酶連接過夜后轉化入大腸桿菌DH5α感受態細胞,涂布含有氨芐霉素(100 μg/mL)的LB平板,37℃過夜培養。挑取陽性克隆,提取質粒,進行測序驗證。并利用Nde I和BamH I進行雙酶切驗證。
1.5 枯草芽孢桿菌重組菌的構建及篩選
制作Bacillus subtilis WB800感受態細胞[12]轉化重組質粒pMA5-cbdpe,將轉化子涂布卡那霉素(50 μg/mL)的LB平板,37℃培養 24 h,挑取單菌落至液體培養基,進行發酵培養,測定菌體酶活,并進行SDS-PAGE分析。
1.6 DPE酶活力測定
將獲得的枯草芽孢桿菌重組菌接入發酵培養基進行搖瓶發酵培養,測定生長曲線和酶活曲線。酶活力測定方法參照文獻[13]。酶活力單位定義為:1 mL發酵液在55℃和pH 7.0條件下,單位時間(1 min)內產生1 μmol的D-阿洛酮糖為一個酶活力單位,以U/mL表示。D-阿洛酮糖采用HPLC檢測,液相柱:Sugar-Pak I鈣型離子交換柱;柱溫:85℃;流動相:0.1mmol/L EDTA-Ca水溶液 (0.22 μm 膜過濾);洗脫流速:0.4 mL/min;進樣量:10 μL;檢測器:Shodex示差折光檢測器。
1.7 DPE酶的分離純化
收集對數中后期的發酵液,10 000 r/min離心5 min,棄上清液,取菌體用50 mmol/L磷酸緩沖液(pH 7.0)溶解,重懸菌體,進行超聲破碎。工作條件為:工作時間1 s,停止時間2 s,共計12 min。將破碎菌體進行低溫高速離心 (4℃、12 000 r/min離心15 min)。收集上清液即為粗酶液。用微孔濾膜(0.22 μm)過濾,備用。
先用上樣緩沖液(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,500 mmol/L NaCl,pH 7.4) 平 衡Ni2+-Chelating Sepharose Fast Flow親和層析柱。將5 mL的粗酶液加到層析柱上,用低咪唑洗脫液(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,500 mmol/L NaCl,50 mmol/L 咪唑,pH 7.4)洗脫雜蛋白質,后利用高咪唑洗脫液 (50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,500 mmol/L NaCl,500 mmol/L 咪 唑 ,pH 7.4)洗脫目的蛋白質。收集目的蛋白質放入透析袋中,利用平衡液透析過夜。
1.8 DPE酶蛋白濃度測定
采用Lowry法[14]測定蛋白質含量,以牛血清蛋白(BSA)為標準蛋白質,做標準曲線。將樣品稀釋至一定濃度,根據標準曲線算出蛋白質濃度。
2 結果與分析
2.1 DPE基因克隆
以大腸桿菌重組質粒pET22b-cbdpe為模板,PCR擴增得到約900 bp的DPE基因,見圖1。獲得的pMD19-T-cbdpe經測序驗證,Clostridium bolteae ATCC BAA-613 DPE基因進行比對發現,目的基因得到正確擴增。

圖1 PCR產物凝膠電泳Fig.1 Agarose gel electrophoresis of PCR product
2.2 重組表達載體的構建與鑒定
將pMD19-T-cbdpe和pMA5質粒,用Nde I和BamH I進行雙酶切,用T4連接酶進行連接,構建重組質粒pMA5-cbdpe,其構建過程見圖2。

圖2 pMA5-cbdpe重組質粒構建過程Fig.2 Restructuring process of pMA5-cbdpe plasmid
對重組質粒進行Nde I和BamH I雙酶切驗證,瓊脂糖凝膠電泳在約900 bp及7 000 bp處出現條帶,與目的基因及pMA5的片段大小一致,初步確定獲得pMA5-cbdpe的陽性克隆,見圖3。

圖3 重組質粒pMA5-cbdpe的雙酶切驗證Fig. 3 Restriction enzyme digestion analysis of recombinant plasmid pMA5-cbdpe
經基因組測序,并與NCBI中Clostridium bolteae ATCC BAA-613 DPE基因序列進行比對,結果表明成功構建了重組載體pMA5-cbdpe。將重組載體轉化入B.subtilis WB800,經卡那霉素(50 μg/mL)LB平板篩選后,挑取陽性克隆子,發酵培養,進行菌液PCR鑒定,獲得一株包含DPE基因的枯草芽孢桿菌重組菌,見圖4。

圖4 重組枯草芽孢桿菌PCR鑒定Fig.4 PCR identification of recombinant B.subtilis
2.3 枯草芽孢桿菌重組菌的表達及活性鑒定
枯草芽孢桿菌重組菌經發酵培養,取菌體進行SDS-PAGE電泳驗證顯示,在34 000左右出現明顯表達蛋白質,見圖5。這與大腸桿菌表達DPE相對分子質量一致,表明該枯草芽孢桿菌可實現DPE的表達,經離心沉淀后即可獲得菌體。干燥后即可制得粗酶粉,用于D-阿洛酮糖的生產,避免理化操作可能對酶性質產生的影響。
利用枯草芽孢桿菌模式菌株B.subtilis 168,進行DPE酶表達時,PCR鑒定重組菌中包含DPE基因后,發酵培養發現重組菌沒有酶活 (結果未顯示);而利用敲除八種蛋白酶的宿主菌B.subtilis WB800作為宿主菌[15],則可在菌體中檢測到酶活。可能是由于宿主菌的蛋白酶可降解所表達的DPE重組蛋白,導致利用B.subtilis 168表達DPE酶不能檢測到酶活。

圖5 SDS-PAGE圖Fig.5 SDS-PAGE profiles
為檢測重組菌產DPE酶的酶活情況,將不同發酵時間的發酵液與D-果糖溶液在合適條件下進行反應,測定不同時間發酵液DPE酶活及菌體生長狀況,見圖6。在對數中后期,發酵16~24 h時,酶活達到最高,為6.8 U/mL,高于大腸桿菌IPTG誘導表達的酶活(約3.5 U/mL)[16]。表明該菌株可表達相對較高活性的DPE酶。

圖6 重組枯草芽孢桿菌發酵曲線Fig.6 Curve of enzyme activity of recombinant B.subtilis
對于DPE酶的工業化生產,大腸桿菌表達的DPE酶在工業化發酵中,需要額外添加誘導劑,并且需保持較低的誘導溫度以減少包涵體的大量產生;而枯草芽孢桿菌表達DPE酶發酵過程簡單,無需降溫,減少能耗,并且無包涵體產生,單位發酵液酶活較高。真核表達系統如畢赤酵母等,一般需要較長發酵時間才能達到較高酶活;而枯草芽孢桿菌16~24 h即可達到較高酶活水平,發酵時間短,節約能耗。
2.4 重組DPE酶的分離純化
Clostridium bolteae DPE酶菌體經超聲破碎,離心后得到粗酶液,由于引入6個組氨酸標簽,通過Ni2+柱親和層析,將目的蛋白質與雜蛋白質分離,經SDS-PAGE電泳檢測,見圖7。在34 000處得到目的蛋白,其相對分子質量大小與預測符合,進一步證明DPE基因在枯草芽孢桿菌宿主中得到正確表達。

圖7 分離純化后的重組蛋白SDS-PAGE電泳圖Fig.7 SDS-PAGE profile of the purified recombinant protein
2.5 重組DPE酶的酶學性質
2.5.1 pH對DPE酶活力的影響 在55℃、pH 5.0~9.0的緩沖溶液中分別測定DPE酶活力,重復3次,取平均酶活力,見圖8。該DPE酶的最適pH為7.0,與大腸桿菌表達的DPE酶一致[17]。其酶活力>90%的pH范圍有所擴大,為6.0~7.5。
2.5.2 pH對DPE酶穩定性的影響 將純化后的DPE酶在pH 5.0~9.0的緩沖液反應體系中,4℃保存2 h,然后測定殘余酶活,以原始酶活為最高酶活100%,見圖9。在pH 5.0~8.5的范圍內,DPE酶相對穩定,殘余酶活均在80%以上。
2.5.3 溫度對DPE酶活力的影響 在pH 7.0條件下,測定40~80℃下的酶活力,結果見圖10。重組DPE酶在55℃下酶活力達到最高。在45~65℃其相對酶活仍可維持在80%以上。

圖8 pH值對酶活力的影響Fig.8 Effects of pH on DPE enzyme activity

圖9 pH值對酶穩定性的影響Fig.9 Effects of pH on DPE stability

圖10 溫度對酶活力的影響Fig.10 Effects of temperature on DPE enzyme activity
2.5.4 溫度對DPE酶穩定性的影響 將酶液在不同溫度下保溫不同的時間,測定DPE酶的殘余酶活,結果見圖11。枯草芽孢桿菌表達的DPE酶的熱穩定性比大腸桿菌表達的DPE酶的熱穩定性略有提高。其55℃的半衰期由42 min增加到45 min[17]。
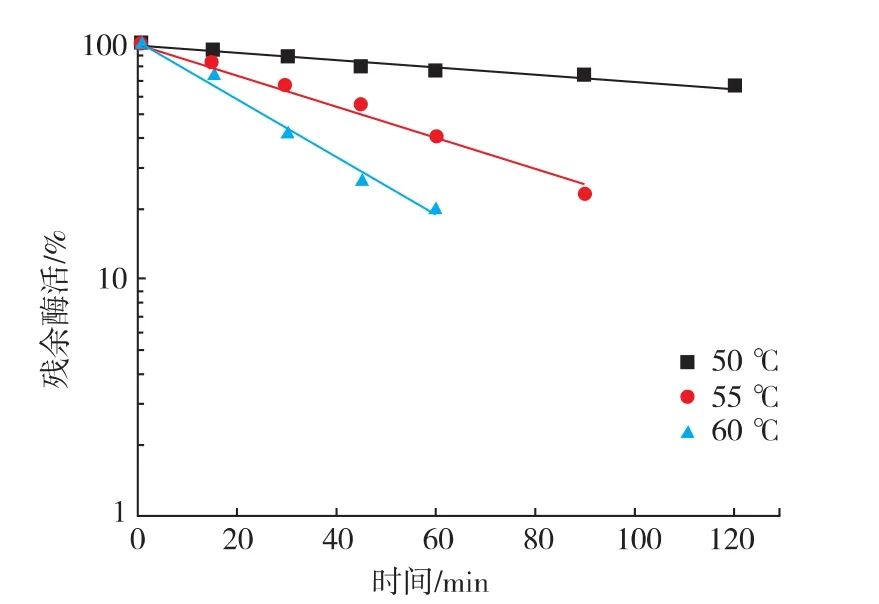
圖11 溫度對DPE酶穩定性的影響Fig.11 Effects of temperature on DPE stability
2.5.5 金屬離子對DPE酶活力的影響 不同金屬離子對酶的催化效果有不同的影響,見圖12。在酶反應體系中加入不同的金屬離子,DPE酶的穩定性及催化活力會有所不同。DPE酶是一種金屬蛋白酶,在金屬螯合劑EDTA的存在下,DPE酶徹底失活。Co2+和Mn2+離子可提高DPE酶的活性,尤其是Co2+離子。 Zn2+、Mg2+、Cu2+、Ca2+對其酶活有明顯抑制作用,這與大腸桿菌表達的重組DPE酶酶學性質一致[17]。
3 結語
D-阿洛酮糖3-差向異構酶可在食品級微生物枯草芽孢桿菌中的表達,利用PCR擴增D-阿洛酮糖3-差向異構酶基因與枯草芽孢桿菌載體pMA5連接,構建重組質粒pMA5-cbdpe。重組質粒轉入枯草芽孢桿菌Bacillus subtilis WB800感受態細胞,利用卡那霉素篩選和PCR鑒定,獲得一株D-阿洛酮糖3-差向異構酶重組枯草芽孢桿菌菌株。該重組菌株無需誘導即可產生D-阿洛酮糖3-差向異構酶,18 h時酶活即可達到6.8 U/mL。同時,對枯草芽孢桿菌表達的重組DPE酶的酶學性質進行測定,發現其酶學性質與大腸桿菌來源的DPE酶相似。

圖12 不同金屬離子對重組DPE酶活影響Fig.12 Effect of different metallic ions on the DPE activity
利用枯草芽孢桿菌作為宿主菌進行D-阿洛酮糖 3-差向異構酶生產,無內毒素產生,無需添加誘導劑,發酵簡單,發酵時間短,能耗低,適用于D-阿洛酮糖的工業化生產。此外,本研究也可為提高我國酶制劑行業在食品及其他相關領域發展的研究提供參考,具有重要的現實意義。
[1]Matsuo T,Suzuki H,Hashiguchi M,et al.D-psicose is a rare sugar that provides no energy to growing rats[J].Journal of Nutrition Science Vitaminol,2002,48:77-80.
[2]Izumori K.Izumoring:a strategy for bioproduction of all hexoses[J].Journal of Biotechnology,2006,124(4):717-722.
[3]Iida T,Hayashi N,Yamada T,et al.Failure of d-psicose absorbed in the small intestine to metabolize into energy and its low large intestinal fermentability in humans[J].Metabolism,2010,59(2):206-214.
[4]N Hayashi,T Iida,T Yamada,et al.Study on the postprandial blood glucose suppression effect of D-psicose in borderline diabetes and the safety of long-term ingestion by normal human subjects[J].Bioscience,Biotechnology,Biochemistry,2010,74:510-519.
[5]Matsuo T,Izumori K.D-Psicose inhibits intestinal α -glucosidase and suppresses the glycemic response after ingestion of carbohydrates in rats[J].Journal of Clinical Biochemistry and Nutrition,2009,45(2):202-206.
[6]Murata A,Sekiya K,Watanabe Y,et al.A novel inhibitory effect of D-allose on production of reactive oxygen species from neutrophils[J].J Bioscience Bioengineering,2003,96:89-91.
[7]Takata M,Yamaguchi F,Nakanose K,et al.Neuroprotective effect of D-psicose on 6-hydroxydopamine-induced apoptosis in rat pheochromocytoma(PC12) cells[J].Journal of Bioscience Bioengineering,2005,100:511-516.
[8]Mu W,Zhang W,Feng Y,et al.Recent advances on applications and biotechnological production of D-psicose[J].Applied Microbiology and Biotechnology,2012,94(6):1461-1467.
[9]儲菲菲,沐萬孟,邢慶超,等.Clostridium bolteae ATCC BAA-613 D-塔格糖3-差向異構酶的誘導表達、純化及活性研究[J].食品工業科技,2012,33(7):198-201.CHU Feifei,MU Wanmeng,XING qingchao,et al.Study on expression,purification and enzyme activity of Clostridium bolteae ATCC BAA-613 D-tagatose 3-epimerase[J].Science and Technology of Food Industry,2012,33(7):198-201.(in Chinese)
[10]Yang H,Liu L,Li J,et al.Heterologous expression,biochemical characterization,and overproduction of alkaline a-amylase from Bacillus alcalophilus in Bacillus subtilis[J].Microb Cell Fact,2011,10:77.
[11]李靜靜,徐美娟,張顯,等.一種耐低溫α-乙酰乳酸脫羧酶在枯草芽孢桿菌中的高效表達[J].食品與生物技術學報,2013,32(5):516-523.LI Jingjing,XU Meijuan,Zhang Xian,et al.High-level expression of cold-adapted α-acetolactate decarboxylase in Bacillus subtilis[J].Food Science and Biotechnology,2013,32(5):516-523.(in Chinese)
[12]Kunst F,Rapoport G.Salt stress is an environmental signal affecting degradative enzyme synthesis in Bacillus subtilis[J].Journal of Bacteriology,1995,177(9):2403-2407.
[13]Wanmeng Mu,Feifei Chu,Qiangchao Xing,et al.Cloning,expression,and characterization of a D-psicose 3-epimerase from Clostridium cellulolyticum H10[J].Journal of Agriculture and Food Chemistry,2011,59:7785-7792.
[14]Lowry O H,Rosenbrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,193:265-275.
[15]Wu S C,Yeung J C,Duan Y,et al.Functional production and characterization of a fibrin-specific single-chain antibody fragment from Bacillus subtilis:effects of molecular chaperones and a wall-bound protease on antibody fragment production[J].Applied and Environmental Microbiology,2002,68(7):3261-3269.
[16]賈敏,江波,張曉鳴,等.乳糖誘導D塔格糖3差向異構酶基因在大腸桿菌中的表達[J].食品工業科技,2013,34(13):143-146.JIA Min,JIANG Bo,ZHANG Xiaoming,et al.Expression of recombinant D-tagatose 3-epimerase in E.coli BL21/(DE3)induced by lactose[J].Science and Technology of Food Industry,2013,34(13):143-146.(in Chinese)
[17]Jia M,Mu W,Chu F,et al.A d-psicose 3-epimerase with neutral pH optimum from clostridium bolteae for d-psicose production:cloning,expression,purification,and characterization[J].Applied Microbiology and Biotechnology,2014,98(2):717-725.

