龍葵果花色苷降解動力學
騰 飛, 劉召君, 鄭洪亮, 王 萍
(東北林業大學 林學院,黑龍江 哈爾濱150040)
龍 葵 (Solanum nigrum L.) 為 茄 科 茄 屬(Solanaceae)一年生草本植物[1],俗稱黑星星、野葡萄、苦葵等,常見于路邊、田間、荒地,植株高約30~60 cm。國內外大量研究表明,龍葵具有抗腫瘤、抗菌和抗病毒、調節神經和內分泌的作用[2],是很有開發潛力的植物資源。此外龍葵果實富含豐富的色素,易被提取,用龍葵色素代替合成色素添加到飲料或果酒中呈美麗鮮艷的玫瑰紅色,并且安全性極高,是一種很有前途的天然食用色素,但作為食品添加劑的天然色素穩定性較差,主要是對熱光等不穩定,因此如何提高天然色素的穩定性,成為食品著色工業急待解決的問題[3]。龍葵色素的研究起步較晚,目前已開展了一些該色素提取及穩定性方面的研究。木合塔爾·吐爾[4]等人研究了戈壁野生龍葵果紫紅色素提取和理化性質,得出該色素在酸性條件下具有較好的穩定性,并且對光、熱和常用食品添加劑都比較穩定,是一種價廉易得,安全可靠,使用方便的天然植物色素。劉良[5]等人研究了酸、二氧化碳、甜味劑、羧甲基纖維素等化學因素對龍葵色素穩定性影響,得出龍葵色素的水,乙醇溶液隨酸度的增大顏色加深、穩定性增強,其水溶液對酸、二氧化碳、甜味劑、羧甲基纖維素等化學因素的影響有較好的穩定性。徐雅琴[6]等人對龍葵紅色素的理化性質進行了研究,結果表明,pH值對該色素的影響非常顯著,當pH<3.0時色素液為紅色,且pH愈小,紅色愈深;pH在3.0~10.0范圍內色素液接近無色;pH大于10.0呈黃色,且pH愈大,黃色愈深。劉志明[7-8]等人研究了溫度對龍葵紅色素降解的影響以及空氣、光照和金屬離子對其穩定性的影響,結果表明,龍葵紅色素熱降解屬于一級動力學反應,降解反應的半衰期隨溫度的升高指數性降低,反應速率常數則指數性增大,長時間的光照和接觸氧氣將對色素產生不利影響,Na+、Ca2+對其顏色有增強作用,而Fe3+則對色素結構有破壞作用。然而劉志明等人僅研究了溫度對龍葵果紅色素降解的影響,其他因素并未涉及,因此對龍葵果色素降解的研究還有待進一步探索。作者在已有研究的基礎上,進一步探討了pH和溫度對龍葵果花色苷的降解動力學的影響,比較了相同條件下不同龍葵果花色苷提取物的穩定性,建立了龍葵果花色苷熱降解動力學模型,為龍葵果的精深加工提供了理論依據。
1 材料與方法
1.1 材料與儀器
1.1.1 材料 龍葵果:9月中旬采自哈爾濱雙環苗圃。
1.1.2 試劑 鹽酸、氫氧化鈉、氯化鉀、無水乙酸鈉、冰乙酸、無水乙醇、正丁醇、柱層析硅膠(200-300目):均為國產分析純試劑。
1.1.3 儀器 HR2004榨汁機:飛利浦電子香港有限公司;RE-53A旋轉蒸發器:上海亞榮生化儀器廠;SHB-4循環水多用真空泵:寧波杜甫儀器廠;722S可見分光光度計:上海精密試驗儀器有限公司;PHS-26數顯pH計:上海精密試驗儀器有限公司;HHS型電熱恒溫水浴鍋:北京博迅實業有限公司醫療設備廠;TDL-5-H臺式低速離心機:上海星科科學儀器有限公司;玻璃層析柱(40 cm×1.0 cm):上海精密儀器實業有限公司。
1.2 實驗方法
1.2.1 龍葵果花色苷的提取 采用溶劑萃取法,詳見文獻[9],得到龍葵果花色苷粗提物。
1.2.2 龍葵果花色苷的純化 以X-5為龍葵果花色苷純化的吸附介質,純化條件為:層析柱徑長比為1∶25,上樣質量濃度為0.4 mg/mL,最大上樣量為0.6 BV,洗脫劑體積為 3.5 BV,用 pH 2.0、60%乙醇做洗脫劑,最適洗脫流速為2.0 BV/h。收集洗脫液40℃減壓旋轉蒸發將溶劑旋出,得到龍葵果花色苷一級精致物。
1.2.3 龍葵果花色苷的分離 稱取50.0 g硅膠濕法裝柱,濕法上樣后用正丁醇∶冰乙酸∶水(體積比4∶1∶0.5)做洗脫劑,收集紫色洗脫液,40℃減壓旋轉蒸發后得到組分1。再用正丁醇∶乙醇∶鹽酸(體積比1∶4∶1)進行二次洗脫,收集紅色洗脫液,旋轉蒸發后得到組分2。
1.2.4 花色苷相對質量濃度的測定 準確吸取不同樣品液0.5 mL,用pH 1.0緩沖溶液 (0.2 mol/L HCl-KCl)和 4.5緩沖溶液(0.2 mol/L HCl-乙酸鈉)定容至5.0 mL。達平衡后(pH 1.0為50 min,pH 4.5時為80 min)分別在510、700 nm處測定吸光值[10]。

式中,A 為吸光度,A=(A510nmpH1.0-A700nmpH1.0)-(A510nmpH4.5-A700nmpH4.5);ε 為矢車菊-3-葡萄糖苷的消光系數 (26 900);DF為稀釋因子;MW為矢車菊-3-葡萄糖苷的相對分子質量(449.2);L 為光程(1.0cm)。
1.2.5 不同pH龍葵果花色苷提取物溶液的配制用2 mol/L HCl和2 mol/L NaOH溶液將不同龍葵果花色苷樣品液的pH值分別調整為1.0、2.0、3.0、4.0、5.0、6.0,用蒸餾水調整為相同的體積后備用,各提取物花色苷初始質量濃度為0.1 mg/mL[11]。
1.2.6 pH和溫度對龍葵果花色苷不同提取物降解動力學的解析 分別吸取調整pH值后的不同花色苷提取物溶液裝入25.0 mL具塞試管中,旋緊試管蓋子后分別放入60、70、80、90℃水浴中避光加熱,熱處理時間為6 h,期間每隔1小時取出試管放入冰水中急速冷卻,測定花色苷的質量濃度和殘留率[12]。

式中,C、C0為熱處理后和處理前花色苷的質量濃度。根據花色苷殘留率,按以下公式計算一級動力學反應的速率常數(k)。

式中,t為熱處理時間。
花色苷降解的半衰期(t1/2)用下式計算:

式中,Q10為溫度系數,表示溫度每升高10℃,反應速率增大的比例數;k1和k2分別為溫度t1和t2時的一級反應速率常數。

式中,Z為半衰期(t1/2)變化10倍所需的溫度變化(℃)。以T對lg(t1/2)作線性回歸,由直線的斜率可得到 Z值[11]。 花色苷熱降解活化能 (Ea) 根據Arrhenius方程k=k0e-Ea/RT進行計算。當方程兩邊同時取對數時,得

式中,k為熱降解速率常數;R為氣體常數;k0為頻率常數;T為溫度(K)。可求出花色苷熱降解的活化能 Ea(kJ/moL)[13]。
1.2.7 數據分析 試驗均重復3次,取其平均值,采用Excel 2010和SPSS11.5進行數據分析。
2 結果與分析

2.1 溫度和pH對龍葵果花色苷粗提物降解動力學的影響
2.1.1 溫度對龍葵果花色苷粗提物降解動力學的影響 圖1表示pH值為1.0~6.0和溫度為60~90℃條件下龍葵果花色苷粗提物降解的動力學過程。由圖1可知,不同溫度條件下-ln(C/C0)與時間呈現良好的線性關系,說明龍葵果花色苷粗提物降解遵循一級反應動力學規律。因此,花色苷的降解應屬于裂解反應,即花色苷被裂解為花色素基元及糖基兩部分[14]。這與文獻[10-13,15]報道的不同來源的花色苷熱降解動力學過程研究結果相吻合。

圖1 龍葵果花色苷粗提物的降解Fig.1 Degradation of anthocyanins crud extracts from Solanum nigrum L.berry at different pH values during heating
表1表示pH值為 1.0~6.0和溫度為60~90℃條件下龍葵果花色苷粗提物降解的動力學參數,結果以(x±s)表示。數據經多因素方差分析,各條件下k值的兩兩比較采用Bonferroni法。結果表明,各條件除pH 3.0和pH 6.0之間不顯著外,其余各條件下k值均達到顯著差異(p<0.05)。結合圖1和表1可以看出,在pH 1.0~4.0范圍內,隨著溫度的升高,花色苷降解速率加快,殘留率明顯下降。高溫對粗提物穩定性有不良影響,其吸光度值隨時間延長而下降,且溫度越高,吸光度值下降速率越快。盡管在實驗溫度范圍內,粗提物始終保持澄清,但隨著溫度的升高及高溫時間的延長,色素液的紅顏色逐漸變淡。在pH 5.0和pH 6.0時,半衰期t1/2隨著溫度的升高變化不明顯,尤其在80℃和90℃時變化及其微小,t1/2僅減小2%。溫度系數Q10表示溫度每升高10℃反應速率增大的比例數,Q10越大說明溫度對降解的影響越大。Z值表示半衰期(t1/2)變化10倍所需的溫度變化,Z值越小說明溫度對降解的影響越大。由表1可以看出,pH 5.0和pH 6.0的Q10明顯小于其他pH值,Z值明顯大于其他pH值。這表明pH 5.0和pH 6.0時溫度對花色苷的降解速率影響小于低pH(pH<4.0)對其降解的影響。這與文獻[11]中對黑米花色苷降解的研究結果相吻合。

表1 不同pH下龍葵果花色苷粗提物的降解參數Table 1 Degradation parameters of anthocyanin crud extracts from Solanum nigrum L.berries at different pH values

續表1
圖2~3分別表示溫度與粗提物降解速率常數和半衰期的關系。由圖2~3可知,反應速率常數隨著溫度的升高呈現指數型增大的趨勢,半衰期t1/2則呈現指數型減小的趨勢。其中pH 1.0~4.0時變化較明顯,pH 5.0和pH 6.0時變化趨勢不明顯。這與文獻[7]報道的龍葵紅色素降解的研究結果趨勢相同。

圖2 溫度與粗提物降解反應速率常數的關系Fig.2 Relationship between temperature and reaction rate constants of crud extracts

圖3 溫度與粗提物降解半衰期的關系Fig.3 Relationship between temperature and the half-lifeof crud extracts
2.1.2 pH對龍葵果花色苷粗提物降解動力學的影響 圖4和圖5分別表示pH與粗提物降解速率常數和半衰期的關系。由圖4和圖5可知,在60℃和70℃時,隨著pH的增大,反應速率常數呈現對數型增大趨勢,而半衰期則隨著pH的增大呈現指數型減小的趨勢。由表1可知,在80℃和90℃時,龍葵果花色苷粗提物的降解隨著pH的變化并未呈現規律性的變化,這可能是因為隨著溫度的升高,花色苷的熱降解機制更加復雜[7]。
綜合溫度和pH對龍葵果花色苷粗提物的影響可以得出,在pH 1.0、溫度為60℃時,龍葵果花色苷粗提物的穩定性較好,半衰期為37.27 h,反應活化能為101.47 kJ/mol。將本研究中的龍葵果花色苷降解動力學參數與其他來源的花色苷降解動力學參數相比可知(見表2),龍葵果花色苷的穩定性強于樹莓花色苷和藍靛果花色苷,弱于黑米和草莓花色苷。與其他龍葵果花色苷降解研究的比較中可知,本研究的半衰期和活化能與參考文獻[7]中的研究結果較為相似,且比參考文獻[7]中的穩定性略強。

圖4 pH與粗提物降解反應速率常數的關系Fig.4 Relationship between pH and reaction rateconstants of crud extracts

圖5 pH與粗提物降解半衰期的關系Fig.5 Relationship between pH and the half-life of crud extracts

表2 不同來源花色苷降解的動力學參數(pH 1.0、60℃)Table 2 Degradation parameters of different anthocyanins extracts at pH 1.0、60 ℃
2.2 pH和溫度對龍葵果花色苷一級精致物降解動力學的影響
2.2.1 溫度對龍葵果花色苷一級精制物降解動力學的影響 圖6表示pH為1.0~6.0和溫度為60~90℃條件下龍葵果花色苷一級精制物降解的動力學過程。


圖6 龍葵果花色苷一級精制物的降解Fig.6 Degradation of anthocyanins purified extracts from Solanum nigrum L.berry at different pH values during heating
由圖6可知,龍葵果花色苷一級精制物降解同樣遵循一級反應動力學方程。這與粗提物的研究結果相吻合。隨著熱處理時間的延長,龍葵果花色苷一級精制物花色苷質量濃度下降較明顯。在pH 1.0~6.0范圍內,溫度對花色苷一級精制物降解的影響均較明顯,這與溫度對粗提物的影響略有差別。這說明在pH 1.0~6.0范圍內,花色苷一級精制物的降解機制相似,而粗提物的降解機制可能不同。
表3表示pH為1.0~6.0和溫度為60~90℃條件下龍葵果花色苷一級精制物降解的動力學參數。各條件下k值差異顯著(p<0.05)。圖7和圖8分別表示溫度與龍葵果花色苷一級精制物降解速率常數和半衰期的關系。結合表3、圖7和圖8可以得出,相同pH時反應速率常數隨著溫度的升高呈現指數增大的趨勢,半衰期t1/2則呈指數型減小的趨勢,這與溫度對粗提物的降解影響趨勢相似。

表3 不同pH下龍葵果花色苷一級精制物的降解參數Table 3 Degradation parameters of anthocyanin purified extracts from Solanum nigrum L.berries at different pH values
2.2.2 pH對龍葵果花色苷一級精制物降解動力學的影響 圖9和圖10分別表示pH與花色苷一級精制物降解的關系。由圖9和圖10可知,在60℃和70℃時,隨著pH的增大,反應速率常數呈現對數型增大,而半衰期則隨著pH值的增大呈現指數型減小的趨勢。由表3可知,在80℃和90℃時,龍葵果花色苷一級精制物的降解隨著pH的變化并未呈現規律性的變化,這一研究結果與粗提物的結果相同。

圖7 溫度與一級精制物降解速率常數的關系Fig.7 Relationship between temperature and reaction rate constants of purified extracts

圖8 溫度與一級精制物降解半衰期的關系Fig.8 Relationship between temperature and the half-life of purified extracts
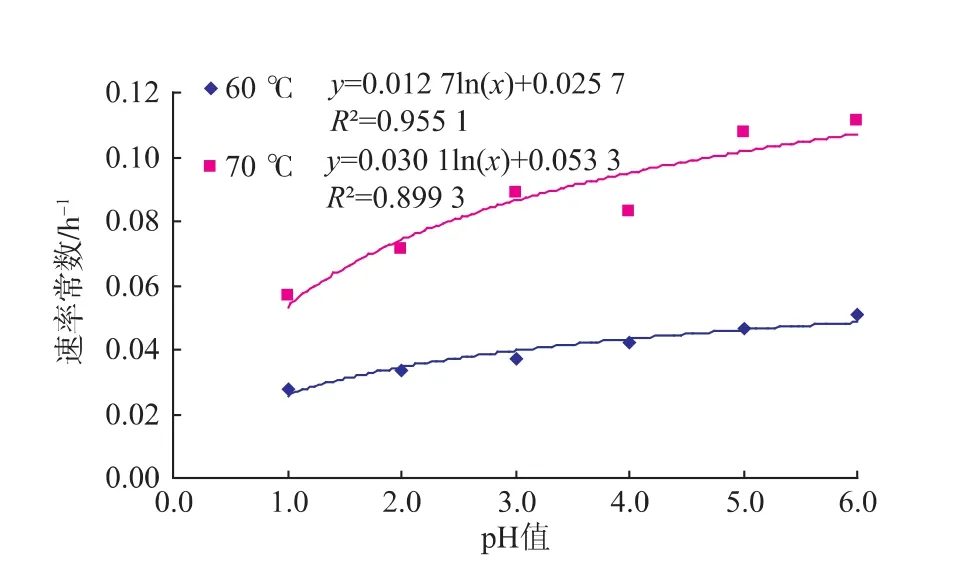
圖9 pH與一級精制物降解速率常數的關系Fig.9 Relationship between pH and reaction rate constants of purified extracts

圖10 pH與一級精制物降解半衰期的關系Fig.10 Relationship between pH and the half-life of purified extracts
綜合溫度和pH對龍葵果花色苷一級精制物降解的影響可以得出,在pH 1.0、60℃時,龍葵果花色苷一級精制物的穩定性較好,半衰期為25.30 h,與粗提物的半衰期37.27 h相比減少了32%,反應活化能為87.16 kJ/mol,比粗提物的反應的活化能101.47 kJ/mol減小了14%。說明在相同條件下,龍葵果花色苷粗提物的降解速率較慢,耐熱性好,也說明可能是粗提物中其它成分,如糖、酸、酚類物質與色素發生了分子內(花色苷分子內各基團間的相互作用)或分子間(花色苷分子與其它分子間相互作用)的輔色效應(co-pigmentation),形成了更加穩定的結構,這與前人的研究結果一致[18]。
2.3 pH值和溫度對龍葵果花色苷組分1和組分2降解動力學的影響
2.3.1 溫度對龍葵果花色苷組分1和組分2降解動力學的影響 龍葵果花色苷組分1和組分2降解趨勢相似。表4表示pH為1.0~6.0和溫度為60~90℃條件下龍葵果花色苷組分1和組分2的降解動力學參數。由表4可知,各條件除pH 1.0和pH 3.0之間不顯著外,其余各條件下組分1的k值均達到顯著差異(p<0.05),組分2的k值在各條件下均達到顯著差異(p<0.05)。龍葵果花色苷組分1和組分2的降解同樣遵循一級反應動力學方程。這與粗提物和一級精制物的研究結果相吻合。隨著熱處理時間的延長,龍葵果花色苷組分1和組分2的花色苷質量濃度明顯下降。在pH 1.0~6.0范圍內,隨著溫度的升高,花色苷組分1和組分2的降解速率變化較大,殘留率迅速下降,這與一級精制物降解的變化趨勢相似。表5是溫度與組分1和組分2降解速率常數和半衰期的關系。由表5可以看出,反應速率常數隨著溫度的升高呈現指數型增大的趨勢,而半衰期t1/2則呈現指數型減小的趨勢。

表4 不同pH下龍葵果花色苷組分1和組分2的降解參數Table 4 Degradation parameters of fraction 1 and fraction 2 from Solanum nigrum L.berries at different pH values

表5 溫度與組分1和組分2降解速率常速和半衰期的關系Table 5 Relationship between temperature and reaction rate constants and half-life of fraction 1 and fraction 2
2.3.2 pH對龍葵果花色苷組分1和組分2降解動力學的影響 表6表示pH與組分1和組分2降解速率常數和半衰期的關系。由表6可知,在60℃和70℃時,隨著pH的增大,反應速率常數呈現指數型增大的趨勢,而半衰期則隨著pH值的增大呈現指數型減小的趨勢。這一研究結果與粗提物和一級精制物略有差別。粗提物和一級精制物隨著pH的變化速率常數呈現對數型增長,而組分1和組分2則呈現指數型增長。由表4可知,在80℃和90℃時,龍葵果花色苷組分1和組分2的降解隨著pH的變化并未呈現規律性的變化,這一研究結果與粗提物和一級精制物的結果相同。

表6 pH與組分1和組分2降解速率常數和半衰期的關系Table 6 Relationship between pH and reaction rate and half-life constants of fraction 1 and fraction 2
綜合溫度和pH對龍葵果花色苷組分1和組分2降解的影響可以得出,在pH 1.0溫度為60℃時,龍葵果花色苷組分1和組分2穩定性較好,組分1半衰期為19.04 h,反應活化能為59.75 kJ/mol,組分2為半衰期為21.46 h,反應活化能為61.91 kJ/mol。由二者半衰期可知,組分2比組分1穩定性強,與粗提物相比,組分1的半衰期減小了48.91%,組分2減小了42.42%;與一級精制物相比,組分1半衰期減小了24.74%,組分2減小了15.18%,從而可知,組分1和組分2的穩定性比粗提物和一級精制物穩定性差。
3 討論
3.1 pH對花色苷穩定性的影響
以上結果充分說明,pH值對龍葵果花色苷穩定性有較大影響,這是由于在不同pH值介質中,花色苷的分子結構呈現不同形式所致。當pH<2.0時,主要以2-苯基苯并吡喃陽離子(AH+)的形式存在而呈現紅色;當pH在4~5時,,主要以醌型堿(B)形式存在,色澤逐漸由紅向藍色變化;而當pH>6.0時,體系的平衡向著無色的查耳酮(C)進行[15]。其降解機制可能有如下兩種:在 pH 2.0~4.0的酸性水溶液中,花色苷的C3糖苷首先水解,然后苷元發生水合反應生成花色素的假堿形式,再異構化生成查耳酮及其同分異構體α-二酮[19]。但由于產物中仍然存在查耳酮糖苷,也可能是花色苷首先生成假堿葡萄糖苷,接著開環生成查耳酮糖苷,查耳酮糖苷繼續脫去糖苷成為查耳酮和其同分異構體α-二酮,最后徹底降解生成酚酸和醛類[20]。
3.2 溫度對花色苷穩定性的影響
在食品加工過程中,最常用的殺菌方式就是高溫處理,溫度的高低和加熱時間的長短都會影響花色苷的降解,其機制為花色苷首先發生水解或去糖基開環反應,然后形成查耳酮或其同分異構體α-二酮,最后降解為酚酸和醛類[14]。Olivier等人認為在花色苷的結構互變中[21],花色苷的二苯基苯并吡喃陽離子(AH+)的失電子過程AH+→A是放熱反應,水解反應AH+→B(甲醇假堿)和開環反應B→C(查爾酮)是吸熱反應并且伴隨著熵的增大。因此,溫度升高時,平衡向著無色的甲醇假堿和查爾酮形式轉化,并顯著影響花色苷的熱降解速率[22]。實驗中發現,4種花色苷提取物中粗提物在相同pH和溫度的條件下降解最慢,最穩定。這是因為在龍葵果花色苷粗提物中存在多酚、黃酮、氨基酸和有機酸等輔色劑。尤其是黃酮和多酚的含量豐富[9]。這些物質與色素發生了分子內或分子間的輔色效應,形成了更加穩定的結構。凌文華[23]等人研究認為在水果和漿果中花色苷更易發生分子間輔色作用,通過分子間上下疊加的π—π共軛作用及一些氫鍵作用影響原花色苷生色體系的能級躍遷,從而使得花色苷穩定性增強。此外,花色苷屬于多酚類物質可作為自身的輔色劑。而黃酮類對花色苷的共色作用主要在于穩定了溶液中紫色的脫水堿阻止其轉化成無色的查爾酮結構[24]。然而隨著花色苷的不斷精制,這些輔色素含量越來越少,輔色作用越來越弱,因此,粗提物的穩定性最強,降解最慢。
4 結語
龍葵果花色苷不同提取物的降解均遵循一級反應動力學規律。pH對粗提物降解的影響為:當pH 1.0~4.0時,溫度對其降解的影響顯著,而pH 5.0和pH 6.0時,溫度對其降解的影響不顯著。pH對一級精制物、組分1和組分2的降解影響為:pH 1.0~6.0時,溫度對一級精制物、組分1和組分2的降解影響均顯著。相同pH值時花色苷不同提取物的降解速率常數隨著溫度的升高呈現指數型增長的趨勢,而半衰期呈現指數型下降的趨勢。
60℃和70℃時,隨著溫度的升高粗提物和一級精制物降解的速率常數呈現對數型增長的趨勢,而組分1和組分2的降解速率常數呈現指數型增長的趨勢;半衰期則均呈現指數型下降的趨勢。而80℃和90℃時,降解速率常數和半衰期隨著pH值的變化均未呈現規律性的變化。
通過比較半衰期可知,4種花色苷提取物均在60℃pH、1.0時穩定性最強。4種提取物的穩定性順序為粗提物>一級精制物>組分2>組分1。
[1]劉為為,劉延慶,戴小軍.龍葵抗腫瘤作用的研究進展[J].中藥材,2009(3):462-465.LIU Weiwei,LIU Yanqing,DAI Xiaojun.Study on progress of Solanum nigrum L.antitumor effect[J].Traditional Chinese Medicine,2009(3):462-465.(in Chinese)
[2]劉穎,張燕玲,王雁.從天然植物龍葵中提取生物堿的工藝研究[J].遼寧絲綢,2003(2):4-5,31.LIU Ying,ZHANG Yanling,WANG Yan.Process study extracted of alkaloids from Solanum nigrum L[J].Liaoning Silk,2003(2):4-5,31.(in Chinese)
[3]徐雅琴,李淑芹,崔艷麗.龍葵紅色素熱效應的研究[J].生物技術,1995,5(5):33-35.XU Yaqin,LI Shuqin,CUI Yanli.Study on the therm l effect of red pigment form black night shade[J].Biotechnology,1995,5(5):33-35.(in Chinese)
[4]木合塔爾·吐爾,洪木尼熱·阿不都克力木.戈壁野生龍葵果紫紅色素的提取及其理化性質研究[J].陜西師范大學學報:自然科學版,2004,32(4):120-121.Muhetaer T H,Munire A B L.Extraction and characteristic of purplish red pigment from Solanum nigrum[J].Journal of Shaanxi Normal University:Natural Science Edition,2004,32(4):120-121.(in Chinese)
[5]劉良,王文蘭,王麗君.化學因素對龍葵色素穩定性影響的研究[J].吉林醫學院學報,1998,18(1):27-28.LIU Liang,WANG Wenlan,WANG Lijun.The study on the influence of chemical factors on the stability of the pigment of Solanum nigrum[J].J Lin Med Col,1998,18(1):27-28.(in Chinese)
[6]徐雅琴,李桂芝.龍葵紅色素理化性質的研究[J].東北農業大學學報,1996,27(4):401-405.XU Yaqin,LI Guizhi.Studies on physical and chemical properties of red pigment from black nightshade[J].Journal of Northeast Agricultural University,1996,27(4):401-405.(in Chinese)
[7]劉志明,李琦,孫清瑞,等.龍葵紅色素熱降解化學動力學的研究[J].食品工業科技,2006,30(6):308-311.LIU Zhiming,LI Qi,SUN Qingrui,et al.Research on chemical dynamics of the thermal degradation for red pigment of Solanum nigrum[J].Journal of Food Science and Technology,2006,30(6):308-311.(in Chinese)
[8]劉志明,張威威,韓小蘭,等.從龍葵果中提取食用紅色素及色素穩定性的研究[J].國土與自然資源研究,2006(3):89-90.LIU Zhiming,ZHANG Weiwei,HAN Xiaolan,et al.Extraction of edible red pigment from Solanum nigrum fruit and study on its stability[J].Territory&Natural Resources Study,2006(3):89-90.(in Chinese)
[9]郭慶啟,張娜.樹莓果汁中花色苷降解動力學的研究[J].中國林副特產,2011(5):35-37.GUO Qingqi,ZHANG Na.Degradation kinetics of anthocyanins in raspberry juice[J].Forest By-Product and Specialty in China,2011(5):35-37.(in Chinese)
[10]HOU Z H,QIN P Y,ZHANG Y.Identification of anthocyanins isolated from black rice (Oryza sativa L.) and their degradation kinetics[J].Food Research International,2013(50):691-697.
[11]Selale K,Emine A E.Thermal degradation kinetics of anthocyanins and visual colour of Urmu mulberry (Morus nigra L.)[J].Journal of Food Engineering,2013,11(6):541-547.
[12]樊金玲,朱文學,鞏衛東,等.牡丹花色苷的熱穩定性和降解動力學[J].應用化學,2011,27(2):231-236.FAN Jingling,ZHU Wenxue,GONG Weidong,et al.Thermal stability and degradation kinetics of anthocyanin in tree penoy extract[J].Chinese Journal of Applied Chemistry,2011,27(2):231-236.(in Chinese)
[13]宋會歌,劉美艷,董楠,等.食品中花色苷降解機制研究進展[J].食品科學,2011,13:355-359.SONG Huige,LIU Meiyan,DONG Nan,et al.Research progress on degradation mechanisms of anthocyanins in foods[J].Chinese Journal of Food Science,2011,13:355-359.(in Chinese)
[14]郭慶啟,張娜,何嬌.藍靛果汁花色苷熱降解動力學的研究[J].食品與發酵工業,2011,37(9):74-78.GUO Qingqi,ZHANG Na,HE Jiao.Thermal degradation dynamic of anthocyanins in Lonicera edulis turcz juice[J].Food and Fermentation Industries,2011,37(9):74-78.(in Chinese)
[15]蔣新龍.黑米花色苷降解特性研究[J].中國糧油學報,2013,4:27-31.JIANG Xinlong.Study on black rice anthocyanin degradation characteristics[J].Chinese Cereals and Oils Association,2013,4:27-31.(in Chinese)
[16]王夢澤,閻勤勞,薛少平,等.草莓渾濁汁花色苷熱降解動力學[J].食品研究與開發,2010,6:50-53.WANG Mengze,YAN Qinlao,XUE Shaoping,et al.Thermal degradation kinetics of anthocyanin in cloudy strawberry juice[J].Food Research and Development,2010,6:50-53.(in Chinese)
[17]方忠祥,倪元穎,唐建成.紫肉甘薯中花色苷熱降解動力學研究[J].食品工業科技,2004,3:111-113.FANG Zhongxiang,NI Yuanying,TANG Jiancheng.Thermal degradation kinetics of anthocyanins from purple-fleshed sweet potato[J].Chinese Journal of Food Science and Technology,2004,3:111-113.(in Chinese)
[18]張麗霞,周劍忠,顧振新.黑莓汁花色苷熱降解動力學及降解機理[J].江蘇農業學報,2011,27(5):1111-1116.ZHANG Lixia,ZHOU Jianzhong,GU Zhenxin.Degradation kinetics of anthocyanins in blackberry juice and its mechanisms[J].Jiangsu J of Agr Sci,2011,27(5):1111-1116.(in Chinese)
[19]Markakis P.Anthocyanins as food colors[M].San Diego:Academic Press,1982:163-207.
[20]O liver D.Polyphonel interactions the copigmentation case:thermodynamic data form temperature variation and relaxation kinetics[J].Can J Chem,1992,70:2174-2189.
[21]董楠,王強,雷丹丹,等.胭脂蘿卜紅色素熱處理及貯藏過程中降解動力學[J].食品科學,2013,5:67-71.DONG Nan,WAHG Qiang,LEI Dandan,et al.Thermal degradation and kinetics of pigment from raddish red[J].Chinese Journal of Food Science,2013,5:67-71.(in Chinese)
[22]凌文華,郭紅輝.植物花色苷[M].北京:科學出版社,2009:66.
[23]李云,趙昶靈,楊曉娜,等.花色苷分子結構與其穩定性以及呈色關系的研究進展[J].云南大學學報,2010,25(5):712-720.LI Yun,ZHAO Xuling,YANG Xiaona,et al.Research advances in the relationship between the molecular structures of anthocyanins and their stability and colorations[J].Journal of Yunnan Agricultural University,2010,25(5):712-720.(in Chinese)

