苧麻纖維素合成酶基因BnCesA4 cDNA序列的克隆與表達分析
劉昱翔,陳建榮,彭 彥,黃 妤,趙 燕,黃麗華,郭清泉,張學文*
(1湖南農業大學生物科學技術學院,長沙410128;2長沙學院生物工程與環境科學系,湖南長沙410003)
苧麻纖維是最優良的植物韌皮纖維之一,具有極佳的彈性和柔軟性,是植物界最長的優質纖維。纖維的組成單位纖維素大分子是由多個D-吡喃葡萄糖殘基以β-1,4-糖苷鍵聯結而成的不分枝多糖,在植物體內纖維素構成纖維素糖苷網,是承受機械壓力的支撐結構,并調控植物形態學上的某些特性與特征[1]。
Pear等從棉纖維cDNA文庫中鑒定出2個纖維素合成酶基因GhCesA1和GhCesA2[2]。植物纖維素合成酶包含保守的D,D,D區和QXXRW結構域,該結構中的第一個D,天冬氨酸殘基在Mg2+存在的情況下是唯一能夠與尿苷二磷酸-葡萄糖(UDP-glc)結合的位點,而第三個D,TED則可能起到催化作用[3,4]。植物纖維素合成酶在氨基酸序列的N-端具有鋅指結構域,這個鋅指結構表明植物纖維素合成酶蛋白至少和一個其他蛋白有互作[5,6]。植物纖維素合成酶共有8個跨膜結構域,2個位于N-端,6個位于C-端,跨膜結構域在細胞質膜上形成供新合成糖苷鏈進入細胞壁的通道[7~9]。植物纖維素合成酶基因表達狀況的研究發現:不同的纖維素合成酶基因在植物不同部位表達,一種纖維素合成酶基因可以在多個部位表達,也可能在某一特定部位專一性地表達[10~12]。同一細胞中有多個纖維素合成酶共同表達,而不同的纖維素的表達受到不同的調控因素的控制[13,14]。
2008年田志堅等利用同源克隆的方法克隆獲得了第一個苧麻纖維素合成酶基因BnCesA1缺少5'端部分堿基的cDNA序列,隨后蔣杰等以此為基礎獲得了BnCesA基因的全長cDNA序列。半定量實驗表明,BnCesA1在根、莖、葉、芽4種組織中均有表達,且表現出莖>葉>芽>根的表達規律[15~17]。本研究在克隆獲得新的苧麻纖維素合成酶基因基礎上,對其序列進行生物信息學分析和熒光定量RTPCR,以為進一步研究苧麻韌皮纖維的合成過程提供一定的理論依據。
1 材料與方法
1.1 材料
苧麻(Boehmeria nivea(Linn.)Gaud.)栽培種湘苧1號、湘苧3號、湘潭大葉白、城步青麻均由湖南農業大學苧麻研究所提供。
大腸桿菌DH5菌株,由湖南農業大學細胞生物學實驗室保存。
1.2 方法
1.2.1 苧麻纖維素合成酶基因BnCesA4 cDNA序列克隆
通過GenBank下載多種已公布的植物纖維素合成酶基因序列構建數據庫,利用本地BLAST工具與前期研究中獲得的苧麻轉錄組數據進行序列比對。從苧麻轉錄組數據中發掘出與多種纖維素合成酶具有較高同源性的片段CL6473。針對該序列設計一對特異性引物:
CL6473 Primer F:5'-AATGCCGATGAGGTTTC CAGAG-3'
CL6473 Primer R:5'-AACTGCTCGTTACTCCA CCAATC-3'
以生長旺盛的湘苧3號苧麻中上部莖稈組織為材料,提取苧麻總RNA,反轉錄合成cDNA第一鏈,以其為模板,擴增片段 CL6473。擴增產物連接pMD18-T載體,轉化大腸桿菌,篩選陽性克隆送交鉑尚生物公司測序,并將測序結果與轉錄組數據進行比較。
利用TaKaRa公司3'及5'RACE試劑盒分別擴增片段CL6473的3'及5'末端cDNA序列。參照試劑盒說明設計3'RACE引物 CL6473 RACE3:5'-TACTGTACCTTGCCTGCTATCTG-3'和 5'RACE巢式PCR引物CL6473 5'GSP1:5'-GATTTCCCTCTC TTCTCTCGTAC-3';CL6473 5'GSP2:5'-GCTCTC CGTCCACAGTCACTTC-3'。3'及5'RACE 所得片段送交鉑尚生物公司測序。
將CL6473核心片段與3'及5'RACE克隆獲得的兩端序列進行拼接,最終得到BnCesA4基因全長cDNA序列。
1.2.2 苧麻纖維素合成酶基因BnCesA4的生物信息學分析
將BnCesA4序列與GenBank核酸數據庫進行聯機比對,分析BnCesA4序列與不同植物纖維素合成酶基因的同源關系。使用軟件DNAMAN查找開放閱讀框,并翻譯蛋白質,預測BnCesA4蛋白的分子量、等電點等基本理化性質。通過NCBI網站Conserved Domain Search Service工具分析蛋白質的保守結構域。使用 http://www.cbs.dtu.dk/services/TMHMM/網站預測BnCesA4蛋白的跨膜結構域。
1.2.3 苧麻纖維素合成酶的進化分析
下載多種植物纖維素合成酶氨基酸序列共66條,與3種苧麻纖維素合成酶BnCesA1、BnCesA3和BnCesA4通過MEGA軟件以Neighbor-Joining的方式共同構建系統發育樹。
1.2.4 苧麻纖維素合成酶基因BnCesA4表達量的熒光定量PCR分析
分離湘苧1號、湘苧3號、湘潭大葉白及城步青麻等4個品種的成熟階段莖稈,分韌皮部和木質部組織并提取總RNA。這4個品種的苧麻在原麻產量和纖維支數上都有明顯差異,湘苧1號高產中支,湘苧3號高產高支,湘潭大葉白中產低支,城步青麻低產高支[18]。依據熒光定量引物設計原則設計BnCesA4基因熒光定量引物:
RT F:5'- ATGGAGGAATGGAGGAAGAAG -3'
RT R:5'- AGAATCACAATCCGAAGAAGG -3'
擴增片段長度200 bp。選擇肌動蛋白Actin1作為內照基因。Actin1基因上下游引物分別為Actin F:5'-GCTCCGTTGAACCCTAAG-3';Actin R:5'-CGATTGTGATGATTT-3'。使用TaKaRa公司SYBR Premix Ex Taq(TaKaRa)熒光定量試劑盒完成熒光定量實驗,分析BnCesA4基因在4個代表性苧麻品種的木質部與韌皮部中的表達差異。
2 結果分析
2.1 苧麻纖維素合成酶基因BnCesA4 cDNA序列克隆與生物信息學分析
將核心片段CL6473與通過3'及5'RACE獲得的兩端序列進行拼接,得到長度為4 008 bp的cDNA序列。BnCesA4基因編碼區全長3 270 bp,5'端非編碼區236 bp,3'端非編碼區502 bp,推測其編碼一個1 090 aa的蛋白質,預測該蛋白質的分子質量123.0 kD,理論等電點為7.63。苧麻纖維素合成酶基因BnCesA4 cDNA核苷酸序列及相對應的蛋白質序列如圖1所示。


圖1 BnCesA4基因cDNA序列及推測的蛋白質序列Fig.1 The cDNA sequence and its putative protein sequences of BnCesA4 gene
將BnCesA4序列與GenBank進行聯機BLAST分析,結果顯示其核酸序列與亮葉樺(Betula luminifera CesA8 KC204972)、歐洲/美洲山楊(Populus tremula×Populus tremuloides CesA2 AY573572)、栽培種毛白楊(Populus tomentosa cultivar CV-BJHR01 CesA5 HQ585873)、陸地棉(Gossypium hirsutum CesA9 JQ345699)、蓖麻(Ricinus communis CesA6 XM_002524253)等序列同源達到80%以上;其氨基酸序列與可可(Theobroma cacao CesA6 XP_007019545)、蓖麻(Ricinus communis CesA6 XP_002524299)、亮葉樺(Betula luminifera CesA8 AGV22110)、陸地棉(Gossypium hirsutum CesA9 AFB18639)、毛白楊(Populus tomentosa CesA AFZ78561)序列同源均超過85%。將BnCesA4氨基酸序列與AtCesA1和兩種已在GenBank中登錄的苧麻纖維素合成酶BnCesA1、BnCesA3進行多重序列比對,結果如圖2所示。比對結果顯示,BnCesA4在氨基酸序列上與3種纖維素合成酶有很高的相似度,這表明克隆獲得的BnCesA4序列為BnCesA基因家族成員。BnCesA4蛋白TMHMM預測顯示具有8個跨膜結構域(287~304、311 ~330、867 ~889、901 ~923、938 ~960、985~1007、1022~1044、1 049~1 071),2個位于 N 端,6個位于C端。氨基酸序列N端39~82位置上具有鋅指結構域,該結構域被認為在纖維素合成酶各亞基之間的相互作用上起到重要作用,在氨基酸829~833的位置上有與底物結合和催化相關的QVLRW保守結構域。研究顯示,纖維素合成酶是N-糖基化的,在擬南芥的研究中也證實CesA蛋白是被磷酸化的,而這些修飾對蛋白質的活性是極為重要的。motif預測顯示,BnCesA4有5個糖基化位點(123~126、142~145、577 ~580、822 ~825、964 ~967)。BnCesA4具有1個CAMP磷酸化位點(691~694)和9個酪氨酸激酶(CK2)磷酸化位點(30~33、148 ~151、343 ~346、369 ~372、492 ~495、727 ~730、743 ~746、787 ~790、917 ~920)。

圖2 AtCesA1、BnCesA1、BnCesA3與BnCesA4蛋白質序列比對結果Fig.2 Multiple Alignment of protein sequence of AtCesA1,BnCesA1,BnCesA3 and BnCesA4
2.2 苧麻纖維素合成酶的進化分析
從GenBank下載多種植物纖維素合成酶氨基酸序列與苧麻纖維素合成酶BnCesA1、BnCesA3和BnCesA4共同構建系統發育樹(圖3),以了解纖維素合成酶之間的系統發育關系,實心圓指示出3種苧麻纖維素合成酶。
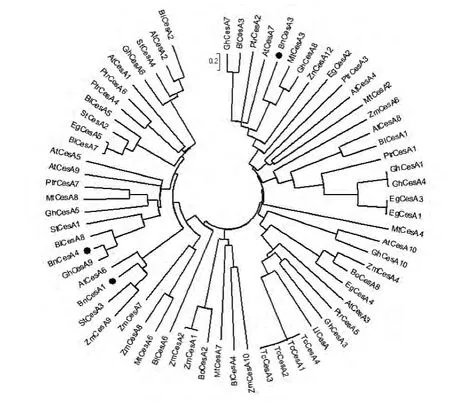
圖3 纖維素合成酶基因系統發育樹Fig.3 Phylogenetic tree of cellulose synthase genes from different species
系統發育樹顯示木本植物與草本植物CesA在系統發育樹中呈分散分布,沒有出現木本植物或草本植物CesA聚集的分枝,推測CesA的分化應早于草本植物與木本植物的分化。而不同植物的纖維素合成酶在系統發育樹中的分布也分散,CesA的分化早于這些物種出現。某些同一物種的多個CesA分布在同一分枝上,如可可纖維素合成酶TcCesA1、2、3、4,可能是相同基因產生的多個拷貝,纖維素合成酶家族成員之間可能在功能上存在冗余。BnCesA4在進化關系上與GhCesA9最為接近。
2.3 苧麻纖維素合成酶基因BnCesA4表達量的熒光定量PCR分析
熒光定量實驗選擇在BnCesA4基因高可變區設計引物,有效避免了具有較高同源性的纖維素合成酶家族其他基因的影響,溶解曲線峰值單一,引物特異性良好。采用雙Δct法對熒光定量結果進行統計,獲得BnCesA4基因在不同品種的木質部與韌皮部的表達量關系如圖4所示。
BnCesA4基因在4個品種的苧麻木質部和韌皮部都有表達,其中在城步青麻韌皮部表達量最高,在湘苧1號木質部中表達量最低,湘苧1號中韌皮部表達量是木質部表達量的2倍,而其他品種中韌皮部與木質部的表達量差距都不大。除湘苧3號中木質部表達量略高于韌皮部外,在其他3個品種中都表現出韌皮部的表達量高于木質部。BnCesA4基因在4個品種韌皮部表達水平差異較小,說明BnCesA4在4個品種的苧麻韌皮纖維的合成過程中表達量穩定。4個品種苧麻韌皮部表達水平與苧麻的原麻產量和纖維支數之間并沒有發現直接聯系,如湘潭大葉白屬于中產低支的苧麻品種,但其韌皮部BnCesA4基因表達量高于屬于高產高支品種的湘苧3號。

圖4 苧麻品種間木質部與韌皮部BnCesA4基因表達差異Fig.4 Differential expression of BnCesA4 in phloem and xylem among different ramie varieties
3 結論與討論
田志堅和蔣杰克隆獲得了第一個苧麻纖維素合成酶基因BnCesA1,并通過半定量RT-PCR實驗發現BnCesA1基因在根、莖、葉和芽組織中均有表達,但表達量有差異。苧麻具有發達的韌皮部纖維,是重要的紡織工業原料,而利用苧麻木質纖維素生產生物能源成為苧麻研究的熱點,木質纖維的質量直接關系到生產成本與轉化過程中的二次污染。本研究克隆獲得了BnCesA4基因全長cDNA序列,利用多種已知植物纖維素合成酶氨基酸序列構建系統發育樹,更重點關注了該基因在苧麻莖稈的韌皮部及木質部中的表達。BnCesA4基因在苧麻莖稈韌皮部與木質部都有表達,其參與了苧麻韌皮纖維的合成過程,但不具有韌皮部表達的特異性。同時筆者也發現在纖維素集中合成的韌皮部中,BnCesA4基因的表達量并沒有極顯著的高于木質部,而BnCesA4的表達量與苧麻纖維產量與品質也沒有直接的聯系。其可能原因:首先,纖維素的生物合成過程是多個纖維素合成酶共同參與的結果,某一種纖維素合成酶并不能決定纖維素的產量與品質。其次,纖維素合成酶需要與其他多種蛋白構成復合體來行使功能,纖維素合成酶直接合成纖維素,而調節纖維素的產量與質量則由其他類型的蛋白完成,如纖維素內切酶對合成的葡聚糖鏈的修飾與加工過程,最終使其轉化為纖維素微纖絲[19~21]。第三,原麻產量與纖維支數取決于多種因素的共同作用,如原麻膠質含量、苧麻纖維分子結晶度等[18]。所以要實現利用基因工程手段改良苧麻纖維產量與品質,需要克隆獲得更多苧麻纖維素合成酶基因家族成員,并對其表達規律有充分的認識,在此基礎上完善對纖維素合成酶復合體的研究,從分子層面上進一步闡明苧麻特殊的纖維發育機制。
[1]Brown RMJr,Saxena IM.Cellulose biosynthsis:a model for understanding the assembly of biopolymers[J].Plant Physiol Biochem,2000,38(1/2):57 -67.
[2]Pear J,Kawagoe Y,Schreckengost W,et al.Higher plants contain homologs of the bacterial CelA genes encoding the catalytic subunit of the cellulose synthase[J].Proc Natl Acad Sci USA,1996,93:12637 -12642.
[3]Charnock SJ,Davies GJ.Structure of the nucleotidediphospho - sugar transferase,SpsA,from Bacillus subtilis,in native and nucleotide - complexed forms[J].Biochemistry,1999,38:6380 -6385.
[4]Morgan JLW,Joanna Strumillo,Jochen Zimmer.Crystallographic snapshot of cellulose synthesis and membrane translocation[J].Nature,2013,493:181 -186.
[5]Kawagoe Y,Delmer DP.Pathway and genes in involved in cellulose biosynthesis[J].Genet Eng,1997,19:63 -87.
[6]Kawagoe Y,Delmer DP.Cotton CelA1 has a LIM - like Zn binding domain in the N-terminal cytoplasmic region[J].Plant Physio,1997b,114:85.
[7]Darby M Harris,Kendall Corbin,Tuo Wang,et al.Cellulose microfibril crystallinity is reduced by mutating C-terminal transmembrane region residues CESA1A903V and CESA3T942I of cellulose synthase [J].Proc Natl Acad Sci USA,2012,109:4098 -4103.
[8]Zhang B,Deng L,Qian Q,et al.A missense mutation in the transmembrane domain of CESA4 affects protein abundance in the plasma membrane and results in abnormal cell wall biosynthesis in rice [J].Plant Mol Biol,2009,71:509 -524.
[9]Kurek I,Kawagoe Y,Jacob - Wilk D.Dimerization of cotton fiber cellulose synthase catalytic subunits occurs via oxidation of the zinc - binding domains[J].Proc Natl Acad Sci USA,2002,99:11109 -11114.
[10]Turner SR,Somerville CR.Collapsed xylem phenotype of Arabidopsis identifies mutants deficient in cellulose deposition innthe secondary cell wall[J].Plant Cell,1997,9:689-701.
[11]Taylor NG,Scheible WR,Cutler S,et al.The irregular xylem 3 locus of Arabidopsis encodes a cellulose synthase required for secondary cell wall synthesis[J].Plant Cell,1999,11:769 -779.
[12]Olawole OO,Evert J,Vincken JP,et al.Differential expression of cellulose synthase(CesA)gene transcriptsin potato as revealed by QRT - PCR[J].Plant Physiology and Biochemistry,2009,47:1116 -1118.
[13]Richmond TA,Somerville CR.The cellulose synthase superfamily[J].Plant Physiol,2000,124:495 -498.
[14]Monika S Doblin,Isaac Kurek,Deborah Jacob - Wilk,et al.Cellulose biosynthesis in plants:from genes to rosettes[J].Plant and Cell Physiology,2002,43(12):1407 -1420.
[15]田志堅,易 蓉,陳建榮,等.苧麻纖維素合成酶基因cDNA 的克隆及表達分析[J].作物學報,2008,34(1):78-83.
[16]易 蓉,田志堅,黃麗華,等.苧麻纖維素合成酶基因cDNA的功能分析[J].湖南農業大學學報(自然科學版),2009,35(1):13 -16.
[17]蔣 杰,揭雨成,周清明,等.苧麻纖維素合酶基因BnCesA1全長cDNA的克隆與表達分析[J].植物遺傳資源學報,2012,13(5):851 -857.
[18]郭清泉,胡日生,孫煥良,等.苧麻膠質的基因型差異與成因及育種中利用研究Ⅰ.苧麻膠質及其組分含量的基因型差異[J].湖南農業大學學報(自然科學版),2000,26(5):340 -342.

