高壓氧對兔耳增生性瘢痕形成過程中缺氧誘導因子1α和胰島素樣生長因子Ⅰ受體表達的影響
任紀禎 陳振雨 楊廷 萬金娥 趙明
高壓氧對兔耳增生性瘢痕形成過程中缺氧誘導因子1α和胰島素樣生長因子Ⅰ受體表達的影響
任紀禎 陳振雨 楊廷 萬金娥 趙明
目的探討高壓氧對兔耳增生性瘢痕的形成及瘢痕組織中缺氧誘導因子1α(HIF-1α)、胰島素樣生長因子Ⅰ受體(IGF-1R)表達的影響。方法選取20只新西蘭大白兔建立兔耳瘢痕模型,隨機分成實驗組和對照組,實驗組根據給予高壓氧時間不同分為7 d、14 d、21 d及28 d組,每組4只共48個創面,實驗組術后立即給予高壓氧處理,對照組處于常氧壓空氣環境中。術后第29天切取瘢痕組織進行蘇木精-伊紅(HE)染色,觀察形態學差異,計算瘢痕增生指數;免疫組化法檢測HIF-1α、IGF-1R的表達。結果HE染色可見實驗組成纖維細胞數量及膠原纖維含量較對照組明顯減少。對照組瘢痕增生指數為4.28±0.22,7 d、14 d、21 d及28 d實驗組分別為3.64±0.29、3.46±0.21、3.29±0.21、3.16±0.15,各組間差異有統計學意義(F=77.70,P<0.05)。免疫組化檢測可見,各實驗組HIF-1α、IGF-1R的表達量均較對照組顯著降低(P<0.01),14 d組兩因子表達量較7 d組、21 d組較14 d組減少(均P<0.05),28 d組與21 d組比較,差異無統計學意義(均P>0.05)。結論高壓氧可降低兔耳瘢痕組織中HIF-1α、IGF-1R的表達,對兔耳增生性瘢痕的形成有明顯抑制作用。
高壓氧;瘢痕;缺氧誘導因子1,α亞基;胰島素樣生長因子-I受體
缺氧是影響瘢痕增生的的重要因素之一,Kischer等[1]研究發現,低氧在病理性瘢痕的形成過程中起著重要作用。低氧不但能調控瘢痕中成纖維細胞的活性、膠原的合成與降解,還能影響一些生長因子如缺氧誘導因子1(HIF-1)、血管內皮生長因子(VEGF)、轉化生長因子 β1(TGFβ1)等的分泌。HIF-1是缺氧特異感受因子,能對缺氧產生適應性反應,減輕缺氧造成的損害,它隨缺氧程度變化而變化[2-4],該因子可調節多種靶細胞因子如血管內皮生長因子、促紅細胞生成素等。胰島素樣生長因子Ⅰ受體(IGF-1R)介導的信號通路與瘢痕的形成密切相關,其不但能誘導成纖維細胞合成和分泌膠原等細胞外基質,還能抑制細胞凋亡,從而使瘢痕中成纖維細胞獲得持久增殖和分泌的能力,影響創面愈合后組織改建[5-6]。高壓氧治療能使創面局部血氧含量增高,改善組織缺氧狀態,增加組織供氧,促進創面愈合[7-8]。本實驗擬在瘢痕形成過程中給予高壓氧治療,并觀察高壓氧對病理性瘢痕中HIF-1α、IGF-1R表達的影響,探討高壓氧在瘢痕形成過程中可能發揮的作用。
材料與方法
一、材料
1.實驗動物:健康新西蘭大白兔20只,體重2.0~2.5 kg,兔耳健全,雌雄不拘,由青島市實驗動物中心提供,許可證號 SCXK(魯)2009~0007。
2.實驗材料:兔抗兔HIF-1α單克隆抗體、兔抗兔IGF-lR單克隆抗體產自北京博奧森生物技術有限公司;SABC試劑盒、DAB顯色試劑盒產自北京中杉金橋生物技術有限公司。
二、方法
1.兔耳增生性瘢痕模型的建立:選取20只新西蘭大耳白兔,適應性飼養1周后,參照李薈元[9]方法制作瘢痕模型,并加以改良,用鹽酸氯胺酮30 mg/kg、地西泮5 mg/kg肌內注射麻醉成功后,固定于操作臺上,兔耳腹側面皮膚聚維酮碘消毒,嚴格無菌操作下,在兔耳腹側中段沿長軸避開可見血管作直徑為1 cm大小創面,每耳6處,創面間隔1 cm以上,去掉兔耳全層皮膚,并用刮勺徹底刮除軟骨膜,壓迫止血。模型制備成功后,采取單兔單籠標準條件下飼養。將兔隨機分成實驗組和對照組,實驗組根據給予高壓氧的時間不同分為7 d、14 d、21 d及28 d組,每組4只共48個創面。
2.高壓氧處理:實驗組于術后立即置于DS-Ⅱ型實驗動物加壓艙,純氧洗艙5 min,升壓10 min至0.1 MPa后穩壓,吸純氧60 min,減壓10 min。實驗組按分組不同分別行高壓氧治療7 d、14 d、21 d及28 d,每天同一時間治療1次。對照組處于常氧壓空氣環境中。
3.標本取材及處理:于模型制備后29 d,在同樣麻醉條件下統一切取實驗組和對照組瘢痕組織及周圍1 mm正常組織,4%甲醛固定,常規石蠟包埋,蘇木精-伊紅(HE)染色、免疫組化染色,光鏡下觀察HE染色切片,用測微尺測出瘢痕最高點至耳軟骨表面的垂直厚度(a)、瘢痕周邊正常皮膚至耳軟骨表面的垂直厚度(b),瘢痕增生指數(hypertrophic index,HI)=a/b。蠟塊包埋時,盡量讓瘢痕的高點豎直線與蠟塊相平行,均由同一醫師切片,切出一個最大面,然后以此最大面完成瘢痕指數的測量計算。
4.結果判定:HIF-1α、IGF-1R陽性細胞半定量(參照徐少駿方法[10])玻片置于相同強度光線下觀察,按染色的深淺(信號強度)分為3級:棕黑色為強陽性“+++”,棕黃色為陽性“++”,淺棕色為弱陽性“+”。在表皮隨機取5個位置,每個位置從表皮層到真皮深層根據組織厚度取4~6個高倍視野,每個視野隨機觀察50個細胞,將陽性細胞選定在各個級別中,用權重方法將全部陽性信號進行量化,即“+++”乘 3,“++”乘 2,“+”乘 1。權重量化的數值反映了該位置的信號強度,取5個位置的平均值作為該標本的相對信號強度。
5.統計學處理:采用SPSS17.0統計軟件對實驗數據進行單因素方差分析,所有數據采用±s表示,組間兩兩比較用LSD-t檢驗,P<0.05為差異有統計學意義。
結 果
一、形態學觀察
7 d、14 d、21 d及28 d實驗組和對照組創面在上皮化后均逐漸形成不同程度瘢痕增生,實驗組瘢痕較對照組明顯減輕。對照組瘢痕增生明顯,高出皮膚表面,充血呈紫紅色,質硬;實驗組瘢痕增生不明顯,瘢痕體積小,色白,質軟。見圖1。
二、HE染色結果
對照組瘢痕組織成纖維細胞數目多、核大,毛細血管增生明顯,膠原纖維致密粗大,排列紊亂;各實驗組瘢痕均較對照組薄,成纖維細胞數目減少,膠原纖維減少,較疏松,可見少量毛細血管,以21、28 d組較為明顯。見圖2。
三、HI
各實驗組HI值均比對照組低(均P<0.05),7 d、14 d、21 d組HI值隨高壓氧治療時間的延長逐漸降低,14 d組低于7 d組,21 d組低于14 d組,差異有統計學意義(均P<0.05),21 d組與28 d組比較,差異無統計學意義(P>0.05)。見表1。
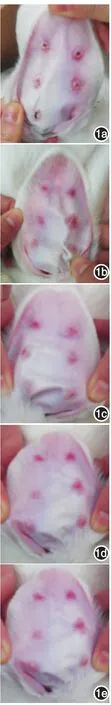
圖1 兔耳增生性瘢痕形成第29天形態學觀察:實驗組和對照組兔耳創面都形成了不同程度的增生性瘢痕 1a:對照組瘢痕增生明顯,高出皮膚表面,充血呈紅色,觸之質硬;1b~1e:分別為7、14、21、28 d組,與對照組相比,各實驗組瘢痕增生不明顯,瘢痕體積較對照組小,顏色較淺,質軟
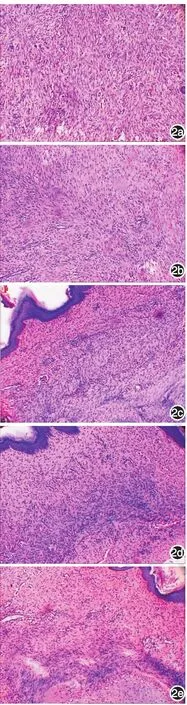
圖2 兔耳增生性瘢痕形成第29天組織學表現(HE×100) 2a:對照組瘢痕內大量成纖維細胞,膠原纖維致密粗大,排列紊亂;2b~2e:分別為7、14、21、28 d實驗組,其瘢痕均較對照組薄,成纖維細胞數目減少,膠原纖維少,排列較疏松
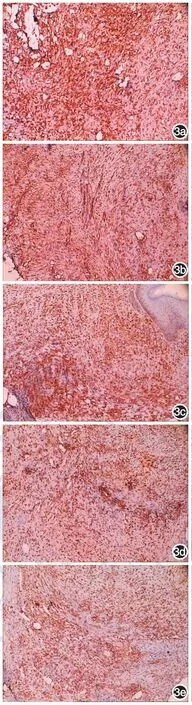
圖3 兔耳增生性瘢痕形成第29天胰島素樣生長因子Ⅰ受體(IGF-1R)的表達(免疫組化 ×100) 3a:對照組可見IGF-1R表達;3b~3e:分別為7、14、21、28 d組,IGF-1R表達較對照組明顯減弱
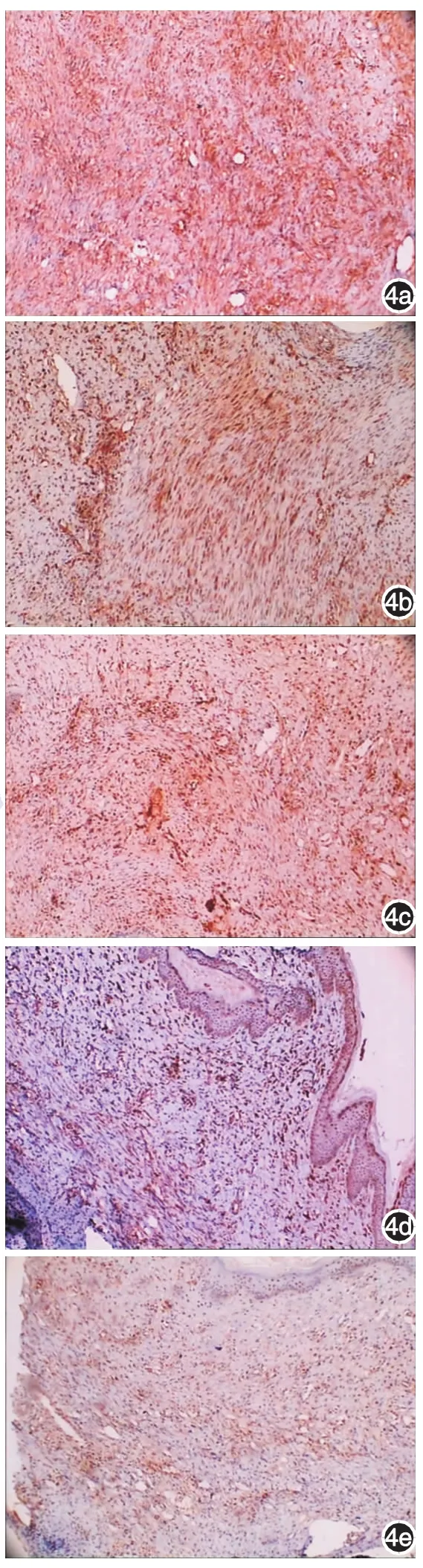
圖4 兔耳增生性瘢痕形成第29天缺氧誘導因子1α(HIF-1α)的表達(免疫組化×100) 4a:對照組可見HIF-1α表達; 4b ~ 4e:分別為7、14、21、28 d實驗組,HIF-1α表達較對照組明顯減弱
四、HIF-1α、IGF-1R 的表達
實驗組和對照組均可見HIF-1α、IGF-1R表達,見圖3、4。各實驗組HIF-1α、IGF-1R的表達量均較對照組顯著降低,差異有統計學意義(P<0.01),14 d組兩因子表達量較7 d組顯著減少,差異有統計學意義(P<0.01),21 d組兩因子的表達量較14 d組減少(P<0.05),28 d組兩因子的表達量與21 d組比較,差異無統計學意義(P>0.05)。見表1。
討 論
研究表明,兔耳瘢痕造模成功后28 d左右瘢痕增生達到高峰[9],此后28~56 d瘢痕處于增生穩定期,在該時間內既可觀察藥物對瘢痕繼續增生的抑制作用,又可觀察藥物等因素對已形成的固有瘢痕的影響[11-12]。本研究在造模后立即給予高壓氧干預,主要觀察高壓氧對兔耳瘢痕形成過程中早期的影響,因此選擇在高壓氧開始干預后的第29天統一取材來觀察高壓氧抑制瘢痕的效果。
表1 高壓氧對各組兔耳瘢痕增生指數、缺氧誘導因子1α(HIF-1α)、胰島素樣生長因子Ⅰ受體(IGF-1R)表達的影響(±s)
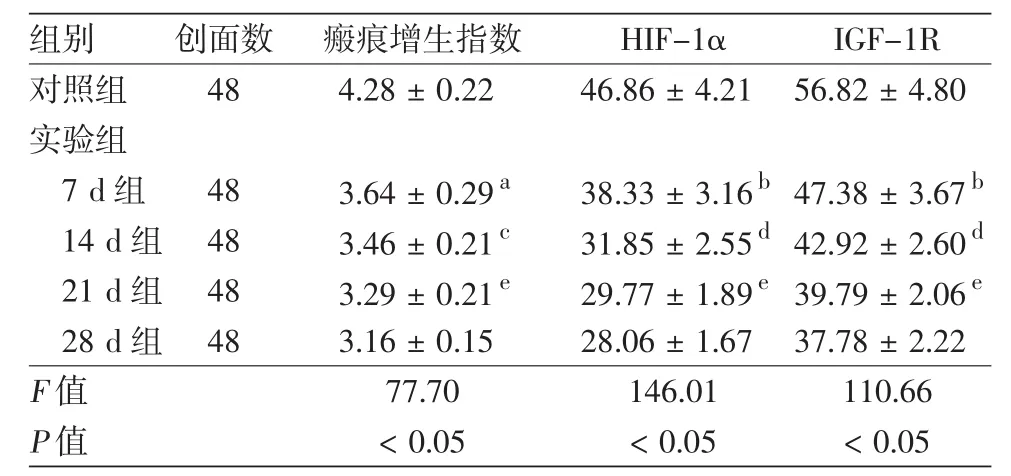
表1 高壓氧對各組兔耳瘢痕增生指數、缺氧誘導因子1α(HIF-1α)、胰島素樣生長因子Ⅰ受體(IGF-1R)表達的影響(±s)
注: 與對照組比較,a:P < 0.05,b:P < 0.01; 與 7 d組比較,c:P <0.05,d:P < 0.01;與 14 d 組比較,e:P < 0.05
組別 創面數 瘢痕增生指數 HIF-1α IGF-1R對照組 48 4.28±0.22 46.86±4.21 56.82±4.80實驗組7 d組 48 3.64±0.29a 38.33±3.16b47.38±3.67b 14 d組 48 3.46±0.21c 31.85±2.55d42.92±2.60d 21 d組 48 3.29±0.21e 29.77±1.89e39.79±2.06e 28 d組 48 3.16±0.15 28.06±1.67 37.78±2.22 F值 77.70 146.01 110.66 P值 <0.05 <0.05 <0.05
黎國屏和李清懷[13]在研究高壓氧對燒傷創面的影響時發現,高壓氧能改善組織低氧,使創面愈合速度加快,減少瘢痕組織形成。Al-Waili等[14]在研究高壓氧和惡性腫瘤的關系時發現,高壓氧能抑制乳腺癌動物模型中TGFβ1和IGF-1的表達。本研究發現,各實驗組HI值均比對照組低;組織形態學上,與對照組比較,各實驗組瘢痕增生不明顯,瘢痕體積小,色白,質軟,HE結果示各實驗組瘢痕均較對照組薄,成纖維細胞數目減少,膠原纖維減少,較疏松,以21 d、28 d組較為明顯;免疫組織化學檢測顯示,各實驗組HIF-1α、IGF-1R的表達量均較對照組顯著降低。此結果與 Romero-Valdovinos等[15]的研究結果基本一致,即高壓氧不但可以降低瘢痕中成纖維細胞的增殖,而且能降低瘢痕中TGF-β mRNA與IGF mRNA的表達,因此,高壓氧不但調控細胞活性,影響膠原的合成與降解,而且還能調節細胞因子的表達來進一步影響瘢痕形成。
本研究發現,HIF-1α及IGF-1R在14 d組表達量較7 d組顯著減少,21 d組較14 d組減少,28 d組與21 d組差異無統計學意義,表明盡早應用高壓氧干預可能更有利于創面愈合。
本研究結果初步表明,兔耳瘢痕形成過程中早期給予高壓氧治療可降低增生性瘢痕中HIF-1α、IGF-1R的表達,抑制增生性瘢痕的形成,推測其機制可能與以下因素有關:瘢痕形成早期,高壓氧通過改善組織氧張力,改善瘢痕的缺氧狀態,同時促進損傷血管的修復及促進新血管的生成,增加組織氧供,促進肉芽組織的生成,加快創面愈合,并且高壓氧下調IGF-1R、HIF-1α等與瘢痕增生密切相關的生長因子。IGF-1R表達降低能抑制成纖維細胞的生長增殖,減少膠原的合成、分泌,HIF-1α表達降低通過調節一系列靶基因來進一步抑制成纖維細胞的增殖及血管生成等來抑制瘢痕的增殖。
[1]Kischer CW,Shetlar MR,Shetlar CL.Alteration of hypertrophic scars induced by mechanical pressure[J].Arch Dermatol,1975,111(1);60-64.
[2]尹光文,李敏,張守民.血管內皮生長因子、缺氧誘導因子1α及基質金屬蛋白酶9在尖銳濕疣組織中的表達[J].中華皮膚科雜志,2007,40(5);280-282.
[3]Semenza GL,Wang GL.A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J].Mol Cell Biol,1992,12(12);5447-5454.
[4]Semenza GL.Expression of hypoxia-inducible factor 1;mechanisms and consequences[J].Biochem Pharmacol,2000,59(1);47-53.
[5]陳曉棟,方方,趙亮,等.胰島素樣生長因子-Ⅰ受體蛋白在瘢痕疙瘩中的表達[J].中華皮膚科雜志,2004,37(12);734.
[6]Daian T,Ohtsuru A,Rogounovitch T,et al.Insulin-like growth factor-I enhances transforming growth factor-beta-induced extracellular matrix protein production through the P38/activating transcription factor-2 signaling pathway in keloid fibroblasts[J].J Invest Dermatol,2003,120(6);956-962.
[7]劉子生,盧培剛,袁紹紀,等.高壓氧對大鼠脊髓損傷后血管內皮生長因子表達的影響[J].中華神經外科疾病研究雜志,2009,8(6);484-487.
[8]梁偉中.高壓氧治療慢性創面的研究進展[J].中國美容醫學,2010,19(11);1737-1740.
[9]李薈元.兔耳瘢痕模型的應用現狀[J].中國美容醫學,2011,20(7);1174-1178.
[10]徐少駿,鮑衛漢,陳東明,等.增殖瘢痕成纖維細胞接觸后增殖及生物合成特性對異常瘢痕形成的機理[J].中華整形外科雜志,2002,18(2);86-88.
[11]劉建波,李薈元.TGFβ1mRNA在兔耳瘢痕中的表達及其意義[J].第四軍醫大學學報,2000,21(4);s46-s48.
[12]李薈元.創傷研究動物模型-兔耳瘢痕模型的建立與應用[M].西安;第四軍醫大學出版社,2005;42-43.
[13]黎國屏,李清懷.高壓氧對燒傷創面的影響[J].河北醫科大學學報,1999,20(2);108.
[14]Al-Waili NS,Butler GJ,Beale J,et al.Hyperbaric oxygen and malignancies;a potential role in radiotherapy,chemotherapy,tumor surgery and phototherapy[J].Med Sci Monit,2005,11(9);RA279-RA289.
[15]Romero-Valdovinos M,Cárdenas-Mejía A,Gutiérrez-Gómez C,et al.Keloid skin scars;the influence of hyperbaric oxygenation on fibroblast growth and on the expression of messenger RNA for insulin like growth factor and for transforming growth factor[J].In Vitro Cell Dev Biol Anim,2011,47(7);421-424.
2013-12-05)
(本文編輯:尚淑賢)
Effects of hyperbaric oxygen on the expressions of hypoxia-inducible factor 1α and insulin-like growth factor-1 receptor in the formation of hyperplastic scar in rabbit ears
Ren Jizhen,Chen Zhenyu,Yang Ting,Wan Jin′e,Zhao Ming.Affiliated Hospital of Qingdao University,Qingdao 266003,China
;Chen Zhenyu,Email;czy.plastic@126.com
ObjectiveTo evaluate the effects of hyperbaric oxygen on the expressions of hypoxia-inducible factor 1α (HIF-1α) and insulin-like growth factor-1 receptor (IGF-1R) in the formation of hyperplastic scar in rabbit ears.MethodsThe ears of 20 New Zealand rabbits were used to construct an animal model for hyperplastic scar by operation.After the establishment of scar models,the rabbits were randomly divided into 4 experimental groups and one control group with 4 mice (48 wound surfaces) in each group.The mice in the 4 experimental groups were treated with hyperbaric oxygen for 7,14,21 and 28 days,respectively,and those in the control group remained in normoxic environment after operation.Scar tissues were resected from all the rabbit ears on day 29 after operation.Hematoxylin and eosin (HE)staining was conducted for the observation of morphological changes and calculation of scar elevation index,and immunohistochemistry to measure the expressions of HIF-1α and IGF-1R.Statistical analysis was carried out by one-way analysis of variance followed by least significant differencet-test.ResultsHE staining showed that both the number of fibroblasts and amount of collagen fibers were significantly reduced in the experimental groups compared with the control group.Scar elevation index was 4.28±0.22 in the control group,3.64±0.29,3.46±0.21,3.29±0.21,3.16±0.15 in the 7-,14-,21-and 28-day experimental groups respectively,with significant differences among these groups (F=77.70,P< 0.05).The expressions of HIF-1α and IGF-1R were significantly lower in these experimental groups than in the control group (allP<0.01),lower in the 14-day group than in the 7-day group(P<0.05),and lower in the 21-day group than in the 14-day group(P<0.05),with no significant differences between the 28-day group and 21-day group (bothP > 0.05).ConclusionHyperbaric oxygen can effectively down-regulate the expressions of HIF-1α and IGF-1R in scar tissue,and significantly inhibit the formation of hyperplastic scar in rabbit ears.
Hyperbaric oxygenation;Cicatrix;Hypoxia-inducible factor 1,alpha subunit;Receptor,IGF type 1
10.3760/cma.j.issn.0412-4030.2014.011.008
山東省科技發展計劃項目(2011YD18036)
266003青島大學醫學院附屬醫院
陳振雨,Email:czy.plastic@126.com

