凝集生長毛乳頭細胞分泌性蛋白組的初步分析
夏汝山 顧靜 陶詩沁 楊莉佳
凝集生長毛乳頭細胞分泌性蛋白組的初步分析
夏汝山 顧靜 陶詩沁 楊莉佳
目的了解毛乳頭細胞在凝集生長狀態下分泌性蛋白組的表達。方法以凝集和非凝集生長的毛乳頭細胞為研究對象,分別制備分泌性蛋白質,以雙向凝膠電泳技術和PDQuest軟件分析二者之間的蛋白圖譜的差異,通過基質輔助激光解吸電離飛行時間串聯質譜(MLDI-TOF-MS)鑒定表達差異的蛋白質,通過蛋白質數據庫NCBInr檢索分析。結果建立了重復性好、分辨率高的雙向電泳圖譜;在凝集生長和非凝集生長的毛乳頭細胞分泌性蛋白質中分別檢測到(1 134±52)個和(1 078±36)個蛋白點,大多匹配。按照差異量在5倍以上的標準,二者存在差異蛋白質28個,經過MLDI-TOF-MS質譜鑒定出10種差異表達蛋白點,其中8種蛋白質表達上調,分別為Rho GDP分離抑制劑1、細絲蛋白A、胱抑素C、纖維連接蛋白、親環素A、前膠原C端蛋白酶增強子、組織金屬蛋白酶抑制劑、組織金屬蛋白酶-2抑制劑。2種蛋白質表達下調,為神經肽h3和基質金屬蛋白酶-3金屬蛋白酶組織抑制劑-1復合物復合物。結論凝集生長和非凝集生長毛乳頭細胞差異蛋白主要涉及信號通路、細胞增殖與分化、細胞外基質合成及降解等功能。
毛乳頭細胞;分泌蛋白質類;電泳,凝膠,雙向;MALDI-TOF質譜
毛乳頭是毛囊的真皮部分,體外培養時呈凝集性生長為其特性之一,有誘導毛囊形成和再生的能力。隨著細胞傳代至第6~15代時,毛乳頭細胞(dermal papilla cells,DPC)失去凝集性生長特性并失去誘導毛囊形成和毛囊再生的能力。研究證實,凝集生長的DPC分泌大量蛋白樣因子,共同調節其他DPC、外根鞘細胞和角質形成細胞的增殖[1]。研究這些蛋白質,對于闡明毛囊周期調控,解決脫發問題具有一定的價值。然而,這些有重要功能的蛋白質大多是低豐度蛋白質,由于含量少,樣品制備成為實驗的關鍵。在前期[2]工作中,我們建立了制備DPC分泌性蛋白質組方法。在本研究中,我們通過蛋白質組學比較凝集與非凝集生長DPC的蛋白表達差異,探討DPC凝集生長的生理基礎。
材料與方法
一、材料
1.試劑及儀器:DMEM培養基為美國Hyclone公司產品;IPG膠條(pH3~10,13 cm)、IPG緩沖液、DTT、碘乙酰胺、CHAPS、尿素、丙烯酰胺、甲叉丙烯酰胺、Tris為美國Amersham Pharmacia產品;三氟乙酸、胰蛋白酶為美國Sigma產品。硝酸銀為國產試劑。雙向電泳模具、IPGPhorⅡ型等電聚焦儀和SE600電泳儀為美國Amersham Pharmacia公司產品;凝膠掃描儀為美國Bio-Rad公司產品;MALDITOF質譜儀為德國Burker公司產品。
2.標本:所需毛乳頭來自門診外科頭皮術后殘留的含毛發正常組織。經無錫市第二人民醫院倫理委員會批準,患者均簽署知情同意書。
二、方法
1.細胞培養:采用“二步酶”法分離和培養人頭皮毛乳頭,DPC在常規條件下擴大培養,培養第3代以前為凝集性生長DPC,第6代以后為非凝集性生長DPC(圖1)。細胞生長至80%融合時,用0.1 mol/L PBS洗滌3次,加入適量Williams E無血清培養基,孵育24 h后收集無血清培養上清,在4℃低溫、1 699×g條件下離心1 h,收集上清液。
2.蛋白質樣品制備:DPC分泌性蛋白質制備,參照已建立的方法[2]。
3.雙向電泳及圖像分析:雙向電泳參照G?rg等[3]描述的方法,150 μg總蛋白與重水化液(8 mol/L尿素,2%CHAPS,60 mmol/L DTT和0.5%IPG緩沖液pH 3~10)混合,總體積250 μl吸入IPG膠槽,置于IPGphor等電聚焦儀電極板上,重水化和等電聚焦在20℃自動進行,總電壓時間積40 000 Vh。等電聚焦后于平衡液中平衡2次。SDS-PAGE在SE600電泳儀中進行。電泳結束后,用質譜兼容的銀染法染色,超純水脫色至背景清楚。用Gel Doc 2000成像系統對凝膠進行掃描,圖像經PDQuest分析軟件進行處理并比較差異蛋白質點。
4.肽質量指紋譜(PMF)鑒定:選取差異5倍以上的蛋白點,從凝膠上準確切割后用水清洗幾次后用含50%乙腈,25 mmol/L NH4HCO3溶液浸泡膠片,至膠片中藍色褪盡;真空離心干燥使膠片完全脫水,加入0.01 μg/μl的胰酶溶液5~10 μl,待酶液完全吸收后補充10 μl 25 mmol/L NH4HCO3,37℃保溫15 h;加5%三氟乙酸50~100 μl于40℃保溫1 h,吸出上清,加入2.5%三氟乙酸,50%乙腈50~100 μl于30℃保溫1 h,吸出上清,合并上清液,冷凍干燥。制備好的樣品置于質譜儀上進行分析,采用線性模式、正離子譜測定,離子源加速電壓1為20 kV,加速電壓2為18.85 kV,N2激光波長337 nm,脈沖寬度為3 ns,離子延遲提取500 ns,真空度4× 10-7Torr,質譜信號單次掃描累加50次,并用基質峰和胰蛋白酶自動降解離子峰為內標校正質譜峰,獲得PMF。
5.數據庫查詢:通過中國國家生物醫學中心的蛋白質組學網站(www.proteomics.com.cn),Mascot網站(http://www.matrixscience.com/)查詢。
6.統計學分析:雙向電泳實驗重復3次,電泳圖譜經PDQuest軟件分析,蛋白點數以±s表示。MASCOT是數據庫檢索軟件,質譜分析中以MASCOT評分作為一個直觀的數值來評價一個結果是否可信,Mascot分數高低取決于數據庫的大小與設定的P值,我們以MASCOT評分>65,P<0.05認定結果可信,以得分最高的蛋白作為匹配蛋白。
結果
一、凝集與非凝集性生長毛乳頭細胞生長特征
低傳代DPC呈現凝集性生長特征(圖1a),第6代后的DPC呈梭形,表現為成纖維細胞形態,不出現凝集性生長特征,為非凝集性生長DPC(圖1b)。
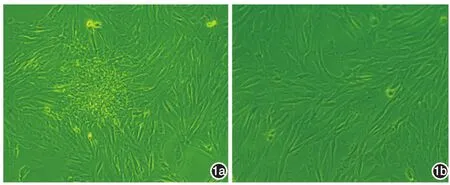
圖1 毛乳頭細胞的生長狀態 1a:凝集生長毛乳頭細胞,細胞呈現聚集成細胞團的生長特點;1b:非凝集生長毛乳頭細胞,細胞呈現成纖維細胞特點,呈梭形,非聚集生長
二、雙向電泳結果
本研究建立了重復性較好、分辨率較高的雙向凝膠電泳銀染圖譜(圖2)。在凝集生長和非凝集生長的DPC分泌性蛋白質中分別檢測到(1 134±52)個和(1 078±36)個蛋白點,各點清晰獨立。差異蛋白點主要集中在分子量較低的蛋白質,與分泌性蛋白質的特點相吻合。按照差異量在5倍以上的標準,凝集生長和非凝集生長毛乳頭細胞存在差異蛋白質28個。
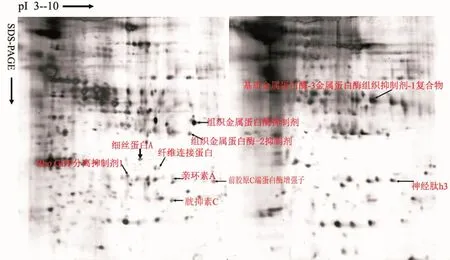
圖2 毛乳頭細胞分泌性差異蛋白質雙向電泳圖譜,二者大多匹配,差異點主要集中在低分子量蛋白質,在此區域凝集生長毛乳頭細胞的蛋白點數高于非凝集生長毛乳頭細胞 2a:凝集生長毛乳頭細胞;2b:非凝集生長毛乳頭細胞
三、質譜鑒定和數據庫檢索
通過MALDI-TOF/TOF質譜儀鑒定差異蛋白點,11個蛋白點獲得很好的PMF圖譜,與10個蛋白質相匹配(表1),其中8種蛋白質表達上調,分別為Rho GDP分離抑制劑1(Rhogdi 1)、細絲蛋白A、胱抑素C、纖維連接蛋白、親環素A、前膠原C端蛋白酶增強子(PCPE-1)、組織金屬蛋白酶抑制劑(TIMP)、組織金屬蛋白酶-2抑制劑(TIMP-2);2種蛋白質表達下調,為神經肽h3和基質金屬蛋白酶-3金屬蛋白酶組織抑制劑-1復合物(Mmp-3TIMP-1)復合物。根據質譜鑒定信息查詢數據庫,這些差異蛋白質主要參與了細胞信號轉導、細胞外基質合成及降解等生理過程等。
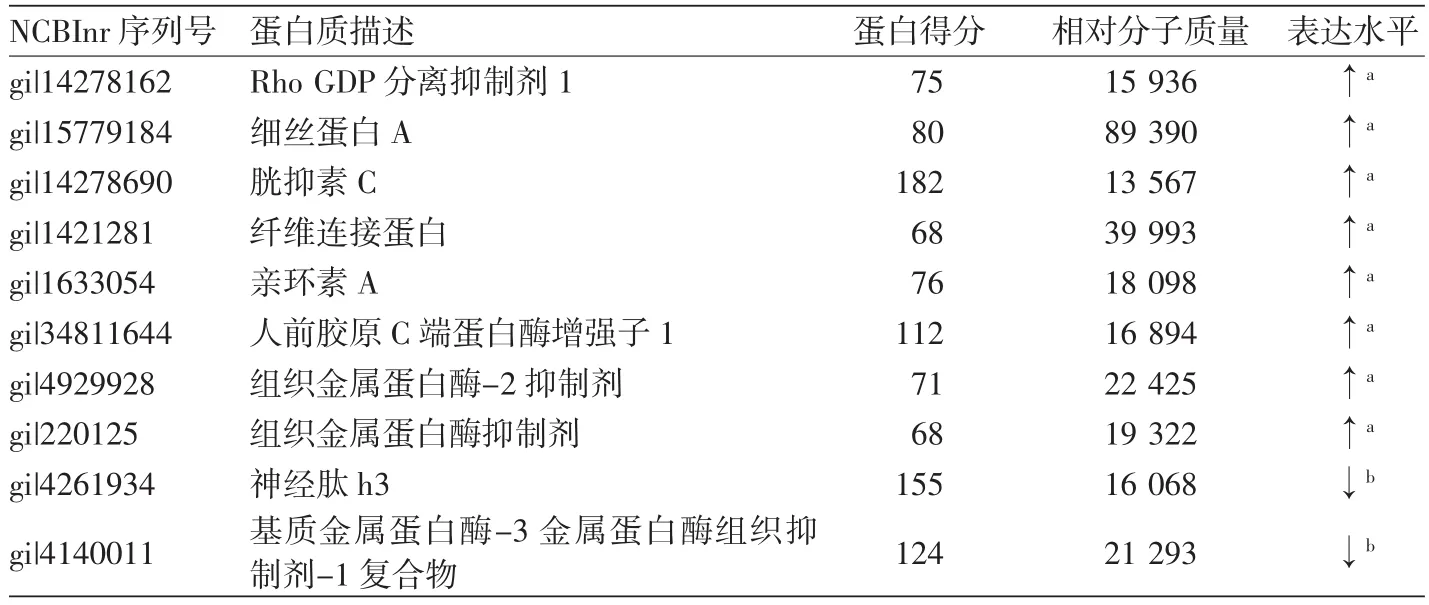
表1 凝集生長和非凝集生長毛乳頭細胞質譜鑒定的差異分泌蛋白質
討論
毛乳頭是毛囊生長和毛發周期的控制中心,毛乳頭細胞的生長狀態決定其生理功能,因此研究凝集和非凝集生長狀態下毛乳頭細胞蛋白表達差異有助于闡明毛乳頭在毛囊生長和周期調控中的作用。比較蛋白質組學已經成功用于分泌性蛋白質組研究[4]。本實驗中,我們應用比較蛋白組學技術對凝集和非凝集生長狀態下毛乳頭細胞分泌的差異蛋白質進行了研究,在多次探索實驗條件后,根據優化的實驗條件進行雙向電泳,獲得了重復性較好、分辨率較高的雙向凝膠電泳銀染圖譜。在凝集和非凝集生長的DPC分泌性蛋白質中分別檢測到(1 134± 52)個和(1 078±36)個蛋白點,各點清晰獨立。按照差異量在5倍以上的標準,凝集生長和非凝集生長毛乳頭細胞存在差異蛋白質28個,其中11個獲得良好的肽質量指紋譜,與10種蛋白質相匹配,8種蛋白質在凝集性生長狀態下表達上調,2種蛋白質在凝集性生長條件下表達下調。通過數據庫查詢得知,這些差異蛋白質主要參與了細胞信號轉導、細胞外基質合成及降解等生理過程等。
由于DPC分泌性蛋白質以低豐度的形式存在,增加了通過雙向電泳進行分析的難度,為此我們采用了與質譜兼容的銀染法,在保證蛋白較好分離的基礎上增加了敏感性。本實驗鑒定的10種差異蛋白質中5種蛋白質參與信號通路、細胞增殖與分化,包括細絲蛋白、纖維連接蛋白、胱抑素C、親環素A和Rho GDI 1。細絲蛋白參與細胞核和細胞質信號通路[5];纖維連接蛋白和胱抑素C參與細胞增殖等[6-7]。親環素A參與信號轉導,維持發育中或變性蛋白質的正確結構[8]。Rho GDI 1參與細胞運動調控[9]。4種蛋白質為細胞外基質蛋白,包括 TIMP、TIMP-2、Mmp-3TIMP-1和PCPE-1,在調節細胞外基質蛋白的合成和降解中發揮關鍵作用[10-11]。我們推測,這些信號分子和基質蛋白可能與毛乳頭細胞的凝集性生長和毛囊生長發育相關。
神經肽是存在于神經組織并參與神經系統功能作用的一類特殊的信息物質,神經肽h3曾在肺癌組織中被發現[12],未見于其他組織和細胞。本研究中神經肽h3的出現是否與毛乳頭生長相關尚不清楚,需要深入探討。
[1]McElwee KJ,Hoffmann R.Growth factors in early hair follicle morphogenesis[J].Eur J Dermatol,2000,10(5):341-350.
[2]夏汝山,郝飛,楊希川,等.毛乳頭細胞分泌性蛋白質組的制備[J].中華皮膚科雜志,2013,46(2):57-58.
[3]G?rg A,Obermaier C,Boguth G,et al.T he current state of two-dimensional electrophoresis with immobilized pH gradients [J].Electrophoresis,2000,21(6):1037-1053.
[4]楊立群,陳曉棟,姚曉東.非標記定量技術研究瘢痕疙瘩的蛋白質組學特點[J].中華皮膚科雜志,2012,45(3):173-177.
[5]Uribe R,Jay D.A review of actin binding proteins:new perspectives [J].Mol Biol Rep,2009,36(1):121-125.
[6]Singh P,Schwarzbauer JE.Fibronectin and stem cell differentiationlessons from chondrogenesis[J].J Cell Sci,2012,125(Pt 16): 3703-3712.
[7]Korolenko TA.Cystatins:biological role and changes in pathology [J].Vestn Ross Akad Med Nauk,2008,(4):43-47.
[8]Lee J.Role of cyclophilin a during oncogenesis[J].Arch Pharm Res,2010,33(2):181-187.
[9]DovasA,CouchmanJR.RhoGDI:multiplefunctionsintheregulation of Rho family GTPase activities[J].Biochem J,2005,390(Pt 1): 1-9.
[10]Weiss T,Ricard-Blum S,Moschcovich L,et al.Binding of procollagen C-proteinase enhancer-1 (PCPE-1)to heparin/ heparan sulfate:properties and role in PCPE-1 interaction with cells[J].J Biol Chem,2010,285(44):33867-33874.
[11]Wasilewska A,Taranta-Janusz K,Zoch-Zwierz W,et al.Role of matrix metalloproteinases(MMP)and their tissue inhibitors (TIMP)in nephrology[J].Przegl Lek,2009,66(9):485-490.
[12]羅國安,鄧斌,葉能勝,等.肺鱗癌和小細胞肺癌組織比較蛋白質組學研究[J].高等學校化學學報,2005,26(9):1645-1649.
2014-01-01)
(本文編輯:吳曉初)
A preliminary analysis of the secretome of aggregated dermal papilla cells
Xia Rushan,Gu Jing,Tao Shiqin,Yang Lijia.Department of Dermatology,Wuxi No.2 People′s Hospital,Nanjing Medical University,Wuxi 214002,Jiangsu,China
Yang Lijia,Email:yanglijia726@163.com
ObjectiveTo study the expression of secreted proteins in aggregated dermal papilla cells (DPCs).MethodsDPCs were isolated from human scalp tissue and subjected to primary culture and subculture. Aggregated and non-aggregated DPCs served as the subject of this study.Secreted proteins were prepared from these cells and subjected to two-dimensional polyacrylamide gel electrophoresis.Differentially expressed proteins were screened by the PDQuest image analysis software.Protein spots were digested and identified by matrix-assisted laser desorption/ionization time-of-flight(MALDI-TOF)mass spectrometry,and finally analyzed using the National Center forBiotechnologyInformation (NCBI)non-redundant(Nr)proteindatabase.ResultsTwo-dimensional electrophoresis maps with good repeatability and high resolution were established.Image analysis of 2-D gels revealed that the average number of detected protein spots was 1 134±52 and 1 078±36 in aggregated and nonaggregated DPCs respectively,and the majority of these protein spots were matched between aggregated and nonaggregated DPCs.Twenty-eight protein spots showed more than 5-fold difference between the two groups of cells,and 10 proteins were preliminarily identified as differentially expressed proteins by peptide-mass fingerprinting.Of these differentially expressed proteins,8 proteins including Rhogdi 1,filamin A,cystatin C,fibronectin,cyclophilin A,procollagen C proteinase enhancer 1,tissue inhibitor of metalloproteinase and tissue inhibitor of metalloproteinase-2 were up-regulated,and 2 proteins including neuropolypeptide h3 and matrix metalloproteinase-3/tissue inhibitor of metalloproteinase-1 complex were down-regulated in aggregated DPCs compared with non-aggregated DPCs.ConclusionsDifferentially expressed proteins between aggregated and non-aggregated DPCs are mainly implicated in cell signaling pathway,cellular proliferation and differentiation,extracellular matrix synthesis and degradation,and so on.
Dermal papilla cells;Secretory proteins;Electrophoresis,gel,two-dimensional;MALDI-TOF mass spectrometry
10.3760/cma.j.issn.0412-4030.2014.10.003
南京醫科大學科技發展基金(2011NJMUZ05);無錫市衛生局科研計劃項目(ML201202)
214002江蘇無錫,南京醫科大學附屬無錫市第二人民醫院皮膚科
楊莉佳,Email:yanglijia726@163.com

