抗體偶聯小分子藥物T-DM1的ELISA檢測方法的建立
胡百卉 ,車津晶,許先興,諶瑛,劉運龍,陳知航,程遠國,許麗娜
1.吉林農業大學 動物科技學院,吉林 長春 130062;2.軍事醫學科學院 微生物與流行病研究所,北京 100071;3.第二炮兵總醫院 藥學部,北京 100088;4.吉林神話集團 通化玉圣藥業有限公司,吉林 通化 134000
近幾年,隨著環境污染增加和生活壓力增大,我國國民中癌癥的發生率呈快速上升趨勢。過去10年里,抗癌藥物的研發取得了重大進展,尤其是生物制品的出現,增加了醫生和患者對抗腫瘤藥物的選擇機會。傳統的小分子化療類藥物通常存在非特異性結合靶點,因而可能產生嚴重的副作用;相反,具有靶向性特征的單克隆抗體藥物一般具有非常強的特異性結合靶點,雖然諸如血小板減少、急性腎功能衰竭、免疫毒性、肺毒性和潛伏病毒感染的易感性等不良反應也偶有發生,但從整體而言其副作用相對較少[1]。人源化單克隆抗體已獲準用于治療癌癥、炎癥、自身免疫性疾病、傳染病和修復移植排斥反應[2],但單抗藥物的藥代動力學和藥效學非常復雜[3]。
理想化的抗癌藥物就是把具有良好的臨床療效的靶向特異性抗體和小分子藥物結合,這就是抗體-藥物偶聯制劑(antibody-drug conjugate,ADC)。抗體-藥物偶聯制劑結構是具有靶向性作用的單克隆抗體與具有特定藥理學特性(如細胞毒作用)的化合物結合。然而,利用單克隆抗體把一種化療藥物靶向到腫瘤細胞,在實際操作中是一項復雜的技術[4]。單克隆抗體必須與一種具有治療作用的細胞毒素偶聯,并且這種結合足夠穩定,而不至于釋放大量細胞毒素進入全身循環;如果結合不穩定,導致細胞毒素釋放,最終會引起靶向細胞對毒素的內化[5]。同時,把細胞毒素偶聯到單克隆抗體產生一種抗體-藥物偶聯物的制備過程,在偶聯后應該保持該藥物(抗體-藥物偶聯物)對靶點的識別[6]。
T-DM1 就是抗體偶聯小分子藥物,它結合了單克隆抗體赫賽汀(Herceptin,曲妥珠單抗)與trastuzumab emtansine(T-DM1)。曲妥珠單抗可靶向作用于乳腺癌和胃癌人表皮生長因子受體2(human epidermalgrowth factor receptor-2,HER2),而emtansine 是美登素(maytansine)的合成衍生物(美登素是一種小分子毒素,可與微管蛋白結合,通過非還原的雙-馬來酸亞胺-丙二醇聯合體防止微管形成)[7]。曲妥珠單抗僅被批準用于HER2 陽性的癌癥,但不能促使所有的HER2陽性細胞凋亡。T-DM1結合了選擇性靶向HER2 受體的曲妥珠單抗與強效的細胞毒劑而殺死腫瘤細胞(不管HER2 是否誘導凋亡反應),即T-DM1 抗體與HER2 受體結合,引起從偶聯物釋放的美登素細胞內化,進而殺死腫瘤細胞。體內外研究顯示,與曲妥珠單抗相比,T-DM1 具有較好的整體療效和藥代動力學特性,且毒性較低[8]。
鑒于抗體偶聯藥物的復雜性,常規方法難以滿足對其的檢測要求。本研究的目的在于建立一種靈敏度高、特異性好的T-DM1 檢測方法,用于定量分析生物樣品中的T-DM1含量。
1 材料和方法
1.1 材料
T-DM1(濃度20.8 mg/mL,于4℃保存)、抗DM1單抗(濃度9 mg/mL,于-80℃保存)由上海恒瑞醫藥股份有限公司提供;猴血清吸附的羊抗人IgG-HRP購于BETHYL公司;脫脂乳購于BD醫療器械(上海)有限公司;牛血清白蛋白(BSA)購于羅氏公司;TMB底物液購于阿拉丁公司;聚苯乙烯96 孔酶標板購于Costar公司;酶標儀購于BIO-RAD公司。
1.2 試劑配制
pH7.4 磷酸鹽緩沖液(PBS):稱取16 g NaCl、0.4023 g KCl、2.84 g Na2HPO4、0.544 g KH2PO4,溶于2 L ddH2O。封閉液:用PBS 配置5%脫脂乳。稀釋液:用PBS 配置1% BSA 溶液。顯色液:TMB 底物液A液與B液等體積混合。終止液:將20.8 mL硫酸緩慢加入100 mL 蒸餾水中,邊加邊攪拌。ELISA 洗板液:將0.5 mL Tween-20加入999.5 mL PBS中。
1.3 檢測步驟
包被:用PBS 稀釋抗DM1 單抗至10μg/mL,100μL/孔包被于96 孔板中,4℃過夜;封閉:洗板后,加入封閉液200μL/孔,室溫封閉2 h;加樣:洗板后,用20%猴血清稀釋標準品和質控,100μL/孔加入96 孔板,室溫孵育1 h;加二抗:二抗稀釋至1/40 000,在洗板后以100μL/孔加入96 孔板,室溫孵育1 h;顯色:洗板后,加入顯色液100μL/孔,室溫避光孵育15 min;終止:加入終止液100μL/孔;讀數:在酶標儀中讀取D450nm值。
2 結果
2.1 標準曲線與線性范圍
將T-DM1 用20%猴血清梯度稀釋至80、40、20、10、5、2.5、1.25及0.625 ng/mL,取100μL樣品,按上述測定方法檢測。以D450nm值為縱坐標、各標準管濃度為橫坐標,對其進行非線形回歸運算,所得回歸方程即為T-DM1 的標準曲線。擬合曲線見表1、圖1。經四參數Logistic 函數模型擬合,求得曲線斜率、EC50,及上下端漸進線間的近線性范圍。
2.2 方法的靈敏度與最低檢測濃度
按照制備標準曲線的方法制成0.625 ng/mL 的T-DM1,同樣按上述方法進行測定,重復6 次,由同一板上的標準曲線回歸方程計算出的濃度為TDM1 的檢出量。標準品回收率試驗滿足批內CV<20%的檢測下限(LOQ)為0.625 ng/mL。見表2。
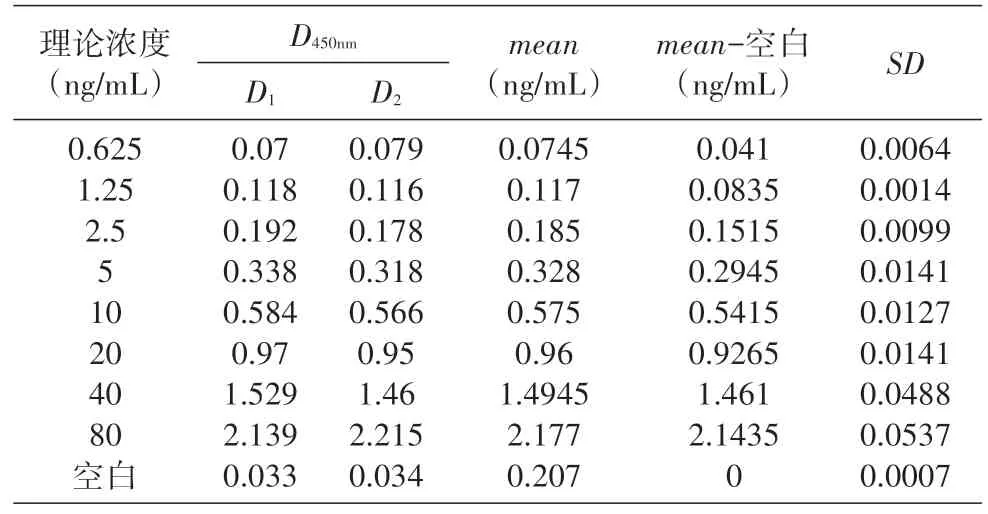
表1 標準曲線與線性范圍
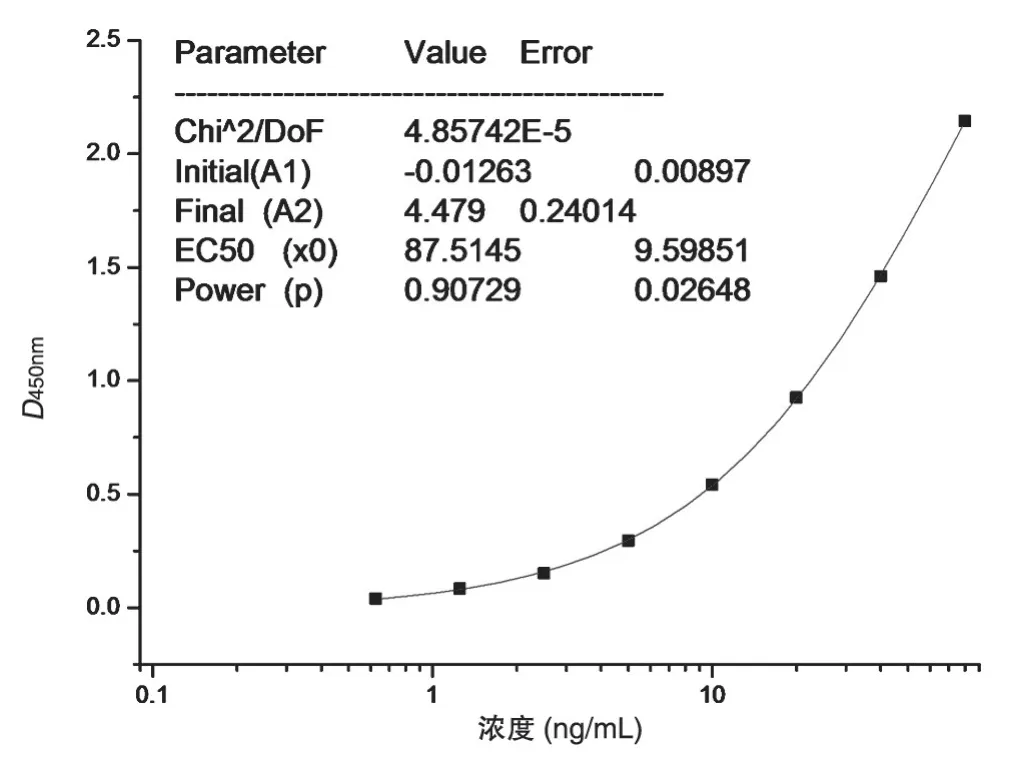
圖1 T-DM1的四參數校正曲線
2.3 方法的精密度與準確度
按上述方法測定40、5、1.25 ng/mL 高、中、低3個濃度,每個濃度平行測定6次,共測定3次,分別計算批內與批間的CV值與RE值。結果見表3,3 種濃度水平批內與批間CV值均小于10%,檢測方法具有較高的精密度;同時,3 種濃度水平測定批內與批間RE值均小于10%,檢測方法具有較高的準確度。
2.4 方法的特異性
按照制備標準曲線的方法制成終濃度為45 ng/mL的T-DM1樣品,在其中加入PEG-EPO(促紅細胞生成素)、IL-2(白細胞介素2)、IFN-α2a(α2a 干擾素)和GH(生長激素),在標準曲線范圍內進行測定,每樣品重復6 次,檢測結果見表4。T-DM1 與EPO、IL-2、IFN-α2a和GH 沒有發生交叉反應,T-DM1 測定結果沒有受到影響。
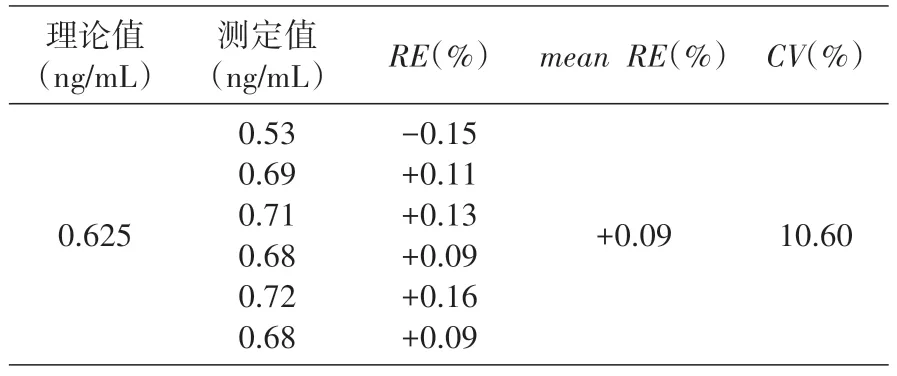
表2 ELISA方法檢測加入猴血清中受試物的靈敏度
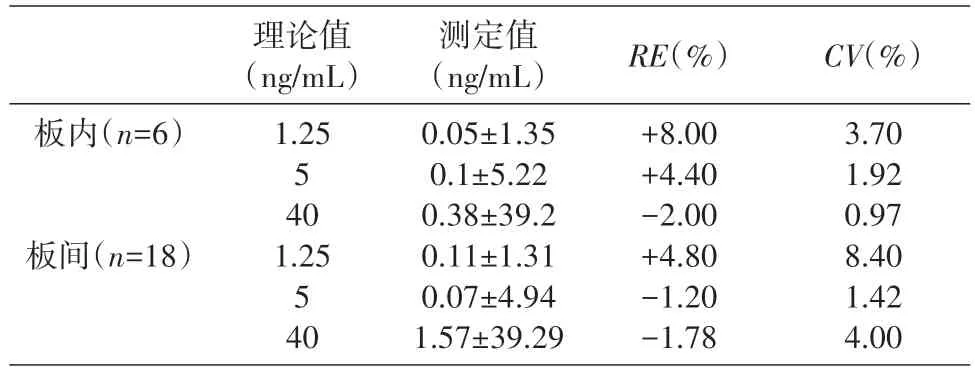
表3 ELISA方法檢測加入猴血清中受試物的T-DM1精密度與準確度
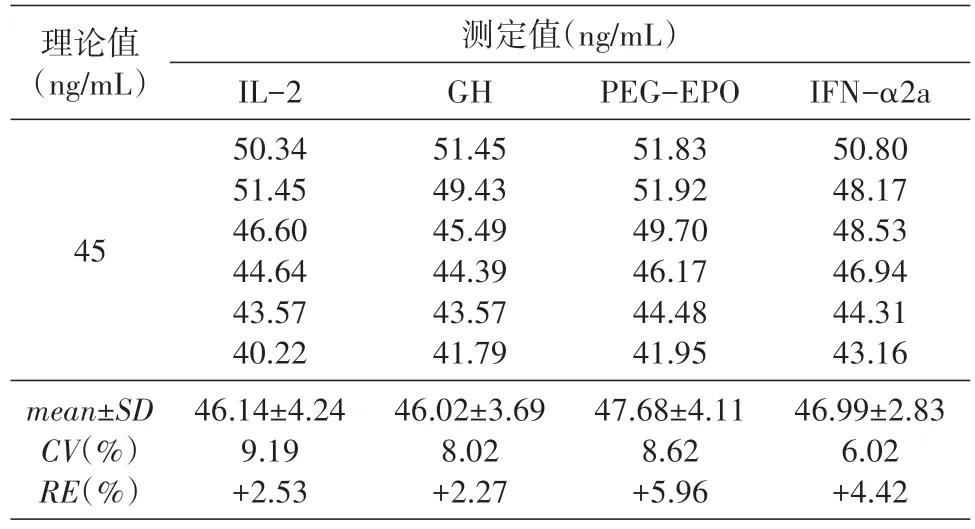
表4 受試藥加入PEG-EPO、IL-2、IFN-α2a和GH后的回收率
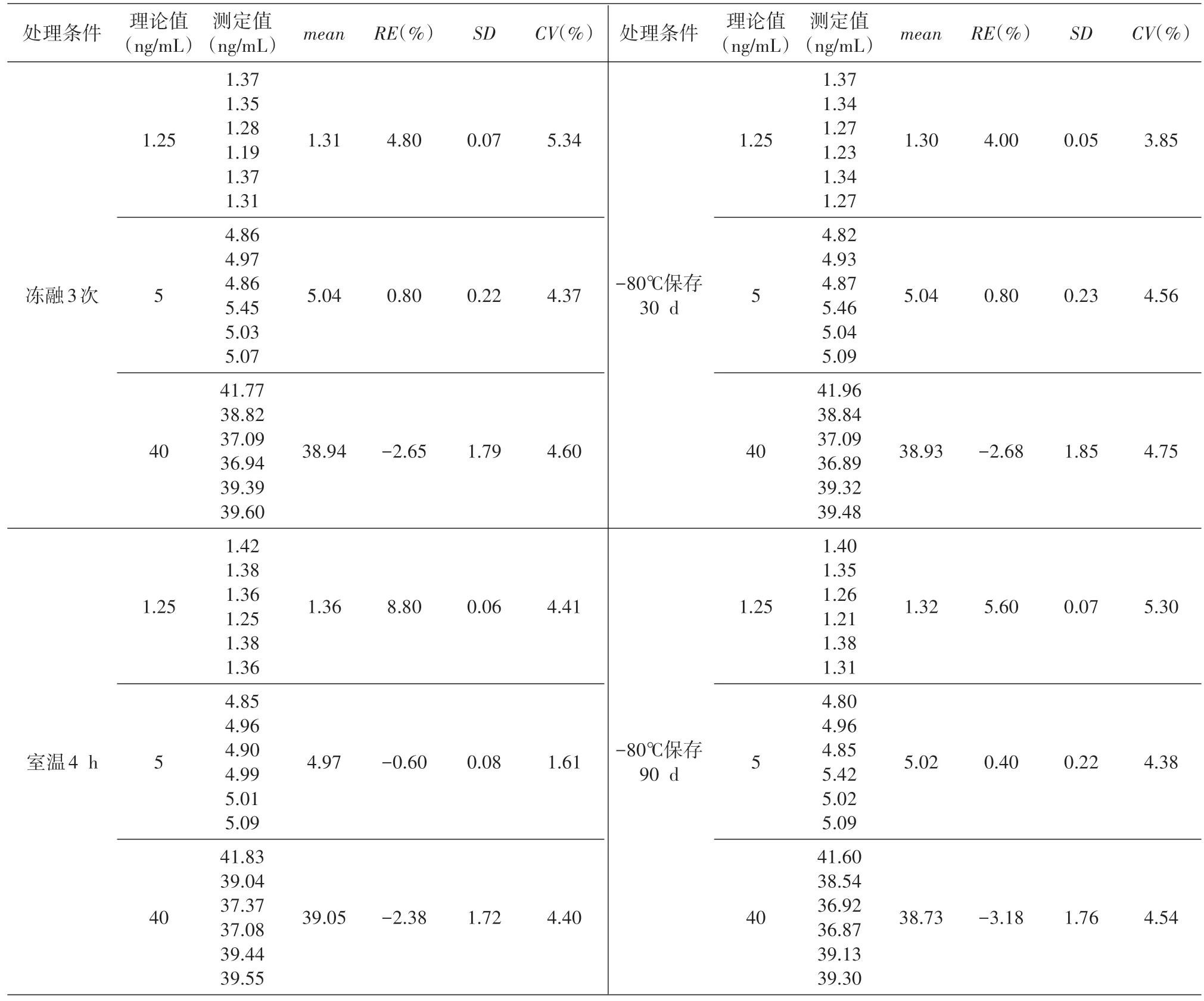
表5 T-DM1的穩定性
2.5 樣品的穩定性
猴血清中T-DM1 的穩定性研究結果見表5,TDM1 在血清中凍融3 次,或室溫放置4 h、30 d、90 d,或-80℃長期保存,均不影響其穩定性。
2.6 樣品稀釋率的影響
用20%猴血清將25μg/mL 濃度的T-DM1 標準液分別稀釋至1/20 000、1/5000和1/625,每個稀釋率6 個樣品進行測定,結果見表6,不同的稀釋率對樣品檢測無影響,不存在稀釋效應。
上述方法學確證結果表明,我們建立的ELISA方法的特異性、板內和板間精密度、LOQ、回收率、穩定性及樣品稀釋率的影響均滿足生物樣品分析要求,可用于T-DM1的藥代動力學研究。
3 討論
研究表明ADC 在治療實體瘤方面仍存在較大問題。實體瘤的細胞被致密的基質包裹,抗體難以穿透這一屏障。大多數實體瘤都存在淋巴回流障礙,導致間質內壓力升高,阻礙了抗體進入腫瘤實質;而小部分進入實體瘤內部的抗體,首先遇到的是血管周圍的腫瘤細胞而被結合,使得抗體無法到達距離血管較遠的腫瘤細胞[9]。因此,目前應用抗體藥物治療大體積實體瘤的效果仍不理想。ADC類藥物下一步的發展目標必定是增加其腫瘤血管特異性,使其充分進入腫瘤細胞[10]。
生物制品分析方法通常開始于創建適當的制造工藝,然后通過其確認目標產品(起初是單克隆抗體,然后是抗體-藥物偶聯物)的正確結構和功能[11]。監管機構提出的對生物制品分析要求,包括對其分子結構、乙二醇微觀不均一性、雜質、降解產物和生物利用度的研究。
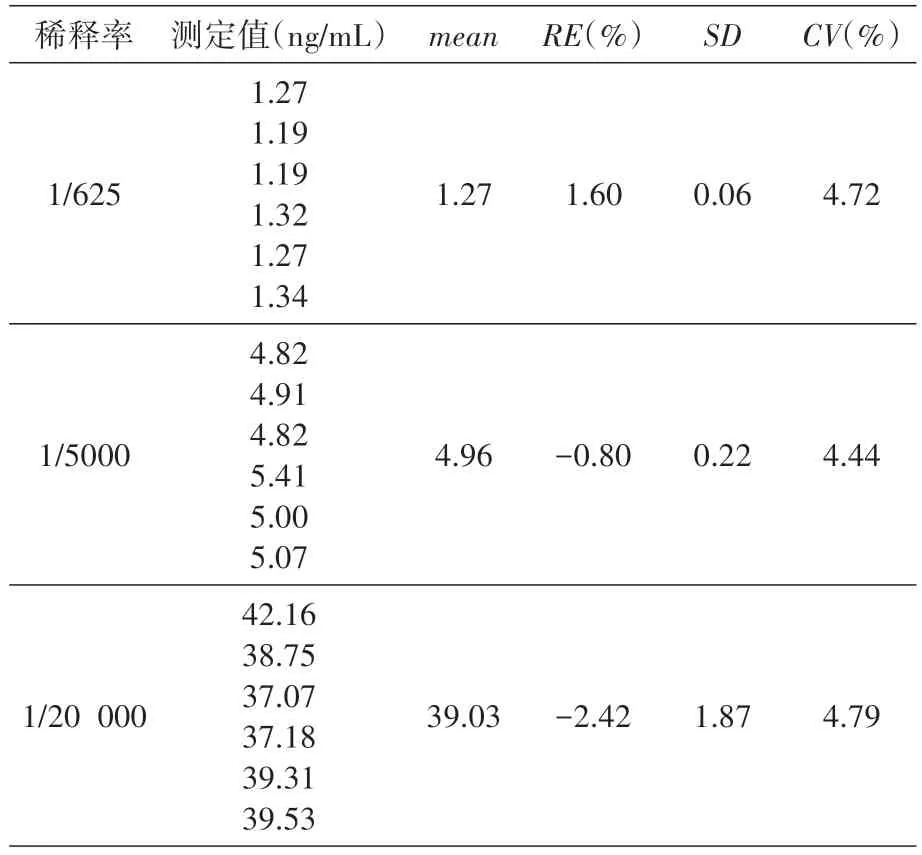
表6 樣品稀釋率的影響
抗體-藥物偶聯物的3 個主要組成部份(單克隆抗體、連接器和細胞毒素)都需要充分滿足某些特點,因此評價批次差異將會異常復雜[12]。根據歐洲藥品管理局(EMA)的生物仿制藥指南,“每一種單克隆抗體都是獨特的,結構也會有微小的改變,進而顯著影響其功能,即使是在同樣的表達系統和相似的培養條件下,也可能會產生一個不同特性的產品(例如,雜質和微觀不均一性)”[13]。
[1]Erickson H K,Park P U,Widdison W C,et al.Antibodymaytansinoid conjugates are activated in targeted cancer cells by lysosomal degradation and linker-dependent intracellular orocessing[J].Cancer Res,2006,66:4426-4433.
[2]Girish S,Gupta M,Wang B,et al.Clinical pharmacology of trastuzumab emtansine(T-DM1):an antibody-drug conjugate in development for the treatment of HER2-positive cancer[J].Cancer Chemother Pharmacol,2012,69:1229-1240.
[3]Reichert J M,Dhimolea E.Foundation review:the future of antibodies as cancer drugs[J].Drug Discovery Today,2012,3:1-10.
[4]Xie Hongsheng,Audette C,Hoffee M,et al.Pharmacokinetics and biodistribution of the antitumor immunoconjugate,cantuzumab mertansine(huC242-DM1),and its two components in mice[J].J Pharmacol Exp Ther,2004,308:1073-1082.
[5]Krop I E,Beeram M,Modi S,et al.Phase I study of trastuzumab-DM1,an HER2 antibody-drug conjugate,given every 3 weeks to patients with HER2-positive metastatic breast cancer[J].Am Soc Clin Oncol,2010,28:2698-2704.
[6]Lewis Phillips G D,Li Guangmin,Dugger D L,et al.Targeting HER2-positive breast cancer with trastuzumab-DM1,an antibody-cytotoxic drug conjugate[J].Cancer Res,2008,68:9280-9290.
[7]豐雪,龍亞一,廖翰,等.抗腫瘤抗體-藥物偶聯物的臨床研究進展[J].現代生物醫學進展,2013,13(16):3164-3168.
[8]朱貴東,傅陽心.設計新一代抗體藥物偶聯物[J].藥學學報,2013,48(7):1053-1070.
[9]Poon K A,Flagella K,Beyer J,et al.Preclinical safety profile of trastuzumab emtansine(T-DM1):mechanismof action of its cytotoxic component retained with improved tolerability[J].Toxicol Appl Pharmacol,2013,9:1-16.
[10]Kümler I,Tuxen M K,Nielsen D L,et al.A systematic review of dual targeting in HER2-positive breast cancer[J].Cancer Treat Rev,2013,9:1-12.
[11]Kumar A,Agarwal S,Agarwal D,et al.Myotonic dystrophy type 1(DM1):a triplet repeat expansion disorder[J].Gene 2013,522:226-230.
[12]Nielsen D L,Kümler I,Palshof J A E,et al.Efficacy of HER2-targeted therapy in metastatic breast cancer.Monoclonal antibodies and tyrosine kinase inhibitors[J].Breast,2013,22:1-12.
[13]Gemtuzumab,Ozogamicin.Pre-authorisation Evaluation of Medicines for Human Use[Z].London:European Medicines Agency,2008-01-24.

