不同亞型多囊卵巢綜合征患者的臨床及生化特征比較
張少娣,張合龍,李萌,路錦,張翠蓮
(河南省人民醫院,鄭州 450003)
多囊卵巢綜合征(PCOS)是一種好發于育齡婦女的內分泌紊亂綜合征,是引起女性排卵異常性不育的主要原因,其發病率在育齡婦女中為5%~10%[1]。由于其病因不明,臨床表現多樣,因此圍繞PCOS診斷標準的爭論從1935年報道該病到現在一直存在。中國(2011年)的診斷標準從發布至今已經2年,本文回顧性分析了就診于本院的1,248例PCOS患者,通過分析所有PCOS患者的臨床特點,比較不同亞型PCOS的臨床生化特征,比較分析了鹿特丹診斷標準和中國診斷標準差異。
資料和方法
一、研究對象
2008年1月至2012年12月在本院生殖醫學研究所就診的PCOS患者,按照鹿特丹診斷標準[2]收集患者。診斷標準為(以下3項中的至少2項)臨床和/或生化有高雄激素表現;稀或無排卵;超聲檢查發現多囊性卵巢,除外其他甲狀腺、腎上腺等內分泌疾病[3]。
二、PCOS患者的分型(分組)
按照鹿特丹診斷標準PCOS可以分為四個亞型:Ⅰ型PCO+高雄激素臨床或生化特征+月經異常;Ⅱ型PCO+月經異常;Ⅲ型高雄激素臨床或生化特征+月經異常;Ⅳ型PCO+高雄激素臨床或生化特征。
三、方法
在生殖醫學研究所門診收集以下內容:一般情況、月經史、婚育史、家族史、多毛評分及痤瘡情況、身高、體重、腰圍、臀圍、性激素水平測定、葡萄糖耐量試驗、胰島素釋放試驗及卵泡數目、卵巢體積的測定。采用統一的調查表、體檢方法、檢驗標準、填表要求,體格檢查、體毛評分、超聲檢查分別由固定的兩個醫生進行操作。生化檢查由檢驗科專業人員專人測定。卵泡刺激素(FSH)、黃體生成素(LH)、雌二醇(E2)、睪酮(T)等性激素的測定在月經第2~4天上午8~10點空腹抽血,超聲監測無優勢卵泡及卵巢囊腫。性激素的測定批內誤差<10%,批間誤差<5%。
四、定義[4]
月經稀發:月經周期長度為35d~6個月;閉經:繼發閉經(停經時間≥6個月)和原發閉經(16歲尚無月經初潮);不規則子宮出血:月經周期或經期或經量無規律性。多囊卵巢:超聲檢查對卵巢形態的一種描述,一側或雙側卵巢內直徑2~9mm的卵泡數≥12個,或卵巢體積≥10ml。卵巢體積按0.5×長徑(cm)×橫徑(cm)×前后徑(cm)計算;高雄激素臨床表現:按國際常用的激素相關9個部位(上唇、上臂、大腿、胸部、上腹、下腹、背上部、背下部)體毛總分Ferriman-Gallway(F-G)評分,F-G評分≥6多毛標準[5]或持續痤瘡;高雄激素血癥:以睪酮(T)高于正常值上限為高睪酮血癥。
五、統計學處理
采用SPSS13.0統計軟件對數據進行分析,所有計量資料結果以均數士標準差(±s)表示,兩組間均數比較用t檢驗,等級或計數資料采用非參數檢驗,以P<0.05為差異有統計學意義。
結 果
一、PCOS的主要臨床生化特征的發病率
本研究PCOS的臨床生化特征根據發病率高低依次為PCO、月經異常、LH/FSH>1、胰島素抵抗、高雄激素臨床及生化表現、肥胖等(表1)。
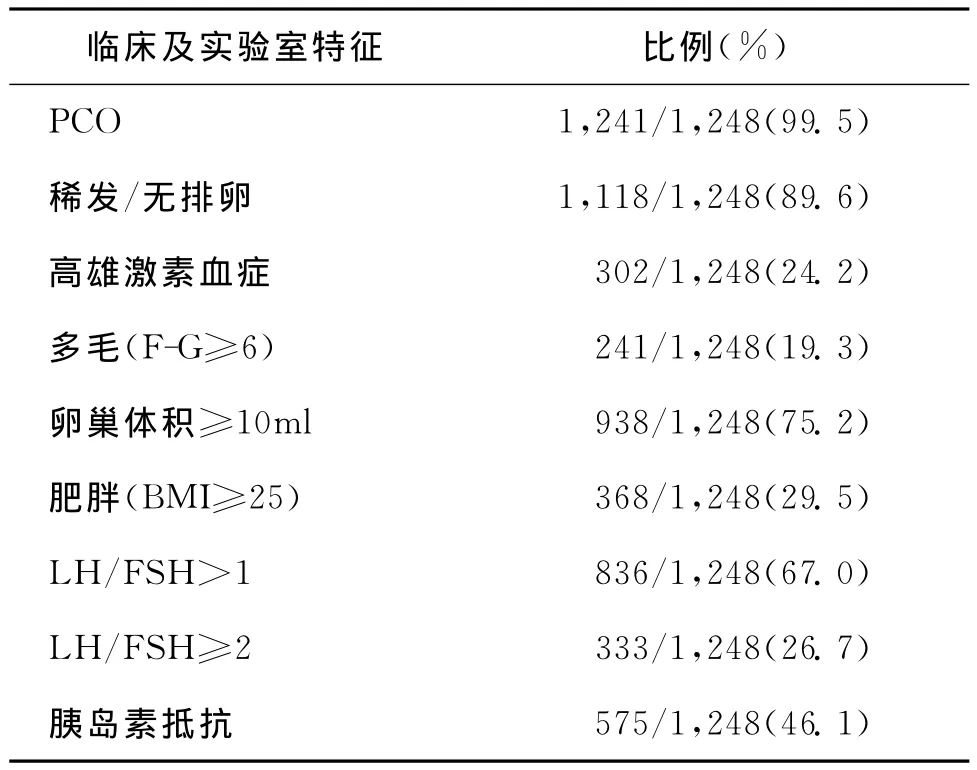
表1 PCOS的臨床生化特征發病率
二、PCOS患者的分型及構成比
Ⅰ型、Ⅱ型和Ⅲ型的患者既符合鹿特丹診斷標準,也符合2011年中國制定的診斷標準,Ⅳ型患者僅符合鹿特丹診斷標準。在本研究中Ⅰ型和Ⅱ型的發病率為89.1%,提示其在中國發病的廣泛性,尤其是Ⅱ型PCOS。本研究中各組PCOS的發病情況見表2。
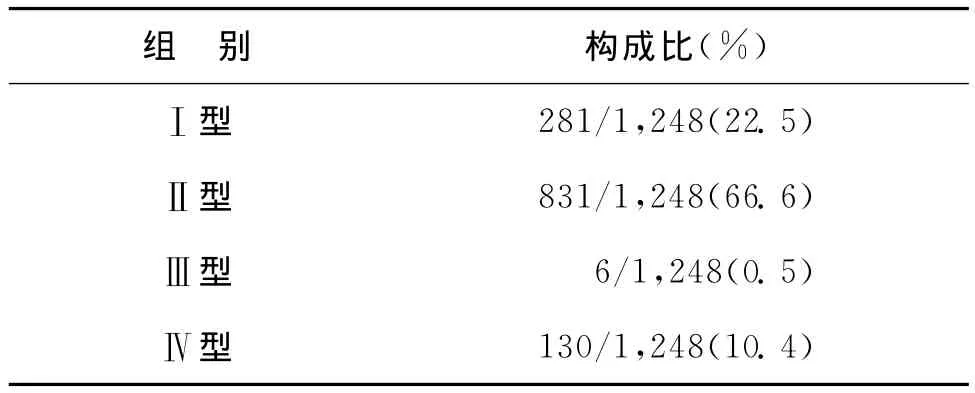
表2 PCOS患者的分型及構成比
三、PCOS不同分組間臨床生化特征比較
年齡、基礎卵泡刺激素(bFSH)、基礎雌二醇(bE2)、體重指數(BMI)、空腹血糖、空腹胰島素、胰島素曲線下面積、葡萄糖曲線下面積在四組之間差異無統計學意義(P>0.05)。Ⅰ型的bLH及LH/FSH比值最高,且與Ⅲ型、Ⅳ型的有統計學差異(P<0.05);Ⅱ型的雄激素水平(T)最低,與其他三組比較有統計學差異(P<0.05);Ⅲ型的卵巢體積最小,與其他三組比較有統計學差異(P<0.05)(表3)。
表3 PCOS不同分型間臨床生化特征比較(±s)
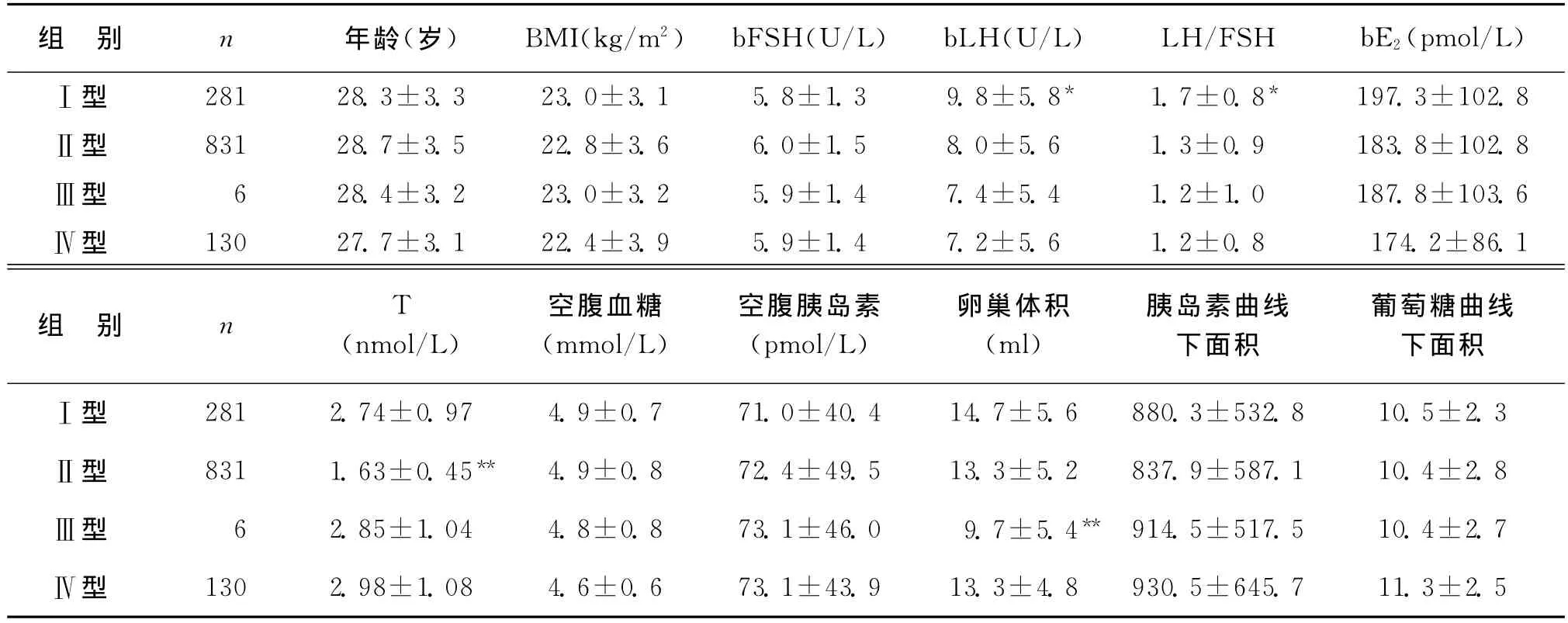
表3 PCOS不同分型間臨床生化特征比較(±s)
注:與其他三型相比,**P<0.05;與Ⅲ型、Ⅳ型相比,*P<0.05
組 別 n 年齡(歲) BMI(kg/m2) bFSH(U/L) bLH(U/L) LH/FSH bE2(pmol/L)197.3±102.8Ⅱ型 831 28.7±3.5 22.8±3.6 6.0±1.5 8.0±5.6 1.3±0.9 183.8±102.8Ⅲ型 6 28.4±3.2 23.0±3.2 5.9±1.4 7.4±5.4 1.2±1.0 187.8±103.6Ⅳ型 130 27.7±3.1 22.4±3.9 5.9±1.4 7.2±5.6 1.2±0.8 174.2±86.1組 別 n T(nmol/L)Ⅰ型 281 28.3±3.3 23.0±3.1 5.8±1.3 9.8±5.8* 1.7±0.8*葡萄糖曲線下面積Ⅰ型 281 2.74±0.97 4.9±0.7 71.0±40.4 14.7±5.6 880空腹血糖(mmol/L)空腹胰島素(pmol/L)卵巢體積(ml)胰島素曲線下面積.3±532.8 10.5±2.3Ⅱ型 831 1.63±0.45** 4.9±0.8 72.4±49.5 13.3±5.2 837.9±587.1 10.4±2.8Ⅲ型 6 2.85±1.04 4.8±0.8 73.1±46.0 9.7±5.4** 914.5±517.5 10.4±2.7Ⅳ型 130 2.98±1.08 4.6±0.6 73.1±43.9 13.3±4.8 930.5±645.7 11.3±2.5
討 論
一、PCOS鹿特丹標準與中國(2011年)診斷標準的比較
PCOS的臨床表現多樣,且存在種族和地域差異[6]。圍繞PCOS診斷標準的爭論一直沒有間斷。1935年Stein和Leventhal首次提出該綜合癥,被描述為多囊卵巢,男性毛發分布(多毛),月經不規則和不育。自此起,PCOS的診斷標準一直困擾著患者、醫生、研究者。1990年和2003年[2]美歐曾嘗試制定出國際公認的多囊卵巢綜合征的診斷標準。在這兩次會議上,關于卵巢形態在診斷標準中的重要性存在爭論。為了制定公認的診斷標準,2003年歐洲人類與胚胎學會(ESHRE)和美國生殖醫學協會(ASRM)在鹿特丹進行了第二次嘗試,這次大會認為對于PCOS并不存在一個獨立的診斷標準,因此它僅是一個排除性的診斷標準。然而鹿特丹會議的結論提升了卵巢形態的重要性。但是我們認為該診斷標準仍然不夠全面,因為它沒有考慮種族差異。亞洲人PCOS的臨床生化癥狀與歐美存在差異,上個世紀90年代日本婦產科學家注意到日本PCOS患者多毛及肥胖等臨床發生率顯著低于歐美人[7],因此鹿特丹診斷標準尚不完善,制定中國PCOS患者的診斷標準,對鹿特丹診斷標準的補充完善有重要意義。2011年中國衛生部制定了中國的PCOS診斷標準,該標準也是個排除性診斷標準(排除其他可能引起高雄激素的疾病和引起排卵異常的疾病),與鹿特丹診斷標準的區別在于強調月經異常為診斷的必要條件,因此僅有高雄激素臨床或生化表現及多囊卵巢的人群,依此標準不能診斷為PCOS。
二、中國PCOS患者的臨床生化特征及其與歐美PCOS的比較
本調查結果顯示PCOS患者多囊卵巢、月經異常、高雄激素的臨床表現或高雄激素血癥、肥胖、胰島素抵抗的發生率分別為:99.5%、89.6%、33.1%、29.5%、46.1%。與歐美報道的數據相比[8],月經異常的發生率偏高,高雄激素的臨床表現或高雄激素血癥、肥胖、胰島素抵抗的發生率偏低。
根據PCOS的診斷標準將患者分為四型,分別是Ⅰ型(PCO+高雄激素臨床或生化特征+月經異常)、Ⅱ型(PCO+月經異常)、Ⅲ型(高雄激素臨床或生化特征+月經異常)、Ⅳ型(PCO+高雄激素臨床或生化特征)。Ⅰ型、Ⅱ型和Ⅲ型PCOS既符合鹿特丹診斷標準也符合中國(2011年)診斷標準,Ⅳ型PCOS僅符合鹿特丹診斷標準。本調查中不同分型PCOS的發病率與歐美文獻報告相比也有明顯差異,在本研究中患者以Ⅰ型(22.5%)和Ⅱ型(66.6%)為主,尤其是Ⅱ型PCOS患者人群最多,Ⅳ型(10.4%)次之,Ⅲ 型 (0.5%)很少見;Zhang等[9]的流行病學調查也認為在中國Ⅱ型PCOS最常見。而歐美的報道以Ⅰ型(60.6%)PCOS患者最多,Ⅱ型 (16.3%)和 Ⅳ 型(16.5%)次之,Ⅲ型(6.7%)最少。由此可見,高雄激素癥狀的發生率在歐美遠遠高于中國,而兩者的共同點是Ⅲ型PCOS的發生率均很低。
本次研究對象均來自我院不孕癥患者,因此需進一步擴大樣本量,在人群中進行多中心聯合流行病學調查。
三、在中國人群中PCO+高雄激素臨床或生化特征(Ⅳ型)是否可以診斷為PCOS
中國(2011年)PCOS診斷標準認為月經稀發或閉經或不規則子宮出血是診斷必須條件,而鹿特丹診斷標準將稀發或無排卵做為診斷條件之一。稀發排卵或無排卵是病因,而月經異常(月經稀發或閉經或不規則子宮出血)是病因的臨床表現。有研究表明,有21%的月經正常的高雄激素患者出現無排卵[10]。月經周期27~34d但月經第22~24天孕酮水平<12.72nmol/L,提示有排卵障礙[11]。因此,我們認為相對于月經異常,排卵異常作為PCOS的一個診斷標準更客觀、更合理。而且,我們在收集過程中發現Ⅳ型PCOS中有66.9%(87/130)的患者存在排卵異常,并在門診接受了促排卵治療。我們進一步比較了四個亞型的臨床生化特征,四個亞型的年齡、bFSH、bE2、BMI、空腹血糖、空腹胰島素、胰島素曲線下面積、葡萄糖曲線下面積均無差異,Ⅱ型的雄激素水平低及Ⅲ型的卵巢體積小均是由于分型因素的不同導致的差異,因此四個亞型PCOS的臨床生化指標并無差異,Ⅳ型的臨床生化特征與其他三個亞型無明顯差異,進而我們認為PCO+高雄激素臨床或生化特征(Ⅳ型)可以診斷為中國PCOS亞型之一。
綜上所述,目前尚需對PCOS的臨床生化特征進行多中心、大樣本的流行病學調查,根據中國婦女PCOS的實際臨床表現、體征和實驗室指標及遠期并發癥,完善、修正中國PCOS診斷標準。
[1]Laven JS,Imani B,Eijkemans MJ,et al.New approaches to PCOS and other forms ofanovulation[J].Obstet Gynecol Surv,2002,57:755-767.
[2]The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group,Revised 2003consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome[J].Fertil Steril,2004,81:19-25.
[3]Carmina E.Dignosis of polycystic ovary syndrome:from NIHcriteria to ESHRE-ASRM guidelines[S].Minerva Ginecol,2004,56:1-6.
[4]中華人民共和國衛生部 .多囊卵巢綜合征行業標準[S].WS330-2011:1-5.
[5]Hatch R,Rosenfield RL,Kim MH,et al.Hirsutism:implications,etiology,and management[J].Am J Obstet Gynecol,1981,140:815-830.
[6]Williamson K,Gunn AJ,Johnson N,et a1.The impact of ethnicity on the presentation of polycystic ovarian syndrome[J].Aust N Z J Obstet Gynaecol,2001,41:202-206.
[7]Azziz R.PCOS:a diagnostic challenge[J/OL].Reprod Biomed Online,2004,8:644-648.
[8]Hassa H,Tanir HM,Yildiz Z.Comparison of clinical and laboratory characteristics of cases with polycystic ovarian syndrome based on Rotterdam’s criteria and women whose only clinical signs are oligo/anovulation or hirsutism[J].Arch Gynecol Obstet,2006,274:227-232.
[9]Zhang HY,Guo CX,Zhu FF,et a1.Clinical characteristics,metabolic features,and phenotype of Chinese women with polycystic ovary syndrome:a large-scale case-control study[J].Arch Gynecol Obstet,2013,287:525-531.
[10]Carmina E,Lobo RA.Do hyperandrogenic women with normal menses have PCOS?[J].Fertil Steril,1999,71:319-322.
[11]Wendy Y,Chang MD,Eric S,et al.Phenotypic spectrum of polycystic ovary syndrome: clinical and biochemical characterization of the threemajor clinical subgroups[J].Fertil Steril,2005,83:1717-1723.

