十全大補湯多糖成分抑瘤及免疫調節作用的初步研究*
河北大學基礎醫學院
杜春海△ 戎瑞雪 王 夢△△ 賈 薇△△△ 曹志然 (保定071000)
腫瘤是危害人類健康的惡性疾病之一,很多抗腫瘤藥物在殺滅癌細胞的同時對正常組織細胞,尤其是對骨髓和免疫細胞有一定的損害作用,從而降低肌體的抗腫瘤免疫功能,影響腫瘤的治療效果。許多研究表明,一些經典的中藥方劑在腫瘤的放療和化療方面有一定減毒增效作用。十全大補湯(SQDBT)為氣血雙補的著名方劑,前期研究中發現十全大補湯及其多糖成分在體內外均有明顯的抗腫瘤活性。[1-4]為了進一步研究十全大補湯制劑的藥效物質基礎及抗腫瘤作用的機制,本文通過荷瘤小鼠結合體外細胞培養的方法,觀察了十全大補湯多糖成分的抗腫瘤作用及作用機制。
1 材料與方法
1.1 實驗動物 6~8 周齡昆明種小鼠,雄性,40 只,體質量(20±2.0)g,由河北醫科大學實驗動物中心提供,合格證號121027。
1.2 細胞株 H 22小鼠肝癌實體瘤株:由河北醫科大學基礎醫學院免疫學系惠贈,本實驗室傳代保存。
1.3 主要藥品、儀器和試劑 十全大補湯組方中的生藥(人參、白術、茯苓、甘草、白芍、熟地黃、黃芪、當歸、川芎、肉桂)均購自保定市藥材公司,經中醫學院馮天鑄教授鑒定均為真品。新生牛血清購自杭州四季青生物工程材料有限公司,RPMI-1640 培養液購自美國Gibco 公司;IL-2、TNF-α、IFN-γ ELISA 檢測試劑盒購自深圳達科為生物技術公司,Annexin-Ⅴ-FITC/PI 雙染凋亡檢測試劑盒購自美國BD 公司,HF90 二氧化碳培養箱(上海力申科學儀器有限公司)。倒置顯微鏡(日本Olympus),ELX-800 全自動酶標儀(美國寶特有限公司),流式細胞儀(美國BD 公司)。
1.4 十全大補湯總多糖的提取 人參、白術、茯苓各16 g,甘草8 g,當歸24 g,川芎8 g,白芍16 g,熟地黃24 g,黃芪16 g,肉桂4 g,加20 倍體積水分別1、1、0.5 h 回流提取3 次,提取液合并冷卻后6 000 r/min,離心10 min;將上清液減壓回收至5 倍體積,加體積比為80%乙醇,靜置24 h,6 000 r/min 20 min;上述沉淀加5 倍體積蒸餾水溶解,加硫酸銨至沉淀完全溶解,用0.5%活性炭脫色后,抽濾后棄去沉淀;將濾液用少量80%乙醇洗滌多次去除多余硫酸銨,沉淀用少量水溶解,冷凍干燥后為總多糖成分,多糖獲得率為19.22%。
1.5 荷瘤小鼠模型的建立及分組處理 常規復蘇H22細胞,用含10%新生牛血清的培養基的RPMI-1640 培養液培養在5%CO2培養箱中,傳代后,取處于對數生長期的H22細胞1×107接種于小鼠腹腔,10 d 后無菌條件下生長良好的H22荷瘤小鼠腹水,臺盼藍染色計數細胞活力>95%,用無菌生理鹽水調整細胞濃度為5×106/mL,接種于小鼠右腋部皮下,每只注射0.2 mL (含1×105個細胞)。在接種腫瘤細胞后24 h 隨機分為5 組,每組8 只,稱重并用苦味酸標記。1 組為陰性對照組:2 組為單純順鉑(DDP)組;3 組為順鉑聯合高劑量復合多糖組;4 組為順鉑聯合中劑量復合多糖組;5 組為順鉑聯合低劑量復合多糖組。3 組~5 組分別用168.4、84.2、42.1 mg/mL 總多糖灌胃,每天每只0.5 mL,連續10 d;2 組~5 組腹腔注射順鉑,1 mg/kg,1 次/d,連續10 d;陰性對照組用等量溫開水灌胃和腹腔注射等量生理鹽水。
1.6 十全大補湯總多糖對荷瘤小鼠體質量及腫瘤生長的影響 末次給藥后24 h 將小鼠稱重,小鼠眼球放血,分離血清備用。75%乙醇浸泡消毒,解剖摘取瘤塊、用濾紙吸干后稱重,計算抑瘤率。抑瘤率=(1-用藥組平均瘤質量/模型對照組平均瘤質量)×100%
1.7 十全大補湯總多糖對腫瘤細胞和脾細胞凋亡的影響 無菌操作剝離腫瘤組織及脾臟,吸取表面的血液和組織液,稱重后立即置含有冰PBS 的培養皿中,分別制備脾細胞懸液和腫瘤細胞懸液,200 目篩網過濾后調整細胞濃度為2×106/mL,AnnexinⅤ-PI 雙染后流式細胞儀檢測腫瘤細胞和脾細胞的凋亡率。
1.8 十全大補湯總多糖對荷瘤小鼠體內TNF-α,IFN-γ 和IL-2 分泌水平的影響 采用ELISA 法,按試劑盒說明操作。
1.9 數據的統計學處理 所有數據均用SPSS16.0 軟件處理,采用單因素方差分析和t 檢驗。檢驗水準α=0.05,P<0.05 表示差異有顯著性。數據用±s 表示。
2 實驗結果
2.1 十全大補湯總多糖對荷瘤小鼠體質量及腫瘤增長的抑制作用 結果顯示:實驗前各組小鼠體質量差異無顯著,實驗結束時順鉑對照組小鼠體質量明顯低于陰性對照組,順鉑聯合高、中劑量組小鼠體質量較單純順鉑組有所增加,但仍低于陰性對照組。詳見表1。
表1 十全大補湯總多糖對荷瘤小鼠體質量及瘤質量的影響 (±s)
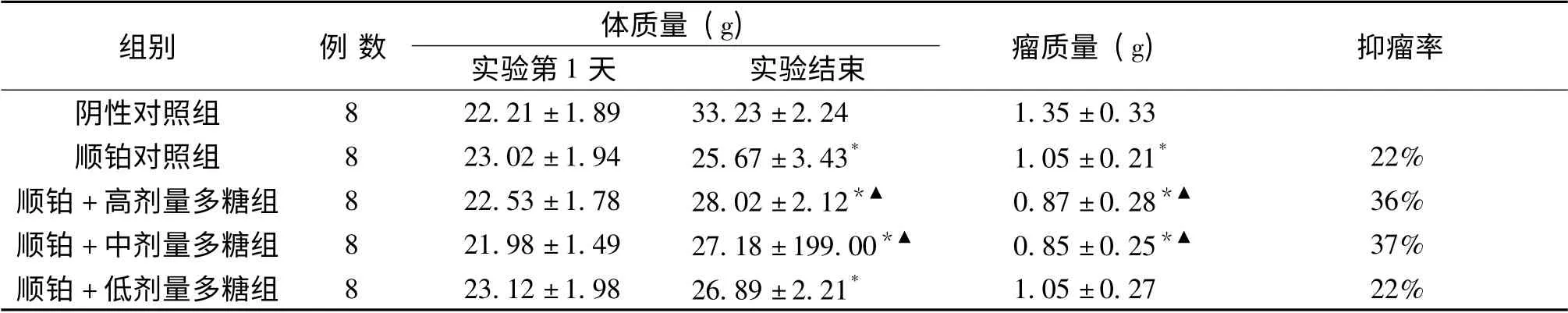
表1 十全大補湯總多糖對荷瘤小鼠體質量及瘤質量的影響 (±s)
注:與陰性對照組比較,* P<0.05;與單純順鉑組比較,▲P<0.05
組別 例數 體質量(g)實驗第1天實驗結束 瘤質量(g)抑瘤率陰性對照組8 22.21±1.89 33.23±2.24 1.35±0.33順鉑對照組 8 23.02±1.94 25.67±3.43* 1.05±0.21* 22%順鉑+高劑量多糖組 8 22.53±1.78 28.02±2.12*▲ 0.87±0.28*▲ 36%順鉑+中劑量多糖組 8 21.98±1.49 27.18±199.00*▲ 0.85±0.25*▲ 37%順鉑+低劑量多糖組 8 23.12±1.98 26.89±2.21*1.05±0.27 22%
2.2 十全大補湯總多糖對腫瘤細胞凋亡的影響結果顯示:順鉑可明顯誘導腫瘤細胞的凋亡,但主要以晚期凋亡(壞死)為主,與陰性對照組比差異有顯著性(P<0.05);而順鉑聯合各劑量多糖組腫瘤細胞的早期凋亡率和晚期凋亡率均明顯高于順鉑對照組,且主要以早期凋亡為主,其中以順鉑聯合高劑量多糖組作用最強。詳見表2、圖1。
表2 十全大補湯總多糖對腫瘤細胞凋亡的影響 (±s),%
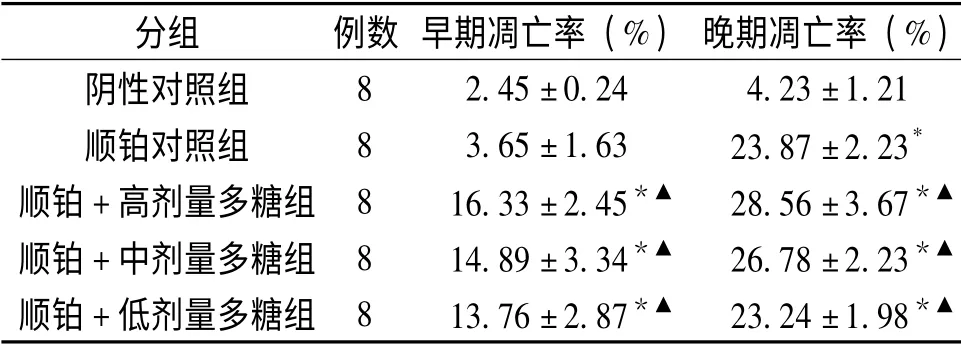
表2 十全大補湯總多糖對腫瘤細胞凋亡的影響 (±s),%
注:與陰性對照組比較,* P<0.05;與單純順鉑組比較,▲P<0.05
分組 例數 早期凋亡率(%) 晚期凋亡率(%)8 2.45±0.24 4.23±1.21順鉑對照組 8 3.65±1.63 23.87±2.23*順鉑+高劑量多糖組 8 16.33±2.45*▲ 28.56±3.67*▲順鉑+中劑量多糖組 8 14.89±3.34*▲ 26.78±2.23*▲順鉑+低劑量多糖組 8 13.76±2.87*▲ 23.24±1.98陰性對照組*▲
圖1 十全大補湯總多糖對腫瘤細胞凋亡的影響
2.3 十全大補湯總多糖對荷瘤小鼠脾細胞凋亡的影響 結果顯示順鉑可明顯誘導荷瘤小鼠脾細胞的凋亡,其早期凋亡率和晚期凋亡率均高于陰性對照組,順鉑聯合各劑量十全大補湯總多糖組脾細胞的凋亡率均明顯低于單純順鉑組(P<0.05),但仍高于單純陰性對照組(P<0.05),表明十全大補湯總多糖可拮抗順鉑誘導的脾細胞的凋亡,對脾細胞有一定保護作用。詳見表3、圖2。
表3 十全大補湯總多糖對荷瘤小鼠脾細胞凋亡的影響 (±s),%
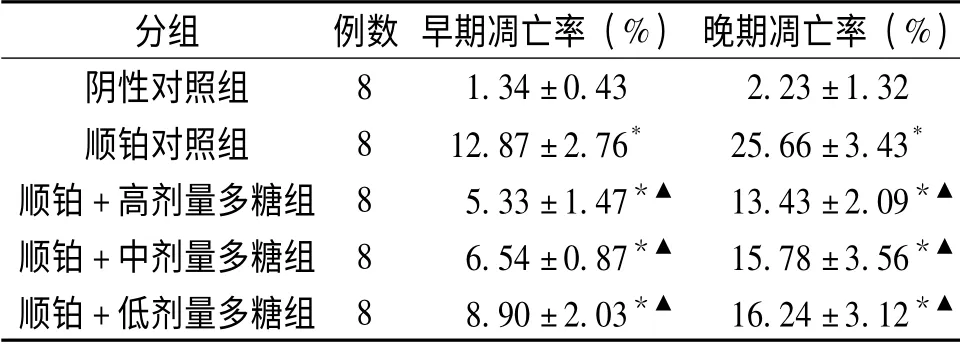
表3 十全大補湯總多糖對荷瘤小鼠脾細胞凋亡的影響 (±s),%
注:與陰性對照組比較,* P<0.05;與單純順鉑組比較,▲P<0.05
分組 例數 早期凋亡率(%) 晚期凋亡率(%)8 1.34±0.43 2.23±1.32順鉑對照組 8 12.87±2.76* 25.66±3.43*順鉑+高劑量多糖組 8 5.33±1.47*▲ 13.43±2.09*▲順鉑+中劑量多糖組 8 6.54±0.87*▲ 15.78±3.56*▲順鉑+低劑量多糖組 8 8.90±2.03*▲ 16.24±3.12陰性對照組*▲
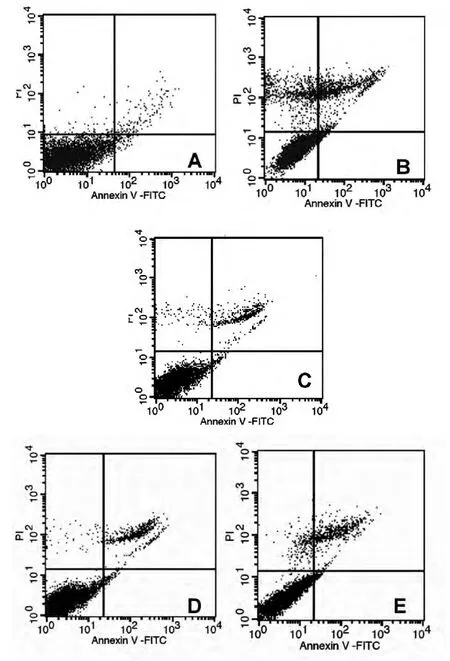
圖2 十全大補湯總多糖對荷瘤小鼠脾細胞凋亡的影響
2.4 十全大補湯總多糖對荷瘤小鼠脾臟TNF-α、IFN-γ、IL-2 的影響 結果顯示順鉑組小鼠脾細胞分泌TNF-α、IFN-γ、IL-2 的量明顯低于陰性對照組(P<0.05),順鉑聯合各劑量多糖組小鼠脾細胞TNF-α、IFN-γ、IL-2 的分泌水平明顯高于單純順鉑組(P<0.05),順鉑聯合各劑量多糖組小鼠脾細胞IL-2 的分泌水平高于陰性對照組,但順鉑聯合各劑量多糖組TNF-α 的分泌水平仍低于陰性對照組;順鉑+低劑量多糖組IFN-γ 的分泌與陰性對照組差異無顯著(P>0.05)。提示十全大補湯總多糖可刺激荷瘤小鼠的脾細胞合成和分泌TNFα、IFN-γ 和IL-2,但對各種細胞因子分泌的調節程度不同。詳見表4。
表4 十全大補湯總多糖對荷瘤小鼠脾臟TNF-α、IFN-γ、IL-2 的影響 (±s),pg/mL

表4 十全大補湯總多糖對荷瘤小鼠脾臟TNF-α、IFN-γ、IL-2 的影響 (±s),pg/mL
注:與陰性對照組比較,* P<0.05;與單純順鉑組比較,▲P<0.05
分組 例數 TNF-α IFN-γ IL-2陰性對照組569.22±4.43 74.09±2.12 80.55±5.65順鉑對照組 8 298.87±4.87* 47.32±2.30* 45.87±5.45*順鉑+高劑量多糖組 8 479.43±5.44*▲ 108.31±3.01*▲ 139.08±4.79*▲順鉑+中劑量多糖組 8 432.86±4.87*▲ 96.12±3.31*▲ 132.86±4.87*▲順鉑+低劑量多糖組 8 320.76±4.32*▲ 72.04±2.34▲ 120.76±4.32 8*▲
3 討論
惡性腫瘤作為威脅人類健康的主要殺手之一,目前常用的化療藥物在殺傷腫瘤細胞的同時對肌體的正常組織尤其是免疫系統帶來嚴重損傷,從而影響腫瘤的治療效果。尋找無毒害作用的抗癌藥物成為廣大研究人員追求的共同目標。研究發現來源于中藥的多糖不僅能對腫瘤細胞產生毒性作用,而且還能提高人體免疫力,其獨特的藥理作用已引起了國內外學者的廣泛關注。大量研究證實多糖抗腫瘤作用的機制主要體現在兩個方面:①直接作用于腫瘤細胞,可通過影響腫瘤細胞的細胞膜、干擾細胞內信號轉導、抑制細胞周期和誘導細胞凋亡等發揮抗腫瘤作用;②通過激活淋巴細胞、巨噬細胞、自然殺傷細胞等多種免疫細胞,活化補體系統,有效促進多種細胞因子的分泌和表達,增強肌體免疫功能,發揮抗腫瘤作用。[5]因此,中藥多糖作為一種免疫增強劑輔助化療、放療已成為腫瘤治療的重要組成部分。但目前對多糖的研究大多是針對單味中藥多糖,有關中藥方劑中復合多糖的抗腫瘤及免疫調節作用的研究少有報道。
中藥方劑是由不同藥物根據中藥配伍原則組成,各藥之間相輔相成,具有比單味藥更強的作用。十全大補湯是補血益氣的代表方劑,臨床主要用于貧血、產后虛弱、術后恢復等。有研究表明十全大補湯可抑制腫瘤的生長與轉移、提高荷瘤肌體的免疫功能。[6-7]我們前期研究發現十全大補湯總多糖在體內外明顯抑制腫瘤細胞的增殖,并能改善化療所致的惡液質、貧血和白細胞下降等毒副作用。[2]本文通過體內實驗結合體外細胞培養的方法進一步研究了十全大補湯總多糖在腫瘤化療中減毒增效的作用機制。結果顯示十全大補湯總多糖可明顯促進順鉑誘導腫瘤細胞凋亡,且以早期凋亡為主。化療藥物最大的毒副作用是在殺傷腫瘤細胞的同時對免疫細胞也有殺傷活性,從而降低了肌體抗腫瘤免疫力,本文結果表明十全大補湯總多糖可明顯拮抗順鉑所致的脾細胞的凋亡,對脾細胞具有保護作用。研究表明荷瘤肌體的抗腫瘤免疫以細胞免疫為主,在腫瘤細胞抗原的刺激下CD4+T 細胞活化、分化為Th1 細胞,通過分泌IL-2,IFN-γ,TNF-α 等細胞因子作用于其他免疫細胞從而發揮抗腫瘤免疫。[8-9]本研究結果顯示接種腫瘤細胞后荷瘤小鼠血清中均可監測到IL-2,IFN-γ,TNF-α 的分泌,其中以TNF-α 分泌水平最高。順鉑可降低荷瘤小鼠上述3 種細胞因子的分泌,而順鉑聯合應用十全大補湯總多糖組各種細胞因子的分泌水平均顯著高于單純順鉑化療組,尤其是IL-2 和IFN-γ 的分泌水平均高于陰性對照組,且有劑量依賴性,表明十全大補湯總多糖可拮抗順鉑導致的細胞免疫功能受損狀態,提高荷瘤小鼠的抗腫瘤細胞免疫功能。
綜上所述,十全大補湯總多糖可明顯協同順鉑導致的腫瘤細胞凋亡,其作用機制一方面可能與該復方多糖直接作用于腫瘤細胞,誘導其凋亡;其次也可能是通過激活NK 細胞,單核吞噬細胞,CTL等免疫細胞,促進其合成分泌細胞因子,從而誘導腫瘤細胞的凋亡,即十全大補湯總多糖抗腫瘤作用機制是多方位、多環節,不僅可以直接作用于腫瘤細胞,而且還從細胞水平,分子水平調節荷瘤肌體的免疫功能。今后若能借助于先進的分離和分析技術,結合臨床實踐進行更加深入的研究,進一步發揮其抗腫瘤的增效低毒的優勢。
[1]戎瑞雪,王蓓,曹志然.十全大補湯總多糖的體外抗腫瘤作用[J].山東醫藥,2011,51 (7):15-16
[2]曹志然,王潔,王蓓,等.中藥復方多糖體內外抗腫瘤活性實驗研究[J].中國中醫基礎醫學雜志,2010,16 (6):480-483
[3]韓艷梅,曹志然,王曉輝,等.十全大補湯對移植乳腺癌小鼠化療的減毒增效作用[J].軍醫進修學院學報,2007,28(5):358-359
[4]曹志然.十全大補湯對荷瘤鼠脾細胞增殖、IL-6、TNF 分泌的影響[J].上海免疫學雜志,2002,22 (6):370
[5]陳艷.中藥多糖抗腫瘤機制研究進展[J].藥學與臨床研究,2010,18 (2):123-126
[6]劉華巖,王軍.十全大補湯對小鼠骨髓源性細胞向腦內遷移的影響[J].中國醫科大學學報,2011,40 (12 ):1 075-1 078
[7]李松,吳青華,陳暢,等.多糖抗腫瘤活性的最新研究進展[J].中國生化藥物雜志,2007,28 (3):213-216
[8]Gajewski TF,Schreiber H,Fu YX.Innate and adaptive immune cells in the tumor microenvironment [J].Nat Immunol,2013,14 (10):1 014-1 022
[9]Lakshmi Narendra B,Eshvendar Reddy K,Shantikumar S,et al.Immune system:a double-edged sword in cancer [J].Inflamm Res,2013,62 (9):823-834

