藥師參與嚴重腹腔感染患者的會診與藥學監護
張晉萍,張海霞,楊 賢,吳秋惠,謝 菡
南京大學醫學院附屬鼓樓醫院藥學部,南京 210008
大腸埃希菌是院內感染最常見的致病菌[1],可引發尿路感染、血液感染、醫院獲得性肺炎及各種腹腔內感染[2]。隨著抗菌藥物的廣泛使用,其對多種抗菌藥物表現出不同程度的耐藥,已成為目前抗感染治療中面臨的難題之一[3]。
本文通過臨床藥師對1例吞入刀片后腹腔嚴重感染患者的2次會診,介紹了藥師如何參與臨床藥物治療團隊、為患者制定給藥方案并實施藥學監護的過程。
1 病例概況
患者,男性,32歲,身高174 cm,體質量55 kg,因“腹痛八天,腸破裂穿孔,術后五天”于2013-09-19入住我院普外科。患者1年前曾吞入刀片,傷及消化道,未予正規治療。09-13在我院行剖腹探查術,術后抗感染治療4天,患者于09-17自動出院。出院后發熱,又于09-19再次入住普外科。
患者無高血壓、糖尿病病史,10年前外傷后在當地醫院行脾切除手術,否認藥物、食物過敏史。
入院查體:T 36.4 ℃,P 102 次/分,R 20 次/分,BP 118/72 mmHg。神清,精神差。輔助檢查:血常規:WBC 17.0×109·L-1,N 73.5%,Hb 117 g·L-1;血生化:ALT 24.8 U·L-1,AST 20.7 U·L-1,Cr 53 μmol·L-1,CRP 152 mg·L-1;腹部 CT:腹腔膿腫可能。
入院診斷:①腸破裂穿孔術后;②升結腸造瘺術后;③腹部切口感染;④脾切除術后。
2 抗感染治療經過
2.1 第一次住院手術
09-13在我院行剖腹探查術,術中見腸壁間廣泛粘連,肝區橫結腸破裂穿孔,刀片突出腸壁外,伴大便滲出,小腸腸管嚴重充血水腫,表面有膿苔附著,去除膿苔后見腸管破裂穿孔,行“復雜粘連松解術+結腸異物取出術+部分小腸、結腸切除術+結腸造口術”。術后使用頭孢呋辛聯合奧硝唑抗感染治療4天,患者于09-17自動出院。
2.2 第二次住院手術
患者出院后自行恢復經口飲食,后出現持續性腹痛腹脹伴畏寒發熱,體溫最高38.5℃,造瘺口有排氣排便,為求進一步治療,09-19再次入院。
患者再次入院后予抗感染、抑酸、營養支持治療。抗感染治療先后使用頭孢呋辛、奧硝唑、左氧氟沙星等。09-20、09-22兩次分泌物培養均檢出肺炎克雷伯菌。09-23行“剖腹探查術+腸粘連松解術+膿腔沖洗引流+空腸造瘺術”,術中見切口下方有淡黃色糞臭液體約50 mL,腸管與腹壁以及腸管之間廣泛粘連,小腸明顯擴張積氣積液,結腸造口上方與肝臟之間可探及一大膿腔,周圍包裹,內有黃色糞臭液體約300 mL。術后診斷:①腸破裂穿孔術后;②升結腸造瘺術后;③腹腔膿腫;④腸粘連;⑤腹部切口感染;⑥脾切除術后。術后轉入ICU,予頭孢吡肟2.0 g靜滴12 h抗感染治療。
2.3 第一次會診
09-24患者從ICU轉回普外科。09-26分泌物培養示糞腸球菌、星座鏈球菌及奇異變形桿菌;腹腔膿液培養示糞腸球菌、奇異變形桿菌及大腸埃希菌。09-27因切口感染伴脂肪液化,請臨床藥師會診。藥師了解病情后,建議:①停用頭孢吡肟,改用美羅培南1.0 g靜滴q8h、聯合萬古霉素0.5 g靜滴q12h抗感染;②靜滴萬古霉素達穩態后監測血藥濃度;③繼續營養支持;④用藥后監測血常規、血生化,復查腹腔膿液及切口分泌物培養+藥敏試驗;⑤觀察腹部感染控制情況,必要時加用氟康唑預防二重感染,根據感染控制情況及時調整給藥方案。臨床采納上述建議。
2.4 第二次會診
10-07分泌物培養示大腸埃希菌,全耐藥。普外科再次請臨床藥師會診。藥師會診建議:①做好切口部位換藥工作,及時移除感染源;②繼續美羅培南聯合萬古霉素抗感染,萬古霉素調整為0.5 g靜滴q8h;③繼續營養支持,監測血常規、血生化,復行病原學檢查。患者血常規、體溫正常5天后,臨床停用美羅培南與萬古霉素,繼用氟康唑至10-12。
患者住院過程中治療用藥及病原學檢查結果詳見表1、表 2。

表1 抗感染治療方案
3 用藥分析
3.1 腹腔感染常見致病菌與藥物選擇
患者10年前行脾切除術,免疫功能受損;一年前吞下刀片,未行正規治療。本次在我院行剖腹探查術,見腹腔內腸壁間廣泛粘連,橫結腸破裂穿孔伴大便滲出,小腸腸管嚴重充血水腫,表面膿苔附著,去除膿苔后見腸管破裂穿孔,雖經抗感染治療,但療程不足, 患者術后發熱,WBC 17.0×109·L-1,CRP 152 mg·L-1,提示感染較重。此患者的腹腔感染已不具備原有腹膜炎的典型臨床特征和對治療的反應,被稱為第三型腹膜炎(tertiary peritonitis),通常表現為腹部范圍不定的蜂窩組織炎和多發膿腫[4]。
中國SMART研究提示,大腸埃希菌和肺炎克雷伯菌是腹部感染頭號細菌,其中大腸埃希菌占49.2%,肺炎克雷伯菌占66.1%[5-6]。對于下消化道穿孔或破裂,細菌污染要嚴重得多,厭氧菌(主要是脆弱類桿菌)參與的混合感染機會很大,主要表現為在感染后期引起膿腫形成,而腸球菌等革蘭陽性球菌導致的腹部感染也不能排除。因此,抗感染治療應考慮覆蓋上述可能的各病原菌。對于第三型腹膜炎來說,其細菌譜尤其復雜多變,因此常須聯合用藥。對于危及生命的重度腹腔感染,抗菌藥物初始治療必須有足夠的力度,力爭迅速扭轉局面,不可循一定之規逐步升級,以免貽誤救治時機[4]。故患者術后僅使用頭孢吡肟抗感染力度遠遠不夠[4]。
3.2 第一次會診方案制定依據
患者入院后,先后使用頭孢呋辛、奧硝唑、左氧氟沙星等抗感染,09-23再次行腹腔手術,術中發現腹腔污染、感染嚴重,術后頭孢吡肟抗感染4天,腹腔膿腫、腹部切口感染控制不佳。
09-26 血常規示:WBC 20.4×109·L-1,N 83.1%;血生化示:Cr 40 μmol·L-1,CRP 83.5 mg·L-1;腹腔膿液培養示:大腸埃希菌、奇異變形桿菌、糞腸球菌;切口分泌物培養示:大腸埃希菌、肺炎克雷伯菌、奇異變形桿菌、糞腸球菌、星座鏈球菌。其中,第三代頭孢菌素均顯示耐藥,第四代頭孢菌素顯示中介,碳氫酶烯類藥物顯示敏感,因此須警惕細菌可能同時產 AmpC、ESBLs酶。
對于產ESBLs的細菌,推薦使用的抗菌藥物包括碳青霉烯類、頭霉素類、酶抑制劑復合制劑等,也可以根據藥敏試驗和病情選擇氨基糖苷類、氟喹諾酮類與上述抗菌藥物聯合治療[7]。對于產AmpC酶的細菌,治療時應放棄使用青霉素類和頭孢菌素類,也不用添加β-內酰胺酶抑制劑的混合制劑,可用四代頭孢或碳青霉烯類[4]。目前,產AmpC、ESBLs酶菌株對亞胺培南等碳氫酶烯類藥物保持高度敏感性[8]。患者肝腎功能正常,根據其體重和血肌酐,計算其肌酐清除率為148.8 mL·min-1,所用藥物可按正常劑量。藥師會診時建議停用頭孢吡肟,改用美羅培南1.0 g靜滴q8h、聯合萬古霉素0.5 g靜滴q12h抗感染。
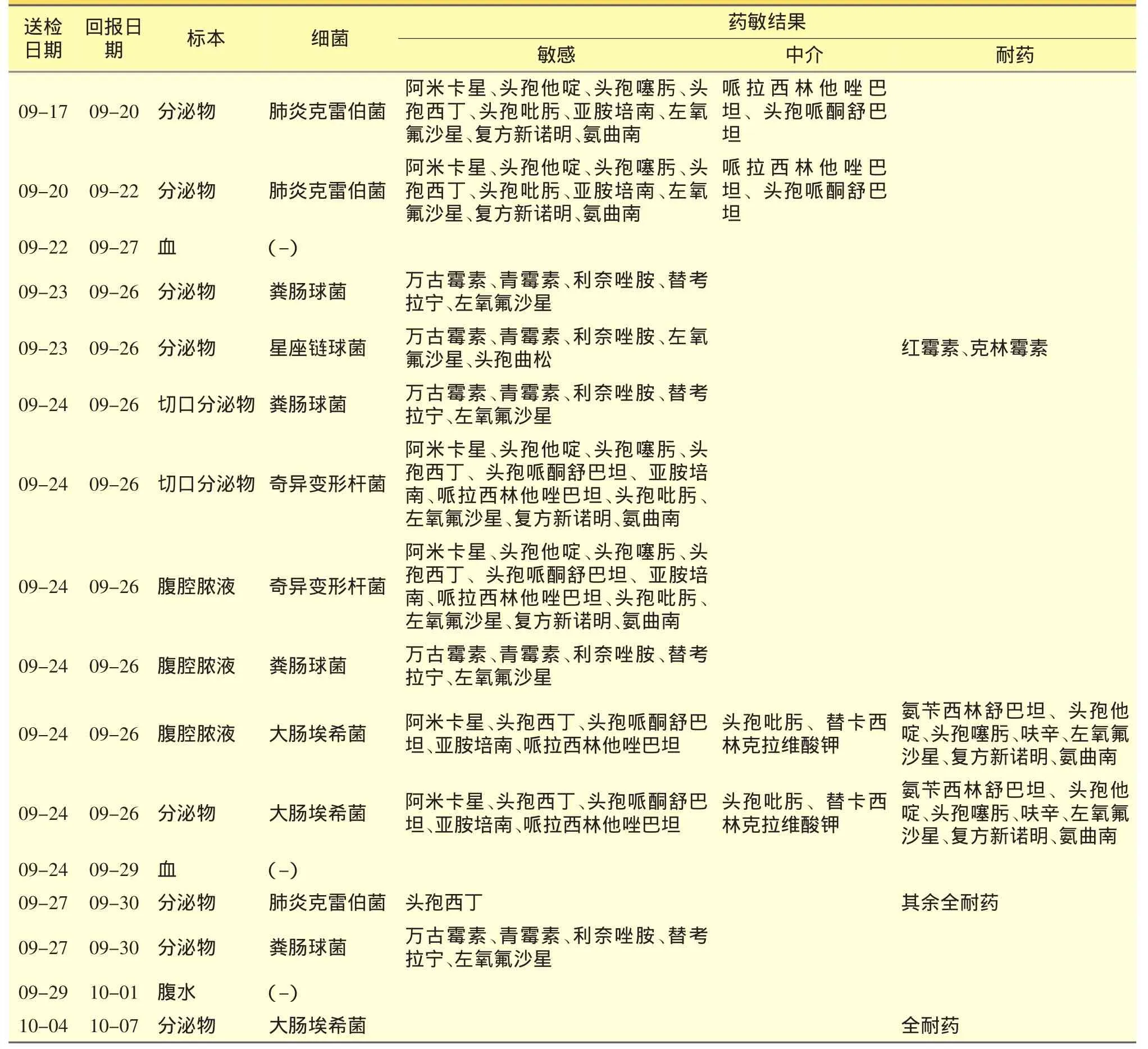
表2 病原學檢查情況
3.3 第二次會診方案制定依據
10-07切口分泌物培養示:大腸埃希菌,全部藥物耐藥。臨床藥師分析:10-03萬古霉素血藥濃度(谷)為 6.70 mg·L-1,低于目標范圍(嚴重感染 15~20 mg·L-1);10-06 WBC 8.6×109·L-1,N 62.4% ,CRP 18.5 mg·L-1;10-07 WBC 8.6 ×109·L-1,N 70.4% ,CRP 12.6 mg·L-1;09-30 分泌物培養示:肺炎克雷伯菌,對頭孢西丁、亞胺培南敏感,其余藥物耐藥;糞腸球菌,全部藥物敏感。除病原學檢查結果外,患者還表現腹腔引流管已無液體引出,切口雖有黃色稀便樣液體引出,量漸少,體溫正常已達6天,血常規、CRP等均較前有明顯好轉。
藥師會診時建議繼續使用美羅培南聯合萬古霉素抗感染,萬古霉素用法用量調整為0.5 g靜滴q8h;加強切口部位換藥,及時消除感染源;繼續營養支持,并復查血常規、血生化、病原學檢查。
4 藥學監護
4.1 抗感染治療方案與療效監護
臨床藥師會診時根據藥敏結果更改治療方案,使用美羅培南聯合萬古霉素。用藥過程中,除監測切口及引流情況、體溫、血常規、CRP等感染指標外,還需監測肝腎功能變化。
10-07 臨床藥師再次會診時,WBC、N、CRP 等感染指標逐漸回落到正常水平,體溫也恢復正常,提示治療有效。藥師建議繼續使用上述藥物,同時加強換藥。10-15患者好轉后出院。
4.2 給藥劑量
血生化監測示患者肝功能正常,血肌酐波動在47~55 μmol·L-1,計算其肌酐清除率在 132.6~155.2 mL·min-1。因此,患者所用藥物均可給予正常劑量。
4.3 血糖、血壓控制情況
患者住院期間行腸外營養支持,進行了血糖、血壓監測,兩項指標均控制在正常范圍內。
4.4 不良反應監測
患者使用抗感染藥物期間,須關注有無皮疹、頭痛、失眠、癲癇發作等癥狀;使用腸外營養期間,觀察有無腹瀉、腹痛、靜脈炎等不良反應。
5 小 結
腸桿菌科細菌通過產ESBLs、AmpC酶等對一些抗菌藥物表現為耐藥。臨床藥師參與抗菌藥物治療方案制定時,須了解患者感染的特點、嚴重程度、肝腎功能狀況,在細菌耐藥最新研究進展以及相關臨床診治指南指導下,正確解讀藥敏報告,依據PK/PD原理,為患者制定合適的藥物治療方案,并做好療效觀察、不良反應監測、藥物相互作用審核,及時調整治療方案,確保患者治療的安全、有效。
[1]Hoban DJ,Bouchillon SK,Hawser SP,et al.Trends in the frequency of multiple drug-resistant Enterobacteriaceae and their susceptibility to ertapenem,imipenem,and other antimicrobial agents:data from the Study for Monitoring AntimicrobialResistanceTrends2002 to 2007[J].Diagn Microbiol Infect Dis,2010,66(1):78-86.
[2]呂 媛,王 珊.衛生部全國細菌耐藥監測網2011年度腸桿菌科細菌耐藥監測 [J].中國臨床藥理學雜志,2012,28(12):937-40,947.
[3]Pournaras S,Protonotariou E,Voulgari E,et al.Clonal spread of KPC-2 carbapenemase-producing Klebsiella pneumoniae strains in Greece[J].J Antimicrob Chemother,2009,64(2):348-52.
[4]《應用抗菌藥物防治外科感染的指導意見》撰寫協作組.應用抗菌藥物防治外科感染的指導意見Ⅲ[J].中華外科雜志,2003,41(8):629-30.
[5]Hawser SP,Bouchillon SK,Hoban DJ,et al.In vitro susceptibilities ofaerobic and facultative anaerobic Gram-negative bacilli from patients with intraabdominal infections worldwide from 2005-2007:resrlts from the SMART study[J].Int J Antimicrob Agents,2009,34(6):585-8.
[6]Hawser SP,Bouchillon SK,Hoban DJ,et al.Emergence of high levels of extended-spectrum β-lactamase-producing Gram-negative bacilli in the asia-pacific region:data from the study for Monitoring Antimicrobial Resistance Trends (SMART)Program,2007[J].Antimicrob Agents Chemother,2009,53(8):3280-4.
[7]產超廣譜β-內酰胺酶細菌感染防治專家委員會.產超廣譜β-內酰胺酶細菌感染防治專家共識 [J].中華實驗和臨床感染病雜志(電子版),2010,4(2):207-14.
[8]黃曉群.產AmpC酶和ESBLs的大腸埃希菌藥敏分析[J].海南醫學,2009,20(10):126-7.

