凍存前后臍帶間充質干細胞生物學特性的比較
李潔,傅勇輝,吳瓊,孫萬磊,袁鏗
(1、南昌大學第二附屬醫院 江西省分子醫學重點實驗室,江西 南昌 330006;2、江西省精神病醫院,江西 南昌330029;3、江西省醫學科學研究院,江西 南昌 330006)
間充質干細胞 (mesenchymal stem cell,MSC)是近年來一種重要的種子細胞,它不僅具有支持造血、調節免疫的功能,而且在一定條件條件下能分化成為骨、軟骨、脂肪、肌肉等組織被應用于組織工程及各種疾病的治療,具有廣闊的臨床前景。身體的各種組織均具有MSC的存在,現在MSC主要來源于骨髓、臍血和臍帶。骨髓源性MSC存在高度病毒污染的可能,且隨著年齡增長其細胞數量和擴增、分化能力出現明顯下降趨勢。胎兒臍血MSC含量非常低,且其分離會損失臍血造血干細胞,影響臍血凍存。故尋找一種新的MSC來源,已成為細胞組織工程研究的熱點。我們設計本實驗利用被人們所廢棄的臍帶培養出MSC,并對培養出的MSC進行生物學特性的鑒定,同時將傳代后的細胞凍存復蘇觀察凍存復蘇對其生物學特性的影響,為臍帶MSC的保存從而被更廣泛的應用提供實驗依據。
1 材料與方法
1.1 材料 采集正常分娩胎兒臍帶組織標本。方法:UC-MSC的分離培養:臍帶以75%酒精浸泡10min后剪成5cm左右的小段,以PBS沖洗3遍后剝去血管及外膜,將去除血管及外膜的臍帶剪成長條狀并以1mg/ml膠原Ⅱ置于37℃、5%CO2、飽和濕度的培養箱中消化18~21h。取出臍帶,消化液加PBS稀釋降低黏度,2000r/min離心20min,棄上清液,PBS洗滌3次。所得細胞均用臺盼藍染色,細胞計數,調整細胞濃度為1×106/ml,用含體積分數為10%FBS的DMEM-LG培養基接種于一次性T75培養瓶中,置飽和濕度、5%CO2、37℃培養箱中進行培養。7d后半量換液,去除懸浮細胞,以后3~4d換液1次。待細胞80%融合后以吸管吹打貼壁胞,以1∶3傳代培養,取P3代細胞用于實驗,并將部分P3代的細胞凍存用于后續的實驗。
1.2 UC-MSC表面CD分子的鑒定 將傳至P3代的UC-MSC以及凍存復蘇后的細胞以1:1的0.25%和0.04%EDTA消化后,PBS洗滌3次,分成每EP(1.5ml)管1×105細胞,分別加入小鼠抗人直標PE或 FITC單抗CD13、CD29、CD31、CD34、CD44、CD45、CD166、HLA-DR、HLA-Ⅰ等 10μl,室溫避光反應30min,設立陰性同型對照。PBS洗滌3次后,進行流式細胞儀分析。
1.3 體外MSC定向誘導分化 實驗分組:A.陰性對照組:正常MSC的培養液;B.實驗組:加入下列不同的誘導液。
1.3.1 體外MSC向脂肪誘導分化 取P3代的UCMSC液100μl(1×106/ml)接種于事先放置有經多聚賴氨酸處理的消毒蓋玻片的24孔板內制備細胞爬片,每組3孔。誘導分化體系為10%FBS、1mmol/L地塞米松、0.5mmol/L 3-異丁基-1-甲基黃嘌啉、10ug/ml胰島素、100μmol/L消炎痛,3~4d換液 1次,3周后以0.5%油紅O染色,蘇木素復染后顯微鏡下觀察。
1.3.2 體外MSC向軟骨誘導分化 取P3代的UCMSC液100μl(1×106/ml)接種于事先放置有經多聚賴氨酸處理的消毒蓋玻片的24孔板內制備細胞爬片,每組3孔。誘導分化體系為含10%FBS、0.1μmol/L地塞米松、50μmol/L維生素 C、10ng/mlTGF-β1誘導培養液1ml進行誘導培養,3~4d換液1次,3周后以阿新蘭染色鑒定。
2 結果
2.1 臍帶間充質干細胞培養及鑒定 臍帶源性MSC原代21~28d融合80%,P3代5~7d細胞80%融合以成纖維樣細胞為主,呈漩渦狀排列生長,傳至P3代細胞多呈長梭形,排列有明顯方向性,細胞排列成網狀、輻射狀,復蘇后形態也無改變(圖1)。
2.2 UC-MSC表面CD分子的鑒定 復蘇前后MSC均表達黏附分子和基質細胞標記CD29、CD105、CD166、CD90 ,不表達造血細胞標記 CD13、CD34、CD45,差異無統計學意義(P>0.05)(圖2、圖3)。
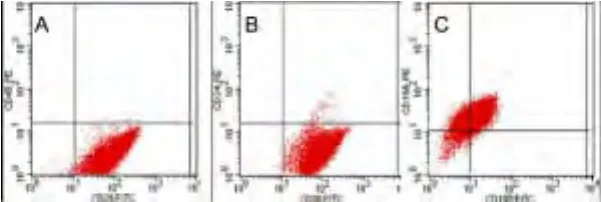
圖2 間充質干細胞細胞表面分子表達流式圖
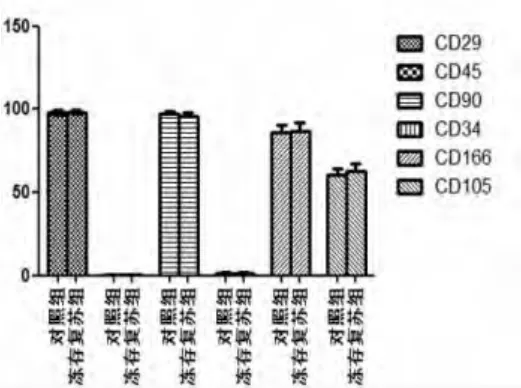
圖3 正常組與凍存復蘇組細胞表面標志比較圖
2.3 體外MSC定向誘導分化
2.3.1 體外MSC向脂肪誘導分化 MSC誘導組可見油紅O染色后為紅色陽性的脂肪細胞(圖4)。
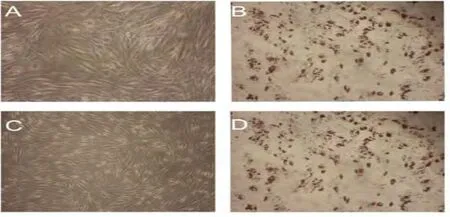
圖4 體外MSC向脂肪定向誘導分化
2.3.2體外MSC向軟骨誘導分化 MSC誘導組可見阿新蘭染色后為藍色色陽性的脂肪細胞(圖5)。
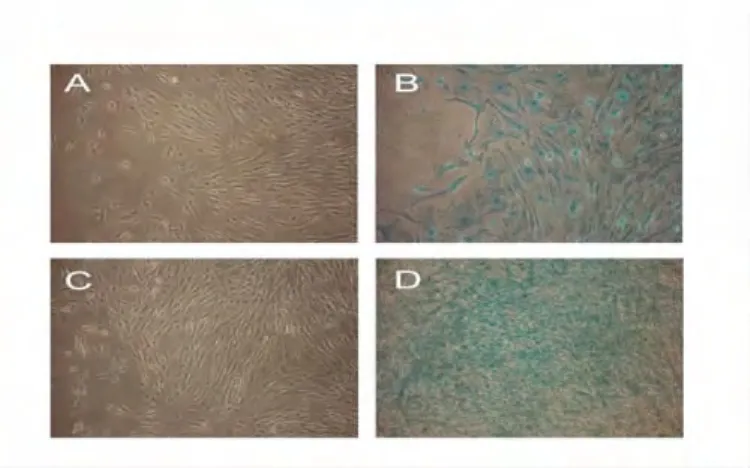
圖5 體外MSC向軟骨定向誘導分化
3 討論
近來國內外已有許多研究證實從臍帶的不同部位(臍帶靜脈內皮,內皮下層,Wharton's jelly,血管及其周圍組織)均可分離得到MSC[1]。本研究采用膠原酶消化法從臍帶中分離培養的細胞,形態上呈長梭形,排列有明顯方向性具有典型的MSC形態特征,流式檢測結果更表明其細胞表面抗原標志與以往報道的骨髓、臍血MSC相同,并且在體外證實其具有多向分化的功能,經過誘導能夠分化成為脂肪、成骨及軟骨等多種組織[2-6]。因此,臍帶分離到的貼壁細胞也屬于MSC,并證實臍帶MSC具有與骨髓、臍血MSC相同的生物學特征。另外,本研究不同于以往的胰酶消化收集細胞的方式,采用膠原酶消化臍帶,主要作用于細胞間的膠原組織,不容易損傷細胞膜,更有利于細胞的體外培養。同時,我們對凍存前后的臍帶間充質干細胞的形態、表型及多向分化能力進行了比較,證實凍存復蘇后的細胞與未凍存的細胞具有相同的生物學特征。臍帶作為分娩的廢棄物,具有來源廣泛,采集相對簡單,對供者無任何損傷,且MSC含量豐富,免疫原性低,不表達HLA-DR等優點。因此,臍帶作為一種新的MSC來源,可以避免獲得骨髓源性MSC來源受限、易污染、采集給患者帶來痛苦的缺點,又可避免胎兒臍血MSC含量非常低,培養成功率低的缺點,可成為臍血和骨髓MSC的替代來源,廣泛地用于科研和臨床前試驗具有廣闊的應用前景。同時,我們的實驗證實臍帶MSC凍存后能仍保持其完整的生物學特征使其的應用更方便有利。
[1]Margossian T,Reppel L,Makdissy N,et al.Mesenchymal stem cells derived from Wharton's jelly:Comparative phenotype analysis between tissue and in vitro expansion[J].Biomed Mater Eng,2012,22(4):243-254.
[2]Zhang H,Zhang B,Tao Y,et al.Isolation and characterization of mesenchymal stem cells from whole human umbilical cord applying a single enzyme approach[J].Cell Biochem Funct,2012,30(8):643-649.
[3]Zhang L,Ye JS,Decot V,et al.Research on stem cells as candidates to be differentiated into hepatocytes[J].Biomed Mater Eng,2012,22(1):105-111.
[4]Fan CG,Zhang QJ,Zhou JR.Therapeutic potentials of mesenchymal stem cells derived from human umbilical cord[J].Stem Cell Rev,2011,7(1):195-207.
[5]Berg L,Koch T,Heerkens T,et al.Chondrogenic potential of mesenchymal stromal cells derived from equine bone marrow and umbilical cord blood[J].Vet Comp Orthop Traumatol,2009,22(5):363-370.
[6]Cheng H,Qiu L,Ma J,et al.Replicative senescence of human bone marrow and umbilical cord derived mesenchymal stem cells and their differentiation to adipocytes and osteoblasts[J].Mol Biol Rep,2011,38(8):5161-5168.

