飲食鉀緩解鹽誘導的冠狀動脈損傷*
張玉婕, 閆承慧, 朱 男, 張效林, 趙 昕, 韓雅玲
高血壓是由多個環境因素和遺傳因素相互作用的結果[1-2],在環境因素和遺傳基因共同影響下,已經成為影響全球三分之一成人的嚴重公共衛生問題和沉重負擔。鹽作為高血壓發病的主要環境因素之一,始終備受人們關注。
大量的證據顯示高血壓與氧化應激相關[3-5],氧化應激產物促使內皮功能紊亂[6-7]和血管損傷[8]。在血管中的活性氧誘導內皮功能紊亂、血管平滑肌增殖、收縮性增加、脂質氧化、單核細胞浸潤、炎癥和基質蛋白聚集,導致血管改變,最終形成高血壓血管病[9-10]。
在基礎[11]和臨床[12]研究中顯示高鹽飲食能夠增加氧化應激,在鹽敏感高血壓個體中尤為明顯。即使在鹽負荷后血壓沒有顯著提高,鹽敏感性依然可以引起靶器官(例如心臟和腎臟)結構和功能的損害[13]。除了對心臟和腎臟的影響,高鹽也能夠誘導非血壓依賴的動脈血管結構和功能的改變[14],例如胸主動脈、頸動脈、股動脈和腸系膜上動脈等血管改變,但目前尚無高鹽對冠狀動脈影響的相關研究。
既往研究證實高鹽攝入能夠導致心血管損害,補鉀能夠抑制這種損害[15]。例如,高鹽攝入能夠降低Dahl鹽敏感高血壓大鼠的生存率,而補鉀能夠緩解鹽誘導的生存率降低,這很可能與補鉀對心血管的保護作用相關[16-17]。Ma等[18-19]指出髙鉀攝入能夠抑制多種血管損傷模型中新生內膜的形成,例如球囊損傷后的大鼠頸動脈及豬冠狀動脈。此外,飲食鉀不僅能夠降低血壓,還能夠抑制血管平滑肌細胞的增殖[20]和遷移[21],但飲食鉀對血管保護的調節因素還沒有被闡明。本研究探討高鹽攝入能否引起冠狀動脈結構和功能的改變,以及補鉀后能否緩解高鹽引起的冠狀動脈結構和功能的改變。
材料和方法
1 材料
抗內皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和gp91多克隆抗體均購自Sigma;一氧化氮測試盒及丙二醛(malondialdehyde,MDA)測試盒購自南京建成生物工程有限公司;二氫乙啶(dihydroethidium,DHE)熒光探針及辣根過氧化物酶標記的Ⅱ抗購自中杉金橋生物公司;蛋白印跡發光試劑購自Amersham。
2 方法
2.1 動物分組 取4周齡SD大鼠30只,隨機分為正常對照組(NS)、高鹽組(HS)和高鹽補鉀組(HS+HP),每組各10只。正常對照組給予蒸餾水,高鹽組給予含1.5%NaCl的蒸餾水,高鹽補鉀組給予含1.5%NaCl和0.5%KCl的蒸餾水,各組均干預16周。實驗終止前1 d,將SD大鼠置于新陳代謝籠中,搜集24 h尿液用于分析尿鈉。實驗終止時,10% 水
合氯醛經腹腔注射麻醉動物。分離左側頸動脈周圍組織,剪斷左側頸總動脈并采血。開胸后分離心臟用于形態學和免疫熒光染色分析。
2.2 各組SD大鼠血壓的測定 將大鼠放入固定器內,全身加熱。加熱溫度設置在37℃。將加壓尾套套在鼠尾合適的位置。大鼠適應環境約10 min后,測量收縮壓,連測3次,取其平均值作為一個測量值。所有測量均是在下午進行,以減少因生理節律造成的波動。
2.3 HE染色觀察各組大鼠冠狀動脈的改變 將標本在3% 多聚甲醛中固定4 h,PBS清洗,然后置于7.5% 蔗糖PBS溶液4℃過夜;將心臟切為每段1 cm,固定于OTC中;置于冰凍切片機中,切片厚度為5 μm;進行HE染色。血管圖像分析:在光鏡下觀察冠狀動脈的形態。在20倍和63倍物鏡下將完整的血管橫切面HE染色圖像攝入計算機圖像分析系統中。用Image-Pro Plus 6.0分析冠脈動脈管壁厚度、管壁面積/管腔面積的比。
2.4 免疫熒光染色觀察各組大鼠冠狀動脈的eNOS表達 取不同組中SD大鼠的心臟,行冰凍切片,進行eNOS免疫熒光染色。PBS溶液沖洗3次,每次5 min;山羊血清封閉1 h,阻斷非特異性著色;每張切片滴Ⅰ抗(稀釋倍數 1∶100)30 μL,4 ℃過夜;PBS 溶液沖洗3次,每次5 min;室溫下熒光標記Ⅱ抗孵育2 h;PBS溶液沖洗3次,每次5 min;DAPI染核5~8 s;PBS溶液沖洗3次,每次5 min;用封片液進行封片;熒光顯微鏡下觀察,拍照。
2.5 DHE熒光探針染色 染液稀釋后濃度為10 μmol/L,滴定到冰凍切片上30 μL,37℃避光孵育10 min;孵育結束后,用新鮮溶液清洗冰凍切片;顯微鏡下觀察,拍照。
2.6 Western blotting檢測gp91在大鼠冠狀動脈的表達 采用BCA比色法測量大鼠冠狀動脈提取物中蛋白的濃度,使各組中蛋白濃度相一致,用Eppendorf管分裝,每管40 μL在-80℃冰箱中凍存;樣品在8%或10%分離膠中行SDS-PAGE電泳,每條泳道上樣25 μL;轉膜;5%脫脂奶粉室溫封閉1 h;TBS-T洗膜5次,每次10 min;加入Ⅰ抗(1∶1 000稀釋),4℃孵育過夜;TBS-T洗膜5次,每次10 min;加入Ⅱ抗(1∶2 000稀釋)室溫孵育2 h;TBS-T洗膜5次,每次10 min;進行顯色,膠片曝光成像。
2.7 硝酸還原酶法測定大鼠血清中NO水平 收集各組大鼠血清,采用硝酸還原酶法,按試劑盒說明書操作,測定標準品和樣品的540 nm波長的吸光度值,按公式[NO含量(μmol/L)=(測定管吸光度-空白管吸光度)/(標準管吸光度-空白管吸光度)×標準品濃度×樣本測試前稀釋倍數]計算血清中NO的代謝產物NOx-(包括 NO3-和NO2-)含量,以此代表NO的產量,其中樣品具有復孔,添加2次,取均值。
2.8 硫代巴比妥酸(thiobarbituric acid,TBA)法測定大鼠血清中MDA的水平 收集各組大鼠血清,采用TBA法,按試劑盒說明書操作,測定標準品和樣品的540 nm波長的吸光度值,按公式[血清中MDA含量(μmol/L)=(測定管吸光度-空白管吸光度)/(標準管吸光度-空白管吸光度)×標準品濃度×樣本測試前稀釋倍數]計算血清中MDA含量,其中樣品具有復孔,添加2次,取均值。
3 統計學處理
計量資料用均數±標準誤(mean±SEM)表示,用SPSS 17.0統計軟件對各組數據進行正態性及方差齊性檢驗,然后用單因素方差分析,以P<0.05為差異有統計學意義。
結 果
1 高鹽攝入誘導SD大鼠血壓升高及冠狀動脈重塑
在HS組中,大鼠血鈉和尿鈉較NS組大鼠顯著升高(P<0.05),見表1。提示鹽負荷成功。鹽負荷16周HS組中約70%的大鼠血壓顯著升高,根據HS組SD大鼠血壓分布情況將其分為鹽敏感大鼠和鹽抵抗大鼠,其中鹽敏感大鼠為后續實驗中的HS組大鼠;鹽抵抗大鼠因實驗過程中血壓無明顯升高,在本實驗中被剔除,用于其它研究。
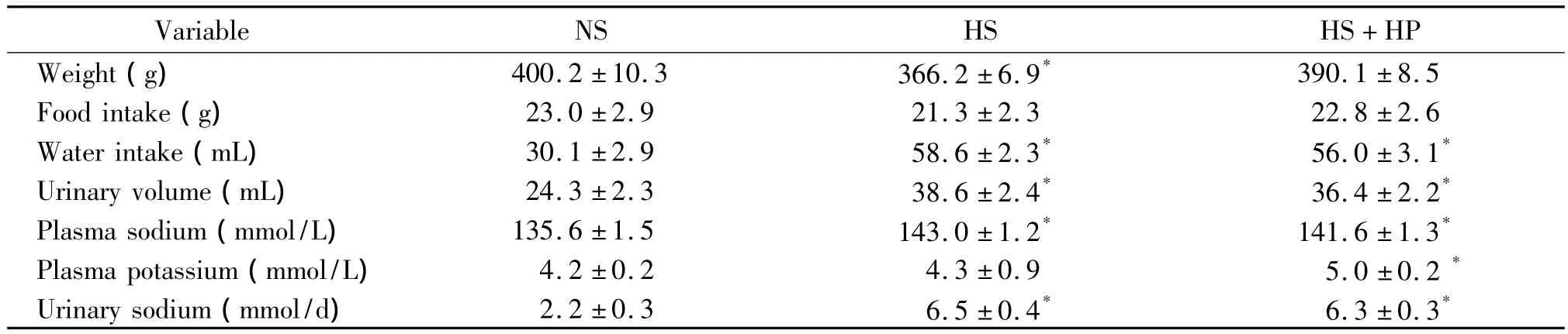
表1 各組大鼠的數據比較Table 1.Compiled data of the animals with different treatments(Mean±SEM.n=5)
如圖1A所示,隨著鹽負荷時間的延長,HS組大鼠的血壓逐漸升高,鹽負荷5周前血壓較正常組無明顯差異,鹽負荷6周后血壓較正常組顯著增加。4周血壓增加至(120.1±3.3)mmHg,處于高血壓前期I級;10周以后血壓顯著增加至(131.2±3.8)mmHg,為高血壓前期II級。鹽負荷16周時,HS組SD大鼠收縮壓為(135.7±2.9)mmHg,較正常組SD大鼠收縮壓顯著增加29 mmHg(P<0.05),見圖1B。
如圖1C所示,鹽負荷16周時,HS組較NS組SD大鼠的冠狀動脈管壁厚度及管壁面積與管腔面積比顯著增加(P<0.05),可見高鹽攝入能夠誘導SD大鼠血壓升高及冠狀動脈重塑。
2 高鹽誘導SD大鼠冠狀動脈氧化應激增加及內皮細胞損傷
鹽負荷16周時大鼠冠狀動脈內超氧陰離子較對照組明顯增多,MDA含量顯著增加,且冠狀動脈內gp91的表達顯著增加,見圖2。這提示高鹽誘導SD大鼠冠狀動脈氧化應激增加。
圖3顯示鹽負荷后大鼠冠狀動脈內皮eNOS表達較對照組顯著降低,且血清中NO含量顯著降低,提示高鹽能夠誘導SD大鼠冠狀動脈內皮細胞損傷。
3 補鉀緩解高鹽誘導的SD大鼠血壓增加和冠狀動脈重塑
鹽負荷的同時給予補鉀治療,HS+HP組與HS組比大鼠的血鈉沒有顯著差異,但HS+HP組與HS組比大鼠的血鉀顯著增高(P<0.05),提示補鉀成功。補鉀后可以顯著降低高鹽攝入誘導的SD大鼠血壓的升高[(114.6 ±4.2)mmHg vs(135.7 ±2.9)mmHg,P <0.05],見圖1A、B。補鉀除了可以顯著降低血壓外,還可以緩解高鹽誘導SD大鼠冠狀動脈重塑[管壁厚度:(21.2 ±1.8)μm vs(30.9 ±2.5)μm,P <0.05;管壁面積/管腔面積比:0.195 ±0.008 vs 0.271 ±0.017,P <0.01],見圖 1C。與此同時,補鉀可以緩解高鹽誘導SD大鼠血清中NO含量的降低和MDA水平的增加,見圖2、3。DHE熒光探針染色結果顯示,HS組與其它組比,冠狀動脈中超氧陰離子顯著增加,HS+HP組可以緩解由鹽負荷引起的超氧陰離子增加,見圖2。

Figure 1.Long-term high salt loading results of the hypertension and the coronary remodeling in salt-loaded rats.A:systolic blood pressure(SBP)monitoring every 2 weeks;B:SBP in the 3 groups after 16-week salt loading;C:HE staining of the coronary artery sections and quantitative analysis of the media thickness and the ratio of coronary artery wall to lumen.Scale bars:50 μm.Mean ± SEM.n=5.*P <0.05 vs NS.圖1 鹽負荷后大鼠血壓升高及冠狀動脈重塑
討 論
本研究證實高鹽攝入不僅能引起血壓升高,還能引起冠狀動脈結構和功能的改變,誘導氧化應激增多及內皮細胞損傷,補鉀后通過降低氧化應激來緩解高鹽引起的有害效應。
既往的研究報道表明,短期高鹽飲食并不引起SD大鼠血壓的變化[21-22],然而長期高鹽飲食可以誘導SD大鼠血壓升高[23-25]。在本實驗中,我們發現長期高鹽攝入可以誘導大部分SD大鼠(70%)血壓升高。高鹽干預1~5周時,高鹽組大鼠與正常組大鼠血壓無明顯差異,與既往研究相一致,短期高鹽攝入并不影響SD大鼠血壓的改變。高鹽干預第6周時,大鼠血壓開始升高,并隨著高鹽干預時間的延長,血壓進一步升高。補鉀后可以緩解由高鹽攝入引起的大鼠血壓的升高。

Figure 2.Oxidative stress detected in coronary arteries of salt-loaded rats.A:DHE staining for superoxide anion production in coronary arteries at 16 weeks;B:gp91 expression detected by Western blotting;C:serum MDA content detected by thiobarbituric acid method.Scale bars:50 μm.Mean ± SEM.n=5.*P <0.05 vs NS.圖2 鹽負荷后大鼠冠狀動脈氧化應激增加
已有人群研究證實,長期高鹽飲食可以引起炎癥、氧化應激、血管內皮功能障礙、腎損傷、腎臟細胞因子基因表達的改變等,進而引起高血壓[26]。長期高鹽飲食不但可以引起血壓的升高,也可以誘導血管結構發生改變[27]。短期高鹽飲食時,并不引起血管結構的改變,但長期高鹽飲食時,會發生血管結構的改變,如頸動脈、腸系膜上動脈等,然而,目前尚不清楚是否長期高鹽攝入可以引起SD大鼠冠狀動脈結構和功能的改變。本研究證實,長期高鹽攝入可以引起冠狀動脈重塑,管壁厚度和管壁面積/管腔面積比顯著增加。補鉀后可以緩解由高鹽誘導SD大鼠冠狀動脈重塑。氧化應激在高血壓的發生、發展中發揮著重要作用。高血壓動物模型可見血管出現氧化應激,降低血管氧化應激或減少活性氧的產生,可以降低血壓[28]。臨床研究表明,高血壓與血管氧化應激密切相關,給予抗高血壓藥物可以降低氧化應激的產生。氧化應激主要通過損傷內皮細胞,降低NO釋放量,從而減少其血管舒張的作用[29]。在本研究中,長期高鹽飲食誘導SD大鼠血鈉增加,內皮損傷(血清中NO含量降低,冠狀動脈eNOS表達下降),產生氧化應激(血清中MDA含量顯著增加,DHE熒光探針染色發現高鹽組大鼠冠狀動脈內超氧陰離子增加,Western blotting發現高鹽組大鼠冠脈內gp91表達增加)。綜上所述,長期高鹽飲食,通過激活氧化應激,損傷內皮細胞,減少NO釋放量,引起高血壓。
既往的研究表明,補鉀飲食(含2.1%KCl鼠糧)飼養大鼠,其24 h尿鉀含量較正常對照組顯著增加,提示補鉀成功。標準鼠糧含1.1%KCl,根據大鼠每日飲食量及飲水量估算補鉀飲水干預需含0.5%KCl的蒸餾水飼養大鼠,故本研究采用含0.5%KCl的蒸餾水干預大鼠[30]。NADPH氧化酶是血管內生成活性氧簇(reactive oxygen species,ROS)的主要酶體,在外來信號刺激下激活或失活,從而迅速升高或降低細胞內的ROS水平。gp91是NADPH氧化酶的活性亞單位,在電子轉移和活性氧族生成中發揮著重要作用。在本研究中,發現補鉀后能夠降低高鹽干預后大鼠冠狀動脈內gp91的表達,從而降低NADPH氧化酶的活性來減少氧化應激的生成,進而改善高鹽引起的內皮損傷(大鼠血清中NO水平和冠狀動脈內eNOS表達恢復正常水平),起到保護冠狀動脈的作用。
本研究提示,建議人們改善生活方式,限制鹽飲食并多吃富含鉀的蔬菜水果,有助于血壓的降低和血管結構及功能的保護,減少心血管疾病的發生率及其危害。
(致謝:真誠感謝沈陽軍區總醫院指導老師在查閱文獻、實驗設計及論文寫作方面提供的幫助。)
Figure 3.Endothelium damage detected in coronary arteries of salt-loaded rats.A:immunofluorescence staining for eNOS expression in coronary arteries;B:serum NO level detected by nitrate reductase method.Scale bars:50 μm.Mean ± SEM.n=5.*P <0.05 vs NS.圖3 鹽負荷誘導大鼠冠狀動脈內皮細胞損傷
[1] 郭 軍,蔡 軍,李自成.原發性高血壓患者ABCG4基因啟動子的甲基化差異分析[J].中國病理生理雜志,2011,27(11):2067-2071.
[2] 華 琦,任海榮.正確認識高鹽和高血壓[J].首都醫科大學學報,2011,32(5):617-626.
[3] 吳秀香,張 妍,孫柳青,等.葡萄籽原花青素對腎血管性高血壓大鼠血管重塑的影響[J].中國病理生理雜志,2012,28(6):1023-1027.
[4] Redón J,Oliva MR,Tormos C,et al.Antioxidant activities and oxidative stress by products in human hypertension[J].Hypertension,2003,41(5):1096-1101.
[5] Paravicini TM,Touyz RM.Redox signaling in hypertension[J].Cardiovasc Res,2006,71(2):247-258.
[6] McIntyre M,Bohr DF,Dominiczak AF.Endothelial function in hypertension:the role of superoxide anion[J].Hypertension,1999,34(4):539-545.
[7] Taddei S,Virdis A,Ghiadoni L,et al.Endothelial dysfunction in hypertension[J].J Nephrol,2000,13(3):205-210.
[8] Touyz RM.Reactive oxygen species,vascular oxidative stress,and redox signaling in hypertension:what is the clinical significance?[J].Hypertension,2004,44(3):248-252.
[9] Taniyama Y,Griendling KK.Reactive oxygen species in the vasculature:molecular and cellular mechanisms[J].Hypertension,2003,42(6):1075-1081.
[10]Touyz RM,Tabet F,Schiffrin EL.Redox-dependent signalling by angiotensin II and vascular remodelling in hypertension[J].Clin Exp Pharmacol Physiol,2003,30(11):860-866.
[11] Bayorh MA,Ganafa AA,Socci RR,et al.The role of oxidative stress in salt-induced hypertension[J].Am J Hypertens,2004,17(1):31-36.
[12] Laffer CL,Bolterman RJ,Romero JC,et al.Effect of salt on isoprostanes in salt-sensitive essential hypertension[J].Hypertension,2006,47(3):434-440.
[13] Frohlich ED,Varagic J.Sodium directly impairs target organ function in hypertension[J].Curr Opin Cardiol,2005,20(5):424-429.
[14] Safar ME,Thuilliez C,Richard V,et al.Pressure-independent contribution of sodium to large artery structure and function in hypertension[J].Cardiovasc Res,2000,46(2):269-296.
[15]Kido M,Ando K,Onozato ML,et al.Protective effect of dietary potassium against vascular injury in salt-sensitive hypertension[J].Hypertension,2008,51(2):225-231.
[16] Tobian L,Lange J,Ulm K,et al.Potassium reduces cerebral hemorrhage and death rate in hypertensive rats,even when blood pressure is not lowered[J].Hypertension,1985,7(3):I110-I114.
[17] Zhou MS,Kosaka H,Yoneyama H.Potassium augments vascular relaxation mediated by nitric oxide in the carotid arteries of hypertensive Dahl rats[J].Am J Hypertens,2000,13(6):666-672.
[18] Ma G,Srivastava NT,Anderson PG,et al.Elevated potassium intake inhibits neointimal proliferation in the swine coronary artery[J].Am J Hypertens,2001,14(9):879-886.
[19] Ma G,Young DB,Clower BR,et al.High potassium intake inhibits neointima formation in the rat carotide artery balloon injury model[J].Am J Hypertens,2000,13(9):1014-1020.
[20] Ma G,Mason DP,Young DB.Inhibition of vascular smooth muscle cell migration by elevation of extracellular potassium concentration[J].Hypertension,2000,35(4):948-951.
[21] Ma G,Mamaril JLC,Young DB.Increased potassium concentration inhibits stimulation of vascular smooth muscle proliferation by PDGF-BB and bFGF[J].Am J Hypertens,2000,13(10):1055-1060.
[22] Miyajima E,Bunag RD.Dietary salt loading produces baroreflex impairment and mild hypertension in rats[J].Am J Physiol,1985,249(2):H278-H284.
[23]符云峰,孫紀新,李素琴,等.長期攝取高鈉鹽飲食引發的高血壓發病機制實驗研究[J].中國病理生理雜志,2001,17(2):143-146.
[24] Farjah M,Washington TL,Roxas BP,et al.Dietary NaCl regulates renal aminopeptidase N:relevance to hypertension in the Dahl rat[J].Hypertension,2004,43(2):282-285.
[25] Titze J,Luft FC,Bauer K,et al.Extrarenal Na+balance,volume,and blood pressure homeostasis in intact and ovariectomized deoxycorticosterone-acetate salt rats[J].Hypertension,2006,47(6):1101-1107.
[26]Gu JW,Bailey AP,Tan W,et al.Long-term high salt diet causes hypertension and decreases renal expression of vascular endothelial growth factor in Sprague-Dawley rats[J].J Am Soc Hypertens,2008,2(4):275-285.
[27]Simon G,Jaeckel M,Illyes G.Development of structural vascular changes in salt-fed rats[J].AJH,2003,16(6):488-493.
[28] Banday AA,Muhammad AB,Fazili FR,et al.Mechanisms of oxidative stress-induced increase in salt sensitivity and development of hypertension in Sprague-Dawley rats[J].Hypertension,2007,49(3):664-671.
[29] Chabrashvili T,Tojo A,Onozato ML,et al.Expression and cellular localization of classic NADPH oxidase subunits in the spontaneously hypertensive rat kidney[J].Hypertension,2002,39(2):269-274.
[30] Sudhir K,Kurtz TW,Yock PG,et al.Potassium preserves endothelial function and enhances aortic compliance[J].Hypertension,1993,22(3):315-322.

