綠色熒光蛋白轉基因小鼠不同源性間充質干細胞原代培養及生物學特性比較*
辛 毅, 李 娜, 張 穎, 黃益民, 劉 颯, 許秀芳, 張兆光
綠色熒光蛋白(green fluorescent protein,GFP)轉基因小鼠是將來源于維多利亞多管水母(Aequorea victoria)的發光蛋白通過轉基因技術敲入C57小鼠基因序列中獲得的組織細胞發出綠色熒光的小鼠,其細胞自發熒光的特點為干細胞示蹤提供了良好的動物來源[1-2]。目前對GFP轉基因小鼠臍帶間充質干細胞(umbilical cord mesenchymal stem cells,UCMSCs)的純化培養未見報道,而骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)的分離培養報道也較少。MSCs具有多向分化潛能,在體外適當的誘導條件下可以分化為骨、脂肪、內皮、軟骨、肌肉和神經等多種組織細胞,體外培養不丟失其多向分化潛能,GFP小鼠作為良好的示蹤工具提供了一個很好的細胞來源[3]。本實驗擬通過酶消化法培養UCMSCs與密度梯度離心法分離BMSCs,在生物學特性、表面標志及多向分化潛能等方面進行比較,為干細胞示蹤提供了良好的細胞來源及技術方法。
材料和方法
1 動物
孕晚期健康GFP轉基因小鼠,體質量50~55 g,由北京大學醫學部實驗動物中心提供,北京市心肺血管疾病研究所實驗動物中心繁殖。
2 主要試劑
DMEM/F12培養基、胎牛血清(fetal bovine serum,FBS)、青霉素和鏈霉素均為Gibco產品。Ⅱ型膠原酶和胰蛋白酶均為Sigma產品。MTT為Promega產品。成骨和成脂誘導試劑盒(Mesenchymal Adipogenesis Kit和Mesenchymal Stem Cell Osteogenesis Kit)為Millipore產品。小鼠淋巴細胞分離液為國產試劑。流式抗體 PE-CD90、PE-CD105、PE-CD44、PE-CD45、PE-CD79a、PE-CD19 和 PE-CD14 為 BD 產品;細胞培養板、離心管和培養皿等均為Corning產品。4000B型熒光倒置顯微鏡為Leica產品。CO2細胞培養箱(Thermo Electron產品)。酶標檢測儀(Beckman產品)。超凈工作臺購自北京昌平長城凈化空氣儀器廠,TGL-16C離心機購自上海安亭科學儀器廠。
3 方法
3.1 取材 用0.3%戊巴比妥鈉腹腔注射麻醉孕鼠,75%乙醇消毒腹部,將子宮取出并分離胚胎,剪取臍帶組織,置含雙抗預冷0.01 mmol/L PBS的培養皿中清洗3次,去除血污抗菌,將臍帶用眼科剪剪碎成約1 mm×1 mm×1 mm組織塊,放入50 mL離心管中備用;再用消毒的手術器械無菌分離四肢長骨,去除骨膜及殘留肌肉,剪去長骨兩端,暴露髓腔后放入100 mm培養皿中備用。
3.2 Ⅱ型膠原酶消化分離UCMSCs 將臍帶組織碎塊放入50 mL離心管,再加入2 g/LⅡ型膠原酶,體積為組織的15~20倍為宜。37℃、100 r/min水浴搖床消化60~90 min,吸管輕輕吹打組織塊1~2 min,當臍帶組織塊由白色呈半透明狀態時,用10%FBS DMEM/F12終止消化,收獲細胞;在其余未完全消化的組織塊中再次加入消化液,是上一次消化液總體積的1/2,消化時間為60 min,余步驟同前;重復消化2~3次,所有的細胞懸液均過200目銅網純化。細胞懸液1 000 r/min離心5 min,棄上清,細胞沉淀中加含10%FBS的DMEM/F12培養基2 mL,將細胞接種于T25培養瓶,再補充3 mL含10%FBS的DMEM/F12培養基,置體積分數5%CO2、37℃培養箱中繼續培養,每隔2 d換液1次。
3.3 密度梯度離心法分離BMSCs 用注射器吸取DMEM/F12培養基反復沖洗骨髓腔,收集沖洗液,1 200 r/min離心10 min,棄上清。用含10%FBS的DMEM/F12培養基吹打重懸細胞,制成單細胞懸液,緩緩加入到15 mL裝有小鼠淋巴細胞分離液離心管中,使細胞懸液位于分離液之上,2 500 r/min離心20 min后取出離心管,管中液體分為4層,從上至下為培養基層、單個核細胞層、分離液層及沉淀的紅細胞,用無菌吸頭吸取單個核細胞層置于新的離心管,加入 DMEM/F12培養基重懸,1 200 r/min離心10 min,棄上清。計數后以1×1010/L密度接種于25 cm2培養瓶,標記為P0,置于體積分數5%CO2、37℃飽和濕度培養箱內培養。24 h后全量換液,以后每2~3 d換液,棄去未貼壁細胞以達到純化的目的。
3.4 UCMSCs及BMSCs生長曲線的測定 分別取2種原代細胞,按2×107/L接種于24孔培養板,每孔接種1 mL。從接種時間算起,每隔24 h計數5孔內的細胞密度,算出平均值,共計7 d。以培養時間(d)為橫坐標、細胞數為縱坐標繪制生長曲線。
3.5 MST法測定UCMSCs及BMSCs增殖 分別取2種原代細胞,以每孔約2×104個細胞等量接種于96孔板中,每孔加入100 μL培養液,置體積分數5%CO2、37℃細胞培養箱內孵育。每隔1 d向其中5孔加入5 g/L MTT溶液20 μL,孵育4 h后,用酶標儀在490 nm波長處測定各孔的吸光度 (A490),每天測5孔,連續測7 d。設立平行對照孔調零。
3.6 UCMSCs及BMSCs傳代及純化 細胞生長成致密單層后,用2.5 g/L胰蛋白酶消化,待大部分細胞變圓時,加含100 mL/L FBS的DMEM/F12完全培養液終止消化,反復輕輕吹打,1∶3傳代;依次標記為P1、P2 和 P3。
3.7 UCMSCs及BMSCs周期的測定 分別取P3達到80% ~90%融合細胞,消化、洗滌并計數2×108/L,700 mL/L冰乙醇固定24 h后,PBS洗滌2次,加 200 μL RNase A(1 g/L),37 ℃水浴 30 min,再加 PI染色液(50 mg/L)避光反應 30 min,BD FACS Calibur流式細胞儀檢測,Multicycle軟件分析。
3.8 UCMSCs及BMSCs流式細胞術分析 分別取P3細胞,胰蛋白酶消化成單細胞懸液,PBS洗滌2次,分別加入標志物 PE-CD90、PE-CD105、PE-CD44、PE-CD45、PE-CD14、PE-CD79a和 PE-CD19 流式抗體,同時做同型對照,4℃孵育30 min,PBS洗去未標記的抗體,20 g/L多聚甲醛固定后流式細胞術檢測。
3.9 UCMSCs及BMSCs誘導分化潛能的檢測
3.9.1 UCMSCs及BMSCs成脂的誘導 分別取P3細胞,以2×105個接種于6孔板,體外向脂肪細胞誘導分化:含10%FBS的DMEM/F12培養基培養至100%融合,換為成脂分化誘導液(10%FBS的DMEM/F12,10 mg/L 胰島素,1 μmol/L 地塞米松,0.5 mmol/L 1-甲基-3-異丁基黃嘌呤,100 μmol/L 吲哚美辛,1×105U/L青霉素,100 mg/L鏈霉素),連續誘導30 d后,PBS洗2次,油紅O染液染色30 min,蒸餾水沖洗至背景干凈,蘇木素復染10 min,自來水沖洗3次,在顯微鏡下取圖,并統計油紅O染色的陽性細胞。陰性對照組用含10%FBS的DMEM/F12培養基培養,每3~4 d換1次液,連續誘導30 d后,后續處理與誘導組同時進行并觀察統計細胞數。
3.9.2 UCMSCs及BMSCs成骨的誘導 分別取 P3細胞,以2×105個接種于6孔板,體外向成骨細胞誘導分化:含10%FBS的DMEM/F12培養基培養至80%融合,棄培養液,PBS洗2次,換成成骨分化誘導液(含體積分數10%胎牛血清,100 nmol/L地塞米松,10 mmol/L β-甘油磷酸鈉,0.2 mmol/L 抗壞血酸,1×105U/L青霉素,100 mg/L鏈霉素),連續誘導14 d,在顯微鏡下觀察可見細胞不透明區域時,PBS洗2次,700 mL/L冰乙醇固定1 h,PBS洗2次,用茜素紅染料1 mL滴加于每孔中,染色20 min后,用PBS洗2次,在倒置顯微鏡下觀察,并統計陽性細胞數。陰性對照組用含10%FBS的DMEM/F12培養基培養,每3~4 d換1次液,連續培養14 d后,后續染色步驟與誘導組相同并觀察統計細胞數。
4 統計學處理
應用SPSS 11.0統計軟件分析,計量資料以均數±標準差(mean±SD)表示,組間均數比較采用t檢驗,以P<0.05為差異有統計學意義。
結 果
1 酶消化法分離培養UCMSCs
用Ⅱ型膠原酶消化臍帶組織塊,可以得到較多的單個游離細胞,接種到培養皿里,24 h后可貼壁,1 d后形狀由圓形逐漸變成長梭形,見圖1A;2 d后細胞已開始生長,向四周伸展,呈旋渦狀生長,見圖1B;4 d后貼壁的細胞由中心向周圍不斷生長,細胞排列成復層,細胞生長形狀變得不規則,相互之間緊密相連,鋪滿平皿底部就可傳代,見圖1C。
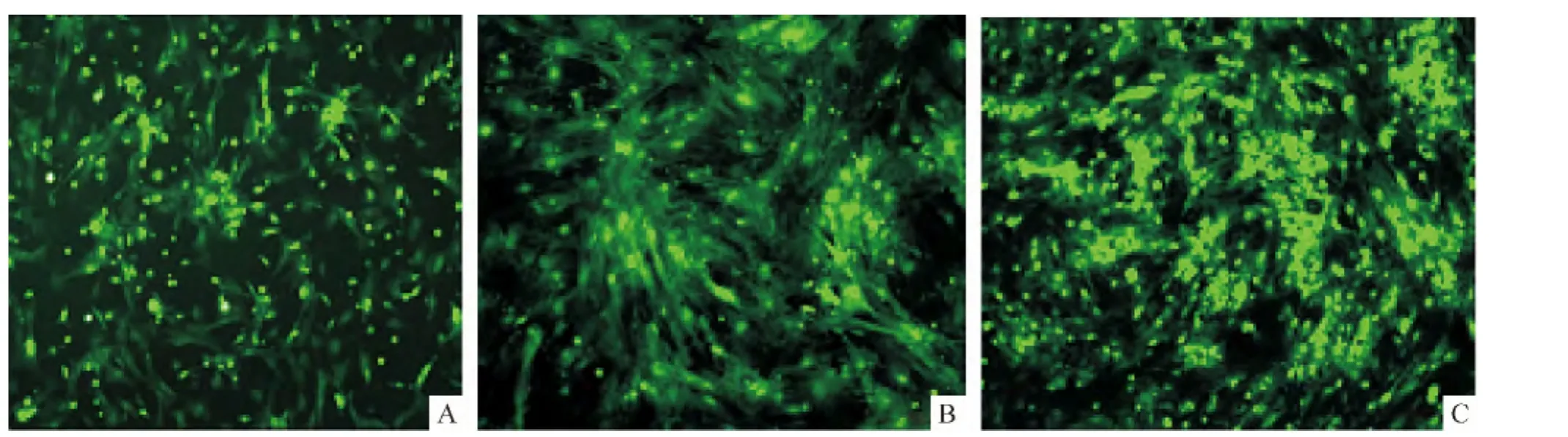
Figure 1.Primary culture of UCMSCs by enzyme digestion method(×100).A:1 d;B:2 d;C:4 d.圖1 酶消化法原代培養的UCMSCs
2 密度梯度離心法分離BMSCs
用密度梯度離心法分離BMSCs,可以得到較多的單個游離細胞,接種到培養皿里,24 h后可貼壁,細胞兩端伸出突起,見圖2A,細胞射光性較強;2 d后形狀由長橢圓形逐漸變成短梭形,由中心向四周不斷生長,見圖2B,呈克隆樣生長;4 d后細胞大量生長,呈集聚性長梭形伸展的細胞,排列成單層,細胞生長形狀變得規則,相互之間緊密相連,鋪滿平皿底部就可傳代,見圖2C。
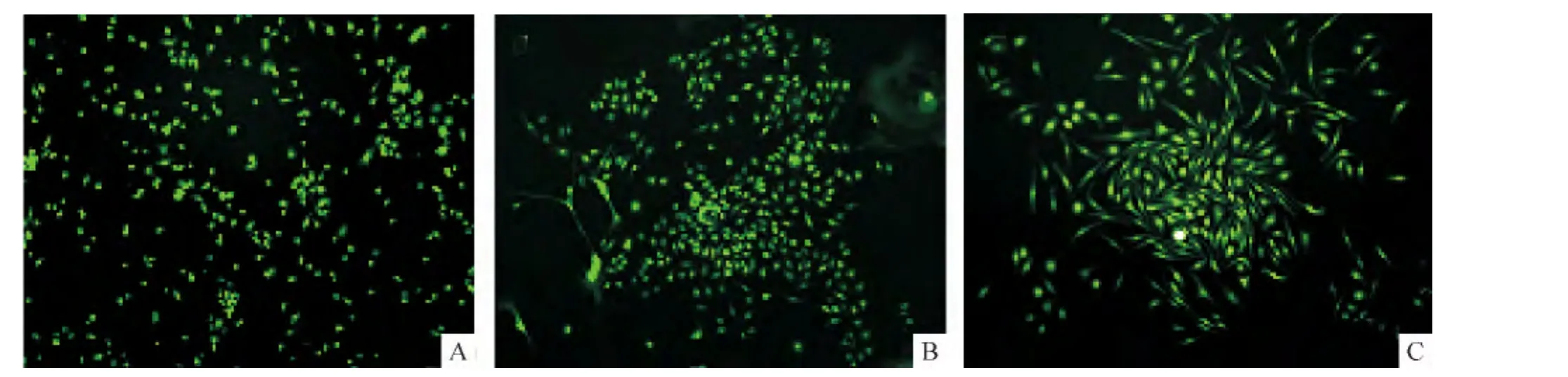
Figure 2.Primary culture of BMSCs by density gradient separation method(×100).A:1 d;B:2 d;C:4 d.圖2 密度梯度分離法原代培養的BMSCs
3 原代培養UCMSCs及BMSCs生長曲線
比較連續7 d測定的生長曲線顯示:原代培養的UCMSCs接種0~1 d后,細胞數明顯增加,比BMSCs數目增多,差異顯著(P<0.05);2~5 d為對數生長期,細胞數在此段時間內達到高峰,比BMSCs數目增多,差異顯著(P<0.01);5 d后細胞數量減少,但細胞數仍比BMSCs略多,差異顯著(P<0.01);細胞呈現“潛伏期-對數生長期-平臺期”的生長模式,細胞生長曲線近似“S”形;原代培養的BMSCs接種0~4 d后,細胞數緩慢增加,5~7 d后細胞數也有增加趨勢,細胞生長曲線平緩,未顯示出“S”形特征,見圖3。
4 原代培養UCMSCs及BMSCs MTT測定結果
原代培養UCMSCs增殖能力測定,連續7 d測定A490值。UCMSCs生長前2 d與第3天比較有顯著差異(P<0.05),提示增殖能力較弱;3~5 d變化較為顯著,提示此段時間內細胞增殖較快,可進行傳代;原代培養BMSCs增殖能力的測定,接種細胞后1~4 d,細胞數目無明顯變化(P>0.05),提示此階段增殖能力較弱,5~7 d細胞數目變化較明顯,前4 d與第5~7天比較有統計學意義(P<0.05),提示此段時間內細胞增殖較快,7 d后可進行傳代。原代培養UCMSCs與BMSCs增殖能力相比較有顯著差異(P<0.05),見表1。
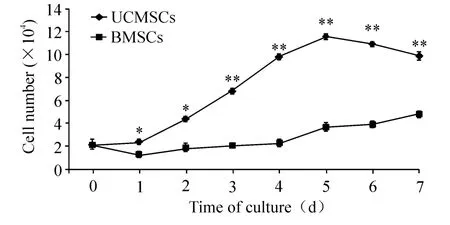
Figure 3.The growth curves of primarily cultured UCMSCs and BMSCs.Mean ± SD.n=5.*P < 0.05,**P < 0.01 vs BMSCs.圖3 原代培養UCMSCs及BMSCs生長曲線

表1 原代培養UCMSCs及BMSCs細胞活力測定Table 1.Viability of primary culture of UCMSCs and BMSCs(Mean±SD.n=5)
5U CMSCs及BMSCs傳代及純化特點
2種方法培養的細胞長至70%~80%即可傳代,2.5 g/L胰蛋白酶消化后,細胞呈單個,亮而圓,1 d后,細胞貼壁,單層生長,呈散在的長梭形,3d后細胞呈密集單層生長,有細胞集落出現,融合率達80%左右,可形成致密的單層;細胞體外培養時,從細胞開始生長3~5 d傳代1次。UCMSCs與BMSCs計數統計,即細胞的成活率約為97%,表明培養的細胞消化傳代成活率高,見圖4。2種細胞差異無統計學意義(P >0.05)。
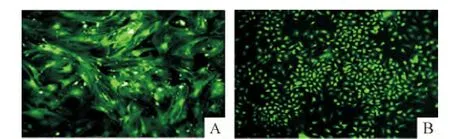
Figure 4.Morphologic changes of UCMSCs(A)and BMSCs(B)in the third passage(fluorescence microscope,×100).圖4P3 UCMSCs及BMSCs形態特征
6U CMSCs及BMSCs周期分析
流式細胞術分別檢測P3 UCMSCs和BMSCs的G0/G1和S+G2/M百分率,結果顯示,UCMSCs G0/G1期細胞占85.95%,顯著高于S期與G2/M期細胞之和,見圖5A;BMSCs G0/G1期細胞占87.92%,顯著高于S期與G2/M期細胞之和,見圖5B。2種細胞差異無統計學意義(P>0.05)。
7 UCMSCs及BMSCs免疫表型流式細胞術檢測結果
P3 UCMSCs PE-CD44、PE-CD105和 PE-CD90陽性表達率為(65.40 ±1.43)%、(58.90 ±1.67)%和(64.50 ±1.96)%,而 PE-CD79a、PE-CD19、PE-CD14和PE-CD45表達率低,陽性率分別為(12.70±0.45)%、(39.40 ± 0.34)%、(3.40 ± 0.54)%、(31.50 ±0.26)%,見圖 6A;P3 BMSCs PE-CD44、PE-CD105和PE-CD90高表達,為(55.30±1.29)%、(61.90 ± 1.76)% 和(57.90 ± 1.96)%,而 PECD79a、PE-CD19、PE-CD14 和 PE-CD45表達率低,分別為(10.90% ±0.64)%、(27.70 ±2.19)% 、(20.60±0.84)%和(25.90±0.84)%,見圖6B;2種細胞差異無統計學意義(P>0.05)。
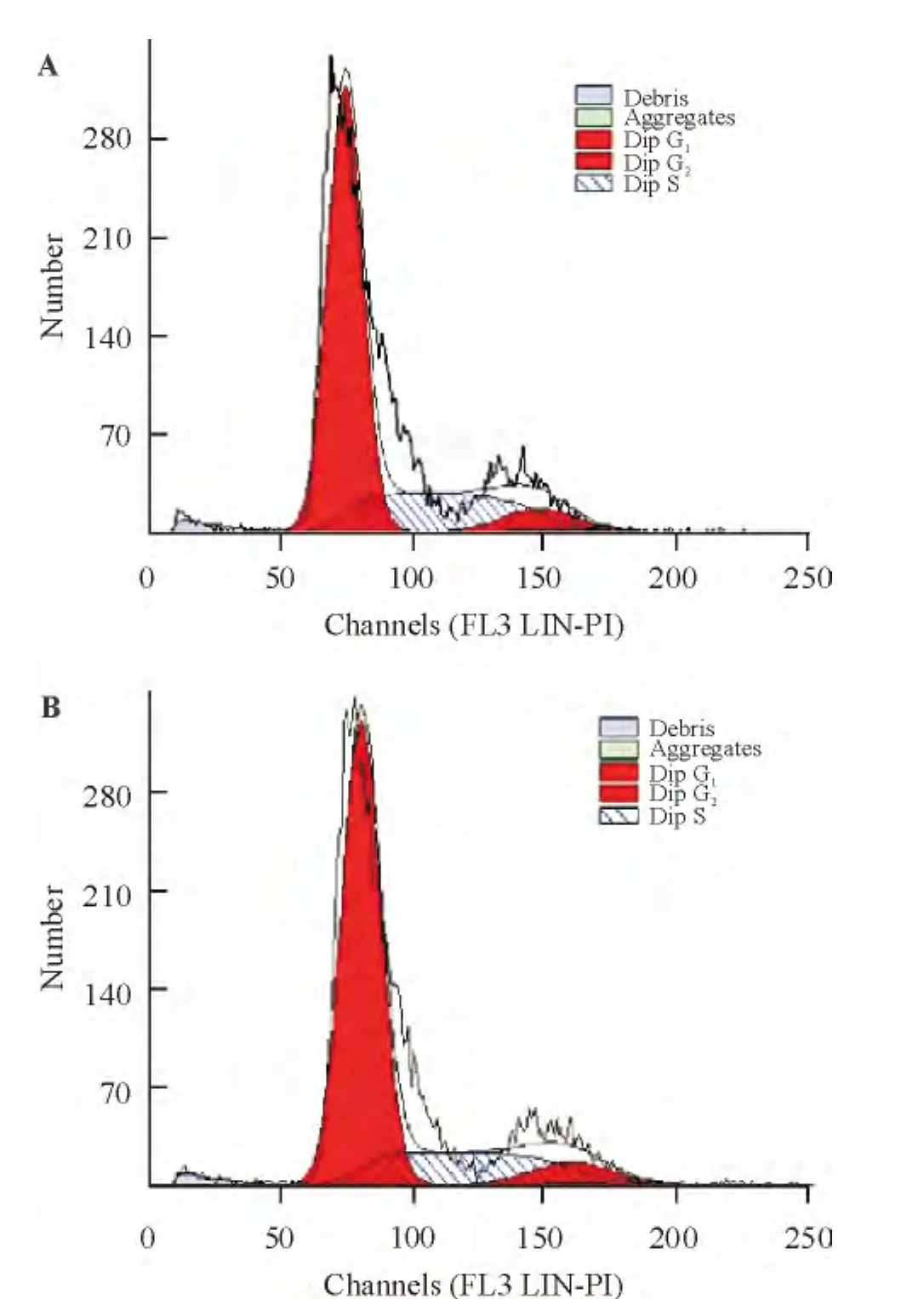
Figure 5.Cell cycle analysis of UCMSCs(A)and BMSCs(B)in third passages.圖5P3代UCMSCs及BMSCs DNA周期分析
8U CMSCs及BMSCs成脂細胞誘導
P3 UCMSCs和BMSCs分別成脂誘導20 d左右,細胞形態逐漸由長梭形變為短梭形,隨著誘導時間的延長,高倍鏡下可見細胞變為橢圓形或圓形,細胞質內有顆粒樣物質,胞質較多,核較大,空泡,提示脂滴開始形成。隨著誘導時間延長,胞質內的脂滴增多。誘導后的細胞經油紅O染色,可見胞質中有大量被染成紅色的脂滴,UCMSCs油紅O染色呈陽性,陽性率為(94.6±3.8)%,見圖 7A;BMSCs陽性率為(30.5±2.6)%,見圖7B。2種細胞的陽性率有顯著差異(P<0.05)。對照組 P3 UCMSCs和 BMSCs用基礎培養基培養20 d后,在顯微鏡下觀察未見細胞形態學變化,油紅O染色均未見胞質中紅色的脂滴,即油紅O染色陰性,見圖7C、D。
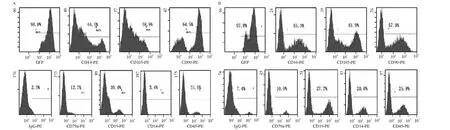
Figure 6.Flow cytometry analytic results of cellular surface antigens of UCMSCs(A)and BMSCs(B)in the third passage.圖6 P3 UCMSCs及BMSCs細胞免疫表型分析
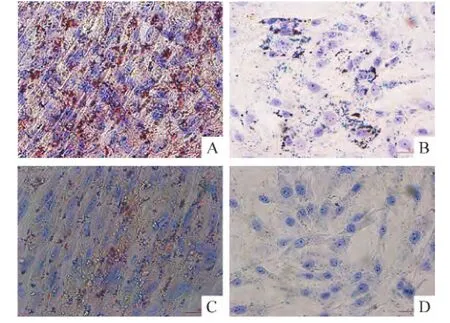
Figure 7.Adipogenic differentiation of UCMSCs and BMSCs in the third passage(Oil red O staining,× 400).A:UCMSCs(induction group);B:BMSCs(induction group);C:UCMSCs(control group);D:BMSCs(control group).圖7 P3 UCMSCs及BMSCs成脂細胞誘導分化結果
9U CMSCs及BMSCs成骨細胞誘導
P3 UCMSCs及BMSCs分別成骨誘導15 d左右,細胞形態逐漸由長梭形變為鱗片形、三角形或多角形等,細胞外基質分泌增多,中央可見類似結節狀的結構,部分細胞呈現層疊狀生長,茜紅素染色后可見細胞密集處有紅色的沉著物,呈團狀并向四周放射狀排列,中心顏色明顯加深。UCMSCs茜紅素染色陽性率達(92.5±5.1)%,見圖 8A;BMSCs陽性率為(35.5±3.4)%,見圖8B。2種細胞的陽性率有顯著差異(P<0.05)。對照組 P3 UCMSCs和 BMSCs用基礎培養基培養15 d后,在顯微鏡下觀察未見細胞形態學變化,茜素紅染色均未見紅色的結節狀細胞團,即茜素紅染色陰性,見圖8C、D。
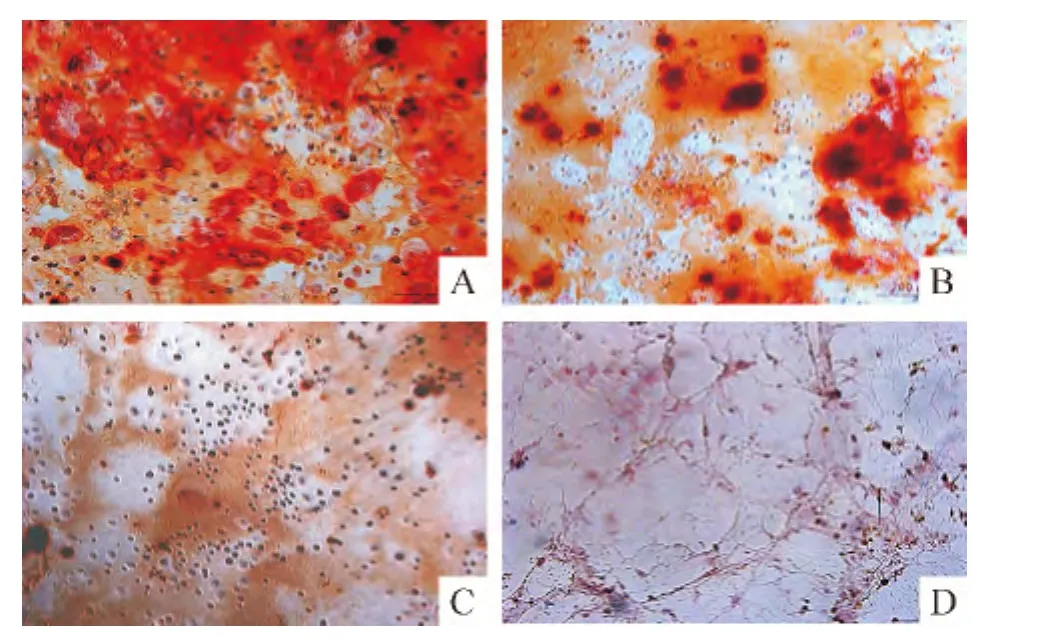
Figure 8.Osteogenic differentiation of UCMSCs and BMSCs in the third passage(Alizarin red staining,×100).A:UCMSCs(induction group);B:BMSCs(induction group);C:UCMSCs(control group);D:BMSCs(control group).圖8 P3 UCMSCs和BMSCs成骨細胞誘導分化結果
討 論
熒光蛋白標記技術是近年來高速發展的一種細胞標記技術,采用基因嵌合的方式將熒光蛋白基因嵌合入待標記的細胞。GFP基因是研究活細胞中基因表達和定位的新型報告基因,被廣泛應用于移植干細胞的體內示蹤,但其細胞標記的時效性極不穩定,熒光容易淬滅[4]。而熒光蛋白轉基因動物則不存在標記不穩定的缺陷,細胞體外擴增傳代和體內分化均不會引起熒光強度減弱或淬滅,可以提供熒光穩定、獲取簡便的示蹤細胞[5-6]。
目前國內對于BMSCs分離純化和培養的研究中,采用GFP轉基因小鼠進行研究的比較少,在GFP小鼠臍帶中分離MSCs進行體外培養的技術方法未見報道。有研究表明,臍帶中富含干細胞,遠遠高于骨髓中的含量,臍帶間充質干細胞有望取代骨髓間充質干細胞成為組織工程中更為理想的種子細胞[7]。本研究利用GFP轉基因小鼠作為細胞供體,采用酶消化法消化臍帶組織的方式獲得數量充足的UCMSCs,且操作簡單易行,可更好地保持細胞活力,細胞呈長梭形旋渦狀生長且增殖能力較強,3 d后即可傳代,細胞在短期內增殖迅速,縮短了原代培養時間。BMSCs可以通過貼壁細胞分離法、密度梯度離心法、流式細胞儀分選法和免疫磁珠分離法進行分離[8],本研究利用密度梯度離心法分離BMSCs,操作較復雜,能夠獲取較均一的單個核細胞但細胞數量較少,細胞貼壁慢,呈成纖維狀克隆樣生長,原代培養7 d后才能傳代,傳代培養時間較長。臍帶MSCs與骨髓MSCs相比較,分離細胞操作簡單且數量多;原代培養細胞貼壁時間快,所用時間短,短期內迅速增殖,臍帶源MSCs可為后續實驗提供充足的細胞。
為了更加深入地比較2種源性干細胞的生長增殖特性,本研究采用生長曲線法、MTT法和DNA周期檢測細胞生物學特性,其結果顯示:原代培養的UCMSCs在3~5 d生長迅速,即可傳代;BMSCs于8 d后迅速增殖且可以傳代,細胞增殖生長曲線與MTT結果相一致。UCMSCs與BMSCs比較,UCMSCs原代培養所需時間較短,在短期內可獲得數量較多的細胞,為基礎研究提供充足的靶細胞。通過對第3代UCMSCs、BMSCs經DNA周期檢測法分析,其結果顯示,85%的細胞處于G0/G1期,只有接近15%的細胞處于 S+G2/M期,符合干細胞生長特性[9]。從DNA周期結果可以得出,2種源性的MSCs傳代后增殖潛力基本一致,具有典型干細胞增殖特點,將對深入了解細胞的生長發育有重要意義。
目前尚未明確MSCs的特異性抗原標志,不同的實驗室分離和擴增MSCs的條件差異很大,通常以細胞形態、流式細胞術檢測結果和多向分化潛能作為判斷標準[10],對細胞的分子免疫表型、分化潛能及功能的鑒定亦有不同,有一些比較公認的表面分子標志,包括 CD29、CD73、CD90、CD105、CD44 等,同時不表達造血干細胞的表面標志,包括 CD14、CD45、CD11b、CD34 等[11],本研究對第 3 代 UCMSCs及BMSCs經流式細胞術檢測高表達間充質細胞標志CD105、CD90和 CD44,而低表達血源性標志物CD45、CD19、巨噬細胞表面分化抗原CD14及B細胞表面抗原CD79a,2種源性細胞無明顯差異。
為驗證GFP轉基因小鼠的UCMSCs及BMSCs的多向分化潛能,在不同培養條件下,本研究采用成脂及成骨誘導試劑盒對第3代細胞進行體外誘導。結果表明:UCMSCs和BMSCs經成脂及成骨誘導培養后,通過油紅O染色證實分化為脂肪細胞,經茜紅素染色證實分化為成骨細胞。臍帶MSCs向脂肪細胞及成骨細胞分化潛能遠遠高于骨髓MSCs,臍帶MSCs將更有利于干細胞的實驗研究及臨床應用。
綜上所述,本研究建立了GFP轉基因小鼠的UCMSCs和BMSC原代培養方法,通過對2種源性細胞進行體外傳代培養、生長增殖特性、細胞表型鑒定、誘導分化潛能等的生物學特性的對比研究,證實UCMSCs可作為一種方便、高效的示蹤干細胞,為研究干細胞龕調控機制打下良好的細胞學基礎。
[1] Kanatsu-Shinohara M,Kato M,Takehashi M,et al.Production of transgenic rats via lentiviral transduction and xenogeneic transplantation of spermatogonial stem cells[J].Biol Reprod,2008,79(6):1121-1128.
[2] 李秀梅,尤玉琴,劉光澤,等.慢病毒介導的綠色熒光蛋白轉基因小鼠的制備及鑒定[J].解放軍醫學雜志,2011,36(9):964-966.
[3] Stephens DJ,Allan VJ.Light microscopy techniques for live cell imaging[J].Science,2003,300(5616):82-86.
[4] Kim SS,Lim SH,Hong YS,et al.Tissue engine eering of heart valves in vivo using bone marrow-derived cells[J].Artif Organs,2006,30(7):554-557.
[5] Lippincott-Schwartz J,Patterson GH.Development and use of fluorescent protein markers in living cells[J].Science,2003,300(5616):87-91.
[6] 段晴月,董金山,金超威,等.綠色熒光蛋白轉基因小鼠骨髓間充質干細胞的體外培養和鑒定[J].牙體牙髓牙周病學雜志,2010,20(4):196-199.
[7] 辛 毅,李 娜,黃益民,等.人臍帶間充質干細胞的原代培養及多向分化潛能的研究[J].細胞與分子免疫學雜志,2013,29(3):1087-1093.
[8] Short B,Brouard N,Occhiodoro-Scott T,et al.Mesenchymal stem cells[J].Arch Med Res,2003,34(6):565-571.
[9] 辛 毅,劉小希,趙 偉,等.差速貼壁法分離兔骨髓源性間充質干細胞和內皮祖細胞及其生物學特性的研究[J].中國實驗血液學雜志,2013,21(3):746-753.
[10]肖 盼,陳 劍,王彥平,等.不同消化分離方法分離人羊膜間充質干細胞效果比較[J].中國病理生理雜志,2010,26(5):1033-1037.
[11] Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.

