阿司匹林與氟尿嘧啶協同抑制結腸癌細胞生長增殖的機制研究*
劉 宇, 高 東, 鐘靜靜, 萬巖巖, 李翔英, 靳廣毅, 王曉冬
氟尿嘧啶是一種目前臨床上常用的廣譜抗腫瘤藥物,對結腸癌有較好的效果,對其它消化系統癌癥、宮頸癌、卵巢癌等也有效[1-2]。氟尿嘧啶主要通過抑制脫氧胸苷酸合成酶,阻斷脫氧尿苷酸甲基化轉變為脫氧胸苷酸,進而干擾DNA的合成以發揮抗腫瘤效果,屬于抗代謝類抗腫瘤藥物。但氟尿嘧啶本身毒性較大,用藥后患者易發生嚴重的不良反應,如骨髓抑制、胃腸道及神經系統損害等。阿司匹林是一種歷史悠久的解熱鎮痛藥,近年來研究表明阿司匹林能顯著降低結腸癌、食管癌、前列腺癌、胰腺癌等腫瘤發病的危險性[3],并具有抑制結腸癌細胞生長增殖的作用[4]。本研究主要通過MTT法觀察阿司匹林與氟尿嘧啶協同抑制結腸癌細胞生長增殖的作用,旨在采用低濃度的藥物協同作用發揮藥效并減低不良反應,并且通過Hoechst染色、caspase活性測試、流式細胞術、real-time PCR、Western blotting等方法探討其作用機制,為今后可能的臨床應用奠定基礎。
材料和方法
1 主要試劑
阿司匹林、氟尿嘧啶、噻唑藍(MTT)、二甲亞砜(DMSO)和碘化丙啶(PI)購自 Sigma-Aldrich;Hoechst 33258、casapse-3、caspase-8、caspase-9 試劑盒和BCA蛋白定量試劑盒購自碧云天生物技術有限公司;RNA提取試劑盒和實時熒光定量PCR試劑盒(SYBR Premix Ex Taq)購自 TaKaRa;Bcl-2、Bax、βactinⅠ抗及相應Ⅱ抗購自Santa Cruz;RPMI-1640培養基和胎牛血清購自HyClone,其它常規試劑均為國產分析純。
2 細胞培養和實驗分組
人結腸癌細胞株HCT-116和SW620為本實驗室保藏并常規傳代培養,生長于含有10%滅活胎牛血清、青霉素(1×105U/L)和鏈霉素(100 mg/L)的RPMI-1640培養基中,于37℃、5%CO2、飽和濕度的培養箱內培養;細胞常規每3~4 d傳代1次,所有實驗采用對數生長期細胞。
體外培養的結腸癌細胞分成4組進行處理:空白對照組(control group),用RPMI-1640完全培養基進行培養;阿司匹林組(aspirin group),用含 100 μmol/L阿司匹林的培養基進行培養;氟尿嘧啶組(5-fluorouracil,5-Fu),用含 0.3、1、3、10、30 或 100 μmol/L氟尿嘧啶的培養基進行培養;氟尿嘧啶+阿司匹林組(5-Fu+aspirin),用同時含有不同濃度的氟尿嘧啶與100 μmol/L阿司匹林的培養基進行培養。
3 方法
3.1 MTT法 HCT-116或SW620細胞常規胰酶消化成單細胞懸液,1×108/L細胞接種于96孔板,培養箱內孵育過夜;次日每孔加入含100 μmol/L阿司匹林和0.3、1、3、10、30、100 μmol/L 氟尿嘧啶的培養基;作用一定時間后,每孔加入5 g/L MTT 20 μL,繼續孵育4 h,棄上清每孔加入100 μL DMSO,室溫振蕩搖勻,酶標儀檢測490 nm處吸光度,并計算不同藥物作用下細胞的存活率。
3.2 Hoechst 33258染色法 1×108/L HCT-116細胞接種于24孔板,加入含100 μmol/L阿司匹林和1、3、10、30、100 μmol/L 氟尿嘧啶的培養基作用48 h 后,棄上清,4%甲醛固定10 min;棄上清,Hoechst 33258染色5 min;熒光顯微鏡觀察細胞核狀態并拍照。
3.3 Caspase-3、-8、-9活性的檢測 1×108/L HCT-116細胞接種于6孔板,加入含100 μmol/L阿司匹林和1、3、10、30、100 μmol/L 氟尿嘧啶的培養基作用48 h后,收集細胞,并按照試劑盒操作說明進行活性檢測。
3.4 流式細胞術 1×108/L HCT-116細胞接種于6孔板,加入含100 μmol/L阿司匹林和100 μmol/L氟尿嘧啶的培養基作用48 h后,收集細胞,PBS洗滌并重懸,加入RNase A 37℃作用30 min,再加入PI于4℃作用30 min,流式細胞術檢測細胞周期。
3.5 Real-time PCR 1×108/L HCT-116細胞接種于6孔板,加入含100 μmol/L阿司匹林和100 μmol/L氟尿嘧啶的培養基作用48 h后,收集細胞提取RNA并逆轉錄成cDNA。實時熒光定量PCR按照試劑盒操作說明進行,引物序列見表1,具體反應條件為:預變性95 ℃ 1 min,95 ℃ 15 s,59 ℃ 20 s,40 個循環。不同樣本目的基因表達的相對差異量用2-ΔΔCt法計算。
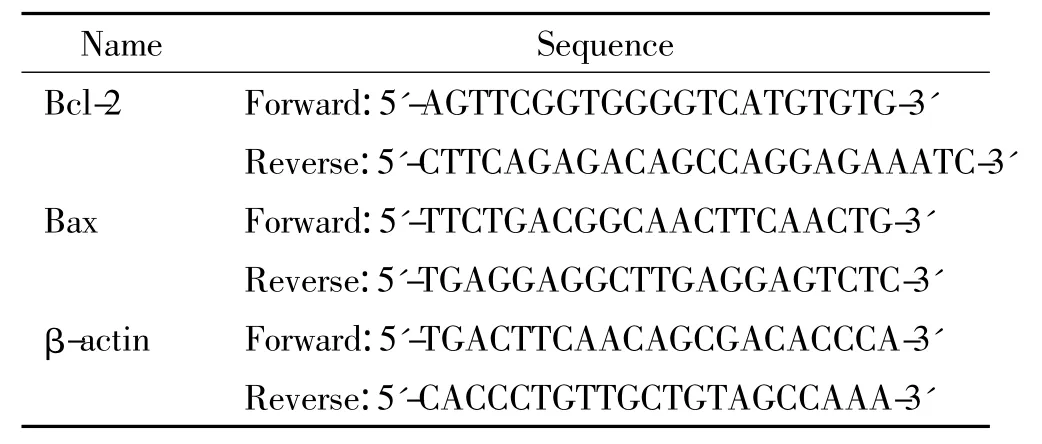
表1 引物序列Table 1.Sequences of the primers
3.6 Western blotting 1×108/L HCT-116細胞接種于6孔板,加入含100 μmol/L阿司匹林和100 μmol/L氟尿嘧啶的培養基作用48 h后,收集細胞,提取總蛋白并用BCA法進行蛋白定量。樣品于SDS-PAGE分離后轉印至PVDF膜上,5%BSA封閉1 h,Ⅰ抗4℃過夜,Ⅱ抗1 h,ECL法顯色。
4 統計學處理
數據均用數±標準差(mean±SD)表示,采用SPSS 17.0統計軟件分析,組間均數比較采用t檢驗或方差分析,以P<0.05為差異有統計學意義。
結 果
1 阿司匹林與氟尿嘧啶協同抑制結腸癌細胞生長增殖
單獨應用氟尿嘧啶對HCT116細胞的生長增殖具有抑制作用,且作用效果呈時間及濃度依賴性。單獨應用100 μmol/L阿司匹林對HCT116細胞增殖沒有明顯的抑制效果,但將100 μmol/L阿司匹林與不同濃度的氟尿嘧啶協同應用于HCT116細胞時,細胞增殖能力被更有效地抑制,且此種協同抑制同樣具有時間及濃度依賴性,見圖1及表2。同時,協同應用阿司匹林與氟尿嘧啶于SW620結腸癌細胞時,出現相似的實驗結果,見表2。
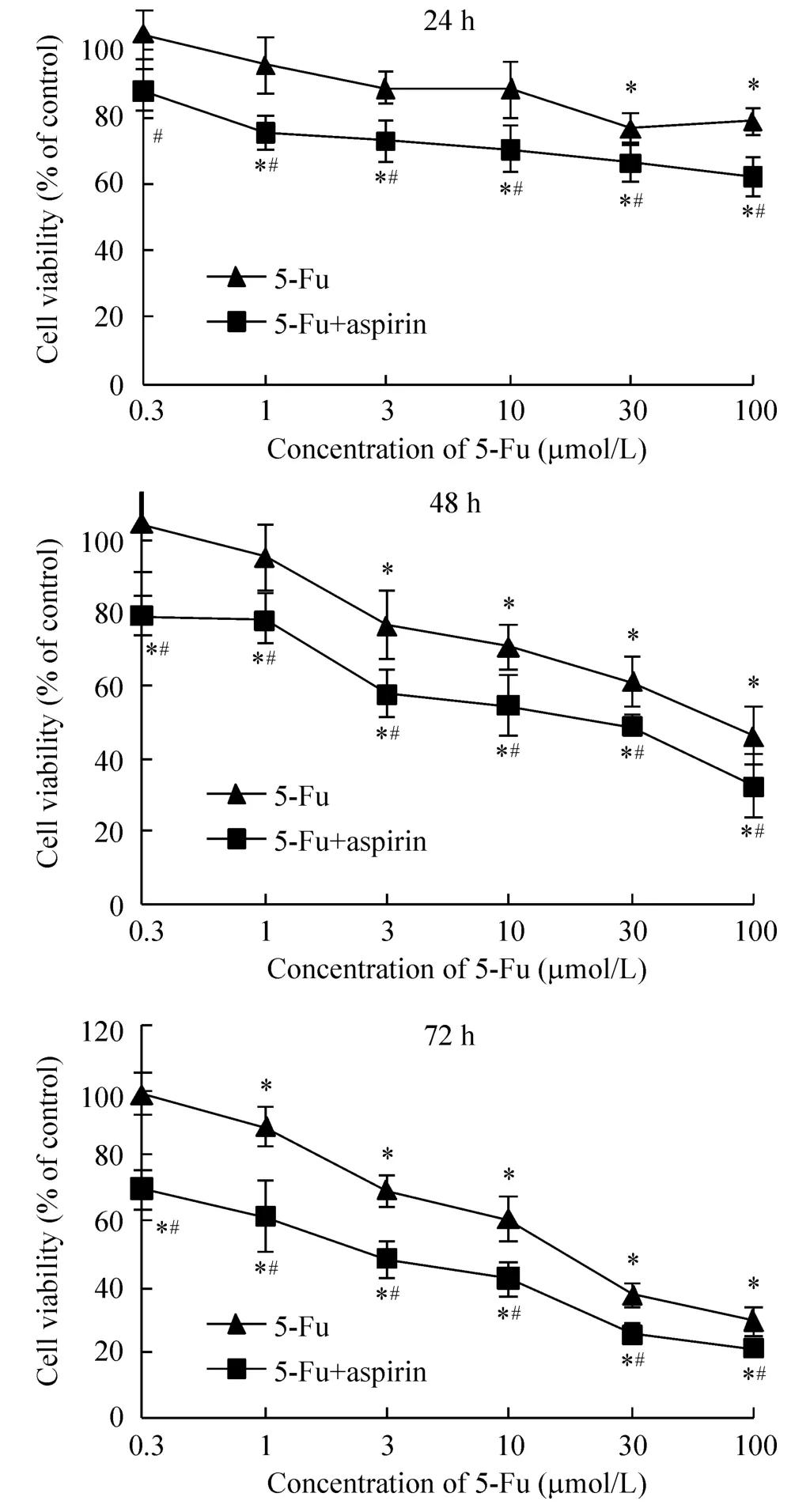
Figure 1.Changes of HCT116 cell viability after treatment with various concentrations of 5-Fu and 100 μmol/L aspirin for 24,48 and 72 h.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs 5-Fu group.圖1 5-Fu與阿司匹林對HCT116細胞存活率的影響
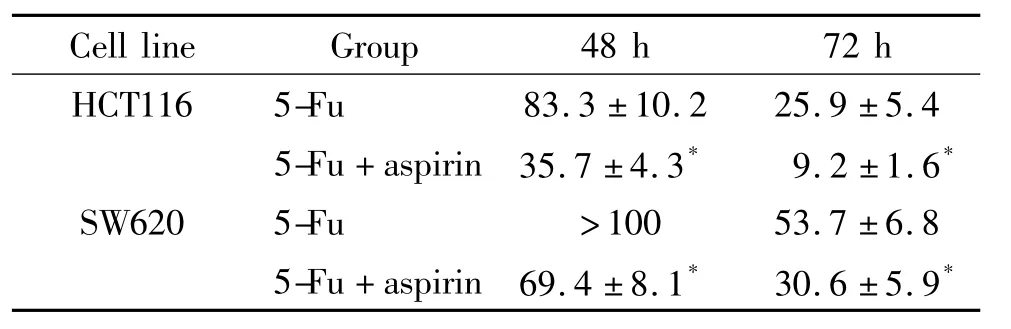
表2 5-Fu單獨作用或在阿司匹林協同下對結腸癌細胞增殖的IC50值Table 2.The IC50values of 5-Fu alone or combined with aspirin(100 μmol/L)for the proliferation of colon cancer cell lines(μmol/L.Mean±SD.n=3)
2 阿司匹林與氟尿嘧啶協同誘導結腸癌細胞出現凋亡形態
HCT116細胞用Hoechst 33258染色后通過熒光顯微鏡觀察可見,未經處理組活細胞核呈均勻熒光,藥物處理組則表現出不同程度的濃染致密顆粒狀熒光,即發生細胞凋亡的典型特征。單獨應用100 μmol/L氟尿嘧啶48 h后可見凋亡形態,單獨應用30 μmol/L氟尿嘧啶則凋亡形態不明顯。不同濃度氟尿嘧啶與100 μmol/L阿司匹林協同作用48 h后,細胞核皺縮碎裂、染色質濃縮等凋亡形態均更加顯著,見圖2。
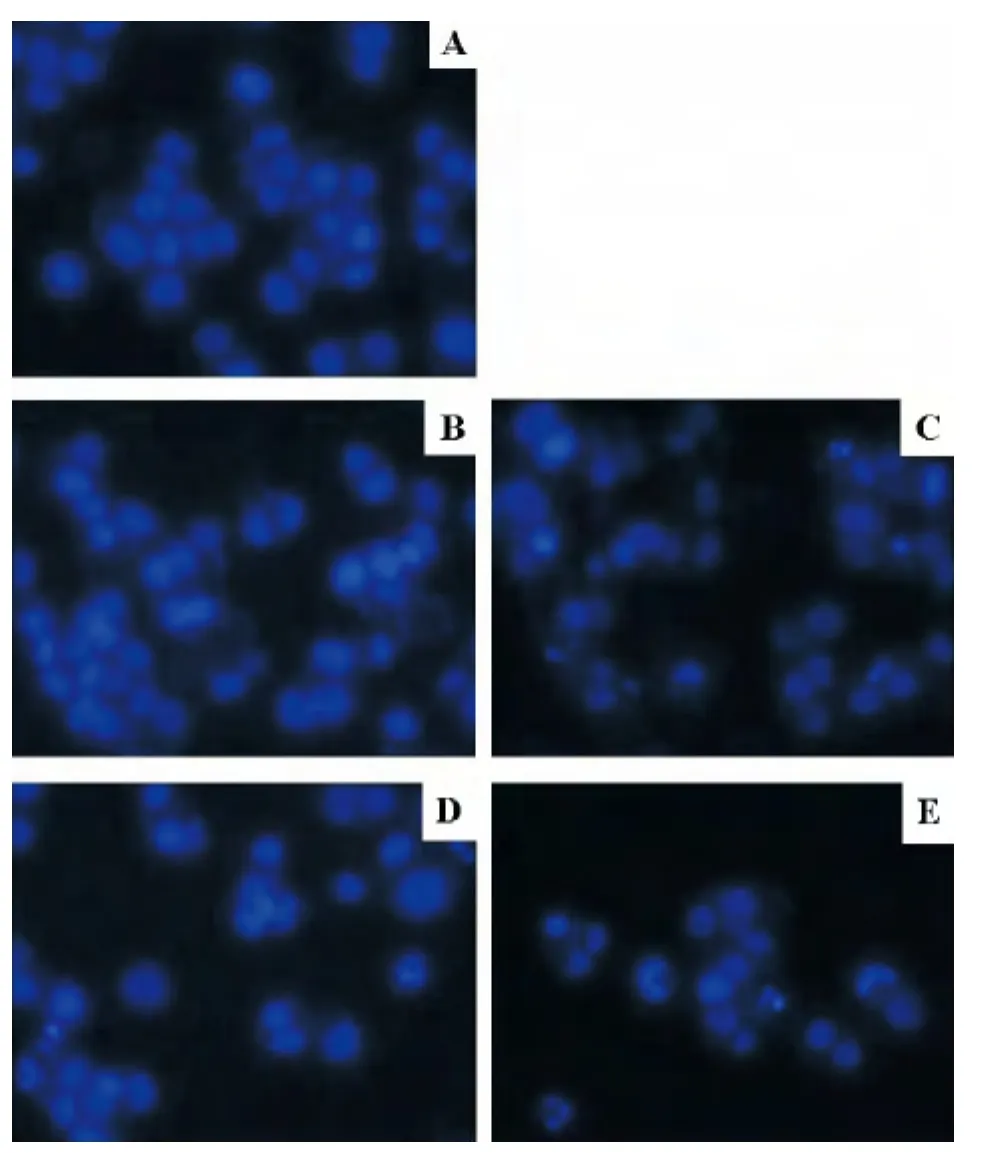
Figure 2.Nuclear morphology of HCT116 cells treated with 5-Fu and aspirin for 48 h (Hoechst 33258 staining,×200).A:control;B:30 μmol/L 5-Fu;C:30 μmol/L 5-Fu+100 μmol/L aspirin;D:100 μmol/L 5-Fu;E:100 μmol/L 5-Fu+100 μmol/L aspirin.圖2 5-Fu與阿司匹林對HCT116細胞核形態的影響
3 阿司匹林與氟尿嘧啶協同應用激活結腸癌細胞caspase酶活性
HCT116細胞用不同濃度氟尿嘧啶刺激48 h后,caspase-3、-8、-9酶活性均有所提高,且活性增強呈濃度依賴性,但單獨應用100 μmol/L阿司匹林則對caspase酶活性幾無影響。100 μmol/L阿司匹林與氟尿嘧啶協同應用后,相對于單用氟尿嘧啶,細胞的caspase酶活性明顯增加。100 μmol/L氟尿嘧啶與阿司匹林合用后,caspase-3、-8、-9酶活性分別由1.7、3.2和2.8倍提高到2.2、4.0和3.4倍,見圖3。
4 阿司匹林與氟尿嘧啶協同應用影響結腸癌細胞周期
HCT116細胞藥物作用48 h后,流式細胞術檢測發現100 μmol/L氟尿嘧啶顯著提高了sub-G1及S期的比例。單用100 μmol/L阿司匹林對細胞周期無明顯影響。100 μmol/L阿司匹林與氟尿嘧啶協同作用后,與單用氟尿嘧啶相比,細胞凋亡(sub-G1期)比例有所增加,G0/G1期及S期變化則無顯著差異,見圖4、表3。
5 阿司匹林與氟尿嘧啶協同應用影響Bcl-2和Bax mRNA水平
如圖5所示,單獨應用阿司匹林對Bcl-2 mRNA水平無明顯影響,單獨應用氟尿嘧啶則抑制Bcl-2 mRNA水平,2種藥物協同應用更顯著下調 Bcl-2 mRNA水平,但阿司匹林和氟尿嘧啶對Bax mRNA水平均無明顯影響。
6 阿司匹林與氟尿嘧啶協同應用影響Bcl-2和Bax蛋白表達
如圖6所示,單獨應用阿司匹林對蛋白表達無明顯影響,單獨應用氟尿嘧啶抑制Bcl-2表達,協同應用后抑制Bcl-2表達效果更顯著,但2種藥物對Bax表達水平無明顯影響。
討 論
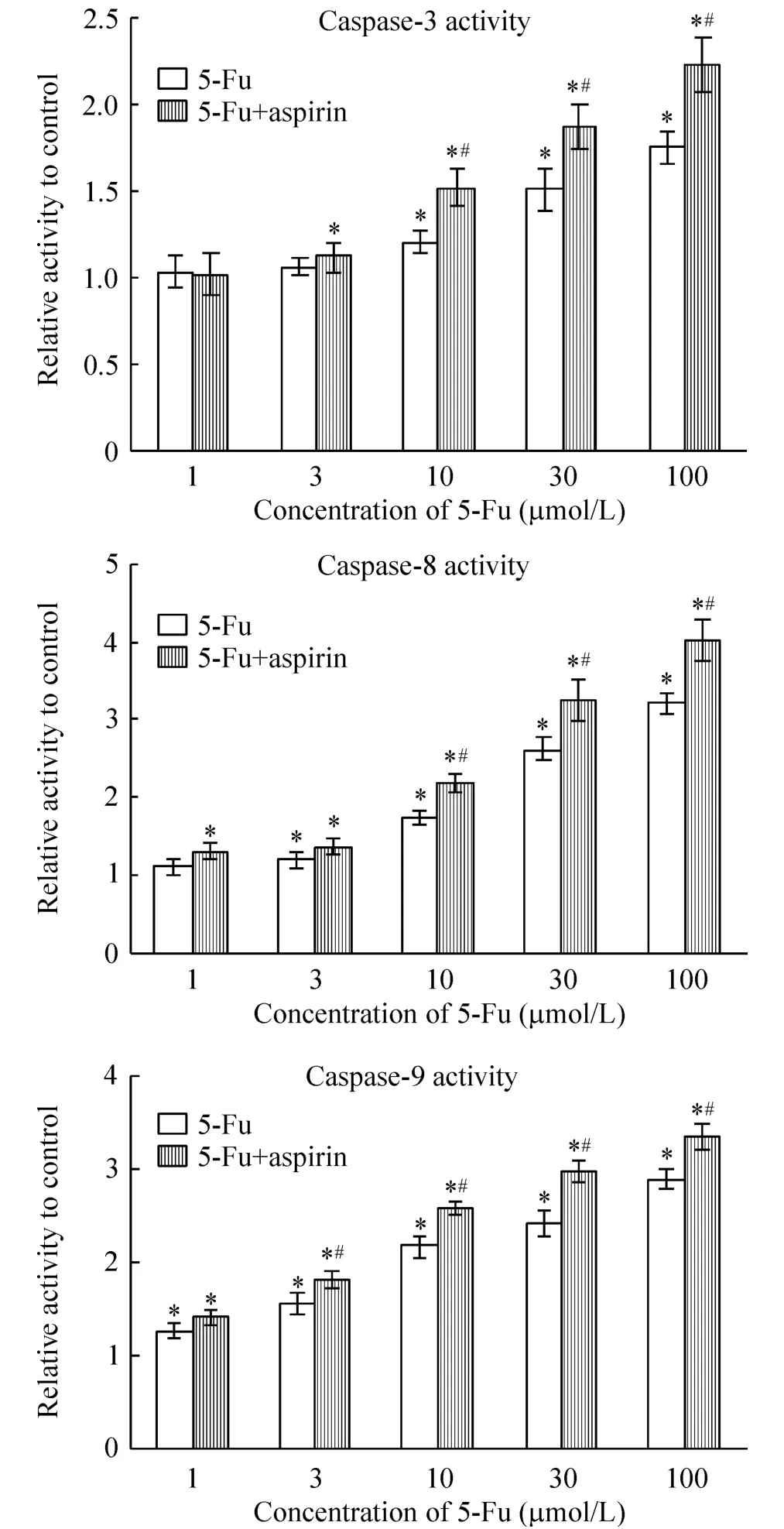
Figure 3.Changes of caspase-3,caspase-8 and caspase-9 activity in HCT116 cells after 5-Fu treatment for 48 h with or without 100 μmol/L aspirin.Mean ± SD.n=3.*P<0.05 vs control group;#P<0.05 vs 5-Fu group.圖3 5-Fu與阿司匹林對HCT116細胞caspase酶活性的影響
氟尿嘧啶和阿司匹林是臨床上常用的2種藥物。氟尿嘧啶主要用于治療結腸癌在內的多種腫瘤,且文獻顯示氟尿嘧啶可以誘發腫瘤細胞凋亡以達到抗腫瘤的效果[5]。阿司匹林是一種常用的非甾體抗炎藥,主要臨床作用為解熱、鎮痛、抗炎等。近期研究發現阿司匹林可以預防結腸癌等腫瘤發生,且對腫瘤細胞凋亡也有一定的影響[6-7]。已有文獻報道將阿司匹林與氟尿嘧啶聯合應用于HT-29結腸癌細胞,通過誘發凋亡取得較好的腫瘤抑制效果[8]。本課題則將2種藥物聯合應用于HCT116及SW620結腸癌細胞,證明2藥均采用較低的藥物濃度可以達到單藥高濃度時的抑制腫瘤效果,并研究其相關機制。另外,之前研究結果僅證明無明顯細胞毒性的低濃度氟尿嘧啶與高濃度阿司匹林聯合應用的效果,而本研究則主要探討低濃度阿司匹林對氟尿嘧啶毒性的增強作用。
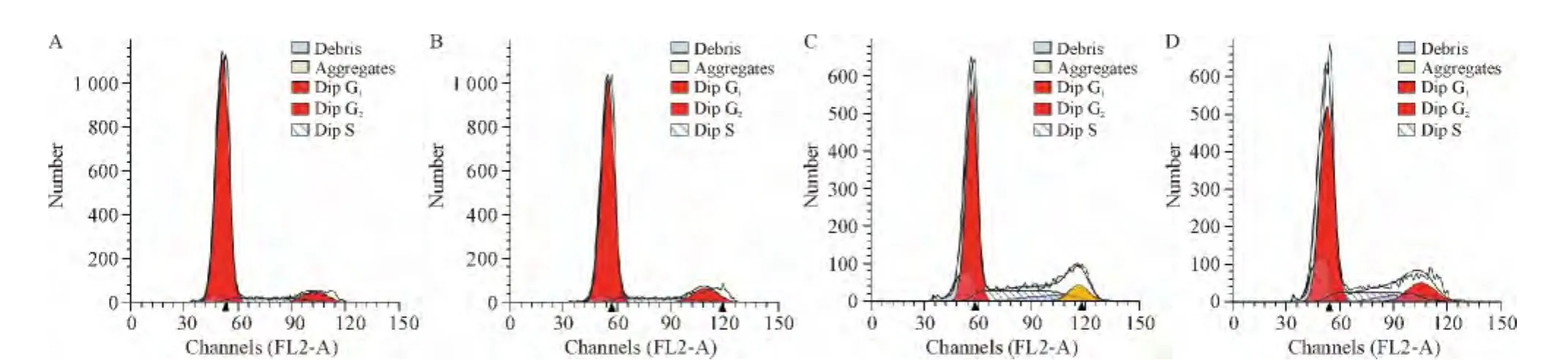
Figure 4.The cell cycle of HCT116 cells after treatment with 100 μmol/L 5-Fu or 100 μmol/L aspirin for 48 h.Debris represented the apoptotic cells(sub-G1phase).A:control;B:100 μmol/L aspirin;C:100 μmol/L 5-Fu;D:100 μmol/L 5-Fu+100 μmol/L aspirin.圖4 5-Fu與阿司匹林對HCT116細胞周期的影響
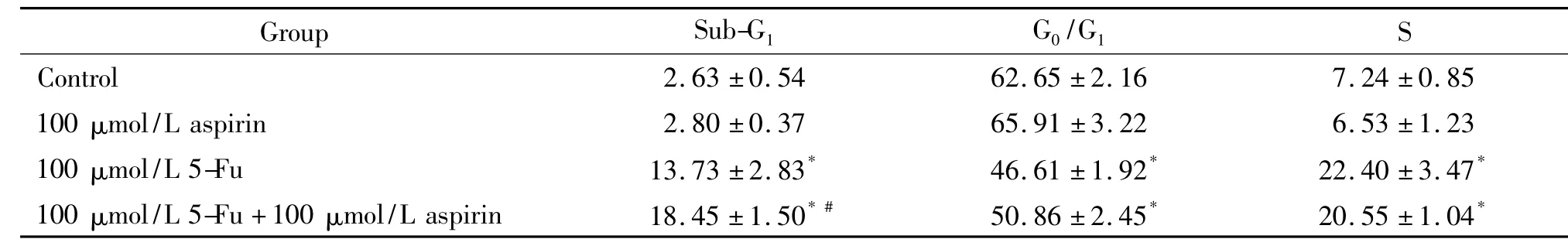
表3 5-Fu與阿司匹林對HCT116細胞周期的影響Table 3.Effects of 5-Fu and aspirin on cell cycle of HCT116 cells(%.Mean±SD.n=3)
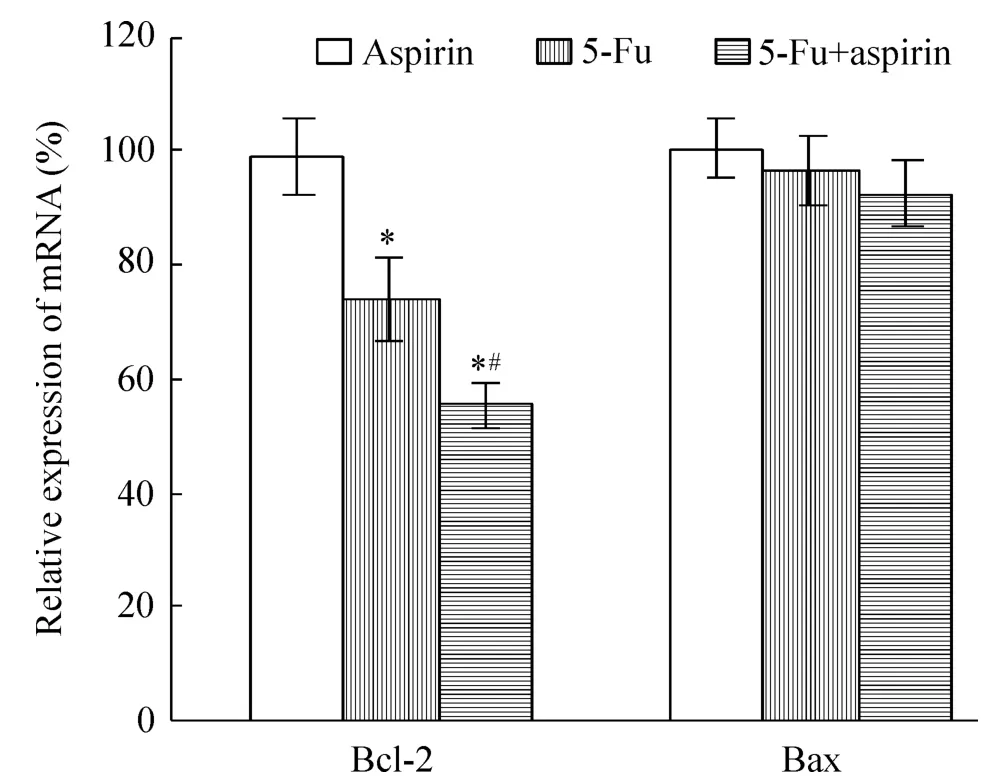
Figure 5.Relative mRNA expression levels of Bcl-2 and Bax in HCT116 cells after treatment with 100 μmol/L 5-Fu or 100 μmol/L aspirin for 48 h.Mean ±SD.n=3.*P <0.05 vs control group;#P<0.05 vs 5-Fu group.圖5 5-Fu與阿司匹林影響Bcl-2和Bax mRNA的表達
阿司匹林采用對細胞生長增殖幾乎沒有影響的濃度(100 μmol/L)與氟尿嘧啶協同應用,結果表明與單用氟尿嘧啶相比,抑制HCT116和SW620結腸癌細胞增殖的效果明顯增強,IC50顯著降低,且上述效果具有時間和濃度依賴性。Hoechst 33258染色及流式細胞術檢測發現100 μmol/L阿司匹林協同作用后,氟尿嘧啶可以誘發HCT116細胞產生更明顯的凋亡形態(細胞核皺縮、碎裂等)及細胞凋亡(sub-G1期)比例增加,越高濃度的氟尿嘧啶誘發凋亡的作用越明顯。另外,氟尿嘧啶是一種周期特異性藥物,可以將腫瘤細胞有效阻滯在S期[9]。阿司匹林也有報道較大濃度時誘導腫瘤細胞G0/G1期比例增高[10]。流式細胞術檢測結果發現氟尿嘧啶作用下,HCT116細胞的S期比例確有明顯提高。但低濃度阿司匹林協同作用對于S期及G0/G1期比例沒有明顯效果,即2種藥物協同殺傷HCT116細胞的主要作用機制在于誘發細胞凋亡,協同影響S期、G0/G1期效果甚微。
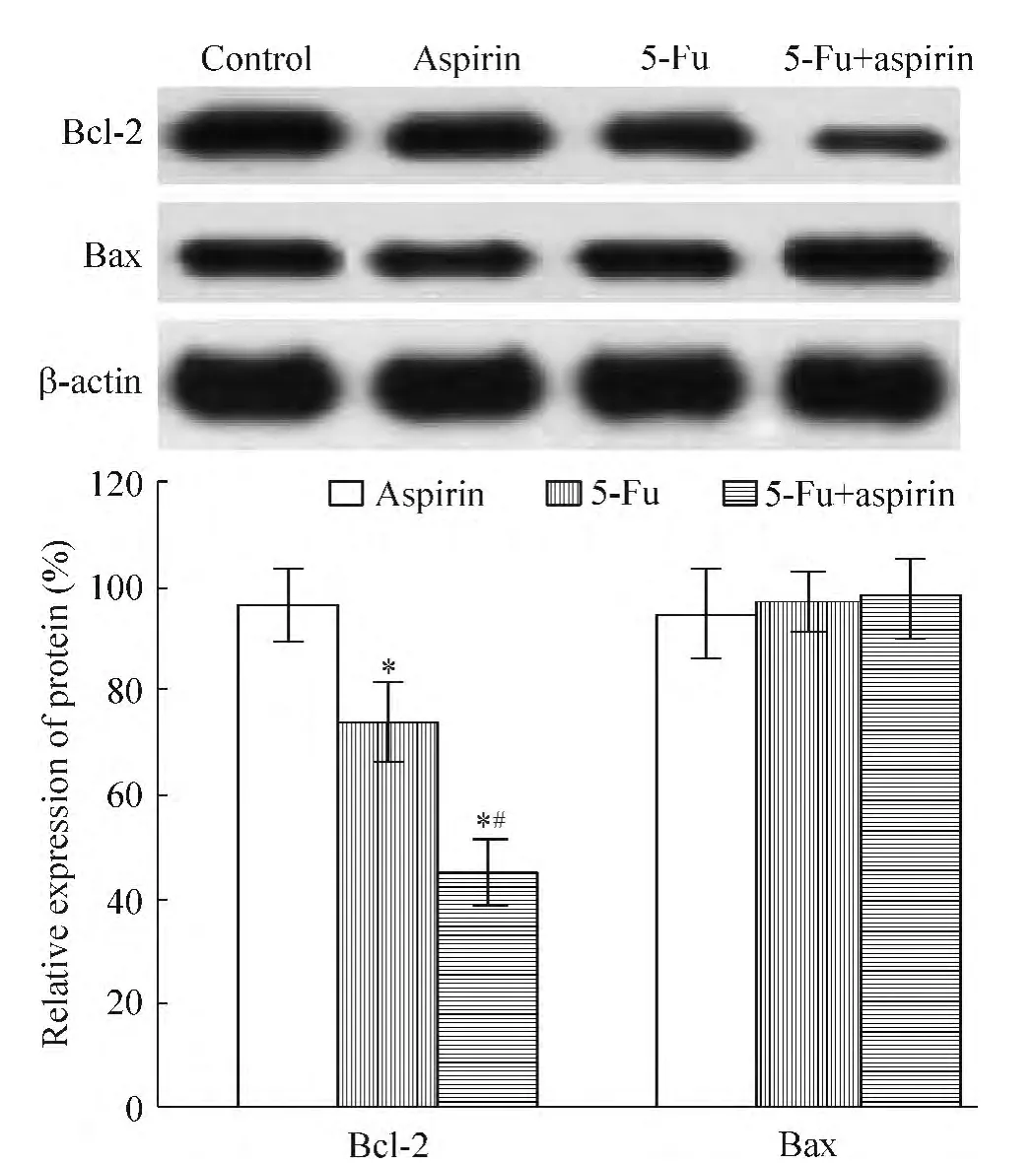
Figure 6.Relative protein expression levels of Bcl-2 and Bax in HCT116 cells after treatment with 100 μmol/L 5-Fu or 100 μmol/L aspirin for 48 h.Mean ± SD.n=3.*P<0.05 vs control group;#P<0.05 vs 5-Fu group.圖6 5-Fu與阿司匹林影響Bcl-2和Bax蛋白的表達
經典的細胞凋亡包括外源性途徑和內源性途徑兩種,外源性途徑(死亡受體途徑)caspase級聯反應包括上游凋亡啟動因子caspase-8和下游凋亡執行因子caspase-3,內源性途徑(線粒體途徑)則包括上游凋亡啟動因子caspase-9和下游凋亡執行因子caspase-3[11]。已有文獻表明氟尿嘧啶可以通過上述2種途徑誘發腫瘤細胞凋亡[12-13]。Caspase活性測試結果表明,單用氟尿嘧啶導致HCT116結腸癌細胞caspase-3、-8、-9 激活,協同應用 100 μmol/L 阿司匹林后caspase-3、-8、-9活性更為提高,且此種激活能力具有濃度依賴性。Bcl-2蛋白家族是調控細胞凋亡的主要因素之一,包括以Bcl-2為代表的抗凋亡蛋白和以Bax為代表的促凋亡蛋白。Bax主要負責在線粒體的外膜上形成通透性轉運孔道,使細胞色素C等物質進入細胞質并引發凋亡,Bcl-2則可以結合并抑制促凋亡蛋白,使凋亡不會發生[14]。Real-time PCR及Western blotting檢測證明氟尿嘧啶抑制抗凋亡bcl-2基因的轉錄及翻譯,進而誘導HCT116細胞發生凋亡,且阿司匹林具有協同效果,但藥物對于促凋亡bax基因則影響微弱。
上述實驗表明在無明顯細胞毒性的低濃度阿司匹林作用下,氟尿嘧啶誘發結腸癌細胞凋亡的作用顯著增強,且外源性及內源性凋亡途徑均發揮效果。兩藥合用的抗腫瘤效果與抑制Bcl-2表達呈正相關,但與Bax表達無明顯關系。總之,氟尿嘧啶和阿司匹林可以通過誘發細胞凋亡途徑,協同發揮抑制結腸癌細胞生長增殖的效果。
[1] Chue AL,Fernando IN,Hussain SA,et al.Chemotherapy related encephalopathy in a patient with Stage IV cervical carcinoma treated with cisplatin and 5-fluorouracil:a case report[J].Cases J,2009,2:8526.
[2] Lee HJ,Kim HS,Park NH,et al.Feasibility of oxaliplatin,leucovorin,and 5-fluorouracil(FOLFOX-4)chemotherapy in heavily pretreated patients with recurrent epithelial ovarian cancer[J].Cancer Res Treat,2013,45(1):40-47.
[3] Sutcliffe P,Connock M,Gurung T,et al.Aspirin for prophylactic use in the primary prevention of cardiovascular disease and cancer:a systematic review and overview of reviews[J].Health Technol Assess,2013,17(43):1-253.
[4] Pathi S,Jutooru I,Chadalapaka G,et al.Aspirin inhibits colon cancer cell and tumor growth and downregulates specificity protein(Sp)transcription factors[J].PLoS One,2012,7(10):e48208.
[5] Wyatt MD,Wilson DM 3rd.Participation of DNA repair in the response to 5-fluorouracil[J].Cell Mol Life Sci,2009,66(5):788-799.
[6] Jana NR.NSAIDs and apoptosis[J].Cell Mol Life Sci,2008,65(9):1295-1301.
[7] Raza H,John A,Benedict S.Acetylsalicylic acid-induced oxidative stress,cell cycle arrest,apoptosis and mitochondrial dysfunction in human hepatoma HepG2 cells[J].Eur J Pharmacol,2011,668(1-2):15-24.
[8] Ashktorab H,Dawkins FW,Mohamed R,et al.Apoptosis induced by aspirin and 5-fluorouracil in human colonic adenocarcinoma cells[J].Dig Dis Sci,2005,50(6):1025-1032.
[9] 朱玉萍,何 超,朱洪波,等.結腸癌細胞獲得性5氟尿嘧啶耐藥的機制研究[J].中國病理生理雜志,2007,23(10):2007-2011.
[10]李 盛,嚴 浩,黃志琨.阿司匹林誘導人宮頸癌He-La細胞凋亡及機制[J].中國醫院藥學雜志,2012,32(9):675-678.
[11] Xu G,Shi Y.Apoptosis signaling pathways and lymphocyte homeostasis[J].Cell Res,2007,17(9):759-771.
[12] Can G,Akpinar B,Baran Y,et al.5-Fluorouracil signaling through a calcium-calmodulin-dependent pathway is required for p53 activation and apoptosis in colon carcinoma cells[J].Oncogene,2013,32(38):4529-4538.
[13]Lei X,Lv X,Liu M,et al.Thymoquinone inhibits growth and augments 5-fluorouracil-induced apoptosis in gastric cancer cells both in vitro and in vivo[J].Biochem Biophys Res Commun,2012,417(2):864-868.
[14] Shamas-Din A,Kale J,Leber B,et al.Mechanisms of action of Bcl-2 family proteins[J].Cold Spring Harb Perspect Biol,2013,5(4):a008714.

