蓽茇明堿對人乳腺癌MDA-MB-231細胞放射增敏作用
姚建新, 姚志峰, 李占峰, 劉永彪
蓽茇明堿(piplartine)又稱蓽茇酰胺(piperlongumine),化學名為 5,6 二氫-1-[1-氧代-3-(3,4,5-三甲氧基苯基)-2-丙烯基]-2(1H)吡啶酮,具有諸如鎮痛、鎮靜、抗炎、抗血小板凝集、抗真菌、抗血吸蟲、抗焦慮以及抗抑郁等多種藥理活性[1]。研究發現,蓽茇明堿可顯著抑制乳腺癌[2]、前列腺癌[3]、白血病細胞[4]等多種實體瘤和 血 液 系 統 腫 瘤的生長增殖,誘導腫瘤細胞的凋亡[4-5],并能干擾細胞周期進程[3,5],而腫瘤細胞的放射敏感性與細胞凋亡以及細胞在增殖周期各時相的分布密切相關。本研究選擇三陰性乳腺癌MDA-MB-231細胞為研究對象,觀察蓽茇明堿對該細胞放射敏感性的影響并探討可能機制,從而為今后臨床能使用蓽茇明堿作為放射增敏劑提供依據。
1 材料與方法
1.1 材料
1.1.1 細胞株 人乳腺癌細胞株MDA-MB-231購自中國科學院上海細胞生物研究所細胞庫。采用含10%胎牛血清的高糖DMEM完全培養液 (內含青-鏈霉素100 u/ml),置于含5%CO2、37℃恒溫培養箱中培養,為單層貼壁生長。每2~3 d傳代1次,取對數生長期細胞進行實驗。
1.1.2 藥物 蓽茇明堿由華東師范大學余家會課題組合成,用二甲基亞砜(DMSO)配成5 mmol/L的儲備液,過濾除菌,置于-20℃冰箱保存,使用時DMSO稀釋至<0.1%。
1.1.3 試劑及儀器 高糖DMEM培養基、0.25%胰酶、磷酸鹽緩沖液(PBS)、青-鏈霉素溶液為GIBCO公司產品;胎牛血清購于杭州四季青生物工程材料有限公司;DMSO、Annexin V-FITC/PI凋亡檢測試劑盒為南京凱基公司產品;β-action抗體、Bax抗體、Bcl-2抗體均購自美國Santa Cruz公司;辣根過氧化酶標記二抗購自北京中杉金橋生物技術有限公司;活性氧試劑盒為碧云天生物工程公司產品;Giemsa染液為南京建成生物工程研究所產品。余為國產分析純試劑。主要儀器有CO2培養箱(Heraeus公司)、流式細胞儀(FACScan,美國BD公司)和雙光子型醫用高能直線加速器(瑞典ELEKTA公司)。
1.2 方法
1.2.1 細胞照射 實驗分為單獨照射組和加藥照射組,均采用6 MV X線進行不同劑量照射,劑量率為 300 cGy/min,源皮距(source skin distance,SSD)為100 cm,照射野為15 cm×15 cm,照射時機架角轉至180°,培養皿下墊1.5 cm厚的組織補償膠,單獨照射組和聯合處理組 (蓽茇明堿聯合照射組)的吸收劑量均為6 Gy。
1.2.2 克隆形成試驗 觀察蓽茇明堿對MDA-MB-231細胞的放射增敏效應。取一定數量MDA-MB-231細胞置6 cm培養皿傳代,待細胞生長面積30%~40%時用于下一步試驗,每次試驗均取對數生長期細胞,以0.25%胰酶消化、離心并制成單細胞懸液。設立 3 個藥物濃度組(0、1、2.5 μmol/L),配置上述3種濃度的無血清培養液各100 ml,移走6 cm培養皿中的舊培養液;分為3個濃度組,每個培養皿加入5 ml培養液,放入培養箱中培養24 h;待蓽茇明堿作用于細胞24 h后,平均分組照射0、2、4、6和8 Gy的劑量。照射結束后,立即行細胞播種,根據不同的照射劑量接種不同數量的細胞,即按照200,500,1 000,2 000,4 000 個細胞對應 0、2、4、6和8 Gy照射劑量進行接種,每個劑量點設3個平行樣;各組細胞經上述處理后在37℃、含5%CO2培養箱靜止培養14 d;當培養皿中出現肉眼可見的克隆時,終止培養棄去培養基,用PBS漂洗后,無水乙醇固定15 min,棄固定液后Giemsa染液染色20 min,流水沖去染液,空氣干燥,顯微鏡下行克隆計數,計數≥50個細胞的克隆。試驗重復3次。按下列公式計算克隆形成率 (planting efficiency,PE)和細胞存活分數(survival fraction,SF)。 PE(%)= 克隆數/細胞接種數 ×100%,SF=照射各劑量點PE/0 Gy PE×100%。為扣除蓽茇明堿本身作用對試驗結果的影響,本試驗以單獨加藥組的SF為基準,對加藥照射組的SF進行校正從而得到蓽茇明堿的放射增敏作用。
按多靶單擊模型SF=1-(1-e-D/D0)N使用SPSS 17.0中的非線性回歸法擬合細胞存活曲線,計算單獨照射組和加藥照射組的D0和Dq值,并計算放射增敏比(SER)。SERD0=單獨照射組D0/加藥照射組D0;SERDq= 單獨照射組 Dq/加藥照射組 Dq;SERSF2=單獨照射組SF2/加藥照射組SF2。
1.2.3 FCM檢測細胞凋亡 實驗分組如下:①空白對照組,未作處理;② 單獨加藥組,加入1 μmol/L蓽茇明堿;③ 單獨照射組,照射劑量為6 Gy;④ 加藥照射組,在相同劑量的照射前加入等體積的1 μmol/L蓽茇明堿。將細胞接種于6孔板中,待細胞貼壁后進行上述處理后收集細胞,將細胞消化、懸浮,PBS洗滌離心,70%冷乙醇固定,-20℃保存過夜備用。重新收集細胞,取1×106個細胞,1 000 r/min,離心5 min,棄固定液,2 ml PBS懸浮細胞,400目篩網過濾 1 次,1 000 r/min,離心 5 min,棄去 PBS,經AnnexinV-FITC和PI雙染色,室溫避光染色30 min,FCM檢測細胞凋亡率,數據獲取用 CELLQuest軟件,試驗重復3次。
1.2.4 Western blot法檢測凋亡相關蛋白的表達 實驗分組如下:① 空白對照組,未作處理;② 單獨加藥組,加入濃度為2.5 μmol/L的蓽茇明堿;③ 單獨照射組,照射劑量為6 Gy;④ 加藥照射組,在相同劑量的照射前加入等體積的2.5 μmol/L蓽茇明堿。按上述分組處理后收集細胞,預冷的PBS洗2遍,離心。加適量預冷的細胞裂解液,置于冰上裂解30 min,12 000 r/min,4℃離心 20 min, 取上清液備用。按照Bradford蛋白濃度測定試劑盒測定蛋白,并調整各組蛋白質量濃度一致。蛋白提取物經定量后,各組取等量蛋白加入等量10%SDS-PAGE上樣緩沖液,并置95~100℃水中變性5 min,行SDSPAGE垂直電泳,電轉PVDF膜,麗春紅染色觀察轉膜情況。加5%脫脂奶粉于4℃冷庫封閉過夜,TBST洗膜1.5 h后加一抗Bcl-2,Bax鼠抗人單克隆抗體,內參照β-actin羊抗鼠單克隆抗體 (均為1∶1 000稀釋),過夜孵育(37℃孵育),TBST洗膜1.5 h后加辣根過氧化物酶(HRP)標記羊抗鼠IgG二抗,37℃孵育1 h,TBST洗膜 40 min后,ECL試劑顯色、曝光,并翻拍成照片。
1.2.5 FCM檢測細胞活性氧水平 2′,7′-二氯熒光黃 雙 乙 酸 鹽 (2′,7′-dichlorofluorescin diacetate,DCFH-DA)是非標記性的氧化敏感的熒光探針,可了解細胞內活性氧的水平。將對數生長期細胞接種于6孔培養板,生長至90%融合時,按1.2.3要求進行分組處理后吸出6孔板中的培養液,用PBS洗滌3次,收集1×106個經上述處理的細胞,用無血清培養基清洗3次。將上述細胞重懸于DCFH-DA(終濃度為 10 μmol/L)1 ml探針中,37℃避光孵育20 min后吸去染液,用不含EDTA的胰酶消化,PBS洗滌3次,300網過濾后,上FCM測定細胞內DCF的熒光強度,以488 nm為激發波長,525 nm為發射波長。以上試驗重復3次。
1.3 統計學方法
采用SPSS17.0統計軟件包對試驗數據進行t檢驗和單因素方差分析,所有數據均以s表示,檢驗水準α=0.05。
2 結果
2.1 細胞存活分數
按實驗分組要求處理各組細胞,扣除藥物本身作用對試驗結果的影響,相同照射劑量的加藥照射組SF均比單獨照射組低,兩組的SF差異有統計學意義(P<0.05)。根據多靶單擊模型擬合的細胞存活曲線見圖1,表1示隨著蓽茇明堿濃度增加,D0、Dq和SF2均逐漸減小。
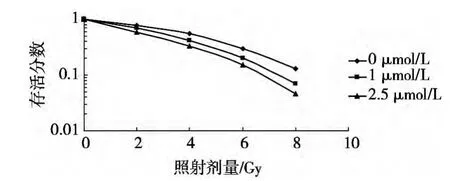
圖1 不同濃度蓽茇明堿聯合X射線照射后多靶單擊模型擬合的細胞存活曲線
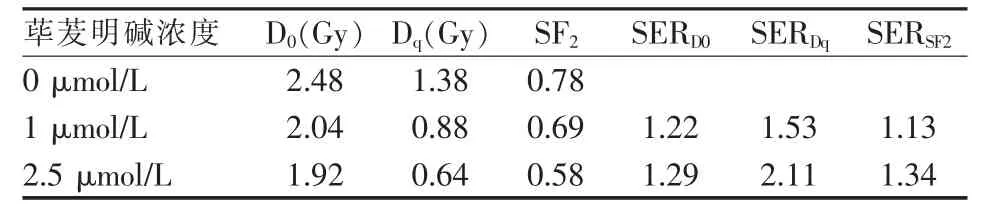
表1 不同濃度蓽茇明堿聯合X射線照射后多靶單擊模型擬合細胞存活曲線放射生物學參數
2.2 蓽茇明堿聯合X射線照射對細胞凋亡的影響
經1 μmol/L蓽茇明堿處理后的細胞凋亡率為(7.5±0.60)%,經6 Gy X射線單獨照射后的細胞凋亡率為(5.8±1.65)%,當1 μmol/L蓽茇明堿和X線共同處理MDA-MB-231細胞后48 h,細胞凋亡率為(34.6±2.05)%,較蓽茇明堿組以及單獨X線照射組均有明顯增高,且高于兩者引起的凋亡率之和,與單獨照射組相比,差異有統計學意義 (P<0.05),表2、圖2、3。
表2 不同處理因素對MDA-MB-231細胞凋亡的影響

表2 不同處理因素對MDA-MB-231細胞凋亡的影響
注:與單獨加藥組相比,aP<0.05;與單獨照射組細胞,bP<0.05
組別 壞死細胞(Q1) 早期凋亡(Q2)正常細胞(Q3) 晚期凋亡(Q4)對照組 0.45±0.01 0.85±0.03 97.65±2.55 1.05±0.02單獨加藥組 1.55±0.05 4.50±0.35 90.95±3.42 3.00±0.46單獨照射組 0.98±0.06 3.20±0.65 93.30±1.48 2.60±0.48加藥照射組 2.58±0.08 18.40±1.05ab62.82±2.45 16.20±2.45ab
2.3 蓽茇明堿聯合X射線對細胞凋亡相關蛋白表達的影響
與對照組細胞相比,單獨照射組和單獨加藥組細胞的Bcl-2蛋白表達均有下降,Bax蛋白表達均有增加,Bcl-2與Bax的灰度比值均降低(P<0.05);蓽茇明堿單獨處理組細胞與單獨照射組細胞的Bcl-2蛋白和Bax蛋白表達沒有明顯差異(P>0.05);而與對照組細胞和單獨照射組細胞相比,蓽茇明堿和X射線照射聯合處理組細胞的Bcl-2蛋白表達有明顯的下降,Bax蛋白的表達有明顯的上升,Bcl-2與Bax的灰度比值均降低(P < 0.05),圖 4、表 3。
圖2 各組細胞的凋亡情況±s,n=3)
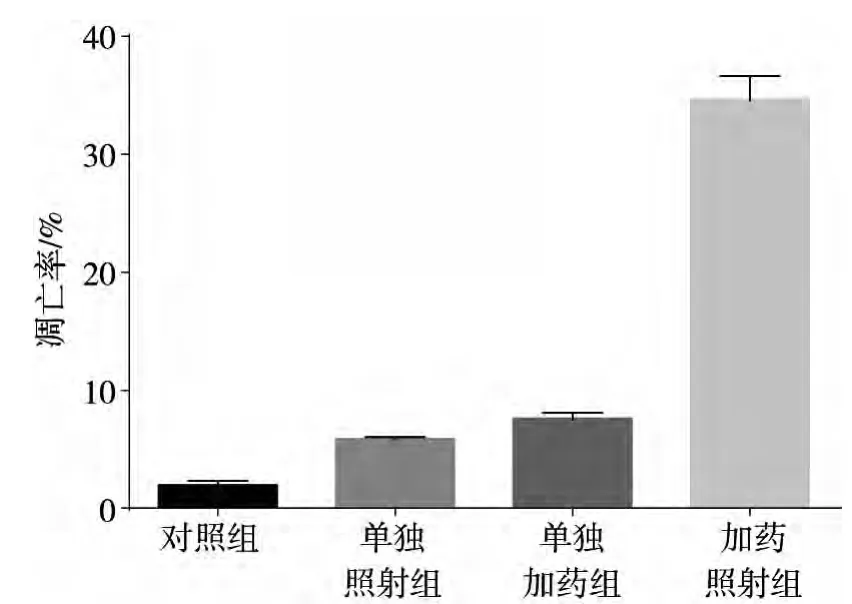
圖3 各處理組細胞凋亡率

圖4 各處理組凋亡相關蛋白的表達
表3 不同處理組凋亡相關蛋白Bcl-2、Bax的表達(n=3,

表3 不同處理組凋亡相關蛋白Bcl-2、Bax的表達(n=3,
注:與對照組相比,aP<0.05;與單獨照射組相比,bP<0.05;與單獨加藥組相比,cP<0.05
組別 Bcl-2 Bax Bcl-2/Bax對照組 1.55±0.09 0.42±0.02 3.69±0.15單獨照射組 1.43±0.02a 0.74±0.1a 1.93±0.27a單獨加藥組 1.19±0.03ab 0.82±0.07ab 1.45±0.05ab加藥照射組 0.72±0.08abc 0.48±0.05abc 0.49±0.07abc
2.4 蓽茇明堿聯合X射線對細胞活性氧水平的影響
裝載探針的各組細胞均檢測到熒光,與對照組相比,單獨加藥組(1 μmol/L)與單獨照射組(6 Gy)細胞的熒光強度的差異無統計學意義 (P>0.05),而加藥照射組細胞的平均熒光強度與其他各組相比均顯著提高(P<0.05),圖 5。
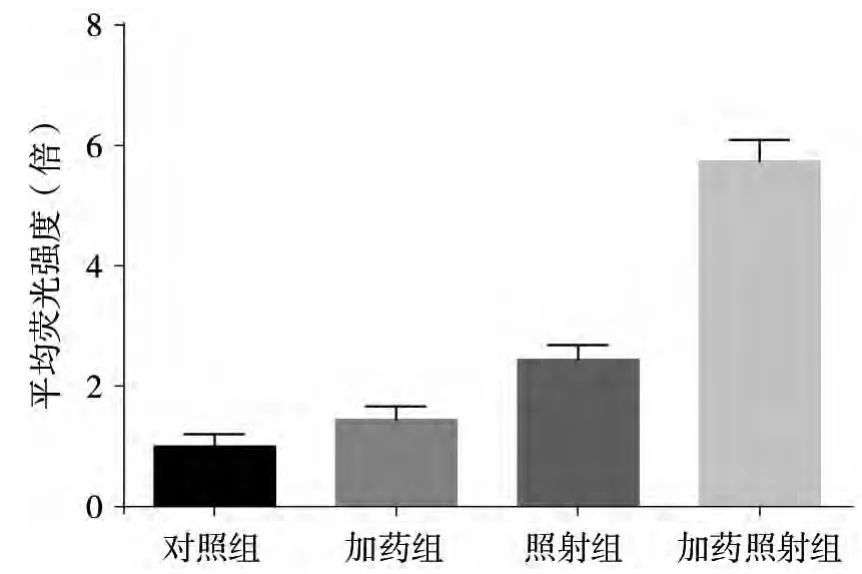
圖5 各處理組細胞活性氧水平
3 討論
三陰性乳腺癌(TNBC)是指雌激素受體(ER)、孕激素受體(PR)和人表皮生長因子受體2(HER-2)均為陰性的一種特殊類型乳腺癌,其對內分泌治療和分子靶向藥物曲妥珠單抗均無效[6]。由于TNBC細胞含有突變型p53(mtp53),該型乳腺癌對臨床放療的敏感性較其他類型差[7]。
蓽茇明堿對多種腫瘤細胞具有特異性的細胞毒作用,誘導腫瘤細胞凋亡,而對正常細胞沒有明顯毒性作用[8-9]。蓽茇明堿在體外能抑制MDA-MB-231細胞的增殖,且呈現一定的濃度、時間依賴關系[2]。DNA是X線殺傷腫瘤細胞的主要靶點,因此基于靶學說的多靶單擊模型SF=1-(1-e-D/D0)N在放射生物學領域被廣泛用于衡量細胞的放射敏感性[10]。 本研究結果表明,加藥照射組 D0、Dq和 SF2較單獨照射組均降低(P<0.05,表 1),D0減小,意味著在相對高劑量區,蓽茇明堿增加了細胞的放射敏感性,Dq值減小,意味著在很小劑量的照射就可使細胞進入致死性損傷的指數性存活曲線部分。本實驗中,1 μmol/L及 2.5 μmol/L的蓽茇明堿放射增敏比(SERD0)分別為 1.22 和 1.29。
研究發現,腫瘤受電離輻射后,凋亡反應的增加與放射敏感性的提高成正相關[11]。本研究結果表明,單獨蓽茇明堿預處理并沒有提高細胞的凋亡率,而聯合X線照射后,則明顯增加了照射引起的晚期凋亡和早期凋亡。由此可見,低細胞毒濃度的蓽茇明堿雖然本身不誘導MDA-MB-231細胞的凋亡,但可能通過影響凋亡相關的調控途徑來增加放射線誘導的細胞凋亡。
在細胞凋亡的調控基因中,Bcl-2家族是目前發現的與凋亡關系密切的原癌基因之一[12]。Kong等[3]研究證實了蓽茇明堿能促進前列腺癌細胞的凋亡,進一步研究發現蓽茇明堿未明顯改變Bax的表達,但使Bcl-2表達下降,Bax/Bcl-2比值下降。本研究結果發現,蓽茇明堿和X線照射聯合處理組Bax表達水平明顯高于對照組和單獨處理組,而Bcl-2的表達明顯低于對照組和單獨處理組,Bax/Bcl-2增加,而腫瘤細胞Bax/Bcl-2的表達程度與其放射敏感性呈正相關,說明了蓽茇明堿可能是通過調節Bcl-2家族蛋白的表達表現出放射增敏效應的。
有研究提示氧化應激是一種普遍的細胞凋亡調控因子,其參與了細胞凋亡的過程,并起了關鍵作用。為了減少有氧代謝過程中活性氧(ROS)對細胞的損害,正常細胞自身具有一系列有效的抗氧化防御系統,是機體參與消除氧自由基的主要生物分子,能夠通過不斷清除細胞代謝過程中產生的ROS,維持細胞內氧化還原水平動態平衡,被認為是腫瘤抗輻射的物質基礎。
在蓽茇明堿誘導MDA-MB-231細胞凋亡的過程中,ROS水平升高,并與濃度呈正相關[2]。本實驗結果證實蓽茇明堿可通過提高射線照射后MDAMB-231細胞內ROS的水平發揮增敏作用。有研究證實,Bcl-2能抗過氧化反應保護脂質膜、保持細胞的氧化還原狀態[13]。因此提出Bcl-2是一種抗氧化劑,可通過抗氧化劑的作用或通過抑制氧自由基的產生而抑制細胞死亡的觀點。本研究表明,蓽茇明堿聯合X線照射明顯降低Bcl-2的表達的同時,也明顯增加胞內ROS水平,從而明顯增加細胞凋亡。我們推測,活性氧應激途徑與細胞凋亡調控途徑似乎存在某種內在聯系,這或許正是值得進一步研究之處。
[1] 張 鵬,黃啟來,華子春.蓽茇酰胺的藥理作用研究進展[J].中草藥,2012,43:201-204.
[2] Yao ZF, Yao JX, He X, etal.Experimentalstudy of piperlongumine inducing apoptosis of human breast adenoma MDA-MB-231 cells [J].Chinese-German J Clin Oncol, 2013,12:319-325.
[3] Kong EH, Kim YJ, Kim YJ, et al.Piplartine induces caspasemediated apoptosis in PC-3 human prostate Cancer cells[J].Oncol Rep,2008,20:785-792.
[4] Bezerra DP,Militao GC,de Castro FO,et al.Piplartine induces inhibition of leukemia cell proliferation triggering both apoptosis and necrosis pathways[J].Toxicol In Vitro, 2007, 21: 1-8.
[5] Jyothi D,Vanathi P,Mangala Gowri P,et al.Diferuloylmethane augments the cytotoxic effects of piplartine isolated from Piper chaba[J].Toxicol In Vitro, 2009, 23: 1085-1091.
[6] Bauer KR,Brown M,Cress RD,et al.Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast Cancer, the socalled triple-negative phenotype:a population-based study from the California Cancer Registry [J].Cancer, 2007, 109: 1721-1728.
[7] Dent R,Trudeau M,Pritchard KI,et al.Triple-negative breast Cancer: clinical features and patterns of recurrence [J].Clin Cancer Res, 2007, 13: 4429-4434.
[8] Raj L,Ide T,Gurkar AU,et al.Selective killing of Cancer cells by a small molecule targeting the stress response to ROS [J].Nature, 2011, 475: 231-234.
[9] 姚志峰,姚建新,劉永彪.蓽茇明堿抗腫瘤作用及其機制[J].國際腫瘤學雜志,2013,40:259-263.
[10]何信佳,宮文靜,安永恒.塞來昔布對胃癌SGC7901細胞放射敏感性的實驗研究 [J].中華腫瘤防治雜志,2011,18:260-263.
[11] Meyn RE, Stephens LC, Ang KK, et al.Heterogeneity in the development of apoptosis in irradiated routine tumors of different histologies[J].Int J Radiat Biol Phys, 1993: 583.
[12] Tsukahara S, Yamamoto S, Ahmed S, et al.Inhalation of lowlevel formaldehyde increases the Bcl-2/Bax expression ratio in the hippocampus ofimmunologically sensitized mice [J].Neuroimmunomodulation,2006,13:63-68.
[13] Métrailler-Ruchonnet I, Pagano A, Carnesecchi S, et al.Bcl-2 protects against hyperoxia-induced apoptosis through inhibition of the mitochondria-dependent pathway[J].Free Radic Biol Med,2007,42:1062-1074.

