含笑內酯對類風濕關節炎小鼠模型治療作用研究
許 華 王 建 王遲鵑 張麗媛 常國強 藺亞妮 張洪菊 張玉娟 張海瑞李慶華 龐天翔
1.中國醫學科學院 北京協和醫學院血液學研究所 血液病醫院 實驗血液學國家重點實驗室,天津 300020;2.天津市第四中心醫院急診科,天津 300140
類風濕性關節炎(rheumatoid arthritis,RA)是一種全身性自身免疫性疾病,主要表現為慢性、對稱性、進行性多關節炎[1]。類風濕性關節炎以關節滑膜炎為特征,反復持久發作,可導致關節內軟骨和骨破壞,關節功能障礙,甚至殘廢。類風濕性關節炎發病呈全球性分布,我國的發病率為0.32%~0.36%[2]。目前副作用較小的治療類風濕關節炎的藥物不多,相關藥物還有待于進一步研究。
含笑內酯(micheliolide,MCL)是近幾年研究者從70多種藥物中篩選出來的一種小分子化合物,其主要成分為倍半萜內酯[3],它可以用小白菊內酯為原料,在一定的溶劑和溫度下反應得到[4]。含笑內酯衍生于小白菊內酯,其活性與小白菊內酯相當,但它在血漿中穩定性比小白菊內酯高,成本比小白菊內酯低[5],因此更適于作為臨床藥物研究。在此次研究中,筆者構建了類風濕關節炎DBA/1小鼠模型,并用MCL和MTX來治療小鼠,從而探究MCL對類風濕關節炎的治療效果是否可靠。同時應用蛋白芯片,檢測MTX治療后小鼠血清中細胞因子的變化。現報道如下:
1 材料與方法
1.1 實驗材料
DBA/1小鼠購自北京華阜康生物科技股份有限公司;牛Ⅱ型膠原、費氏完全佐劑、費氏不完全佐劑購自chondrex公司;MCL由南開大學藥學院陳悅教授提供;甲氨蝶呤(Methotrexate,MTX)注射液購自山西普德藥業股份有限公司,DMSO購自天津市風船化學試劑科技有限公司,小鼠細胞因子檢測試劑盒購自R&D公司。
1.2 構建類風濕關節炎DBA/1小鼠模型
訂購 40只 SPF級 DBA/1小鼠,6周齡,雄性;SPF級飼養1周,讓小鼠熟悉環境,對小鼠進行編號并隨機分為四組:空白對照組(Nor組)、模型對照組(Con組)、甲氨蝶呤治療組(MTX組)和實驗組(MCL組),每組10只。其中Nor組小鼠不作任何處理,對其他三組小鼠進行造模:將2 mg/mL牛Ⅱ型膠原與1 mg/mL費氏完全佐劑等體積混合乳化,使得牛Ⅱ型膠原終濃度為1 mg/mL。對7周齡小鼠進行初次免疫,每只小鼠尾根部皮下注射100 μL牛Ⅱ型膠原的費氏完全佐劑混合液,并記為造模第0天;在造模第21天,將100 μL含100 μg牛Ⅱ型膠原的費氏不完全試劑混合液注入小鼠尾根部皮下,進行加強免疫[2,6-7]。
1.3 給藥觀察
造模第22天開始對三組造模小鼠進行腹腔注射給藥,根據前期預實驗的結果確定MCL組給予溶解于 DMSO的 MCL藥物濃度為30 mg/kg,MTX組給予溶于生理鹽水的MTX的濃度為6.6 mg/kg[8],Con組注射等量的溶劑DMSO,隔天給藥,給藥28 d。造模第23天開始隔天對小鼠進行體重檢測和關節炎癥狀評價。其中關節炎癥狀評價包括前后抓足掌厚度測定和關節炎評分兩方面。關節炎評分標準:正常為0分;輕微的但有明確的發紅和腕關節或踝關節發炎為1分;中等程度的發紅和腕關節或踝關節發炎為2分;整個爪子包括腳趾嚴重的發紅發炎記為3分;涉及多關節,四肢的最大程度的紅腫、關節變形、功能損傷為4分。四只爪子得分相加為小鼠關節炎總評分[9]。
1.4 眼球取血分離血清
給藥停止后繼續隔日觀察8 d,對小鼠進行摘除眼球采血,分離血清并保存于-20℃。
1.5 制備病理標本
解剖小鼠,取爪子、膝蓋,剔除結締組織、肌肉組織,浸泡在4%甲醛溶液中進行組織固定,石蠟包埋,切片,HE染色,封片,病理分析,選取爪關節、膝關節進行半定量評分。每個關節的半定量評分標準為:0分:關節具有正常的結構,如關節間隙、軟骨、骨以及滑膜組織等;1分:關節組織中有纖毛形成和輕度的關節炎癥并有滑膜增生,血管數量增加,以及小的炎癥細胞灶,無軟骨和骨的侵蝕破壞;2分:關節有軟骨的侵蝕破壞,中度的關節炎癥,大量的炎癥細胞浸潤,滑膜細胞增生、血管翳形成較嚴重,骨和關節結構無破壞;3分:有嚴重的血管翳形成,廣泛的軟骨侵蝕破壞,可見骨破壞,關節結構破壞[10-11]。
1.6 血清內細胞因子檢測
取硝酸纖維素膜浸泡,水平振蕩封閉1 h;取1 mL樣品混勻,每個樣品管內加15 μL檢測抗體混合液并在室溫下孵育1 h;將硝酸纖維素膜浸泡在樣品與抗體混合液中4℃孵育過夜,漂洗3次,室溫下二抗孵育30 min,漂洗3次,化學發光法顯色,凝膠成像儀對結果掃描。根據說明書用photoshop圖像分析軟件計算平均像素值,三組模型組的平均像素值與Nor組進行比值分析作為細胞因子的表達量值,每個樣本至少重復3次。
1.7 統計學方法
采用統計軟件GraphPad Prism 5對實驗數據進行分析,計量資料數據以均數±標準差(±s)表示,采用t檢驗。計數資料以率表示,采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 類風濕關節炎DBA/1小鼠模型的構建
實驗中對DBA/1小鼠進行造模實驗,小鼠均在造模第29天開始相繼發病,造模成功率為93%。
2.2 DBA/1小鼠體重檢測
通過對四組小鼠體重情況的檢測發現,各組小鼠的體重之間均未見明顯差異且隨著實驗的進行,單只小鼠的體重也未見明顯變化。且未發現MCT對DBA/1小鼠的毒性作用和生活狀態的不良影響。見表1。
表1 體重檢測結果(g,±s,n=10)
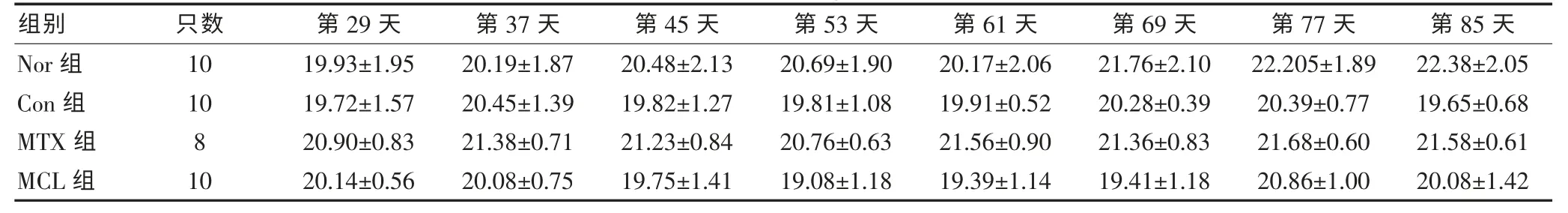
表1 體重檢測結果(g,±s,n=10)
組別 只數 第29天 第37天 第45天 第53天 第61天 第69天 第77天 第85天Nor組1019.93±1.9520.19±1.8720.48±2.1320.69±1.9020.17±2.0621.76±2.1022.205±1.8922.38±2.05 Con組1019.72±1.5720.45±1.3919.82±1.2719.81±1.0819.91±0.5220.28±0.3920.39±0.7719.65±0.68 MTX組820.90±0.8321.38±0.7121.23±0.8420.76±0.6321.56±0.9021.36±0.8321.68±0.6021.58±0.61 MCL組1020.14±0.5620.08±0.7519.75±1.4119.08±1.1819.39±1.1419.41±1.1820.86±1.0020.08±1.42
2.3 DBA/1關節炎評價檢測
通過對三組造模小鼠的足掌厚度變化和關節炎評分的觀察顯示,小鼠大多在造模第29天開始發病,紅腫癥狀多見于后肢趾間關節、踝關節并累及前肢,其中MTX組關節炎評價得分在三組中最低,Con組的得分最高,MCL組的得分處于中間位置。結果表明MCL對類風濕關節炎有一定的治療作用。見表2、3。
表2 足掌厚度檢測結果(cm,±s,n=10)

表2 足掌厚度檢測結果(cm,±s,n=10)
組別 只數 第29天 第37天 第45天 第53天 第61天 第69天 第77天 第85天Nor組100.408±0.0230.398±0.0140.398±0.0310.393±0.0120.404±0.0200.407±0.0220.407±0.0220.409±0.021 Con組100.401±0.0140.431±0.0270.490±0.0360.507±0.0680.556±0.0690.595±0.0850.630±0.0950.681±0.102 MTX組80.400±0.0270.400±0.0270.436±0.0180.477±0.0690.503±0.1040.510±0.1050.541±0.1250.566±0.141 MCL組100.397±0.0280.497±0.0220.442±0.0210.455±0.3220.477±0.0200.503±0.0300.548±0.0580.560±0.073 P值 <0.01<0.01<0.01<0.01<0.01<0.01<0.01<0.01
表3 關節炎評分結果(分,±s,n=10)

表3 關節炎評分結果(分,±s,n=10)
組別 只數 第29天 第37天 第45天 第53天 第61天 第69天 第77天 第85天Nor組1000000000 Con組1002.00±1.554.50±1.055.00±2.005.83±2.406.67±2.338.00±3.1010.17±2.91 MTX組8002.17±1.332.83±1.404.00±1.894.33±1.095.67±1.106.17±1.72 MCL組1002.50±2.073.83±1.174.17±0.755.17±1.176.33±0.827.67±1.038.33±1.86 P值 >0.05>0.05<0.01<0.01<0.01<0.01<0.01
2.4 病理分析結果
對四組小鼠的爪子,膝蓋進行石蠟包埋,HE染色處理后觀察到Nor組未見明顯變化;Con組的切片顯示滑膜細胞增生明顯,呈多層細胞,排列紊亂,炎癥細胞浸潤(圖1D),有炎性肉芽組織形成,纖維母細胞、毛細血管增生(圖1E),纖維組織增生與關節軟骨粘連,關節周圍組織大量炎癥細胞浸潤,有的小鼠關節腔內有壞死組織出現(圖1F),病理評分結果為(4.25±0.25)分;NTX治療的MTX組病理結果為關節滑膜炎癥細胞浸潤,纖維組織增生(圖1G),關節周圍組織炎癥細胞浸潤(圖1H),關節腔內炎癥細胞及變性組織(圖1I),病理評分結果為(1.75±0.50)分;而含笑內酯治療的MCL組小鼠結果顯示與MTX組結果類似為關節腔內炎癥細胞和變性組織(圖1J),關節軟骨未見明顯改變,滑膜細胞增生、腫脹,滑膜炎癥細胞浸潤(圖1K),關節周圍組織炎癥細胞浸潤(圖1L),病理評分結果為(2.00±0.81)分。Con組、MTX 組與 MCL 組三組之間兩兩比較,差異均有統計學意義(P<0.05)。
2.5 血清內細胞因子檢測結果
四組小鼠血清中檢測出C5/C5a、基質金屬蛋白酶抑制因子(TIMP-1)、巨噬細胞集落刺激因子(M-CSF)、可溶性細胞黏附因子(sICAM-1)、干擾素-γ(IFN-γ)和B細胞趨化因子(BLC)等6種細胞因子。C5/C5a和M-CSF在Con組的表達量最低,在MTX組的表達量最高而在MCL組中的表達量則處于Con組和MTX組之間;TIMP-1在MCL組和MTX組的表達量均比Con組高與Nor組水平相當略偏高;sICAM-1結果為MCL組最低;IFN-γ只在Nor組有顯示、BLC只顯示在MCL組,該兩種細胞因子未標注在定量分析圖上。四組小 鼠 血 清 中 檢 測 出 C5/C5a、TIMP-1、M-CSF、sICAM-1、IFN-γ 和 BLC等細胞因子,依次編號為 1~6。MCL組與Con組比較C5/C5a表達量增高(P<0.01);MCL組與MTX組比較,C5/C5a表達量也增高(P<0.01);MCL組和MTX組與 Con組比較,TIMP-1表達量均增高(P<0.01);MCL組與 MTX組比較 M-CSF表達量較低 (P<0.01);MCL組與Con組比較,M-CSF表達量增高(P<0.01);sICAM-1在MCL組中表達量最低,MCL組與MTX組比較,sICAM-1表達量降低(P<0.01);MCL組與Con組比較,sICAM-1表達量降低(P<0.01);IFN-γ只在 Nor組有表達;BLC只表達于 MCL組。結果見表3、圖2。

圖1 關節組織HE染色結果
表3 細胞因子檢測結果像素分析值(±s)

表3 細胞因子檢測結果像素分析值(±s)
注:依據芯片說明書將Nor組的細胞因子像素值視為1,表中結果為其他各組的相應細胞因子像素值與Nor組做比值分析所得;與Con組比較,△△P<0.01;與 MTX 組比較,**P< 0.01
組別 C5/C5a TIMP-1 M-CSF sICAM-1 Nor組1111 Con組0.560±0.6860.884±0.1070.529±0.7000.636±0.100 MTX組0.684±0.153△△1.234±0.266△△0.602±0.100△△0.652±0.100 MCL組0.709±0.115**△△0.943±0.173**△△0.598±0.231**△△0.450±0.073

圖2 細胞因子檢測結果
3 討論
類風濕關節炎是一種全身性慢性侵蝕性關節炎為特征的自身免疫病[12],病變特點為滑膜炎,以及由此造成的關節軟骨和骨質破壞,最終導致關節畸形。該病分布于世界各地,未經正規治療,約75%的患者會在3年之內致殘。類風濕關節炎的治療方法有理療、藥物治療、外科手術等。其中藥物治療又包含非甾體抗炎藥、慢性抗風濕藥、促腎上腺皮質激素、生物制劑和中草藥等多種藥物,然而目前為止,還沒有哪種藥物不但可以很好的治療類風濕關節炎而且還具有很小的毒副作用[13]。
MCL是新近研究出的小分子化合物。在此次實驗中,筆者通過建立類風濕關節炎DBA/1小鼠模型,探究了MCL對類風濕關節炎的治療作用。通過對四組小鼠的體重檢測、關節炎評價、病理切片觀察以及血清內細胞因子檢測,得知在整個實驗過程中,小鼠的體重并未受到藥物治療的影響,表明MCL沒有干擾小鼠的正常生活狀態。關節炎評價中足掌厚度結果、關節炎評分結果均與病理切片評分結果一致,均顯示為MCL組小鼠整體得分低于Con組,處于MTX組和Con組之間,此結果證明MCL在治療類風濕關節炎方面確實有一定的療效。在小鼠血清細胞因子檢測結果中,C5/C5a在 Nor組中表達量最高,MTX組次之,MCL組接近與MTX組,而C5/C5a是機體免疫應答的一部分在適應性免疫中有一定的作用[14],提示MCL同MTX一樣均具有幫助機體恢復免疫調節功能的作用。TIMP-1為基質金屬蛋白酶抑制因子,基質金屬蛋白酶(MMPs)是一類降解細胞外基質的一類多肽家族,其高表達能促進細胞遷移和增殖[15-16]。在此實驗中,MCL組和MTX組中TIMP-1的表達水平與Nor組幾乎一致,提示含笑內酯有效的抑制了相應細胞的遷移和增殖,對類風濕關節炎起到了一定的治療作用。M-CSF為巨噬細胞集落刺激因子,是迄今為止發現的直接參與破骨細胞分化的兩種細胞因子之一。破骨細胞是骨細胞的一種,分解骨組織,行使骨吸收的功能,與成骨細胞在功能上相對應,二者協同,在骨骼發育和形成過程中發揮著重要的作用[17-18]。此實驗中,MCL組的M-CSF水平與略高于Con組,MTX組接近與Nor組且均較前兩組高,表明MTX都能夠在一定程度上恢復M-CSF的表達情況,從而在一定程度上恢復骨組織的自我調節能力,而MCL的療效略低于MTX。MCL組中sICAM-1的表達水平低于其他各組,表明MCL對一些細胞的穩定調節能力不是很強,MCL組出現了BLC的表達,說明MCL具有一定的免疫調節功能。
綜上所述,MCL具有一定的免疫調節功能,能夠在一定程度上幫助機體恢復免疫調節功能。C5/C5a,TIMP-1等細胞因子可能在MCL對類風濕關節炎的調節中起到一定的作用。
[1]郝亮,孫紅勝,趙恒立.清肝祛濁劑對類風濕關節炎模型大鼠治療作用的實驗研究[J].中國中醫急癥,2012,21(11):1772-1773.
[2]Hartog A,Hulsman J,Garssen J.Locomotion and muscle mass measures in a murine model of collagen-induced arthritis[J].BMC Musculoskeletal Disorders,2009,10:59.
[3]Andreas S,Oliver R.Synthesis of biologically active guaianolides with a trans-annulated lactone moiety [J].Eur J Org Chem,2008,2008:2353-2364.
[4]Zhai JD,Li D,Long J,et al.Biomimetic semisynthesis of arglabin from parthenolide [J].J Org Chem,2012,77(16):7103-7107.
[5]Zhang Q,Lu Y,Ding Y,et al.Guaianolide sesquiterpene lactones,a source to discover agents that selectively inhibit acute myelogenous leukemia stem and progenitor cells[J].J Med Chem,2012,55(20):8757-8769.
[6]Jain A,Olsen HS,Vyzasatya R,et al.Fully recombinant lgG2a Fc multimers(stradomers TM) effectively treat collagen induced arthritis and prevent idiopathic thrombocytopenic purpura in mice[J].Arthritis Res Ther,2012,14(4):R192.
[7]BandDD,Latham KA,Rosloniec EF.Collagen-induced arthritis[J].Nat Protoc,2007,2(5):1269-1275.
[8]Suszko A,Obminska MB.Influence of polysaccharide fractions isolated from Caitha palustris L.on the cellular immune response in collagen-induced arthritis (CIA) in mice.A comparison with methotrexate[J].J Ethnopharmacol,2013,145(1):109-117.
[9]Cuzzocrea S,Ayroldi E,Dipaola R,et al.Role of glucocorticoid-induced TNF receptor family gene(GITR)in collagen-induced arthritis[J].FASEB J,2005,19(10):1253-1265.
[10]Trentham DE,Townes AS,Kang AH.Autoimmunity to typeⅡ collagen:an experimental model of arthritis[J].J Exd Med,1977,146:857-868.
[11]高薇,張榕,趙麗娟,等.JAK/STAT信號通路在大鼠類風濕關節炎模型發病過程中的表達[J].中華風濕病學雜志,2007,11(4):229-233.
[12]Xinqiang S,Fei L,Nan L,et al.Therapeutic efficacy of experimental rheumatoid arthritis with low-dose methotrexate by increasing partially CD4+CD25+Treg cells and inducing Th1 to Th2 shift in both cells and cytokines[J].Biomed Pharmacother,2010,64(7):463-471.
[13]Zhang Y,Xu W,Li H,et al.Therapeutic effects of total alkaloids of tripterygium wilfordⅡHook f.on collagen-induced Arthritis in Rats[J].J Ethnopharmacol,2013,145(3):699-705.
[14]Tsuji RF,Kikuchi M,Askenase PW.Possible involvement of C5/C5a in the efferent and elicitation phases of contact sensitivity[J].J Immunol,1996,156(12):4444-4450.
[15]Djafarzadeh R,Mojaat A,Vicente AB,et al.Exogenously added GPI-anchored tissue inhibitor of matrix metalloproteinase-1 (TIMP-1) displays enhanced and novel biological activities[J].Biol Chem,2004,385(7):655-663.
[16]Letra A,Ghaneh G,Zhao M,et al.MMP-7 and TIMP-1,new targets in predicting poor wound healing in apical periodontitis[J].J Endod,2013,39(9):1141-1146.
[17]趙為公,王瑩,邱希江,等.細菌脂多糖對破骨細胞發育的抑制作用研究[J].中日友好醫院學報,2013,27(1):30-33.
[18]Souza PP,Lerner UH.The role of cytokines in inflammatory bone loss[J].Immunol Invest,2013,42(7):555-622.

