錳對(duì)比劑在MRI中的應(yīng)用
曾慶斌,郭茜旎,羅晴,吳光耀,周欣*
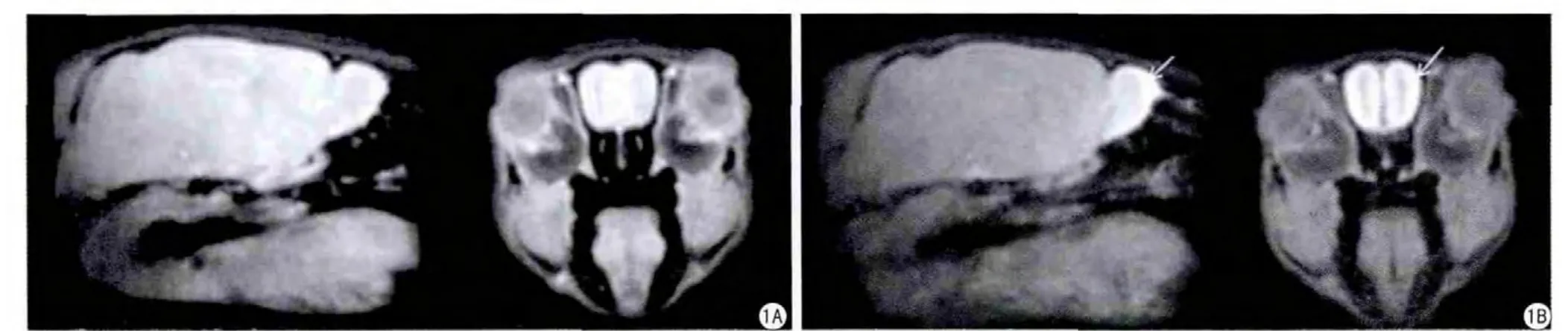
圖1 錳離子增 強(qiáng)的小鼠嗅球MRI。A:灌注MnCl2前,(左)矢狀圖,(右)冠狀圖;B:灌注MnCl2后,(左)矢狀圖,(右)冠狀圖[11]Fig.1 Manganese-enhanced imaging (MEMRI) of mouse olfactory bulb.A: Pre-infusion MnCl2, (left) sagittal image, (right) coronal image.B: Postinfusion MnCl2, (left) sagittal image, (right) coronal image [11].
自從1973年Lauterbur[1]首次實(shí)現(xiàn)MRI,1977年Mans fi eld[2]利用回波平面成像(echo planar imaging,EPI)提高了成像效率以來(lái),MRI這項(xiàng)技術(shù)在世界范圍內(nèi)的生物、醫(yī)學(xué)等領(lǐng)域獲 得很好的發(fā)展和廣泛應(yīng)用。因其優(yōu)勢(shì)明顯使其成為目前活體狀態(tài)下,顯示人體結(jié)構(gòu)的一種主要的臨床影像技術(shù)。其中,功能MRI(fMRI)更是在研究大腦的功能結(jié)構(gòu)、大腦活動(dòng)以及病理狀態(tài)中起著中流砥柱的作用[3]。在醫(yī)學(xué)診斷中,為了得到更高的信號(hào)對(duì)比度,往往就要用到MRI對(duì)比劑(contrast agent, CA)。調(diào)查表明, 在現(xiàn)如今的MRI實(shí)驗(yàn)中,有40%~50%的實(shí)驗(yàn)都要用到對(duì)比劑[4]。目前臨床上正在使用和研發(fā)的對(duì)比劑按照其作用原理來(lái)說(shuō),可以分為T(mén)1對(duì)比劑和T2對(duì)比劑兩類(lèi)。一種合格的可供臨床使用的MRI對(duì)比劑需要同時(shí)滿(mǎn)足以下幾個(gè)條件:(1)足夠的穩(wěn)定性;(2)低毒性;(3)高弛豫率;(4)靶向性;(5)在體內(nèi)既有足夠的停留時(shí)間又易于排出[5]。理論上來(lái)說(shuō)多種過(guò)渡金屬和鑭系金屬都可以用作磁共振對(duì)比劑,但釓一直以來(lái)就是順磁性對(duì)比劑的首選金屬,因?yàn)槿齼r(jià)態(tài)的釓?fù)鈱佑?個(gè)未成對(duì)電子,具有很強(qiáng)的順磁弛豫增強(qiáng)能力。雖然含釓類(lèi)對(duì)比劑使用較為廣泛,但是含釓類(lèi)對(duì)比劑有可能引起一種雖然罕見(jiàn)卻極 其嚴(yán)重的疾病——腎源性系統(tǒng)性纖維化(nephrogenic systemic fibrosis, NSF)[6],因此含釓類(lèi)對(duì)比劑的使用也具有一定的局限性。過(guò)渡態(tài)金屬錳是一種生物體內(nèi)必須的微量元素,毒性非常低。二價(jià)態(tài)的錳外層有5個(gè)未成對(duì)電子,也具有很強(qiáng)的順磁弛豫增強(qiáng)能力,這些特殊的性質(zhì)使得錳在磁共振成像中也得到了一定的應(yīng)用,是一種較早期的用于MRI的順磁性對(duì)比劑。筆者將對(duì)錳對(duì)比劑最近的最新研究進(jìn)展及應(yīng)用進(jìn)行綜述。
1 錳對(duì)比劑的特性
錳因其良好的電子排布以及獨(dú)特的生物化學(xué)性質(zhì),使其在磁共振對(duì)比劑領(lǐng)域也占有一席之地。錳對(duì)比劑相對(duì)于其他對(duì)比劑來(lái)說(shuō),特征比較明顯:一是存在形勢(shì)比較多樣,如有錳鹽、小分子有機(jī)螯合物、大分子螯合物、氧化物納米粒子等多種類(lèi)型;二是錳對(duì)比劑毒性較低;三是錳對(duì)比劑可以用于神經(jīng)影像的研究,因Mn2+是Ca2+的類(lèi)似物,Mn2+可通過(guò)在神經(jīng)活動(dòng)時(shí)打開(kāi)的電壓門(mén)控Ca2+通道進(jìn)入神經(jīng)細(xì)胞,并且可以通過(guò)基于微管道的傳輸系統(tǒng)在神經(jīng)細(xì)胞內(nèi)傳遞,因此Mn2+可以運(yùn)用于神經(jīng)影像學(xué)的研究。
2 錳對(duì)比劑的相關(guān)研究及應(yīng)用
2.1 錳無(wú)機(jī)鹽的研究進(jìn)展及應(yīng)用
Mn2+是最早用于MRI的順磁 性對(duì)比劑,早在1973年,Lauterbur[1]在其發(fā)表的文章中就用到了MnSO4作為MRI對(duì)比劑來(lái)提高信號(hào)對(duì)比度。1997年,Lin等[7]提出了錳離子增強(qiáng)磁共振成像(MEMRI)技術(shù),該方法 通過(guò)在生物體內(nèi)直接引入外源性的Mn2+作為對(duì)比劑來(lái)直接或者動(dòng)態(tài)的研究神經(jīng)細(xì)胞的功能活動(dòng)。目前MEMRI在動(dòng)物神經(jīng)影像研究中的應(yīng)用可以概括為三個(gè)方面:(1)神經(jīng)纖維追蹤,(2)大腦形態(tài)學(xué)研究,(3)腦功能成像[8]。錳曾作為對(duì)比劑來(lái)提高信號(hào)對(duì)比度從而研究大腦的局部缺血,Aoki等[9]在2003年利用MEMRI技術(shù)來(lái)研究大鼠中風(fēng)模型中的神經(jīng)興奮性毒性影像,該方法對(duì)大腦動(dòng)脈栓塞腦缺血具有較好的診斷作用。李英霞等[10]利用MEMRI技術(shù)成功的顯示了大鼠急性腦缺血過(guò)程中的Ca2+超載過(guò)程。2007年,Bock等[8]以MnCl2·4H2O作為對(duì)比劑來(lái)研究大鼠腦部結(jié)構(gòu)。2013年,Gutman等[11]利用MEMRI及DTI技術(shù)對(duì)小鼠的嗅覺(jué)系統(tǒng)進(jìn)行了相關(guān)研究,在小鼠鼻腔灌注MnCl2后,小鼠的嗅球信號(hào)得到了明顯的加強(qiáng)(圖1)。
錳不僅可以用于神經(jīng)影像的研究還可以運(yùn)用于肝臟的影像研究。以前已有的對(duì)肝臟具有特異性的錳對(duì)比 劑的給藥方式都是通過(guò)靜脈注射的方式,然而這種方法會(huì)導(dǎo)致不必要的副作用和并發(fā)癥,為了解決這個(gè)問(wèn)題,2006年,Elizaveta等[12]通過(guò)給病人口服CMC-001對(duì)比劑(該對(duì)比劑包含1.6 g MnCl2·4H2O,1 g丙氨酸,1600IU維生素D3),利用這種方法不但能夠解決靜脈注射會(huì)產(chǎn)生的副作用,而且成功的監(jiān)測(cè)到肝癌細(xì)胞轉(zhuǎn)移過(guò)程。

圖2 大鼠腦部MR T1WI (A、B、C)、T2WI (D、E、F)、注射對(duì)比劑后15 h (A、D)、注射對(duì)比劑后24 h(B、E),注射對(duì)比劑后72 h (C、F)[18]Fig.2 The MRI of rat brain, T1-weighted image (A, B, C), T2-weighted image (D, E, F), post- injected 15 h(A, D), post-injected 24 h, (c, f) post-injected 72 h (B, E) [18].
MEMRI技術(shù)在糖尿病的診斷中也有一定的應(yīng)用。2013年,Antkowiak等[13]利用MEMRI技術(shù),在環(huán)磷酰胺加速誘導(dǎo)的1型糖尿病小鼠模型中成功的監(jiān)測(cè)到了胰腺β細(xì)胞的減少。
2.2 錳有機(jī)小分子螯合物的研究進(jìn)展及應(yīng)用
降低錳的毒性,通常有兩種方案[14]:一是利用一些化合物和錳進(jìn)行螯合,進(jìn)而除去自由的錳,可以有效降低毒性;二是加入能和錳競(jìng)爭(zhēng)的鈣離子,從而降低由鈣通道進(jìn)入細(xì)胞的錳的量。這兩種方案都能夠有效的降低錳的毒性。目前與錳螯合的有機(jī)小分子主要是卟啉和羧酸類(lèi)化合物,錳卟啉對(duì)比劑具有比較好的信號(hào)對(duì)比增強(qiáng)效果,并且具有靶向功能。常見(jiàn)的用于與錳螯合的羧酸類(lèi)化合物基本上都是DTPA和DOTA的系列衍生物。
2004年,Troughton等[15]合成出了一種基于EDTA衍生物的錳對(duì)比劑,該類(lèi)對(duì)比劑在動(dòng)物實(shí)驗(yàn)時(shí)沒(méi)有表現(xiàn)出明顯的毒性。在兔子血管損傷模型中顯示出了較高的對(duì)比度。在注射該對(duì)比劑后,模型兔的正常部位和因損傷造成的炎癥部位形成了明顯的對(duì)比。
通過(guò)MRI進(jìn)行離子識(shí)別并且對(duì)一些離子的分布進(jìn)行測(cè)定逐漸成為一個(gè)重要的研究領(lǐng)域。Zhang等[16]2007年發(fā)表了一篇關(guān)于可特異性識(shí)別Zn2+的錳(Ⅲ)卟啉熒光/MRI雙模態(tài)探針的文章,該作者預(yù)測(cè)這種卟啉探針可以實(shí)現(xiàn)對(duì)生物體內(nèi)Zn2+的探測(cè)以及對(duì)Zn2+的分布進(jìn)行成像。在其后續(xù)的研究工作中[17],成功的實(shí)現(xiàn)了對(duì)大鼠海馬區(qū)內(nèi)Zn2+的探測(cè)和對(duì)Zn2+的分布進(jìn)行磁共振成像,在將來(lái)有可能用于研究與鋅異常引起的精神疾病。
Bertin等[18]2009年合成出了一種新型的樹(shù)枝狀DTPA錳螯合物,4.7 T成像儀和20℃條件下,測(cè)得其T1弛豫率為1.3 mMM-1s-1,T2弛豫率為17.41 mM-1s-1。經(jīng)研究發(fā)現(xiàn)該種對(duì)比劑毒性很低,并且在大鼠模型中,當(dāng)注射對(duì)比劑24 h后,大鼠腦部的對(duì)比劑分布出現(xiàn)了差別,可以清晰的看出組織結(jié)構(gòu)(圖2)。此研究結(jié)果表明此對(duì)比劑不僅可以應(yīng)用于神經(jīng)科學(xué)的基礎(chǔ)研究,還有可能用于診斷帕金森綜合征(PD)或者阿爾茨海默綜合征(AD)。該類(lèi)樹(shù)枝狀DTPA錳螯合物對(duì)比劑T1弛豫率(1.3 mM-1s-1)與MnCl2的T1弛豫率(6.9 mM-1s-1)相比低了很多,主要是因?yàn)樵擃?lèi)樹(shù)枝狀DTPA錳螯合物不含結(jié)合水。有相關(guān)文獻(xiàn)[19]對(duì)金屬 結(jié)合水的個(gè)數(shù)與 弛豫率的關(guān)系進(jìn)行了論述,感興趣 的讀者可對(duì)其進(jìn)行參閱。
2.3 錳高分子螯合物的研究進(jìn)展及應(yīng)用
高分子材料因其合成技術(shù)成熟、化學(xué)結(jié)構(gòu)可控、易于化學(xué)修飾以及具有比較高的穩(wěn)定性等特點(diǎn),得到了科學(xué)家們的廣泛關(guān)注。將順磁性金屬和高分子材料進(jìn)行結(jié)合得到磁共振對(duì)比劑是對(duì)比劑的一個(gè)重要發(fā)展方向。
2009年,Zhang等[20]通過(guò)葡聚糖和錳卟啉反應(yīng)得到了一種可以選擇性靶向癌細(xì)胞的錳卟啉高分子對(duì)比劑,其Mn-porphyrin-dextran T1弛豫率(8.9 mM-1s-1)比Gd-DTPA弛豫率(5.12 mM-1s-1)還高,在活體實(shí)驗(yàn)中,注射對(duì)比劑后,腫瘤部位信號(hào)增強(qiáng)明顯,可以用于對(duì)癌癥的診斷。這種含有卟啉類(lèi)化合物的對(duì)比劑一般弛豫率都比較高,主要是因?yàn)檫策且粋€(gè)平面結(jié)構(gòu),這種結(jié)構(gòu)可以使水分子和順磁性金屬中心進(jìn)行充分的接觸,能量傳遞的將會(huì)更加有效,使得水分子的弛豫變快[20]。
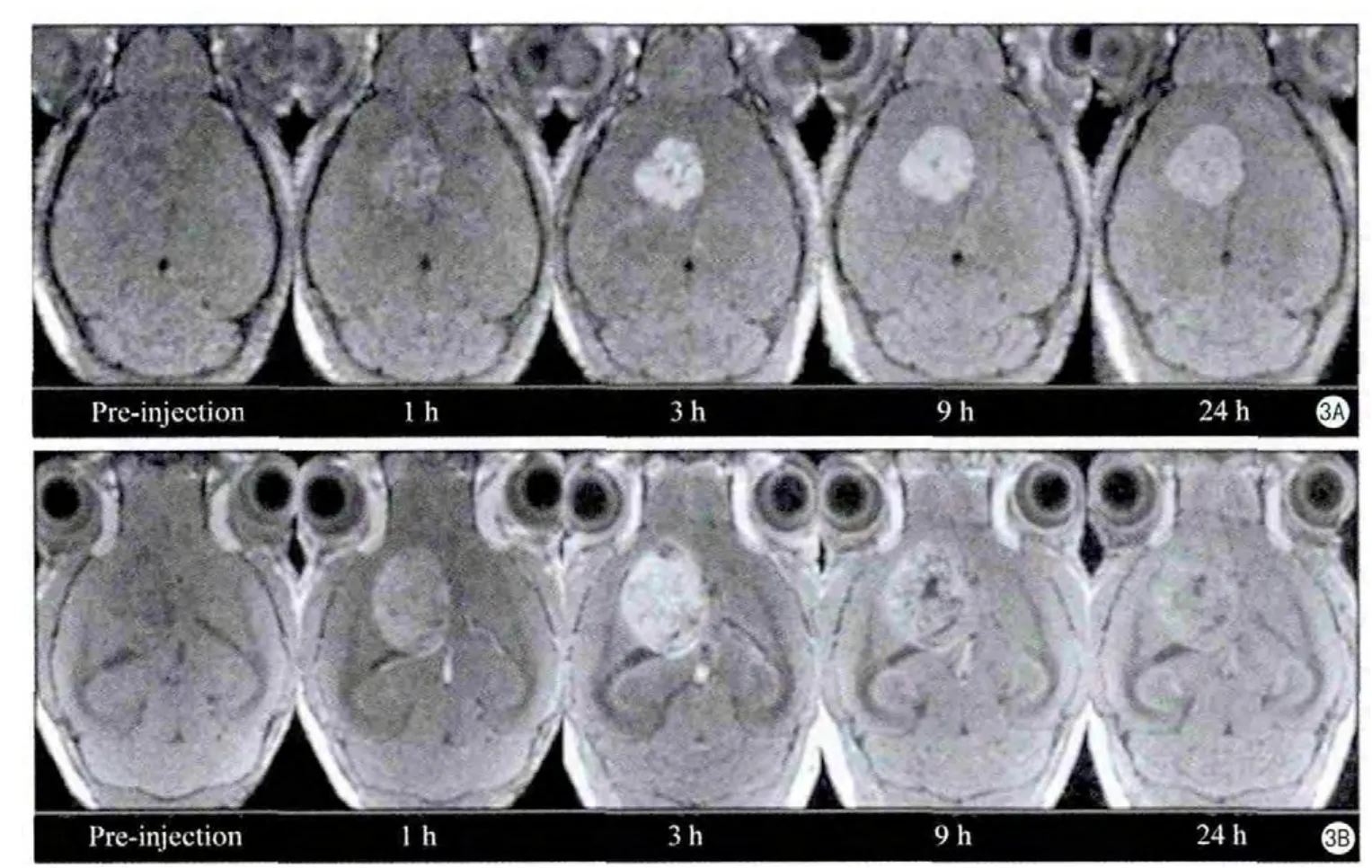
圖3 小鼠腦部T1WI。A:功能化的MnO納米粒子選擇性的對(duì)小鼠腦部乳腺癌部位的信號(hào)加強(qiáng);B:非功能化的MnO納米粒子對(duì)小鼠腦部的腫瘤部位和正常部位的信號(hào)均加強(qiáng)[28]Fig.3 The T1-weighted MRI of mouse brain.A: The functionalized MnO nanoparticles selectively enhanced the breast cancer cells.B: The nonfunctionalized MnO nanoparticles enhanced both the tumor and the normal brain tissue[28].
蛋白質(zhì)是生物體的重要組成部分,其兼容性高。近幾年,順磁性金屬與蛋白質(zhì)螯合的對(duì)比劑引起了科學(xué)家們的特別關(guān)注。2008年,Sotak等[21]合成出了一種錳(Ⅲ)-轉(zhuǎn) 鐵蛋白螯合物,該種對(duì)比劑可以標(biāo)記小鼠肝細(xì)胞,在肝細(xì)胞中其弛豫率和錳離子的差不多,雖然弛豫率很低,但是卻提供了一種新的對(duì)比劑設(shè)計(jì)思路:利用一種生物學(xué)過(guò)程來(lái)釋放對(duì)比劑,即利用受體結(jié)合、內(nèi)吞作用、內(nèi)酸化等過(guò)程來(lái)達(dá)到釋放對(duì)比劑的目的。這種想法為藥物載體以及藥物釋放提供了一種設(shè)計(jì)思路。2011年,Geninatti等[22]合成出了一種錳螯合去鐵鐵蛋白的對(duì)比劑(Mn-Apo),這種對(duì)比劑一個(gè)去鐵鐵蛋白的空穴中含有300~400個(gè)錳原子,其T1弛豫率可以達(dá)到7000mM-1s-1(以去鐵鐵蛋白的量算,7 T成像儀上測(cè)得),經(jīng)實(shí)驗(yàn)研究發(fā)現(xiàn)這種對(duì)比劑可以對(duì)肝癌進(jìn)行很好的診斷,這種將錳離子封裝在去鐵鐵蛋白內(nèi)腔中的方法是一種有效的降低毒性和提高弛豫率的方法,并且去鐵鐵蛋白不會(huì)引起任何生物體內(nèi)的免疫反應(yīng),可以使對(duì)比劑有較長(zhǎng)的保留時(shí)間,為有效的進(jìn)行疾病診斷提供了保障。Winter等[23]最近合成出了一種錳卟啉取代硝酸亞鐵血紅素(H-NOX)的高弛豫率對(duì)比劑,其T1弛豫速率12 mM-1s-1,T2弛豫速率16.8 mM-1s-1(1.4 T成像儀,37 ℃測(cè)得)。這種新型的對(duì)比劑可以通過(guò)基因或者化學(xué)手段進(jìn)一步修飾從而增強(qiáng)MRI信號(hào)和提高生物兼容性。蛋白質(zhì)在水溶液中表面一般都會(huì)有一個(gè)結(jié)合水層,這些結(jié)合的水分子自由度降低,這樣這些水分子的自由運(yùn)動(dòng)頻率變得接近拉莫頻率,就可以產(chǎn)生比較有效的能量傳遞,使得T1弛豫時(shí)間縮短,另外順磁性金屬的存在也會(huì)進(jìn)一步的縮短T1弛豫時(shí)間,這兩種因素一起造成了順磁性金屬螯合蛋白質(zhì)的對(duì)比劑T1弛豫速率很大。
2.4 錳納米粒子的研究進(jìn)展及應(yīng)用
納米粒子材料因其特有的物化性質(zhì),近幾年來(lái)一直是廣大科研工作者們的研究熱點(diǎn),將順磁性金屬與納米粒子材料結(jié)合起來(lái)不僅可以增加其生物兼容性,還可以提高其弛豫率,是一個(gè)很有前景的發(fā)展方向。近年來(lái),納米粒子對(duì)比劑越來(lái)越得到科研工作者的關(guān)注。
早在1993年,就有文獻(xiàn)[24]報(bào)道了基于脂質(zhì)體的錳納米粒子對(duì)比劑,該類(lèi)對(duì)比劑是由脂質(zhì)體包裹的烷基化的錳組成,其毒性低、穩(wěn)定,并且其弛豫率比自由的錳更高,在活體成像實(shí)驗(yàn)中顯示該類(lèi)對(duì)比劑可以特異性的提高肝臟病變部位和正常部位的對(duì)比度。2008年,Pan等[25]首次通過(guò)具有兩親性質(zhì)的超支化聚乙烯亞胺(PEI)分子和Mn(Ⅲ)卟啉以及生物素的自組裝得到了粒徑在180~200nm之間的形如紅細(xì)胞的納米粒子對(duì)比劑,細(xì)胞實(shí)驗(yàn)顯示,該類(lèi)對(duì)比劑具有潛在的靶向能力。
Tan等[26]于2010年首次用Mn-DOTA與以硅三氧烷為核心的第三代賴(lài)氨酸樹(shù)狀高分子相互作用,然后再使之與具有靶向性的CLT1肽鏈作用,得到了可以靶向癌細(xì)胞的錳納米球?qū)Ρ葎摲N對(duì)比劑對(duì)比增強(qiáng)效果明顯,少量的注射量就可以得到足夠的信號(hào)對(duì)比度,將來(lái)可能應(yīng)用于癌癥診斷的分子影像中。在Tan等[27]的后續(xù)工作中,又通過(guò)NOTA或者DOTA與以硅三氧烷為核心的第二、三、四代賴(lài)氨酸樹(shù)枝狀高分子相互作用,然后再螯合Mn2+形成了一種新型的錳納米球?qū)Ρ葎=?jīng)研究發(fā)現(xiàn),不同的錳螯合物,弛豫速率不同,并且隨著代數(shù)的增長(zhǎng),弛豫率增加。在動(dòng)物實(shí)驗(yàn)中發(fā)現(xiàn),很少量的注射對(duì)比劑,在動(dòng)物模型的腫瘤部位就可以得到對(duì)比明顯的信號(hào)。該類(lèi)對(duì)比劑因其熱力學(xué)穩(wěn)定性、在水中的高溶解度以及均勻的粒徑使其具有很廣闊的應(yīng)用前景。
錳氧化物納米粒子對(duì)比劑是另一個(gè)較重要的研究方向,2007年Na等[28]由油酸錳在300℃下熱分解得到球狀MnO納米粒子后,再將之包裹在聚乙二醇(PEG)或者磷脂殼膜中,即可得到具有水溶性的MnO納米粒子對(duì)比劑。該種對(duì)比劑生物兼容性較好,粒徑在10~30nm之間,在小鼠模型實(shí)驗(yàn)中,T1WI可以得到對(duì)比明顯的圖像(圖3),并且該種對(duì)比劑對(duì)乳腺癌細(xì)胞具有靶向性,可以對(duì)腦部轉(zhuǎn)移瘤的乳腺癌細(xì)胞進(jìn)行選擇性成像。2011年,Kim等[29]開(kāi)發(fā)出了一種新型的介孔二氧化硅涂層空心氧化錳納米粒子(HMnO@mSiO2)對(duì)比劑,這種含有介孔的納米殼可以使水分子充分接近磁性中心,進(jìn)而可以有效增強(qiáng)水中質(zhì)子的T1弛豫速率,在11.7 T譜儀上的弛豫速率為0.99 mM-1s-1,實(shí)驗(yàn)發(fā) 現(xiàn)該種納米粒子可以被脂肪間充質(zhì)干細(xì)胞(MSCs)很好的吸收。在小鼠模型實(shí)驗(yàn)中,注射該對(duì)比劑14 d后,仍然可以得到具有一定對(duì)比度的圖像。因干細(xì)胞傾向于轉(zhuǎn)移到腫瘤位置,因此該對(duì)比劑可以用來(lái)檢測(cè)癌細(xì)胞并且可以追蹤癌細(xì)胞的轉(zhuǎn)移過(guò)程。該研究結(jié)果使利用MRI技術(shù)追蹤細(xì)胞轉(zhuǎn)移過(guò)程成為了可能。2013年,Xiao等[30]開(kāi)發(fā)出了一種超高弛豫率的Mn3O4納米粒子對(duì)比劑,在3.0T成像儀上,水溶液質(zhì)子的T1弛豫率為8.26 mM-1s-1,PBS中質(zhì)子的T1弛豫率為6.79 mM-1s-1,該錳氧化物納米粒子的T1弛豫率為目前所見(jiàn)報(bào)道的所有錳氧化物納米粒子T1弛豫率的最高值。在細(xì)胞實(shí)驗(yàn)及活體實(shí)驗(yàn)中均未發(fā)現(xiàn)明顯的毒性,并且在活體成像實(shí)驗(yàn)中,腫瘤部位的成像對(duì)比效果明顯。該研究結(jié)果為錳氧化物納米粒子在臨床中的應(yīng)用鋪平了道路。
3 小結(jié)與展望
由于錳具有良好的電子排布和豐富的生物化學(xué)特性,以其作為對(duì)比增強(qiáng)對(duì)比劑相對(duì)于其他順磁性金屬對(duì)比劑來(lái)說(shuō)具有很大的優(yōu)勢(shì)。然而自由的錳又是具有毒性的,超劑量的使用Mn2+,會(huì)導(dǎo)致Mn2+在大腦基底節(jié)、黑質(zhì)等腦區(qū)沉積,進(jìn)而引起腦細(xì)胞死亡,出現(xiàn)類(lèi)似帕金森綜合癥的臨床癥狀,因此在利用錳作為對(duì)比劑之前需要將之進(jìn)行一定的修飾,比如將之包裹在脂質(zhì)體之內(nèi)或者用一些有機(jī)化合物與錳進(jìn)行螯合使之形成穩(wěn)定的化合物,這樣就可以有效的降低錳的毒性。因此尋找可以有效降低錳的毒性,又能和錳形成穩(wěn)定的化合物,并且生物兼容性好的配體就顯得尤為重要。聚合物、納米粒子材料都是很重要的研究方向,雖然目前在這方面的研究工作已經(jīng)很多,但是目前還沒(méi)有被批準(zhǔn)使用的錳對(duì)比劑,因此在錳造影的研發(fā)上還有很大的發(fā)展空間,還需要廣大的科研工作者做出更多的努力。
[References]
[1]Lauterbur PC.Image formation by induced local interactions:examples employing nuclear magnetic resonance.Nature, 1973,242(5394): 190-191.
[2]Mans fi eld P.Multi-planar image formation using NMR spin echoes.J Physics C: Solid State Physics, 1977, 10(3): L55-L58.
[3]Song WM, Chen NK.fMRI: a brief review and outlook on the stateof-the-art methodology.Chin J Magn Reson Imaging, 2013, 5(1):361-372.宋無(wú)名, 陳南圭.功能MRI:最先進(jìn)方法的簡(jiǎn)要回顧和展望.磁共振成像, 2013, 5(1): 361-372.
[4]Shellock FG, Kanal E.Safety of magnetic resonance imaging contrast agents.J Magn Reson Imaging, 1999, 10(3): 477-484.
[5]Yan GP, Zhuo RX.Research progress of magnetic resonance imaging contrast agents.Chin Science Bulletin, 2001, 46(7): 531-538.鄢國(guó)平, 卓仁禧.磁共振成像造影劑的研究進(jìn)展.科學(xué)通報(bào), 2001,46(7): 531-538.
[6]Kuo PH, Kanal E, Abu-Alfa AK, et al.Gadolinium-based MR con trast agents and nephrogenic systemic fibrosis.Radiology, 2007, 242(3):647-649.
[7]Lin YJ, Koretsky AP.Manganese ion enhances T1- weighted MRI during brain activation: an approach to direct imaging of brain function.Magn Reson Med, 1997, 38(3): 378-388.
[8]Bock NA, Paiva FF.Fractionated manganese-enhanced MRI.NMR Biomed, 2008, 21(5): 473-478.
[9]Aoki I, Ebisu T, Naruse S, et al.Detection of the anoxic depolarization of focal ischemia using manganese-enhanced MRI.Magn Reson Med,2003, 50(1): 7-12.
[10]Li YX, Fang K, Tang SM, et al.Mn2+ enhanced magnetic resonance molecular imaging.Chin J Interventional Imaging and Therapy, 2004,1(1): 65-70.李英霞, 方可, 唐山民, 等.以Mn2+為探針的磁共振分子影像技術(shù).中國(guó)介入影像與治療學(xué), 2004, 1(1): 65-70.
[11]Gutman DA, Magnuson M, Majeed W, et al.Mapping of the mouse olfactory system with manganese-enhanced magnetic resonance imaging and diffusion tensor imaging.Brain Struct Funct, 2013,218(2): 527-537.
[12]Elizaveta C, Vibeke L, Moller JM, et al.Imaging liver metastases with a new oral manganese-based contrast agent.Acad Radiology, 2006,13(7): 827-832.
[13]Antkowiak PF, Stevens BK, Nunemaker CS, et al.Manganeseenhanced magnetic resonance imaging detects declining pancreatic β-cell mass in a cyclophosphamide-accelerated mouse model of type 1 diabetes.Diabetes, 2013, 62(1): 44-48.
[14]Schaefer S, Lange RA, Gutekunst DP, et al.Contrast-enhanced magnetic resonance imaging of hypoperfused myocardium.Invest Radiology, 1991, 26(6): 551-556.
[15]Troughton JS, Greenfield MT, Greenwood JM, et al.Synthesis and evaluation of a high relaxivity manganese (II)- based MRI contrast agent.Inorg Chem, 2004, 43(20): 6313-6323.
[16]Zhang XA, Lovejoy KS, Jasanoff A, et al.Water-soluble porphyrins as a dual- function molecular imaging platform for MRI and fl uorescence zinc sensing.Proc Natl Acad Sci U S A, 2007, 104(26): 10780-10785.
[17]Lee T, Zhang XA, Dhar S, et al.In vivo Imaging with a cell-permeable porphyrin-based MRI contrast agent.Chem Biol, 2010, 17(6):665-673.
[18]Bertin A, Steibel J, Michou-Gallani AI, et al.Development of a dendritic manganese- enhanced magnetic resonance imaging (MEMRI)contrast agent: synthesis, toxicity (in vitro) and relaxivity (in vitro, in vivo) studies.Bioconjugate chem, 2009, 20(4): 760-767.
[19]Caravan P, Ellison JJ, McMurry TJ, et al.Gadolinium (III) chelates as MRI contrast agents: structure, dynamics, and applications.Chemical Rev, 1999, 99(9): 2293-2352.
[20]Zhang Z, He R, Yan K, et al.Synthesis and in vitro and in vivo evaluation of manganese (Ⅲ) porphyrin-dextran as a novel MRI contrast agent.Bioorg Med Chem Lett, 2009, 19(23): 6675-6678.
[21]Sotak CH, Sharer K, Koretsky AP.Manganese cell labeling of murine hepatocytes using manganese (Ⅲ)- transferrin.Contrast Media Mol Imaging, 2008, 3(3): 95-105.
[22]Geninatti CS, Cutrin JC, Lanzardo S, et al.Mn-loaded apoferritin:a highly sensitive MRI imaging probe for the detection and characterization of hepatocarcinoma lesions in a transgenic mouse model.Contrast Media Mol Imaging, 2012, 7(3): 281-288.
[23]Winter MB, Klemm PJ, Phillips-Piro CM, et al.Porphyrin-substituted H-NOX proteins as high-relaxivity MRI contrast agents.Inorg Chem,2013, 52(5): 2277-2279.
[24]Unger E, Fritz T, Kang S, et al.Manganese-based liposomes comparative approaches.Radiology, 1993, 28(10): 933-938.
[25]Pan D, Caruthers SD, Hu G, et al.Ligand-directed nanobialys as theranostic agent for drug delivery and manganese-based magnetic resonance imaging of vascular targets.J Am Chem Soc, 2008, 130(29):9186-9187.
[26]Tan M, Wu X, Jeong EK, et al.An effective targeted nanoglobular manganese (II) chelate conjugate for magnetic resonance molecular imaging of tumor extracellular matrix.Mol Pharm, 2010, 7(4):936-943.
[27]Tan M, Ye Z, Jeong EK, et al.Synthesis and evaluation of nanoglobular macrocyclic Mn (Ⅱ) chelate conjugates as non-gadolinium (Ⅲ) MRI contrast agents.Bioconjugate Chem, 2011, 22(5): 931-937.
[28]Na HB, Lee JH, An K, et al.Development of a T1 contrast agent for magnetic resonance imaging using MnO nanoparticles.Angew Chem,2007, 119(28): 5397-5401.
[29]Kim T, Momin E, Choi J, et al.Mesoporous silica-coated hollow manganese oxide nanoparticles as positive T1 contrast agents for labeling and MRI tracking of adipose derived mesenchymal stem cells.J Am Chem Soc, 2011, 133(9): 2955-2961.
[30]Xiao J, Tian XM, Yang C, et al.Ultrahigh relaxivity and safe probes of manganese oxide nanoparticles for in vivo imaging.Sci Rep, 2013, 3:3424.

