IL- 6對(duì)小鼠腎上腺皮質(zhì)細(xì)胞系Y1合成皮質(zhì)醇的影響
文小平,夏海鳴
(1.東南大學(xué) 醫(yī)學(xué)院,江蘇 南京 210009; 2.東南大學(xué) 附屬第二醫(yī)院,江蘇 南京 210003)
目前認(rèn)為,白介素6(interleukin- 6,IL- 6)與腎上腺皮質(zhì)功能密切相關(guān),它可以通過下丘腦- 垂體- 腎上腺(Hypothalamic- Pituitary- Adrenal,HPA)軸調(diào)節(jié)腎上腺皮質(zhì)功能,也可直接作用于腎上腺來影響腎上腺皮質(zhì)功能。此外,腎上腺自身可分泌IL- 6,通過自分泌或旁分泌方式參與腎上腺皮質(zhì)功能的調(diào)節(jié)。但I(xiàn)L- 6對(duì)腎上腺皮質(zhì)功能的具體影響及調(diào)節(jié)機(jī)制仍不明確。本研究旨在探討IL- 6單獨(dú)及聯(lián)合ACTH處理小鼠腎上腺皮質(zhì)細(xì)胞后皮質(zhì)醇合成水平的變化,以及皮質(zhì)醇合成過程中類固醇急性調(diào)節(jié)蛋白(StAR)相關(guān)基因的調(diào)控作用,從而為今后深入了解內(nèi)毒素休克過程中IL- 6對(duì)腎上腺皮質(zhì)功能的影響提供實(shí)驗(yàn)依據(jù)。
1 材料與方法
1.1 材料
小鼠腎上腺皮質(zhì)細(xì)胞系Y1(中科院上海細(xì)胞生物研究所),IL- 6(Prospec公司),ACTH(Sigma公司),F(xiàn)12培養(yǎng)基(南京凱基生物科技發(fā)展有限公司),胎牛血清(GIBCO公司),臺(tái)盼藍(lán)染液(南京生興生物科技有限公司),皮質(zhì)醇放免檢測(cè)試劑盒(原子高科股份有限公司),Trizol(美國(guó)Invitrogen),cDNA第一鏈合成試劑盒(美國(guó)Thermo Fisher),TaqDNA Polymerase(美國(guó)Thermo Fisher),Real time PCR Master Mix(SYBR Green)(日本TOYOBO),0.1% DEPC水(南京凱基生物科技發(fā)展有限公司),引物由上海英俊公司合成。
1.2 細(xì)胞培養(yǎng)
小鼠腎上腺皮質(zhì)細(xì)胞系Y1細(xì)胞用含10%的胎牛血清、1.176 g NaHCO3及100 U·L-1青鏈霉素的F12培養(yǎng)液,在體積分?jǐn)?shù)為5%CO2、37 ℃濕飽和的條件下培養(yǎng)。細(xì)胞生長(zhǎng)至80%融合時(shí),以0.25%的混合胰酶消化后按1瓶傳至2~3瓶進(jìn)行傳代,取其對(duì)數(shù)生長(zhǎng)期細(xì)胞進(jìn)行實(shí)驗(yàn)。
1.3 臺(tái)盼藍(lán)拒染法檢測(cè)細(xì)胞活性
取對(duì)數(shù)生長(zhǎng)期的Y1細(xì)胞,調(diào)整細(xì)胞濃度為1.0×105ml-1,接種于6孔板,每孔1 ml,F(xiàn)12培養(yǎng)液培養(yǎng)24 h后按照以下分組來添加不同物質(zhì):(1) 空白對(duì)照組:2 ml F12培養(yǎng)液;(2) IL- 6組:2 ml F12培養(yǎng)液含100 ng·ml-1IL- 6;(3) ACTH組:2 ml F12培養(yǎng)液含10-9mol·l-1ACTH;(4) IL- 6+ACTH組:2 ml F12培養(yǎng)液含100 ng·ml-1IL- 6和10-9mol·l-1ACTH;再按照4個(gè)時(shí)間點(diǎn)分別培養(yǎng)3、6、12、24 h終止實(shí)驗(yàn)。取細(xì)胞上清液于無菌EP中,混勻后以2 000 r·min-1離心5 min,吸取上清液,-20 ℃保存。在6孔板中按1∶10加入0.4%的臺(tái)盼藍(lán),染色2~3 min,在光學(xué)顯微鏡下做活細(xì)胞計(jì)數(shù),實(shí)驗(yàn)重復(fù)3次。結(jié)果統(tǒng)計(jì):光鏡下任取5個(gè)視野進(jìn)行活細(xì)胞計(jì)數(shù),細(xì)胞活性=活細(xì)胞數(shù)目/總細(xì)胞數(shù)目×100%。
1.4 放免法檢測(cè)皮質(zhì)醇
從冰箱中取出經(jīng)1.3方法處理的上清液,室溫溶解后通過放免法測(cè)定各組細(xì)胞上清中皮質(zhì)醇含量。根據(jù)皮質(zhì)醇放免檢測(cè)試劑盒的操作說明,用放免儀測(cè)各管沉淀的放射性計(jì)數(shù)(cmp),實(shí)驗(yàn)重復(fù)3次。自動(dòng)γ計(jì)數(shù)器預(yù)先編制程序,直接給出實(shí)驗(yàn)的有關(guān)參數(shù),標(biāo)準(zhǔn)曲線及樣品濃度。測(cè)得的數(shù)據(jù)中,皮質(zhì)醇以g·ml-1為單位。
1.5 實(shí)時(shí)熒光定量PCR法檢測(cè)StAR mRNA的表達(dá)
取對(duì)數(shù)生長(zhǎng)期的Y1細(xì)胞,調(diào)整細(xì)胞濃度為1.0×105ml-1,接種于6孔板,每孔1 ml。以F12培養(yǎng)液培養(yǎng)24 h 后按照以下分組來添加不同物質(zhì):(1) 空白對(duì)照組:2 ml F12培養(yǎng)液;(2) IL- 6組:2 ml F12培養(yǎng)液含100 ng·ml-1IL- 6;(3) ACTH組:2 ml F12培養(yǎng)液含10-9mol·l-1ACTH;(4) IL- 6+ACTH組:2 ml F12培養(yǎng)液含100 ng·ml-1IL- 6和10-9mol·l-1ACTH;24 h終止實(shí)驗(yàn)。用Trizol裂解細(xì)胞提取各組總RNA,純化后用DEPC水溶解RNA,并分別在260 nm和280 nm處測(cè)其吸光度,計(jì)算出OD260/280值。引物是根據(jù)GenBank收錄的小鼠StAR和GAPDHmRNA序列,由Primer 5軟件設(shè)計(jì),由上海英俊公司合成,序列見表1。按cDNA第一鏈合成試劑盒說明書進(jìn)行操作,得到cDNA。用ABI Step one plus Real time- PCR儀進(jìn)行擴(kuò)增反應(yīng),體系總體積為20 μl:SYBR Green為10 μl,cDNA為 1 μl,引物為2 μl,0.1% DEPC水為7 μl。擴(kuò)增條件:95 ℃預(yù)變性5 min,95 ℃變性15 s,60 ℃退火20 s,40個(gè)循環(huán),72 ℃延伸40 s。每個(gè)樣品3個(gè)復(fù)孔,于72 ℃、40 s時(shí)計(jì)算熒光值,實(shí)驗(yàn)重復(fù)3次。用2-ΔΔCT法進(jìn)行數(shù)據(jù)分析。
表1用于實(shí)時(shí)熒光定量PCR的引物序列
Tab1SequencesoftheprimersusedforrealtimeRT-PCR
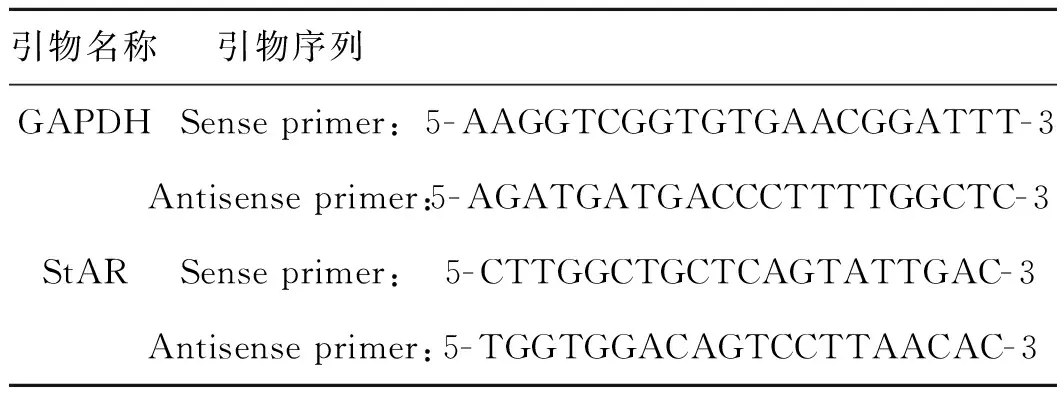
引物名稱引物序列GAPDHSense primer:5-AAGGTCGGTGTGAACGGATTT-3Antisense primer:5-AGATGATGACCCTTTTGGCTC-3StARSense primer:5-CTTGGCTGCTCAGTATTGAC-3Antisense primer:5-TGGTGGACAGTCCTTAACAC-3
1.6 統(tǒng)計(jì)學(xué)處理
2 結(jié) 果
2.1 臺(tái)盼藍(lán)拒染法檢測(cè)細(xì)胞活性
見表2。
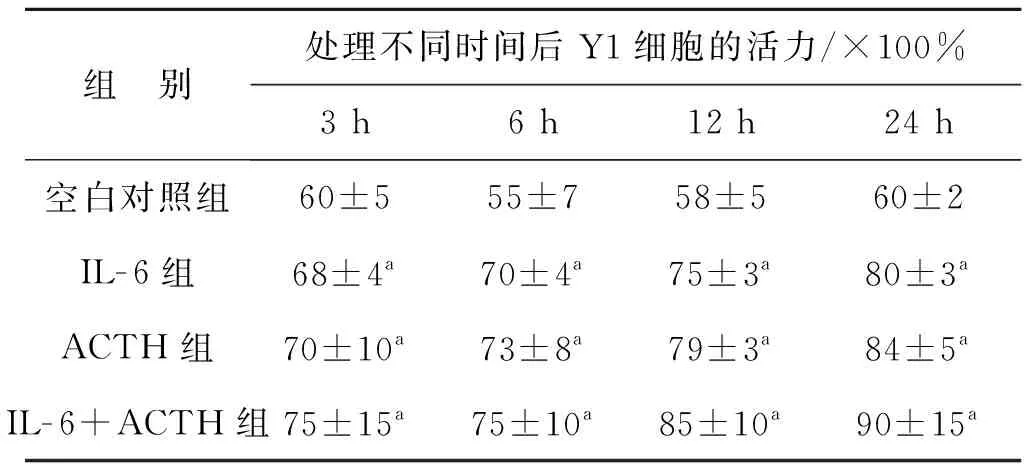
組 別處理不同時(shí)間后Y1細(xì)胞的活力/×100%3 h6 h12 h24 h空白對(duì)照組60±555±758±560±2IL-6組68±4a70±4a75±3a80±3aACTH組70±10a73±8a79±3a84±5aIL-6+ACTH組75±15a75±10a85±10a90±15a
與空白對(duì)照組比較,aP>0.05
實(shí)驗(yàn)結(jié)果顯示:IL- 6單獨(dú)或聯(lián)合ACTH處理Y1細(xì)胞不同時(shí)間后,各組的細(xì)胞活力與空白對(duì)照組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。隨著時(shí)間增加,各組細(xì)胞活力雖有明顯增強(qiáng),但差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。
2.2 IL- 6單獨(dú)或聯(lián)合ACTH處理Y1細(xì)胞后皮質(zhì)醇的合成量
見圖1。
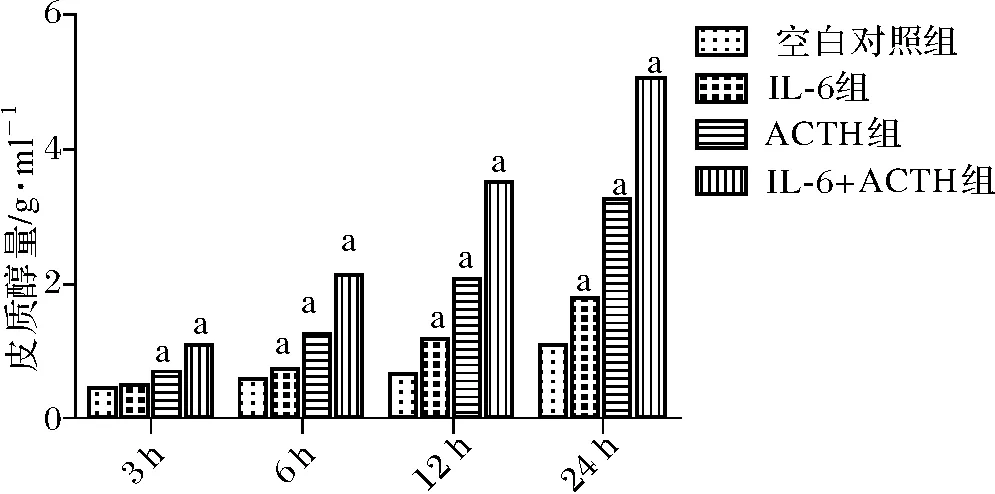
與空白對(duì)照組比較,aP<0.05
Fig1ThesynthesisofcorticosteroidinY1cellstreatedbyⅠL- 6aloneorcombinedwithACTH
實(shí)驗(yàn)結(jié)果顯示:隨著IL- 6處理Y1細(xì)胞的時(shí)間增加,皮質(zhì)醇合成量也增加,與空白對(duì)照組比較,差異有統(tǒng)計(jì)學(xué)意義(6 h后,P<0.05);ACTH處理Y1細(xì)胞不同時(shí)間段,隨時(shí)間增加,皮質(zhì)醇合成顯著增加,與空白對(duì)照組相比,差異有統(tǒng)計(jì)學(xué)意義(3 h后,P<0.05);IL- 6和ACTH聯(lián)合作用Y1細(xì)胞,隨時(shí)間增加,皮質(zhì)醇合成量進(jìn)一步上升,與空白對(duì)照組相比,差異有統(tǒng)計(jì)學(xué)意義(3 h后,P<0.05)。
2.3 IL- 6單獨(dú)或聯(lián)合ACTH處理Y1細(xì)胞后StAR mRNA的表達(dá)
見表3。
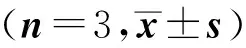
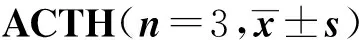
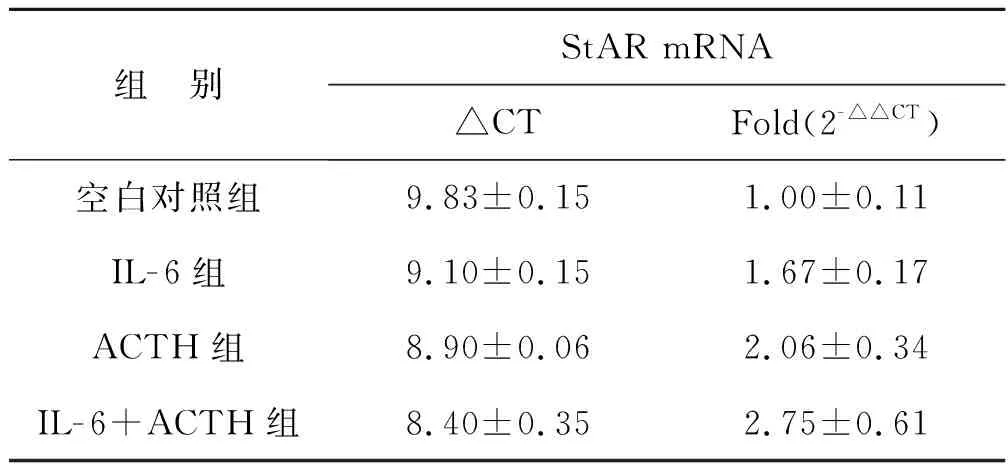
組 別StAR mRNA△CTFold(2-△△CT)空白對(duì)照組9.83±0.151.00±0.11IL-6組9.10±0.151.67±0.17ACTH組8.90±0.062.06±0.34IL-6+ACTH組8.40±0.352.75±0.61
實(shí)驗(yàn)結(jié)果顯示:IL- 6、ACTH分別作用于Y1細(xì)胞24 h后,StAR mRNA的表達(dá)增強(qiáng),與空白對(duì)照組對(duì)比有統(tǒng)計(jì)學(xué)意義(P<0.05);IL- 6和ACTH聯(lián)合處理Y1細(xì)胞24 h后,StAR mRNA的表達(dá)進(jìn)一步增強(qiáng),與空白對(duì)照組對(duì)比有統(tǒng)計(jì)學(xué)意義(P<0.05)。
3 討 論
2000年,Annane等首次提出相對(duì)腎上腺皮質(zhì)功能不全(relative adrenal cortical dysfunction,RAI)的概念:即處于嚴(yán)重應(yīng)激狀態(tài)時(shí),患者體內(nèi)的皮質(zhì)醇水平代償性升高,但升高程度或者持續(xù)時(shí)間仍不能滿足機(jī)體需要,即為RAI[1]。Dalegrave等研究發(fā)現(xiàn),內(nèi)毒素休克患者并發(fā)RAI的概率達(dá)22%~55%[2]。內(nèi)毒素休克時(shí)RAI發(fā)生機(jī)制尚不完全清楚,但內(nèi)毒素休克時(shí)大量釋放的炎性因子與腎上腺皮質(zhì)功能密切相關(guān)。IL- 6是參與內(nèi)毒素休克的重要炎癥因子之一,對(duì)腎上腺皮質(zhì)功能的影響值得進(jìn)一步探討。
近年來研究發(fā)現(xiàn),細(xì)胞因子與腎上腺皮質(zhì)激素的合成密切相關(guān):腫瘤壞死因子- α可抑制牛腎上腺皮質(zhì)細(xì)胞合成皮質(zhì)醇[3],白介素4可促進(jìn)牛腎上腺皮質(zhì)細(xì)胞合成皮質(zhì)醇[4]。體外實(shí)驗(yàn)結(jié)果表明,采用不同濃度(10~200 ng·ml-1)的IL- 6處理從腎口腺皮質(zhì)細(xì)胞不同時(shí)間(4~24 h)后皮質(zhì)醇合成量開始增加[5]。
本研究前實(shí)驗(yàn)分別用1、10、100 pg·ml-1和1、10、100、200、400 ng·ml-1的IL- 6同時(shí)處理Y1細(xì)胞,12 h后發(fā)現(xiàn),當(dāng)IL- 6濃度達(dá)1 ng·ml-1后細(xì)胞合成皮質(zhì)醇量增加,100 ng·ml-1皮質(zhì)醇合成量增加達(dá)峰值,超過100 ng·ml-1皮質(zhì)醇合成量開始下降;用100 ng·ml-1IL- 6分別處理Y1細(xì)胞3、6、12、24、48 h,發(fā)現(xiàn)作用6 h后Y1細(xì)胞合成皮質(zhì)醇量增加,24 h達(dá)到峰值,超過24 h后皮質(zhì)醇合成量開始下降;用100 ng·ml-1IL- 6聯(lián)合10-9mol·l-1ACTH處理細(xì)胞3 h后皮質(zhì)醇合成量明顯增加。這些濃度、時(shí)間差異性的產(chǎn)生可能與細(xì)胞種屬、細(xì)胞活性及培養(yǎng)環(huán)境相關(guān),也可能與實(shí)驗(yàn)試劑的質(zhì)量相關(guān)。
有研究結(jié)果顯示,IL- 6(4.8×10-9mol·L-1)處理腎上腺皮質(zhì)細(xì)胞48 h后細(xì)胞數(shù)量及細(xì)胞活力均無變化[6]。本研究用100 ng·ml-1IL- 6單獨(dú)以及聯(lián)合10-9mol·l-1ACTH共同處理Y1細(xì)胞不同時(shí)間后發(fā)現(xiàn),細(xì)胞活性與對(duì)照組相比差異無統(tǒng)計(jì)學(xué)意義。因此,后續(xù)實(shí)驗(yàn)中使用100 ng·ml-1的IL- 6及10-9mol·L-1的ACTH,排除IL- 6和(或)ACTH對(duì)Y1細(xì)胞活性的影響。
綜上所述,IL- 6可促進(jìn)Y1細(xì)胞合成皮質(zhì)醇,但其具體機(jī)制仍不明確。2004年,Rainey等[7]研究發(fā)現(xiàn)了腎上腺皮質(zhì)細(xì)胞的皮質(zhì)醇合成通路,即在腎上腺皮質(zhì)以膽固醇為基本“原料”,通過StAR介導(dǎo),進(jìn)入線粒體內(nèi)膜后經(jīng)過一系列特異性酶催化作用,包括多種形式的細(xì)胞色素P450系列酶和3β羥基固醇脫氫酶(3 beta hydroxy cholesterol dehydrogenase,3β- HSD),最終合成皮質(zhì)醇。Y1細(xì)胞系是一種研究腎上腺類固醇合成與代謝途徑中多種基因表達(dá)和調(diào)控的較好細(xì)胞模型,其功能與原代腎上腺皮質(zhì)細(xì)胞相似,受ACTH刺激后,細(xì)胞合成類固醇能力可顯著增加。本研究采用10-9mol·L-1的ACTH刺激Y1細(xì)胞后,皮質(zhì)醇合成量明顯增加,間接證明了Y1細(xì)胞活性良好。
細(xì)胞因子的生物學(xué)功能是通過與靶細(xì)胞膜表面的受體相結(jié)合并將信號(hào)傳遞到細(xì)胞內(nèi)部,進(jìn)而發(fā)揮功能。Kontogeogos等應(yīng)用免疫組化和免疫定位方法在人腎上腺皮質(zhì)的束狀帶、網(wǎng)狀帶以及球狀帶區(qū)域檢測(cè)到高水平IL- 6和IL- 6受體的表達(dá)[8]。IL- 6可能通過與Y1細(xì)胞表面IL- 6受體結(jié)合成IL- 6/IL- 6R/gp130六聚體蛋白復(fù)合物,激活細(xì)胞內(nèi)的JAK/STAT途徑和Ras/MAPK信號(hào)轉(zhuǎn)導(dǎo)途徑,影響細(xì)胞合成皮質(zhì)醇[9]。但有研究[6]結(jié)果顯示,IL- 6是通過花生四烯酸代謝途徑調(diào)節(jié)腎上腺皮質(zhì)細(xì)胞的類固醇激素分泌功能。
本研究結(jié)果提示,IL- 6聯(lián)合ACTH可明顯促進(jìn)Y1細(xì)胞合成皮質(zhì)醇,分析其原因可能是:(1) ACTH可促進(jìn)離體的牛腎上腺皮質(zhì)細(xì)胞分泌IL- 6[10]。本研究中ACTH聯(lián)合IL- 6處理Y1細(xì)胞時(shí)可能促進(jìn)Y1細(xì)胞分泌IL- 6或表達(dá)IL- 6R。(2) ACTH通過與腎上腺細(xì)胞表面受體結(jié)合后,在Ca2+調(diào)節(jié)下激活腺苷酸環(huán)化酶(adenylate cyclase,AC)產(chǎn)生第二信使環(huán)磷酸腺苷(Cyclic Adenosine Monophosphate,cAMP),進(jìn)一步激活蛋白激酶(Protein Kinase,PKA)信號(hào)轉(zhuǎn)導(dǎo)途徑,影響腎上腺細(xì)胞分泌類固醇激素[11]。曾有學(xué)者推測(cè),ACTH與IL- 6之間可能存在關(guān)于cAMP的信號(hào)串?dāng)_,共同促進(jìn)腎上腺皮質(zhì)細(xì)胞合成皮質(zhì)醇。有研究[6]發(fā)現(xiàn),IL- 6通過花生四烯酸環(huán)氧酶途徑促進(jìn)ACTH刺激狀態(tài)下的腎上腺皮質(zhì)細(xì)胞合成皮質(zhì)醇,而非ACTH依賴的cAMP途徑。
細(xì)胞因子與其受體結(jié)合后啟動(dòng)復(fù)雜的細(xì)胞內(nèi)分子間的相互作用,最終引起細(xì)胞內(nèi)基因轉(zhuǎn)錄的變化。Koldzic- Zivanovic等通過對(duì)Y1細(xì)胞中StAR以及上游的膽固醇側(cè)鏈裂解酶P450scc(cholesterol side- chain cleavage enzyme P450scc,CYP11A1)和3β- HSD的檢測(cè)發(fā)現(xiàn),IL- 10通過與ACTH共同作用來抑制上述蛋白的合成[12]。本研究亦發(fā)現(xiàn),IL- 6單獨(dú)或聯(lián)合ACTH處理Y1細(xì)胞后,StAR mRNA的表達(dá)水平上升,提示IL- 6可單獨(dú)或聯(lián)合ACTH通過促進(jìn)StAR mRNA表達(dá)增強(qiáng)Y1細(xì)胞合成皮質(zhì)醇的能力。目前,有關(guān)IL- 6對(duì)StAR mRNA表達(dá)的影響機(jī)制尚不明確。影響StAR mRNA表達(dá)的因素主要有cAMP- PKA信號(hào)通路、蛋白激酶C、花生四烯酸(arachidonic acid,AA)、類固醇合成因子- 1、X染色體基因- 1、妊娠特異性β- 1糖蛋白、類固醇誘導(dǎo)蛋白等[13]。在類固醇合成細(xì)胞中,AA從細(xì)胞器釋放是類固醇合成所必需的。許多研究結(jié)果顯示,AA與IL- 6關(guān)系密切,如AA可進(jìn)一步誘導(dǎo)缺氧狀態(tài)下的小鼠胚胎干細(xì)胞分泌IL- 6[14];IL- 6促進(jìn)體外血小板活化的機(jī)制包括AA誘導(dǎo)途徑[15]等。有報(bào)道,IL- 6通過AA代謝途徑調(diào)節(jié)腎上腺細(xì)胞分泌皮質(zhì)醇激素。研究顯示IL- 6通過抑制磷脂酶A2的活性,使AA代謝受阻,進(jìn)一步使StAR蛋白表達(dá)受到抑制而影響類固醇激素的合成[16],并且StAR蛋白表達(dá)受阻出現(xiàn)在轉(zhuǎn)錄水平[17],有可能是通過降低轉(zhuǎn)錄活性或mRNA的穩(wěn)定性實(shí)現(xiàn)的。因此,推測(cè)IL- 6對(duì)StAR mRNA表達(dá)的影響可能通過花生四烯酸脂氧酶代謝途徑進(jìn)行。探討IL- 6與ACTH共同影響StAR表達(dá)機(jī)制的文獻(xiàn)比較少,是否通過促進(jìn)cAMP誘導(dǎo)作用或花生四烯酸代謝途徑以及其他可能的調(diào)節(jié)途徑,這需要進(jìn)一步研究。
近些年來,腎上腺皮質(zhì)功能的損害在內(nèi)毒素休克發(fā)生發(fā)展中的作用已逐漸成為研究熱點(diǎn)。腎上腺皮質(zhì)功能狀態(tài)對(duì)內(nèi)毒素休克的治療和預(yù)后評(píng)估非常重要,而IL- 6是內(nèi)毒素休克發(fā)生過程中重要的細(xì)胞因子。本研究結(jié)果表明,IL- 6與腎上腺皮質(zhì)細(xì)胞功能密切相關(guān)。因此,深入探討IL- 6對(duì)腎上腺皮質(zhì)功能的影響及其機(jī)制將為臨床治療提供實(shí)驗(yàn)基礎(chǔ)和理論依據(jù)。
[1] ANNANE D,SEBILLE V,TROCHE G,et al.A 3- level prognostic classification in sepsis shock based on cortisol level and cortisol response to corticotropin[J].JAMA,2000,283(8):1038- 1045.
[2] DALEGRAVE D,SILVA R L,BECKER M,et al.Relative adrenal insufficiency as a predictor of disease severity and mortality in severe septic shock[J].Rev Bras Ter Intensiva,2012,24(4):362- 368.
[3] BARNEY M,CALL G B,MCLLMOIL C J,et al.Stimulation by interleukin- 6 and inhibition by tumor necrosis factor of cortisol release from bovine adrenal zona fasciculata cells through their receptors[J].Endocrine,2000,13(3):369- 377.
[4] WOODS A M.JUDD A M.Interleukin- 4 increases cortisol release and decreases adrenal androgen release from bovine adrenal cells[J].Domest Anim Endocrinol,2008,34(4):372- 382.
[5] WILLENBERG H S,PATH G,VOGELI T A,et al.Role of interleukin- 6 in stress response in normal and tumorous adrenal cells and during chronic inflammation[J].Ann N Y Acad Sci,2002,966:304- 314.
[6] MICHL P,BEIKLER T,ENGELHARDT D,et al.Interleukin- 3 and interleukin- 6 stimulate bovine adrenal cortisol secretion through different pathways[J].J Neuroendocrinol,2000,12(1):23- 28.
[7] RAINEY W E,SANER K,SCHIMMER B P.Adrenocortical cell lines[J].Mol Cell Endocrinology,2004,228(1- 2):23- 38.
[8] KONTOGEORGOS G,MESSINI I,KYRODIMOU E,et al.Immunohistochemical localization of interleukin- 6 in peripheral human endocrine glands[J].Endocrine,2002,17(2): 135- 140.
[9] GREENHILL C J,ROSE- JOHN S,LISSILAA R,et al.IL- 6 trans- signaling modulates TLR4- dependent inflammatory responses via STAT3[J].J Immunol,2011,186(2):1199- 1208.
[10] CALL G B,HUSEIN O F,MCLLMOIL C J,et al.Bovine adrenal cells secrete interleukin- 6 and tumor necrosis factorinvitro[J].Gen Comp Endocrinol,2000,118(2):249- 261.
[11] LIN X,TAKEMORI H,KATOH Y,et al.Salt- inducible kinase is involved in the ACTH/cAMP- dependent protein kinase signaling in Y1 mouse adrenocortical tumor cells[J].Mol Endocrinol,2001,15(8):1264- 1276.
[12] KOLDZIC- ZIVANOVIC N,TU H,JUELICH T L,et al.Regulation of adrenal glucocorticoid synthesis by interleukin- 10:A preponderance of IL- 10 receptor in the adrenal zona fasciculata[J].Brain Behav Immun,2006,20(5):460- 468.
[13] JEFCOATE C R,LEE J,CHERRADI N,et al.cAMP stimulation of StAR expression and cholesterol metabolism is modulated by co- expression of labile suppressors of transcription and mRNA turnover[J].Mol Cell Endocrinol,2011,336(1- 2):53- 62.
[14] LEE S H,LEE Y J,HAN H J.Effect of arachidonic acid on hypoxia- induced IL- 6 production in mouse ES cells:Involvement of MAPKs,NF- κB,and HIF- 1α[J].J Cell Physiol,2010,222(3):574- 585.
[15] GREMMEL T,PERKMANN T,SEIDINGER D,et al.Differential impact of inflammation on six laboratory assays measuring residual arachidonic acid- inducible platelet reactivity during dual antiplatelet therapy[J].J Atheroscler Thromb,2013,20(7):630- 645.
[16] SHEN W J,PATEL S,NATU V,et al.Interaction of hormone- sensitive lipase with steroidogenic acute regulatory protein:facilitation of cholesterol transfer in adrenal[J].J Biol Chem,2003,278(44):43870- 43876.
[17] LIU M Y,LEU S F,YANG H Y,et al.Inhibitory mechanisms of lead on steroidogenesis in MA- 10 mouse Leydig tumor cells[J].Arch Androl,2003,49(1):29- 38.

