P2X7受體在神經退行性疾病中的研究進展
胡巨偉 郭潔潔 陳曉薇 王欽文
(寧波大學醫學院,浙江 寧波 315211)
P2受體是一類與胞外核苷酸〔如三磷酸腺苷(ATP)、三磷酸尿苷(UTP)、二磷酸腺苷(ADP)等〕相結合的細胞膜受體,可分為離子通道P2X受體和G蛋白耦聯P2Y受體。目前為止,已經發現了7種P2X受體亞型(P2X1~7)和8種P2Y(P2Y1,2,4,6,11,12,13,14)受體亞型〔1〕。P2X受體家族是一類配體門控型非選擇性陽離子通道,可允許鈉、鈣、鉀等陽離子通過。與其他離子型配體門控通道受體有所區別的是,P2X7受體兼具“離子通道”功能和“孔道”功能,即P2X7受體激動劑在短時間(毫秒級)與P2X7受體結合將打開非選擇性陽離子通道;長時間(秒級)與P2X7受體結合則可在細胞膜上形成膜孔道,允許900 D以下的大分子穿膜進入胞內,提示P2X7受體可能具有與其他離子通道不同的特殊作用〔2〕。P2X7受體激活多種胞內信號通路,參與機體免疫反應、神經遞質釋放、氧化應激及細胞增殖和凋亡等〔3,4〕。由P2X7受體介導的ATP信號通路可能在神經退行性疾病的發病機制中扮演重要角色。本文就P2X7受體的結構、生理特性、信號通路及其在神經退行性疾病的最新研究進展做一綜述。
1 P2X7受體的結構特征和生理特性
P2X7受體是以ATP為配體的門控陽離子通道,屬于P2受體家族。功能性P2X7受體通常為由三個相同亞基組成的同源受體,小部分可與P2X4受體構成P2X4/7異源受體。P2X7受體亞基全長595個氨基酸,由胞內的氨基端和羧基端,兩個疏水的跨膜結構域(TM1和TM2)和一個大的細胞外環組成,細胞外環上具有ATP結合位點。P2X7受體由13個外顯子編碼,由于剪接方式的差異存在多種剪接異構體,目前已發現11種(P2X7A~K)剪接異構體〔4,5〕。其中P2X7A受體為全部13個外顯子剪接構成,表達最為廣泛。P2K7B~K為非正常剪接,與P2X7A受體相比在功能上有所差異。例如,P2X7K受體由外顯子1(編碼N末端和部分TM1)的異常剪接產生,集中表達于脾臟的淋巴細胞,受激動劑誘導后內向電流幅度弱于P2X7A受體電流〔6〕。此外,人P2X7受體還存在超過600種單核酸多態性(SNPs)。盡管絕大多數SNPs是位于內含子的同義SNP,其中仍有16個為非同義SNP,具有“功能缺失(loss-of-function)”或“功能獲得(gain-of-function)”的表型,并證實與慢性痛、肺結核、慢性淋巴細胞白血病、乳腺癌、雙相情感障礙病等疾病有關,提示P2X7受體信號通路可能是多種疾病發病機制的關鍵調節因素〔5,7〕。
P2X7受體大量表達于血源性細胞和免疫細胞。在神經系統中,P2X7受體主要表達于膠質細胞,如衛星膠質細胞、小膠質細胞、星形膠質細胞、少突膠質細胞等。有研究〔8〕指出,在部分神經元的末梢也觀察到P2X7的陽性免疫反應。激活P2X7受體能夠促使細胞因子,如白細胞介素(IL)-1β、腫瘤壞死因子(TNF)-α從衛星膠質細胞和小膠質細胞的釋放,且調節谷氨酸、γ-氨基丁酸(GABA)及ATP等神經遞質釋放。因此,在外周神經系統和中樞神經系統,P2X7受體對膠質細胞和神經元之間的信息交流和物質交換都有重要作用〔9〕。最近的研究〔10〕還關注了P2X7介導的膜孔道開放和大分子物質攝取的機制,提示了P2X7可能參與更加廣泛的細胞間信號傳遞。
2 P2X7受體的激活與下游信號通路
目前研究〔11〕表明,ATP是P2X7受體已知的唯一內源性激活劑。在生理情況下,細胞外ATP的濃度較低(pmol/L~nmol/L級),而大部分組織細胞的胞質ATP濃度約為2~5 mmol/L。作為一種遞質,ATP在囊泡中的濃度可高達100 mmol/L。在某些病理情況(如炎癥、免疫應答、細胞損傷或應激等狀態)下,激活的免疫細胞、巨噬細胞、神經小膠質細胞、血小板及凋亡細胞能夠向細胞周圍釋放高濃度的ATP,而組織創傷引起的局部炎癥也能夠誘發局部ATP濃度的顯著升高〔12〕。與其他P2X受體不同的是,P2X7受體與ATP的親和力較低,即P2X7受體僅被高濃度(>100 μm)的ATP激活;P2X7受體激活之后的通道去敏化較其他P2X受體慢,因而通道開放的時程較長。不僅如此,P2X7受體長時程的激活可導致細胞膜上形成直徑3~5 nm的非選擇性孔道(其最大可允許900 D的大分子通過)〔9,13〕。P2X7的膜孔道最初被認為由P2X7激活后引起受體變構而形成,但Pelegrin等〔14〕提出,該非選擇性膜孔道可能與膜孔道蛋白Pannexin-1有關。 P2X7受體激活引發Pannexin-1活化,從而形成可允許大分子通過的膜通道,抑制Pannexin-1阻斷了細胞對大分子的攝取,但不影響P2X7的離子通道功能。
有文獻報道,P2X7受體與多個下游胞內信號通路關聯,參與基因轉錄和翻譯過程,包括磷脂酶D(PLD)、磷脂酶(PLA)2、活化蛋白(AP)-1、核因子 (NF)-κB、p38絲裂原活化蛋白激酶(MAPKs)、細胞外信號受體激酶(ERK)、Jun-氨基端激酶 (JNK)、哺乳動物rapamycin靶蛋白(mTOR)等〔14〕。激活P2X7受體可促使小膠質細胞或巨噬細胞釋放IL-1β,并啟動NF-κB進行基因轉錄與翻譯,引發下游免疫反應〔15〕。Pelegrin等人研究發現IL-1β的釋放可能也需要Pannexin-1的活化〔14,16〕,見圖1。
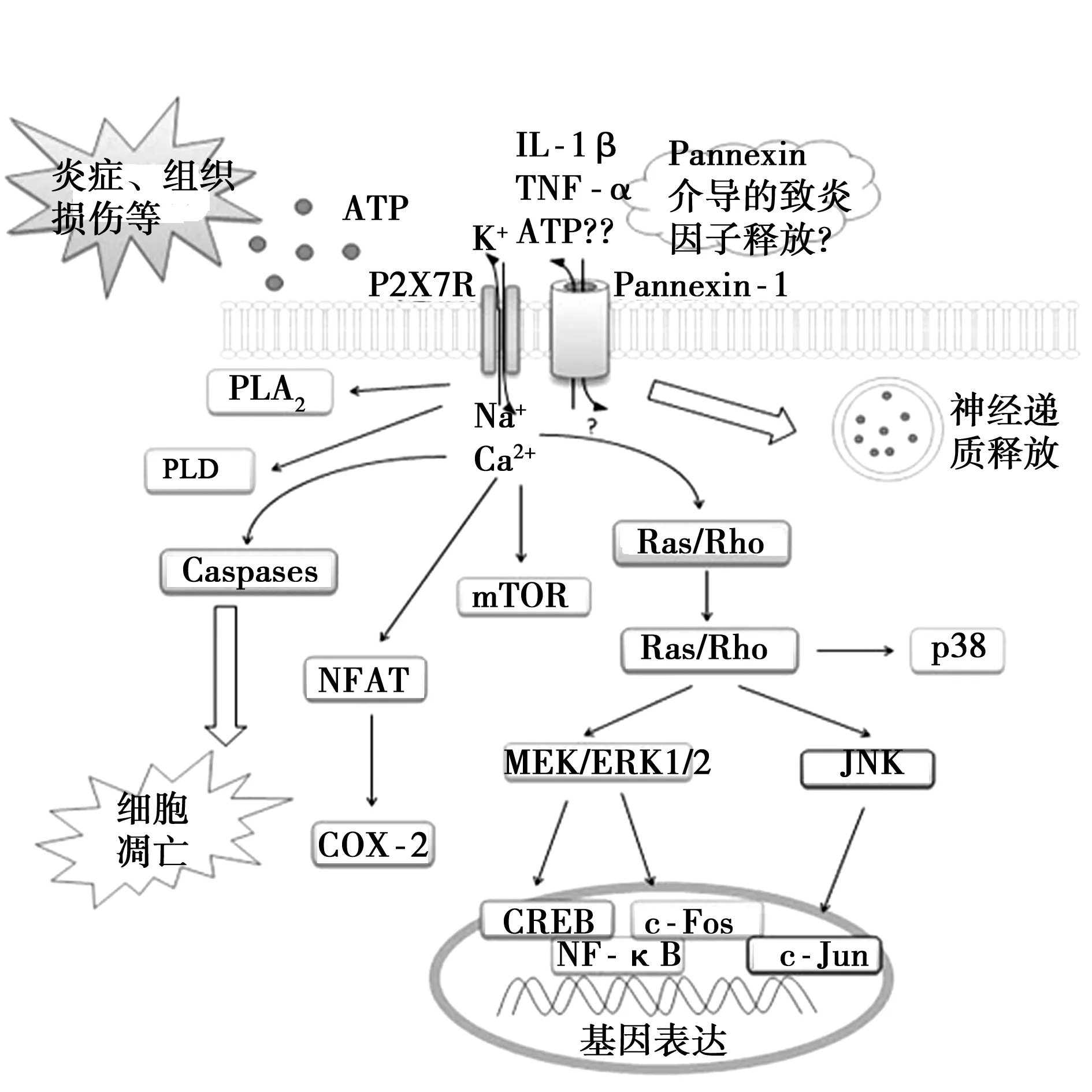
圖1 P2X7受體及其介導的胞內信號通路
有報道〔17〕指出,P2X7受體與程序性凋亡有重要關聯,但其具體的機制仍然有待進一步研究。一個可能的原因為激活P2X7受體可促使膠質細胞釋放促炎因子如IL-1β、TNF-α或ATP,從而引發周圍細胞或神經元死亡。另一方面激活P2X7受體導致大量鈣離子進入胞內,誘發鈣超載,最終也可導致細胞凋亡〔18,19〕。最新研究指出發現單獨激活P2X7受體足以誘導腸神經元死亡,而阻斷P2X7受體、Pannexin-1或caspase均能抑制炎癥誘導的神經元死亡〔20〕,提示P2X7受體誘導神經元凋亡的機制可能涉及更多因素,例如Pannexin-1介導的膜孔道開放以及Caspase通路的活化。
3 P2X7受體與神經退行性疾病
3.1P2X7受體與阿爾茨海默病(AD) AD是與老化(aging)相關最為密切的神經退行性疾病。AD典型的組織病理變化包括腦萎縮、腦皮質神經元凋亡、突觸丟失、神經元周圍出現以β-淀粉樣蛋白(Aβ)為核心的老年斑(SP)或稱神經斑、神經元內Tau蛋白異常聚集形成神經纖維纏結(NFT)等〔21,22〕。盡管誘發AD的關鍵因素尚不明確,研究〔23〕表明由細胞分泌的Aβ單體在腦神經組織中逐漸聚合為多聚體和纖絲及淀粉樣體,最終沉積形成SP。大量實驗證實Aβ聚集后具有神經毒性,破壞細胞穩態平衡,誘導神經突觸丟失,最終引起腦神經元死亡,損害大腦認知功能〔24〕。近年來,有研究〔25〕表明P2X7受體在神經退行性疾病的炎癥反應中有重要作用,提示P2X7受體可能與AD的病理過程有關。
對動物模型和AD患者的研究均發現P2X7受體的表達水平與AD進程呈正相關。無論是在Aβ1~42處理的大鼠海馬組織還是在AD轉基因小鼠(tg2576小鼠)的海馬組織,P2X7受體表達均顯著升高。在成人AD病人大腦的小膠質細胞和Aβ1~42處理的人類胎兒小膠質細胞,P2X7受體表達均顯著高于正常對照組〔26,27〕。對APPswe/PS1dE9轉基因小鼠的研究表明,P2X7受體表達水平的升高要早于組織中Aβ的沉積。P2X7受體拮抗劑BBG處理能夠阻斷P2X7受體的表達升高,對海馬內注射Aβ1~42的小鼠具有神經保護作用〔25〕。 在Aβ斑形成之前3個月,P2X7受體大量表達在CD11b+神經小膠質細胞上。P2X7受體的表達水平在APPswe/PS1dE9轉基因小鼠大腦皮層中隨著小鼠年齡的增加而增加,特別是在3~12個月增加顯著,與認知功能損傷的時間進程相一致〔28〕。
雖然P2X7受體的表達水平與AD的相關性得到了一些實驗證據的支持,但是P2X7參與AD發病進程的細胞與分子機制仍不清楚。目前的研究指出了幾種可能的機制。其一認為P2X7受體可能通過過度激活神經膠質細胞引起神經炎癥反應從而誘發神經元的凋亡。Rampe等〔29〕發現Aβ能刺激野生型小鼠小膠質細胞內Ca2+增加、ATP釋放、IL-1α、IL-1β分泌、細胞膜通透性增強,但是在P2X7受體基因敲除小鼠則沒有觀察到同樣現象。此外,P2X7受體可能參與超氧化物的激活,使還原型輔酶Ⅱ(NADPH)氧化物增多,激活活性氧(ROS)產物進而誘發突觸后蛋白PSD95的丟失,引起神經元的損傷〔30〕。這些結果顯示P2X7受體是Aβ引起的小膠質細胞激活過程中的重要參與者,由此推斷P2X7受體過度表達與炎性反應的過度激活有關,甚至可能推進了AD患者神經元缺失的進程〔31〕。
另外一些研究表明,P2X7受體可能參與了淀粉樣前體蛋白(APP)的切割過程〔32〕。APP是一個跨膜蛋白,在中樞神經系統中廣泛表達于神經元、星形膠質細胞、小膠質細胞、神經前體細胞(NPCs)中。APP可被α、β和γ三種不同的分泌酶切割。APP經由β分泌酶和γ分泌酶切割后生成的片段即為Aβ,而經由α分泌酶切割后則生成了可溶的APP片段(sAPPα),目前認為sAPPα具有神經營養作用與神經保護作用。時至今日,治療AD的一個方向為開發特異性β和γ分泌酶抑制劑,但由于β和γ分泌酶參與了多種信號通路,單純抑制β和γ分泌酶活動將帶來嚴重副作用。因而,另一治療AD的參考途徑為增強α分泌酶活性,促進APP轉向α分泌酶切割,通過競爭性抑制途徑減少Aβ產生,同時促進產生有神經營養作用的sAPPα。
有研究〔32〕證明,Neuro2a細胞中,激活P2X7受體會引起α分泌活動的減少。用P2X7受體激動劑BzATP 〔2,3-O-(4-benzoylbenzoyl)-ATP〕激活P2X7受體,可改變APP加工過程,抑制APPα分泌酶的切割,減少APP的 α碳端片段生成。使用拮抗劑阻斷P2X7受體后,或在P2X7基因敲除小鼠中,則沒有觀察到P2X7受體激動劑BzATP對α分泌酶的抑制作用。另一篇文章〔33〕也指出,在離體細胞模型中抑制P2X7受體正常或過度表達都會增強α分泌酶活性,該作用可能緣于對糖原合成酶激酶(GSK)-3的抑制作用。在J20小鼠(APP轉基因小鼠)中抑制P2X7受體可顯著降低海馬區淀粉樣斑塊密度,該作用同樣與降低GSK-3活性及增強APP的α分泌酶活性有關,提示了阻斷P2X7受體通路可能是另一個干預AD病理進程的有效手段。然而,對P2X7受體調節APP切割途徑的作用尚有爭議。另一研究〔33〕指出,在多個細胞系中(表達人類APP基因的小鼠神經母細胞瘤細胞,人類神經母細胞瘤細胞和小鼠的原代星形膠質細胞)激活P2X7受體刺激了sAPPα的釋放,使用P2X7受體拮抗劑或采用siRNA敲除P2X7受體均能阻斷該作用。P2X7依賴的sAPPα釋放與MAPK通路中的Erk1/2 和JNK1/2有關聯。但該研究中也同時也指出,該P2X7依賴的sAPPα釋放與APP的α分泌酶活性的相關性有待商榷。 雖然金屬蛋白酶(具有α分泌酶活性)抑制劑(TAPI)-2和GM6001抑制了P2X7依賴的sAPPα釋放,然而采用siRNA手段敲除多種金屬蛋白酶卻不能阻斷sAPPα釋放〔34〕,提示對于P2X7調節APP切割途徑的爭議之處尚有待于進一步的研究,值得注意的是,以上研究采用的AD模型(細胞系、原代細胞培養與轉基因小鼠)之間的差異也可能為其原因之一。
總而言之,雖然這些研究指出了P2X7受體與AD的關聯,針對P2X7受體參與AD病理機制,尤其是下游信號通路的研究仍然相對匱乏。P2X7受體可能同時激活了多條信號通路,與其他因子一起開啟了由“生理”狀態轉向“病理”狀態的開關,對P2X7受體通路的干預可能起到延緩AD發病,保護神經元結構和功能完整的作用。研究P2X7受體可能為我們更深刻了解AD復雜發病機制提供重要線索。
3.2P2X7受體與帕金森病(PD) PD主要表現為患者行動緩慢,四肢或軀體其他部分的震顫,肌肉僵硬,嗅覺失敏,快速眼動行為障礙、極度的白天困倦、抑郁、焦慮、便秘等癥狀〔35〕。PD的發病因素包括中樞運動神經退行性病變、神經通路紊亂以及多巴胺、去甲腎上腺素等中樞神經遞質的異常等。P2X7受體可能通過破壞胞內的離子平衡、調節IL-1β的釋放等影響黑質多巴胺神經元的退化過程〔36〕。已有實驗證據〔37〕指出,長時間細胞外高濃度ATP刺激P2X7受體能引起膜孔道的形成,這種情況不僅發生在黑質小膠質細胞和星形膠質細胞中,在受損的黑質多巴胺能神經元中長時間激活P2X7受體也可形成膜孔道,進而誘導多巴胺能神經元死亡。由于P2X7受體在膠質細胞中表達較多,目前認為多巴胺能神經元退變主要是由P2X7受體激活之后誘導星形膠質細胞和小膠質細胞合成及釋放多種細胞因子與信號分子引起〔38〕。有研究表明,在6-OHDA大鼠亨廷頓舞蹈病(HD)模型中,黑質的P2X7免疫反應主要存在于小膠質細胞,星形膠質細胞也有P2X7受體陽性免疫反應,且P2X7競爭性拮抗劑A-438079可阻斷6-OHDA引起的紋狀體多巴胺消耗〔39〕,因此阻斷P2X7受體是保護PD中紋狀體多巴胺的另一個可能的選擇。
3.3P2X7受體與HD HD是一種常染色體顯性的神經退行性疾病,主要癥狀表現為進程性的人格改變、運動障礙和癡呆。兒童和成年人中都可能發病〔40〕。 HD具體的發病機制尚不明確,目前認為原因之一可能為變異的亨廷頓蛋白誘導的神經元死亡。一項研究結果顯示〔41〕,在秀麗隱桿線蟲和果蠅的HD模型中,用藥物控制減少ATP的產生能減少神經元凋亡。Diaz-Hernandez等〔42〕的研究表明,在R6/1 和Tet/HD94 兩種HD小鼠模型和培養的紋狀體和皮層神經元細胞中,觀察到HD神經元的胞體和突觸末端P2X7受體表達升高及P2X7受體介導的Ca2+通透性改變。更進一步,在培養表達變異亨廷頓蛋白的神經元中,激活P2X7受體促使神經元凋亡增加。在HD小鼠體內注射P2X7受體拮抗劑BBG能減少神經元凋亡,增強運動協調性。這些證據顯示,改變P2X7受體的表達和功能能夠干預HD的病理過程,應用P2X7受體拮抗劑治療HD有可能成為一個新的方法。
3.4P2X7受體與肌萎縮性脊髓側索硬化癥(ALS) ALS是一種脊髓運動神經元、腦干、運動皮質逐漸發生退化,最終導致呼吸衰竭死亡的疾病。ALS離體模型之一采用表達超氧化物歧化酶1突變體(SOD1G93A)的星形膠質細胞。SOD1G93A星形膠質細胞可誘發神經炎性反應,模擬ALS發病進程并最終導致運動神經元凋亡。有研究證實,在運動神經元和SOD1G93A星形膠質細胞共培養的ALS離體模型中,重復加入ATP或P2X7激動劑能夠過度興奮星形膠質細胞,誘導運動神經元死亡。該作用可被P2X7選擇性拮抗劑BBG抑制。在SOD1G93A星形膠質細胞中加入P2X7受體抑制劑或者降解胞外ATP均可抑制運動神經元死亡〔19〕。因此,激活脊髓星形膠質細胞的P2X7受體誘導了運動神經元死亡。使用P2X7受體的抑制劑可能通過星型膠質細胞降低ALS的神經炎性反應,進而抑制運動神經元凋亡。
4 展 望
胞外ATP濃度升高是病理狀態(比如炎癥、細胞損傷或應激)的特征之一, P2X7受體可被高濃度ATP激活,并與多個胞內信號通路耦聯,參與免疫應答、神經遞質釋放、氧化應激及細胞凋亡等生理病理反應,因此可以將P2X7視為一個“危險開關”。越來越多的證據表明了P2X7受體及其信號通路與神經退行性疾病的關聯,但其具體機制尚不清楚。目前的研究指出,P2X7受體可能為連接神經元與神經膠質之間溝通的橋梁,通過激活神經膠質細胞釋放細胞因子/致炎因子,或通過調解神經遞質的釋放,影響神經元活動。但是最近的研究〔43〕指出了P2X7與孔道蛋白Pannexin的關聯,初步揭示了P2X7受體介導的膜孔道開放與大分子物質攝取/釋放的機制。雖然已探明的部分仍然有限,但提出了P2X7受體和Pannexin介導的膜孔道開放可能更為直接地參與了維持胞內穩態和調節細胞凋亡。遺憾的是,尚未有研究報道P2X7受體這一功能與神經退行性疾病之間的關聯。在此基礎上,深入探索P2X7受體信號傳導機制及其與神經退行性疾病的關聯,將為疾病的診斷和治療提供新的切入點和依據。
5 參考文獻
1Jarvis MF,Khakh BS.ATP-gated P2X cation-channels〔J〕. Neuropharmacology,2009; 56(1):208-15.
2Volonte C,Apolloni S,Skaper SD,etal.P2X7 receptors:channels,pores and more〔J〕.CNS Neurol Disord Drug Targets,2012;11(6):705-21.
3Surprenant A,North RA.Signaling at purinergic P2X receptors〔J〕.Annu Rev Physiol,2009;71:333-59.
4Zou J,Vetreno RP,Crews FT.ATP-P2X7 receptor signaling controls basal and TNF alpha-stimulated glial cell proliferation〔J〕.Glia,2012; 60(4):661-73.
5Sluyter R,Stokes L.Significance of P2X7 receptor variants to human health and disease〔J〕.Recent Pat DNA Gene Seq,2011;5(1):41-54.
6Masin M,Young C,Lim K,etal.Expression,assembly and function of novel C-terminal truncated variants of the mouse P2X7 receptor:re-evaluation of P2X7 knockouts〔J〕.Br J Pharmacol,2012;165(4):978-93.
7Sorge RE,Trang T,Dorfman R,etal.Genetically determined P2X7 receptor pore formation regulates variability in chronic pain sensitivity〔J〕.Nat Med,2012;18(4):595-9.
8Miras Portugal MT,Diaz-Hernandez M,Giraldez L,etal.P2X7 receptors in rat brain:presence in synaptic terninals and granule cells〔J〕. Neurochem Res,2003;28(10):1597-605.
9Weisman GA,Camden JM,Peterson TS,etal.P2 receptors for extracellular nucleotides in the central nervous system:role of P2X7 and P2Y(2) receptor interactions in neuroinflammation 〔J〕.Mol Neurobiol,2012;46(1):96-113.
10Suh BC,Kim JS,Namgung U,etal.P2X7 nucleotide receptor mediation of membrane pore formation and superoxide generation in human promyelocytes and neutrophils〔J〕.J Immunol,2001;166(11):6754-63.
11Le Feuvre R,Brough D,Rothwell N.Extracellular ATP and P2X7 receptors in neurodegeneration〔J〕.Eur J Pharmacol,2002;447(2-3):261-9.
12Burnstock G.Purinergic signalling and disorders of the central nervous system〔J〕.Nat Rev Drug Discov,2008;7(7):575-90.
13Takenouchi T,Sekiyama K,Sekigawa A,etal.P2X7 receptor signaling pathway as a therapeutic target for neurodegenerative diseases〔J〕.Arch Immunol Ther Exp,2010;58(2):91-6.
14Pelegrin P,Surprenant A.Pannexin-1 couples to maitotoxin- and nigericin-induced interleukin-1beta release through a dye uptake-independent pathway〔J〕.J Biol Chem,2007;282(4):2386-94.
15Duan S,Neary JT.P2X(7) receptors:properties and relevance to CNS function〔J〕.Glia,2006;54(7):738-46.
16Pelegrin P,Surprenant A.The P2X(7) receptor-pannexin connection to dye uptake and IL-1beta release〔J〕.Purinergic Signal,2009;5(2):129-37.
17Elliott JL,Surprenant A,Marelli Berg FM,etal.Membrane phosphatidylserine distribution as a non-apoptotic signalling mechanism in lymphocytes〔J〕.Nature Cell Biol,2005;7(8):808-16.
18Zhang X,Zhang M,Laties AM,etal.Stimulation of P2X7 receptors elevates Ca2+and kills retinal ganglion cells〔J〕.Invest Ophthalmol Vis Sci,2005;46(6):2183-91.
19Gandelman M,Peluffo H,Beckman JS,etal.Extracellular ATP and the P2X7 receptor in astrocyte-mediated motor neuron death:implications for amyotrophic lateral sclerosis〔J〕.J Neuroinflamm,2010;7:33.
20Gulbransen BD,Bashashati M,Hirota SA,etal.Activation of neuronal P2X7 receptor-pannexin-1 mediates death of enteric neurons during colitis〔J〕.Nat Med,2012;18(4):600-4.
21Matenia D,Mandelkow EM.The tau of MARK:a polarized view of the cytoskeleton〔J〕.Trends Biochem Sci,2009; 34(7):332-42.
22Meraz-Rios MA,Lira-De Leon KI,Campos-Pena V,etal.Tau oligomers and aggregation in Alzheimer′s disease〔J〕.J Neurochem,2010;12(6):1353-67.
23Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer′s disease:progress and problems on the road to therapeutics〔J〕.Science,2002;297(5580):353-6.
24Lacor PN,Buniel MC,Furlow PW,etal.Abeta oligomer-induced aberrations in synapse composition,shape,and density provide a molecular basis for loss of connectivity in Alzheimer′s disease〔J〕.J Neurosci,2007;27(4):796-807.
25Ryu JK,McLarnon JG.Block of purinergic P2X(7) receptor is neuroprotective in an animal model of Alzheimer′s disease〔J〕.Neuroreport,2008;19(17):1715-9.
26Parvathenani LK,Tertyshnikova S,Greco CR,etal.P2X7 mediates superoxide production in primary microglia and is up-regulated in a transgenic mouse model of Alzheimer′s disease〔J〕.J Biol Chem,2003; 278(15):13309-17.
27McLarnon JG,Ryu JK,Walker DG,etal.Upregulated expression of purinergic P2X(7) receptor in Alzheimer disease and amyloid-beta peptide-treated microglia and in peptide-injected rat hippocampus〔J〕.J Neuropathol Exp Neurol,2006; 65(11):1090-7.
28Lee HG,Won SM,Gwag BJ,etal.Microglial P2X(7) receptor expression is accompanied by neuronal damage in the cerebral cortex of the APPswe/PS1dE9 mouse model of Alzheimer′s disease〔J〕.Exp Mol Med,2011; 43(1):7-14.
29Rampe D,Wang L,Ringheim GE.P2X7 receptor modulation of beta-amyloid- and LPS-induced cytokine secretion from human macrophages and microglia〔J〕.J Neuroimmunol,2004;147(1-2):56-61.
30Parvathenani LK,Tertyshnikova S,Greco CR,etal.P2X7 mediates superoxide production in primary microglia and is up-regulated in a transgenic mouse model of Alzheimer′s disease〔J〕.J Biol Chem,2003;278(15):13309-17.
31Sanz JM,Chiozzi P,Ferrari D,etal.Activation of microglia by amyloid {beta} requires P2X7 receptor expression〔J〕.J Immunol,2009;182(7):4378-85.
32Leon-Otegui M,Gomez-Villafuertes R,Diaz-Hernandez JI,etal. Opposite effects of P2X7 and P2Y2 nucleotide receptors on alpha-secretase-dependent APP processing in Neuro-2a cells〔J〕.FEBS Lett,2011;585(14):2255-62.
33Diaz-Hernandez JI,Gomez-Villafuertes R,Leon-Otegui M,etal.In vivo P2X7 inhibition reduces amyloid plaques in Alzheimer′s disease through GSK3beta and secretases 〔J〕.Neurobiol Aging,2012;33(8):1816-28.
34Delarasse C,Auger R,Gonnord P,etal.The purinergic receptor P2X7 triggers alpha-secretase-dependent processing of the amyloid precursor protein〔J〕.J Biol Chem,2011;286(4):2596-606.
35Weerkamp N,Nijhof A,Tissingh G.Non-motor symptoms of Parkinson′s disease 〔J〕.Ned Tijdschr Geneeskd,2012;156(8):A3926.
36Ferrari D,Pizzirani C,Adinolfi E,etal.The P2X7 receptor:a key player in IL-1 processing and release〔J〕.J Immunol,2006;176(7):3877-83.
37Surprenant A,Rassendren F,Kawashima E,etal.The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor(P2X7)〔J〕. Science,1996;272(5262):735-8.
38Fuxe K,Manger P,Genedani S,etal.The nigrostriatal DA pathway and Parkinson′s disease〔J〕.J Neural Transm Suppl,2006;(70):71-83.
39Marcellino D,Suarez-Boomgaard D,Sanchez-Reina MD,etal.On the role of P2X(7) receptors in dopamine nerve cell degeneration in a rat model of Parkinson′s disease:studies with the P2X(7) receptor antagonist A-438079〔J〕.J Neural Transm,2010;117(6):681-7.
40Zheng Z,Diamond MI.Huntington disease and the huntingtin protein〔J〕.Prog Molec Biol Transl Sci,2012;107:189-214.
41Varma H,Cheng R,Voisine C,etal.Inhibitors of metabolism rescue cell death in Huntington′s disease models〔J〕.Proc Natl Acad Sci USA,2007;104(36):14525-30.
42Diaz-Hernandez M,Diez-Zaera M,Sanchez-Nogueiro J,etal.Altered P2X7-receptor level and function in mouse models of Huntington′s disease and therapeutic efficacy of antagonist administration〔J〕.Faseb J,2009;23(6):1893-906.
43Pelegrin P,Surprenant A.Pannexin-1 mediates large pore formation and interleukin-1beta release by the ATP-gated P2X7 receptor〔J〕.EMBO J,2006;25(21):5071-82.

