單氰氨誘導巨峰葡萄休眠解除過程中重要基因表達的差異
曹慕明,陳國品,李洪艷,韓佳宇,盤豐平,謝蜀豫,白先進,王 博,黃 露,文仁德
(1.廣西農業科學院葡萄與葡萄酒研究所,廣西 南寧 530007;2.廣西大學,廣西 南寧 530004)
對自然休眠進程調控是目前果樹設施栽培中亟待解決的問題。利用藥劑處理打破落葉果樹休眠的研究國內不多,更缺乏應用于生產實踐的報道。在國外,這方面的研究和應用較多[1-2]。應用化學物質打破葡萄休眠,促進植物反季節生產是研究的熱點之一。國內外目前常用于打破休眠的化學物質有礦物油、含氮化合物、含硫化合物和生長調節劑,如氰氨基化鈣、H2CN2、石灰氮、TDZ、GA3、6-BA和單氰氨等,都是很有效的破眠物質[3]。
隨著單氰氨的逐步推廣,研究單氰氨調控促進葡萄萌芽的生理效應以及分子作用機理方面已顯得越來越重要,葡萄分子生物學研究也逐漸得到重視。
該研究在本課題組單氰氨誘導葡萄解除休眠技術以及生理機理研究[4-5]的基礎上,以巨峰葡萄品種為材料,利用cDNA-SRAP技術分析葡萄在單氰氨調控作用下基因差異表達情況,進而探討單氰氨調控葡萄萌芽的分子機理,為單氰氨的進一步推廣應用提供理論依據。
1 材料與方法
1.1 植物材料
葡萄品種為巨峰葡萄,由廣西農業科學院葡萄與葡萄酒研究所提供,為常規露地栽培模式。試驗所需試劑、酶類、SRAP分析所用引物購自上海生工、Promega公司、Fermentas公司和 New Englad公司;藥劑單氰胺購自寧夏大榮生物公司。
1.2 單氰氨處理及采樣
對結果枝進行摘葉后,每樹留枝(正常老熟)16~17條,每枝留8~10芽進行回縮修剪,之后用棉球浸蘸2.5%單氰氨溶液涂抹剪口芽以下的第一、第二芽(剪口芽不涂藥);對照枝條進行同樣修剪,修剪后噴清水。
試驗處理其它大田管理按正常的葡萄生產技術進行管理。處理后 0、12、24、36、48h分別對葡萄剪口芽以下的第一、第二芽進行取樣,每次取樣時處理和對照各取30個芽,取樣后樣品立即進行RNA分離或小心剝離芽體鱗皮,去污后經液氮速凍后貯存于-80℃備用。
1.3 模板的制備
1.3.1 總RNA的分離及其純度和完整性檢測
用于RNA提取和逆轉錄的溶液均用0.1%(體積分數)DEPC處理水配制;所用的塑料制品均用0.1%DEPC浸泡2d、高壓滅菌并烘干后備用,玻璃器皿經200℃烘烤3h。
提取緩沖液:0.1mol/LTris-硼酸緩沖液(pH 8.0),其中含 30g/L CTAB,2.0mol/L NaCl,30mmol/L EDTA-Na2,5%β-巰基乙醇(用前加入)。12mol/L LiCl,氯仿,75%乙醇(DEPC處理 H2O配制)。其中H2ODEPCRS:含10%RNAsafe(天為時代公司產品)的DEPC處理H2O。DNaseⅠ(TaKaRa公司產品)。2×Taq PCR Oligo(Dt)18 primer,SRAP 引物以及Master Mix酶(上海生物工程有限公司);反轉錄試劑購自TOYOBO公司。其余生化試劑苯酚、氯仿、無水乙醇、冰醋酸、Tris、EDTA、β-巰基乙醇、SDS均為國產分析純,TAE緩沖液加0.1%DEPC處理12h后,滅菌后備用。
實驗具體操作如下:
(1)向1.5mL離心管中加入600uL SDS提取液,60uL β-巰基乙醇,300uL Tris苯酚和 300uL氯仿,將葡萄葉片用液氮研磨后迅速加入離心管中(每管不超過0.2g材料),用旋渦震蕩器劇烈震蕩 3min,于 4℃低溫,12000rpm,離心 5min。
(2)取上清液至1.5mL離心管中,加入等體積的氯仿,用旋渦震蕩器劇烈震蕩3min,于4℃低溫,12000rpm,離心 5min。
(3)重復(2)1次。
(4)取上清液至1.5mL離心管中,向上清液中加入等體積的4M LiCl和上清液1/2體積的無水乙醇,混勻后放置冰上10min,于4℃低溫,12000rpm,離心10min,小心棄去上清液,收集沉淀,用75%乙醇洗滌2次,無水乙醇2次,稍晾干。
(5)沉淀溶于適量DEPC水中,加入等體積的氯仿,用旋渦震蕩器劇烈震蕩3min,于4℃低溫,12000rpm,離心 5min。
(6)重復(5)1次。
(7)取上清液至1.5ml離心管中,向上清液中加入2倍體積的無水乙醇,混勻后放置冰上10min,于 4℃低溫,12000rpm,離心 10min,小心棄去上清液,收集沉淀,用75%乙醇洗滌2次,無水乙醇2次,稍晾干。
⑧沉淀溶于適量DEPC水中,-80℃保存備用。
取RNA樣品4μL,用DEPC水稀釋至1mL,混勻,在TU1800SPC紫外分光光度計測定230~280nm波長范圍內的吸光值,并計算OD260nm/OD280nm和OD260nm/OD230nm比值,以檢測樣品的純度。根據 RNA(μg/μL)=OD260nm×40mg/L×稀釋倍數/1000,計算樣品的RNA濃度。用1.0%瓊脂糖凝膠在1×TBE(Tris硼酸EDTA)緩沖系統下進行電泳檢測其完整性。
1.3.2 cDNA第一鏈的合成
cDNA第一鏈的合成是采用上海生物工程有限公司生產的M一MuLv(RNaseH一)進行的RNA反轉錄,參照M-MULV反轉錄試劑盒使用說明書,具體操作如下:
(1)在冰上加入下列反應混合物混合:
總 RNA(100nng/μL) 4μL
Oligo(Dt)18primer(50μΜ)2.5μL
DEPC處理水 Up to 30μL;
(2)離心3~5s,在70℃條件下保溫5min后,迅速冰上冷卻并加入下列成分:
5×反應緩沖液 6.0μL
10mM dNTPs 2.0μL
RNA 酶抑制劑(20∪/μL) 1.0μL
(3)離心3~5s,在37℃條件下保溫5min后在冰上加入下列成分:
M-Mulv反轉錄酶(200∪/μL) 1.0μL
(4)混合,在42℃條件下保溫90min,移入85℃保溫10min,產物直接用于cDNA第二鏈合成或保存于-80℃備用。
1.3.3 cDNA第二鏈的合成
第二鏈的合成反應體系如下:
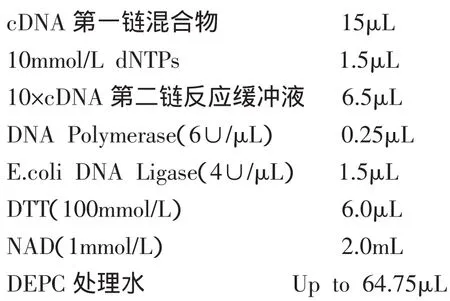
將上述反應混合液置于16℃條件下冰浴30min,加入 RNase H(60∪/μL)0.25μL混勻,16℃繼續冰浴4h后轉移到22℃保溫2h,置換合成cDNA第二鏈。
1.3.4 cDNA的純化
(1)加6倍體積的ddH2O到1倍體積的cDNA中,混勻。
(2)用等體積的氯仿抽提,12000rpm離心5min。
(3)取上清液,加入2倍體積的無水乙醇并置于-20℃環境中1h。
(4)混合液于12000rpm離心10min,棄上清,將沉淀溶于適量的ddH2O或TE(pH8.0)中。
1.4 SRAP-PCR擴增
根據L和Q等[6]設計SRAP引物序列方法,選用不同的3’端選擇堿基,共設計了64條正向引物序列和64條反向引物,由上海生工合成。該實驗選擇性地選用了540對引物組合。
擴增體系和程序主要參考L和Q等[6]提供的方法,略加更改。PCR擴增反應體系如表1。
PCR反應程序按下列參數進行:
94℃預變性5min;
94℃ lmin,35℃ lmin,72℃ 1min,5個循環;
94℃ lmin,50℃ lmin,72℃ 1min,35個循環;72℃延伸 10min。
1.5 非變性丙烯酞胺凝膠電泳檢測
電泳檢測采用Budowle[7]和Bassan[8]的方法稍作修改后進行。配膠一灌膠一凝固一取梳子一電泳,本實驗采用6%的聚丙烯酰胺凝膠包括:6%的聚丙烯酰胺、0.04%過硫酸膠、0.1%TEMED。
(1)擴增后的SRAP產物加入2μL上樣緩沖液,上樣量2μL,電泳緩沖液是0.5xTBE。在DYCz-30型電泳槽上進行,150mA恒流電泳35min。
(2)切斷電源,取下膠板,剝下凝膠,放入300mL固定液中,輕輕搖動12min。
(3)倒掉固定液,加300ml染色液中,輕輕搖動12min。
(4)從染色液中取出凝膠,放入500mL的雙蒸水中,漂洗1~2min,再轉入雙蒸水中漂洗1~2min;
(5)凝膠浸入顯色液,輕輕搖動約5~8min,至出現清晰譜帶。
(6)待凝膠完全顯色后,讀取cDNA片段大小(根據100bp DNA Marker確定)及帶型。
1.6 SRAP二次擴增及電泳檢
選擇有差異條帶出現的SRAP引物,進行二次擴增,體系與1.4相同,電泳檢測與1.5相同。
1.7 聚丙烯酞胺凝膠回收差異片段
用改進的Maxam和Gilbert[9]的破碎浸泡法回收cDNA差異片段。步驟如下:
(1)用手術刀片把二次擴增具有同樣差異的目的帶切割下來。
(2)把切下來的膠片放入離心管中,用槍頭在管中把膠片搗碎。
(3)估計碎膠片的體積,加入2倍體積的Elution Buffer。
(4)蓋上蓋子,常溫下12h。
(5)在 4℃下,12000rpm 離心 10min,移上清液于另一個離心管中(注意不要帶有凝膠碎塊)。
(6)加0.5倍體積Elution Buffer于殘渣中,輕輕渦旋2min,離心(同上)取上清移到原上清液的管中。
(7)用帶有濾網的注射器把上清液中所有的凝膠殘片過濾掉。
(8)用酚:氯仿(1∶1)200μL純化提出的 DNA,(以除去SDS)離心(同上)取上清液于另一管中。
(9)用乙醇沉淀DNA,離心(同上),倒掉上清液,干燥后用200μL TE溶解DNA,及25μL的醋酸鈉(3M),再加2倍體積的乙醇再次沉淀DNA。
(10)小心用70%的乙醇洗滌沉淀,干燥后用10μL TE 溶解 Cdna。
(11)作檢測并進行隨后實驗(以原來的片段擴增帶 Marker)。
1.8 回收片段再次擴增及檢測
把1.7回收所得的片段,用相同的引物進行擴增,以備瓊脂糖凝膠回收使用。體系擴大5倍,程序與1.6相同。所得PCR產物進行瓊脂糖凝膠電泳檢測,緩沖液為lxTAE,原回收cDNA片段為對照。
1.9 瓊脂糖凝膠DNA回收
瓊脂糖凝膠回收利用上海華舜生物工程有限公司生產的膠回收(小量)試劑盒(W5611)回收純化目的片段,步驟如下:
(1)在W1洗脫液中加入48mL無水乙醇。
(2)割下含cDNA的瓊脂糖塊,使它盡可能小,放入1.5mL離心管中。
(3)按每100mg瓊脂糖塊加300μL SA液的比例加入SA液,100mg以下的凝膠加300μL凝膠裂解液SA,置40℃水浴10min,使瓊脂塊完全溶化,每2min顛倒混勻1次。
(4)將溶化后的瓊脂糖移入吸附柱,12000rpm離心30s,倒掉收集管中液體,再將吸附柱放入收集管。

表1PCR擴增反應體系
(5)在吸附柱中加入500μL w1液,12000rpm離心15s,倒掉收集管中液體,將吸附柱放入收集管。
(6)在吸附柱中加入500μL w1液,靜置1min后,12000rpm離心15s,倒掉收集管中液體,將吸附柱放入收集管。
(7)12000rpm 離心lmin。
(8)將吸附柱放入1個干凈的1.5mL的離心管中,在吸附膜中央加入2mMTris30μL,靜置1min后,離心 lmin,將 1.5mL的離心管(cDNA)貯存于-20℃。
1.10 目的片段的生物克隆
1.1 0.1 DH5a感受態的制備
采用《分子克隆實驗指南》中所述氯化鈣二次重懸法:
①從DH5a的LB平板上挑取1個單菌落接種于三角瓶中加20mL LB液體培養基。
②37℃、225rpm培養過夜至OD600=0.5左右。
③吸取200μL菌液接種于新鮮的20mL LB液體培養基中。
④37℃下 225~250rpm培養約 2.5~4h至OD600=0.5左右。
⑤將菌液轉入1個50mL無菌離心管中,冰浴10min。
⑥5000rpm,4℃,離心 6min。
⑦棄上清液,用8mL冰預冷的0.lmol/L CaCl2輕輕重懸菌體至均勻。
⑧冰水浴30min。
⑨5000rpm,4℃,離心 6min。
⑩棄上清液,用冰預冷的0.lmol/L CaCl2輕輕重懸菌體至均勻。
?加無菌甘油至終濃度12.5%左右,分成每管100μL的小份,于-70℃保存備用。1.10.2 cDNA回收片段與pMD18.Tvector載體的連接
①在冰水浴上向一個500mL無菌離心管中混合以下試劑,總體積為10μL:
目的cDNA 4.5μL
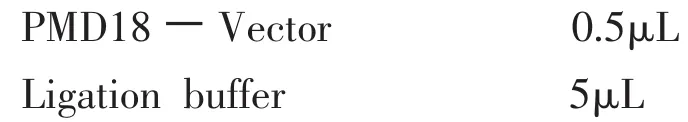
②混合液于16℃連接10~12h或過夜。1.10.3 cDNA與PMD18-T Vector的連接產物轉化DH5a感受態
①將10μL連接產物輕輕加入1管DH5a感受態中,輕輕混勻。
②冰水浴30min。
③42℃熱激90s。
④迅速冰水浴2min。
⑤加入900μL室溫LB液體培養基。
⑥37℃,180rpm復蘇培養60~90min,同時在37℃預熱一個LB/Amp平板。
⑦先在平板上涂布20μL X-gal和5μL IPTG。
⑧復蘇時間到后取出試管,于5000rpm離心5min。
⑨吸去900μL上清液,用余下的100μL上清液重懸菌體至均勻。
⑩將重懸的菌體均勻涂布于平板上。
1.1 0.4 轉化重組載體后的DH5a單斑菌液的培養和菌液PCR鑒定
①當轉化目標cDNA片段的DH5a重組子的單斑在37℃培養18h左右,菌斑長至直徑約2mm大小時,取出平板。
②將平板在4℃冰箱放置1h左右,待藍白斑區分明顯。
③用滅菌了的白色的移液槍槍頭挑取白色的單菌斑于將有1mL LB液體培養基和5mmol AMP的1.5mL無菌離心管中。
④在37℃,225~250rpm的恒溫培養箱中培養單斑菌液8~10h。
⑤以單斑菌液為模板,用與擴增目標片段時基本相同的條件,作目標片段的長度檢測。
做菌液PCR檢測時,反應體系和程序和生成目的片段的PCR反應一致。
⑥對菌液PCR產物進行瓊脂糖凝膠電泳及熒光染色檢測。
1.11 重組克隆的反向Northern鑒定
采用Roche的地高辛標記和檢測試劑盒(DIG High Prime DNA Labeling and Detection Starter KitlⅢ)進行雜交檢測,方法按產品說明書。
(1)探針標記。取差減PCR產物1μL,加無菌去離子水15μL,PCR儀上98℃變性10min,立即冰浴10min。徹底混勻 DIG-High Prime,取 4μL加入變性樣品中。短暫離心,37℃標記過夜,65℃加熱10min,中止標記反應。
(2)菌落PCR產物斑點印跡膜制備。
①將帶正電荷的尼龍膜裁成合適大小,將其置于濾紙上。
②在各菌落PCR樣品中加入菌落PCR產物,在98℃變性10min,立即冰浴10min,將各管離心5s。
③用微量加樣器吸取樣品1μL點于膜上,使其晾干。點兩張相同的膜,分別與正向和反向探針雜交。
(3)雜交與檢測。方法按產品說明書。
1.12 陽性轉化重組子的測序和序列的生物信息學分析
陽性克隆子的測序工作由上海英駿生物工程技術服務有限公司(Invitrogen,China)商業化完成,采用通用引物M13F/M13R組合起始測序。
序 列 對 比 在 NCBI(http://www.ncbi.nlm.ih.gov/網站上進行。
2 結果與分析
2.1 模板制備
利用SDS法從葡萄的鱗芽中提取的總RNA,先在1500rpm、4℃離心去除葡萄組織,然后進行飽和酚抽提2遍后再用氯仿抽提,能有效減少RNA樣品中多糖等次生代謝物的污染,提高RNA的質量。從電泳結果看(圖1),利用該方法從葡萄的鱗芽中提取的RNA在瓊脂糖凝膠電泳中28、18s和5s 3條帶型清晰整齊,完整性好,無DNA污染,而28SrRNA帶的亮度明顯大于18s條帶,泳道中無背景,未見蛋白質和多糖,沒有明顯的降解;樣品的OD260/0D280介于1.8~2.0之間,說明該方法提到的總RNA中蛋白質污染很少,純度較高,總RNA完整性好。

圖1 總RNA(1、2葡萄芽總RNA)的電泳圖
2.2 單氰氨調控葡萄基因的表達
2.2.1 電泳結果分析
在葡萄芽體萌動前分別利用單氰氨和清水進行處理,然后進行基因差異表達研究。結果表明處理和對照在聚丙烯酞胺變性凝膠電泳中顯示條帶都比較多,條帶數量范圍在5~20條之間,其中大多數在10條左右,處理和對照的電泳結果顯示,在單氰胺作用下,葡萄的基因部分受誘導表達、部分受抑制,兩者之間差異明顯(圖2)。

圖2 電泳結果差異表達分析Marker:DL2000
2.2.2 單氰氨調控基因的篩選
我們利用540對引物組合對單氰氨處理和對照的葡萄芽體RNA混合池的樣品進行差異表達分析,處理和對照共獲得1200多條穩定條帶,長度在50~500bP之間。2次PCR重復擴增重復率為62.7%,兩次擴增在對照和處理混合池間表現相同的差異片段有10條,長度在50~500bP之間(圖3)。經變性膠電泳展示后,對重復性較好的差異表達的片段進行回收分析。
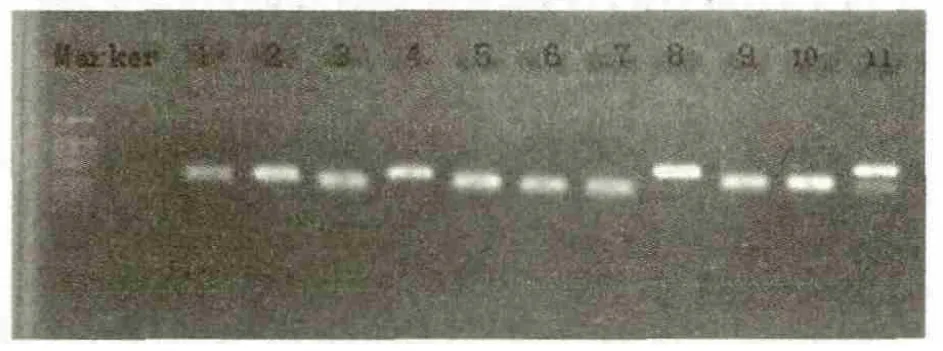
圖3 回收TDFs電泳檢測1-11:回收 TDFs;Marker:DL2000
在綜合分析各引物組合擴增產物的電泳展示結果的基礎上,對部分擴增穩定、重復性好、差異較為明顯的片段進行反向Northern雜交驗證(圖4)。反向Northern雜交結果分析發現:在雜交的10個樣品中,6個差異明顯,4個沒有差異。這表明在所回收的差異片段中,假陽性條帶占有較高的比例。
2.2.3 差異片段序列分析
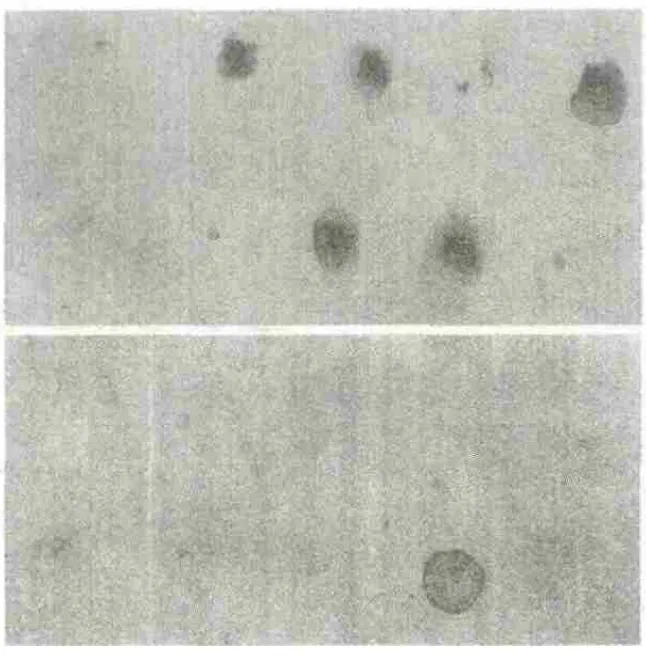
圖4 反向Northern雜交(上:處理;下:對照)
從反向Northern雜交結果陽性的TDFs中選取6個片段進行克隆和序列分析,并把它們BLAST比較的部分信息列于表2。從克隆所得的3個TDFs中Esc1的序列和數據庫中的編碼過氧化氫酶的基因序列具有較高的同源性;另外2個TDFs沒有在NCBI數據庫中找到相似的序列。

表2 部分差異片段序列分析結果
ATCCCCGGGTACCGAGCTCGAATTCGTAAT CATGGTCATAGCTGTTTCCTGTGTGAAATTGTTA TCCGCTCACAATTCCACACAACATACGAGCCGG AAG(過氧化氫酶)
2個未知功能的克隆差異片段序列(Esc2、Esc3)
GTTCGCTCCAAGCTGGGCTGTGTGCACGAA CCCCCCGTTCAGCCCGACCGCTGCGCCTTATCC GGT
CTGAAACACTGCTGGTTGATTAACGTAGTT CTGAATATCAGGCGTGCCGGGTGATATGATAGG TACGTTGCTGTAACTATATTTTGAGAGCAGCAG TAAGACGCTCAGCATAAAATCATCTGTTGCAAT TCGTACGCAGGCAAATGGTCTGGCACTGGCCAA
3 討論與結論
Halaly[10]展示了HC和HS處理對選定基因表達形式影響的比較研究,兩種處理均誘導CAT、ADH和PDC的表達。然而,HS處理的葡萄芽中變化發生得較早,而HC處理的芽內側更強烈。據研究在正常生長條件下,玉米CAT1在盾片、葉、上胚軸及未成熟果實內表達,CAT2主要在種子萌發后的盾片中表達[11]。Norflurazon(NF)誘導玉米CAT1、CAT2轉錄水平的提高主要發生在葉內,在盾片中無明顯變化[12]。創傷誘導玉米CAT1、CAT2和CAT3在幼胚中表達,而在幼葉中只有CAT1和CAT3表達[13]。臭氧誘導玉米CAT1和CAT3表達而抑制CAT2表達,在外源ABA作用下,CAT1表達,CAT3不變,而CAT2則降低[14-15],光誘導玉米CAT2在葉發育過程中的表達在翻譯水平受到控制,黑暗抑制mRNA翻譯多肽的延伸,從而抑制CAT2的表達[16]。趙亞男等的研究表明:層積處理可使鉛筆柏種子內脂肪及蛋白質降解,氨基酸過氧化氫酶活性提高1倍,層積期間由于胞間聯絲的恢復,增強膜的透性,氧化酶和水解酶活性增加,呼吸作用加強,產生了大量ATP并為種子萌發提供了原動力[17]。黨海山等[18]的研究表明:在萌發初期(萌發前3d)GA3處理,可以顯著地提高毛柄小勾兒茶種子中過氧化物酶的活性,從而促進休眠解除,提高了萌芽率。SOD、POD和CAT是膜脂過氧化防御系統的主要保護酶,它們保持較高的活性可以迅速清除積累的活性氧,避免細胞膜發生膜脂過氧化,使細胞得到保護,從而提高植物的抗逆性[19]。由前人的研究結果可知,在不同的組織、器官、發育時期及環境條件下,CAT基因表達具有精細的調控機制;而在人為解除植物組織休眠方面的研究結果表明,適宜的外界環境脅迫或物質誘導下,休眠組織的過氧化氫酶活性提高而提早解除休眠,但具體CAT1、CAT2和CAT3基因表達的精細調控有待進一步研究。另外張運濤等[20]的研究結果單氰胺是一種植物休眠終止劑,它可有效地抑制植物體內過氧化氫酶的活性,加速植物體內氧化磷酸戊糖(PPP)循環,從而加速植物體內基礎性物質的生成,刺激作物生長,終止休眠。
本研究表明:經單氰氨誘導葡萄休眠芽體,能比對照提早12d左右萌芽[5],單氰氨處理后與對照的葡萄芽體基因表達出現了變化,用cDNASRAP技術分離了一些差異表達的基因,對在變性聚丙烯酰胺凝膠電泳檢測中差異明顯、重復性好、穩定性高的差異片段進行回收克隆,獲得了一批差異表達的基因。經反向Northern鑒定,得到了6個陽性克隆,進行測序。用BLASTx在NCBI數據庫中進行同源性比對,分析發現6個差異片段中Esc1表達的差異片段找到同源的基因序列并有相應的基因功能注釋,有2個有未知基因功能的同源序列。獲得的已知基因功能的Esc1與玉米CAT2基因的同源性為74%。這一結果表明:CAT2基因是與植物的抗逆性、生長、終止休眠等密切相關的因子,在單氰氨調控下差異表達。這與前人 Or[20]、Halaly[10]和 Redinbaughm[11]等的報道一致。但具體CAT2基因表達的精細調控有待進一步研究。此外其他未知基因功能的差異表達可能也參與了單氰氨誘導巨峰葡萄休眠芽萌發的生理效應,也可能與葡萄本身抵抗單氰氨作用的一系列防御應激反應相關。
[1]阮新苑.南寧大面積推廣一年兩熟葡萄[J].農業知識,2005,(12):29.
[2]曹慕明,白先進,李楊瑞,等.石灰氮在巨峰葡萄二季生產中的催芽效應初報[J].西南農業學報,2005,18(4):
456-458.
[3]曹慕明;巨峰葡萄一年兩季萌芽調節的生理基礎研究[D].廣西大學,2006.
[4]曹慕明,白先進,李楊瑞.2.5%單氰氨誘導巨峰葡萄解除休眠的生理效應[J].熱帶作物學報,2009,3(3):264-269.
[5]Erez A.Improved methods for breaking rest in peach and other deciduous fruit species[J].J Amer Soc Hort Sci,1971,(96):519-522.
[6]Liang P,Pardee A B.Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction[J].Sci,1992,(257):967-970.
[7]BudowleB.Analysis of the VNTR locus DlS80 by the PCR followed by high resolution PAGE[J].Am J Hum Get,1991,(48):137-145.
[8]BassamBJ.Fast and sensitive silver staining of DNA in polyacryla-degel[sJ].Anal Biochem,1991,(196):80-83.
[9]Maxam AM.Gilbert W.Sequencing end-labeled DNA with base-specific chemical deavages [J].Methods Enzymol,1980,(65):499-560.
[10]Halaly T,Pang X,Batikoff T,et al.Similar mechanisms are triggered by alternative external stimuli that induce dormancy release:comparative study of the effects of hydrogen cyanamide and heat shock on dormancy release in grape buds[J].Planta,2008,(288):79-88.
[11]RedinbaughmG.,Wadsworth G.J.,and Scandalios J.G.,Characterizationof catalase transcripts and their differential expressionin maize [J].Biochim.Biophys.Acta,1988,951(1):104-116.
[12]Jung S.,Kernodle S.P.,and Scandalios J.G.,Differentialantioxidant responses to norflurazon-induced oxidativestress in maize [J].Redox Rep.,2001,6(5):311-317.
[13]Guan L.M.,and Scandalios J.G.,Hydrogen-peroxidemediatedcatalasegene expression in response to wounding [J].FreeRadic.Biol.Med.,2000,28(8):1182-1190.
[14]Willekens H.,van Camp W.,van Montagu M.,et al.Differential response of maize catalases to abscisic acid:Vp1 transcriptional activator is not required for abscisic acid regulated Cat1 expression,Proc[J].Natl.Acad.Sci.,1992,89(18):8842-8846.
[15]Skadsen R.W.,Scandalios J.G..Translational control of photo-induced expression of the Cat2 catalase gene during leaf development in maize[J].Proc.Natl.Acad.Sci.,USA,1987,84(9):2785-2789.
[16]Ruzsa S.M.,Mylona P.,Scandalios J.G.,Differential response of antioxidant genes in maize leaves exposed to ozone[J].Redox.Rep.,1999,4(3):95-103.
[17]趙亞男,孫玉剛,邢世巖.林木種子處理的理論和技術[J].山東林業科技,2006,(3):75-78.
[18]黨海山,張燕君,江明喜,等.瀕危植物毛柄小勾兒茶種子休眠與萌發生理的初步研究[J].武漢植物研究,2005,23(4):327-331.
[19]周玉萍,王正詢,田長恩.多胺與香蕉抗寒性的關系的研究[J].廣西植物,2003,23(4):352-356.
[20]張云濤.生長調節劑延遲早花果樹花期的研[J].果樹學報,1997,14(2):127-131.
[21]OrE,BaybikJ,Sadka A.Isolation ofmitochondrial malatede hydrogenase and phosphenol pyruvate carboxy lasec DNA clones from grape berries and analys-is of the irexpression patter nthroug houtberry developmen[tJ].PlantPhysi-ol,2000,(157):527-534.

