表沒食兒茶素沒食子酸酯對(duì)帕金森病大鼠的神經(jīng)保護(hù)作用及其機(jī)制探討
吳艷芬,劉漢杰,張延平,王 偉*(.河北省邯鄲市第一醫(yī)院內(nèi)分泌科,河北 邯鄲 05600;.河北醫(yī)科大學(xué)第二醫(yī)院神經(jīng)外科,河北 石家莊 050000;.河北省邯鄲市第一醫(yī)院神經(jīng)內(nèi)科,河北 邯鄲 05600)
·論著·
表沒食兒茶素沒食子酸酯對(duì)帕金森病大鼠的神經(jīng)保護(hù)作用及其機(jī)制探討
吳艷芬1,劉漢杰2,張延平3,王 偉3*
(1.河北省邯鄲市第一醫(yī)院內(nèi)分泌科,河北 邯鄲 056001;2.河北醫(yī)科大學(xué)第二醫(yī)院神經(jīng)外科,河北 石家莊 050000;3.河北省邯鄲市第一醫(yī)院神經(jīng)內(nèi)科,河北 邯鄲 056001)
目的觀察表沒食兒茶素沒食子酸酯(epigallocatechin-3-gallate,EGCG)對(duì)魚藤酮致帕金森(Parkinson disease,PD)大鼠模型黑質(zhì)多巴胺能神經(jīng)元的保護(hù)作用。方法健康成年雄性Wistar大鼠60只,隨機(jī)分為對(duì)照組、實(shí)驗(yàn)組和藥物干預(yù)組(每組20只)。實(shí)驗(yàn)組和藥物干預(yù)組背部皮下注射魚藤酮制備PD大鼠模型,藥物干預(yù)組同時(shí)給予大鼠腹腔注射EGCG。采用分光光度法檢測(cè)大鼠腦內(nèi)丙二醛(malondialdehyde,MDA)和還原型谷胱甘肽(glutathione,GSH),免疫組織化學(xué)和Western blot檢測(cè)大鼠中腦黑質(zhì)及紋狀體中酪氨酸羥化酶(tyrosine hydroxylase,TH)的表達(dá)變化。結(jié)果實(shí)驗(yàn)組大鼠紋狀體中MDA明顯增高(P<0.05),GSH含量明顯降低(P<0.05),中腦TH免疫反應(yīng)陽(yáng)性神經(jīng)元數(shù)明顯少于對(duì)照組(P<0.05),TH蛋白在黑質(zhì)和紋狀體與對(duì)照組比較明顯降低(P<0.05);EGCG干預(yù)后與實(shí)驗(yàn)組相比MDA明顯降低及GSH明顯增高(P<0.05),TH免疫反應(yīng)陽(yáng)性神經(jīng)元數(shù)明顯增加(P<0.05),TH蛋白明顯增加(P<0.05)。結(jié)論化應(yīng)激在PD發(fā)病中起著非常重要的作用,抗氧化治療能有效減輕大鼠腦內(nèi)多巴胺能神經(jīng)元損傷情況,同時(shí)改善PD樣癥狀,為PD的治療提供了新的靶點(diǎn)。
帕金森病;表沒食兒茶素沒食子酸酯;多巴胺
帕金森病(Parkinsondisease,PD)是發(fā)生在中老年人群中較為常見的中樞神經(jīng)系統(tǒng)退行性疾病,其特征性病理變化是黑質(zhì)多巴胺能神經(jīng)元變性壞死及Lewy小體形成導(dǎo)致黑質(zhì)紋狀體通路破壞及尾狀核、殼核中多巴胺含量減少,臨床主要表現(xiàn)為靜止性震顫、運(yùn)動(dòng)遲緩、肌張力增高等[1]。最近的研究[2]結(jié)果顯示氧化應(yīng)激損害在PD黑質(zhì)多巴胺神經(jīng)元死亡過程中起著非常重要的作用。抗氧化治療PD已成為新療法中的重要研究方向。表沒食兒茶素沒食子酸酯(epigallocatechin-3-gallate,EGCG)是從天然植物茶葉中分離提純出來的多酚類化合物復(fù)合體茶多酚的重要成分,EGCG具有良好抗氧化效應(yīng),在許多神經(jīng)變性疾病中顯示出神經(jīng)保護(hù)作用[3]。本研究觀察EGCG對(duì)魚藤酮制備PD動(dòng)物模型腦內(nèi)多巴胺能神經(jīng)元的保護(hù)作用,為PD治療提供一個(gè)新的靶點(diǎn)。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物分組和動(dòng)物模型的制備:Witstar大鼠60只,雄性,體質(zhì)量250~300g,由河北省實(shí)驗(yàn)動(dòng)物中心提供。將動(dòng)物隨機(jī)分為對(duì)照組、實(shí)驗(yàn)組和藥物干預(yù)組;對(duì)照組20只背部皮下注射葵花油1mL/kg,實(shí)驗(yàn)組和藥物干預(yù)組各20只,按照2.0mg·kg-1·day-1背部皮下注射魚藤酮(魚藤酮溶解在葵花籽油中,充分振蕩混勻后4℃避光保存),其中藥物干預(yù)組在魚藤酮注射前半小時(shí)給予EGCG50mg·kg-1·day-1腹腔注射,共30d。飼養(yǎng)于晝夜交替的環(huán)境中,其間所有大鼠自由進(jìn)食水。
1.2 腦組織丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)的含量測(cè)定:大鼠直接斷頭取腦,迅速分離紋狀體,液氮速凍,-80℃保存,用于測(cè)量MDA和GSH,具體實(shí)驗(yàn)方法按所購(gòu)試劑盒說明書進(jìn)行。
1.3 免疫組織化學(xué)染色:大鼠深度麻醉下以4%多聚甲醛(4℃)經(jīng)心灌注固定,取腦固定4h,30%蔗糖液4℃過夜。所需部位冠狀位冷凍連續(xù)切片(厚40μm),間斷集片,磷酸緩沖液洗片后行免疫細(xì)胞化學(xué)反應(yīng)。相關(guān)切片分別以小鼠抗酪氨酸羥化酶(tyrosinehydroxylase,TH)單克隆抗體(1∶3 000,Sigma)4℃孵育切片48h;生物素化羊抗小鼠IgG(1∶500)室溫孵育切片2h,1∶500HRP鏈霉卵白素室溫孵育1h。每步中間以Tris緩沖液洗片。二氨基聯(lián)苯胺(diaminobenzine,DAB)呈色、貼片、封片、觀察。以正常羊血清代替一抗,作為陰性對(duì)照。
1.4 細(xì)胞計(jì)數(shù):在光鏡40倍物鏡下,按James等方法,分別計(jì)數(shù)相關(guān)核團(tuán)1cm2面積TH(黑質(zhì)致密部)免疫反應(yīng)陽(yáng)性神經(jīng)元數(shù)目。
1.5Westernblot:大鼠快速斷頭取腦,置于冰板上選取黑質(zhì)及尾殼核所在腦塊,入液氮速凍后入低溫冰箱備用。取所需腦組織入4℃裂解液勻漿5min,冰浴靜置1h,4℃離心,取上清,Bradford法測(cè)定蛋白濃度。相關(guān)樣品取50μg總蛋白經(jīng)10%SDS-PAGE凝膠電泳分離,電轉(zhuǎn)移至PVDF膜上,用5%脫脂奶粉室溫封閉2h后,依照實(shí)驗(yàn)?zāi)康姆謩e加入5%脫脂奶粉稀釋的小鼠TH單克隆抗體(1∶10 000),4℃過夜。聚偏二氟乙烯膜(polyvinylidenefluoride,PVDF)膜以Tris緩沖液洗3次。羊抗小鼠IgG熒光抗體(1∶10 000,Rocland公司)室溫避光1h,漂洗5次,遠(yuǎn)紅外熒光掃描成像系統(tǒng)(Odyssey公司)掃描并測(cè)定目標(biāo)蛋白單位光密度值,與β-actin(1∶5 000,SantaCruz)比值后,做統(tǒng)計(jì)學(xué)分析。
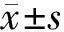
2 結(jié) 果
2.1 一般狀況:與對(duì)照相比較,實(shí)驗(yàn)組大鼠有主動(dòng)活動(dòng)減少、動(dòng)作遲緩、步態(tài)不穩(wěn)、不能直線行走、行走時(shí)多向一側(cè)旋轉(zhuǎn)的行為表現(xiàn);毛色變黃變臟,體態(tài)呈弓背狀。藥物干預(yù)組大鼠的上述癥狀有明顯改善,向一側(cè)旋轉(zhuǎn)的癥狀明顯減輕。
2.2 免疫組織化學(xué)結(jié)果:實(shí)驗(yàn)組大鼠黑質(zhì)TH陽(yáng)性神經(jīng)元數(shù)目較對(duì)照組明顯減少(P<0.05);藥物干預(yù)組黑質(zhì)TH陽(yáng)性神經(jīng)元數(shù)目較實(shí)驗(yàn)組明顯增高(P<0.05),但較對(duì)照組仍有明顯減少(P<0.05)。見表1。
2.3Westernblot結(jié)果:實(shí)驗(yàn)組大鼠TH蛋白在黑質(zhì)及尾殼核比對(duì)照組明顯減少(P<0.05);藥物干預(yù)組TH蛋白在黑質(zhì)及尾殼核較實(shí)驗(yàn)組明顯增高(P<0.05),但是較對(duì)照組仍有明顯減少(P<0.05)。見表1。
2.4 大鼠紋狀體中氧化應(yīng)激參數(shù)的改變:實(shí)驗(yàn)組大鼠紋狀體中GSH的含量比對(duì)照組明顯減少(P<0.05);藥物干預(yù)組GSH明顯增加(P<0.05),但較對(duì)照組仍明顯減少(P<0.05)。實(shí)驗(yàn)組脂質(zhì)代謝產(chǎn)物MDA含量較對(duì)照組明顯增加(P<0.05);藥物干預(yù)組MDA明顯減少(P<0.05),但較對(duì)照組仍明顯增高(P<0.05)。見表1。


GroupsTHpositiveneuronsinSN(number)TH/β?actininSNTH/β?actininstriatumMDAinstriatum(nmol/mg)GSHinstriatum(mg/g)Control34.35±4.040.75±0.070.64±0.025.21±1.5543.73±4.58PD20.27±3.05?0.45±0.08?0.39±0.05?19.13±2.04?28.40±2.61?EGCG+PD25.97±3.02?#0.59±0.01?#0.51±0.03?#10.24±3.21?#35.42±3.21?#
*P<0.05vscontrol group #P<0.05vsPD group byqtest
PD:Parkinson disease;TH:tyrosine hydroxylase;SN:substantia nigra;MDH:malondialdehyde;GSH:glutathione
3 討 論
PD是最常見的神經(jīng)變性病之一,其病理改變主要是黑質(zhì)內(nèi)多巴胺能神經(jīng)元漸進(jìn)性受損。氧化應(yīng)激參與脂質(zhì)過氧化,導(dǎo)致體內(nèi)氧自由基過度蓄積,可能是引起黑質(zhì)多巴胺能神經(jīng)元損傷的重要原因之一,從而促進(jìn)PD的病理過程,PD患者腦內(nèi)氧化應(yīng)激損傷包括腦內(nèi)脂質(zhì)過氧化增加、還原性谷胱甘肽耗竭及DNA損害等[4-6],這些均提示氧化應(yīng)激在PD多巴胺能神經(jīng)元損傷過程中發(fā)揮著一定的作用,因此抗氧化治療是延緩疾病進(jìn)展的一條途徑。本研究發(fā)現(xiàn)魚藤酮處理后大鼠腦內(nèi)發(fā)生了明顯的氧化應(yīng)激,脂質(zhì)代謝產(chǎn)物MDA含量明顯增高,同時(shí)自由基清除劑GSH含量明顯降低,表明紋狀體中氧化平衡被破壞,發(fā)生了氧化損傷。魚藤酮是一種源于某些植物根莖一直被視為安全的廣泛應(yīng)用于果蔬除害等方面的天然殺蟲劑。魚藤酮對(duì)黑質(zhì)多巴胺能神經(jīng)元具有明顯的神經(jīng)毒性作用[7],接觸魚藤酮的大鼠可出現(xiàn)PD樣癥狀及帕金森病理性改變[8]。魚藤酮為制備PD動(dòng)物模型的有效藥物,本研究中也發(fā)現(xiàn)魚藤酮能導(dǎo)致大鼠腦內(nèi)氧化應(yīng)激及多巴胺能神經(jīng)元損傷,同時(shí)也證明了氧化應(yīng)激在PD的發(fā)病中起著非常重要的作用。這也為臨床上對(duì)PD患者抗氧化治療提供了理論依據(jù)。
EGCG是從綠茶中提取出來的多酚類化合物,其酚羥基是天然的供氫體,能夠提高內(nèi)源性抗氧化酶生成,在體內(nèi)外均具有很強(qiáng)的清除自由基和抗氧化的功能[9]。最近研究[10]表明,EGCG具有多種藥理學(xué)作用,如較強(qiáng)清除自由基、抗脂質(zhì)過氧化、抗凋亡、抗病毒、預(yù)防癌癥和心臟病等。氧化應(yīng)激與PD病理機(jī)制密切相關(guān),飲食來源可能成為預(yù)防和治療PD有效的抗氧化劑替代品。本研究結(jié)果顯示,魚藤酮背部皮下注射可以導(dǎo)致大鼠腦內(nèi)氧化應(yīng)激及多巴胺能神經(jīng)元損傷而出現(xiàn)PD樣癥狀,給予大鼠EGCG,通過降低黑質(zhì)多巴胺能神經(jīng)元脂質(zhì)過氧化狀態(tài),調(diào)節(jié)抗氧化蛋白酶的活性,增加總蛋白的合成能力,減少神經(jīng)細(xì)胞的損傷,可改善大鼠PD樣癥狀,抗氧化治療可能是PD治療的新靶點(diǎn)。
[1] 崔利德,王立軒,李陳莉.褪黑素的抗氧化作用對(duì)抗神經(jīng)損傷的研究進(jìn)展[J].河北醫(yī)科大學(xué)學(xué)報(bào),2006,27(3):218-221.
[2] BISAGLIA M,GREGGIO E,BELTRAMINI M,et al.Dysfunction of dopamine homeostasis:clues in the hunt for novel Parkinson′s disease therapies[J].FASEB J,2013,27(6):2101-2110.
[3] SMID SD,MAAG JL,MUSGRAVE IF.Dietary polyphenol-derived protection against neurotoxic β-amyloid protein:from molecular to clinical[J].Food Funct,2012,3(12):1242-1250.
[4] HIRSCH EC.Future drug targets for Parkinson′s disease[J].Bull Acad Natl Med,2012,196(7):1369-1377.
[5] TOLLESON CM,FANG JY.Advances in the mechanisms of Parkinson′s disease[J].Discov Med,2013,15(80):61-66.
[6] SURMEIER DJ,SULZER D.The pathology roadmap in Parkinson disease[J].Prion,2013,7(1):85-91.
[7] CANNON JR,TAPIAS V,NA HM,et al.A highly reproducible rotenone model of Parkinson′s disease[J].Neurobiol Dis,2009,34(2):279-290.
[8] XIONG N,HUANG J,ZHANG Z,et al.Stereotaxical infusion of rotenone:a reliable rodent model for Parkinson′s disease[J].PLoS One,2009,4(11):e7878.
[9] MURAKAMI A,OHNISHI K.Target molecules of food phytochemicals:food science bound for the next dimension[J].Food Funct,2012,3(5):462-476.
[10] CHEN D,WAN SB,YANG H,et al.EGCG,green tea polyphenols and their synthetic analogs and prodrugs for human cancer prevention and treatment[J].Adv Clin Chem,2011,53:155-177.
(本文編輯:趙麗潔)
MECHANISMOFEPIGALLOCATECHIN-3-GALLATENEUROPROTECTIONINPARKINSONDISEASERATSINDUCEDBYROTENONE
WUYanfen1,LIUHanjie2,ZHANGYanping3,WANGWei3*
(1.DepartmentofEndocrinology,theFirstHospitalofHandanCity,HebeiProvince,Handan056001,China;2.DepartmentofNeurosurgery,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China;3.DepartmentofNeurology,theFirstHospitalofHandanCity,Handan056001,China)
ObjectiveToinvestigatetheprotectiveeffectofepigallocatechin-3-gallate(EGCG)onthesubstantianigradopaminergicneuroninParkinsondisease(PD)ratsinducedbyrotenone.MethodsThehealthyadultmale60Wistarratswererandomlydistributedtothefollowinggroupscontrolgroup,PDgroupanddrugtherapygroup(n=20eachgroup),PDanddrugtherapygroupswereinjectedsubcutaneouslyrotenoneinthebacktopreparethePDratsmodel,theratsofdrugtherapygroupwereinjectedintraperitoneallyEGCGatthesametime.Spectrophotometrywasusedtodetectoxidativestressparametersinrats(malondialdehydeandglutathione),immunocytochemistryandwesternblotwereusedtodetecttheexpressionoftyrosinehydroxylase(TH)inthesubstantianigraandstriatumofrats.ResultsMalondialdehyde(MDA)wassignificantlyhigher(P<0.05),andglutathione(GSH)wassignificantlydecreased(P<0.05)intheratsstriatumofrotenonegroupthanthoseofcontrolgroup.ThenumberofTHpositiveneuronsinmidbrainwassignificantlylessthanthatofcontrolgroup(P<0.05),buttheexpressionofTHwassignificantlydecreasedinthesubstantianigraandstriatumcomparedwithcontrolgroup(P<0.05);MDAobviouslydecreasedandGSHincreasedsignificantlyaftertheinterventionofEGCGcomparedwiththatofrotenonegroup(P<0.05),thenumberofTHpositiveneuronssignificantlyincreased(P<0.05)andTHproteinincreasedsignificantly(P<0.05).ConclusionOxidativestressplaysaveryimportantroleinthepathogenesisofPD,anti-oxidationtreatmentcaneffectivelyreducetheinjuryofdopaminergicneuronsinthebrainofrat,whichprovidesanewtargetforthetreatmentofPD.
Parkinsondisease;epigallocatechin-3-gallate;dopamine
2013-02-21;
2013-03-26
河北省科學(xué)技術(shù)研究與發(fā)展指導(dǎo)計(jì)劃項(xiàng)目(132777134)
吳艷芬(1978-),女,河北邯鄲人,河北省邯鄲市第一醫(yī)院主治醫(yī)師,醫(yī)學(xué)碩士,從事內(nèi)分泌疾病診治研究。
*通訊作者。E-mail:sunnywangwei@163.com
R743
A
1007-3205(2014)05-0501-04
10.3969/j.issn.1007-3205.2014.05.003
 河北醫(yī)科大學(xué)學(xué)報(bào)2014年5期
河北醫(yī)科大學(xué)學(xué)報(bào)2014年5期
- 河北醫(yī)科大學(xué)學(xué)報(bào)的其它文章
- 頸椎前路術(shù)后合并雙側(cè)喉返神經(jīng)損傷1例
- 滅菌紙袋與傳統(tǒng)棉布阻菌效果的對(duì)比
- 羅氏Modular P800全自動(dòng)生化分析儀檢測(cè)電解質(zhì)的臨床應(yīng)用評(píng)價(jià)
- 支架影像增強(qiáng)顯影技術(shù)在冠狀動(dòng)脈介入中指導(dǎo)球囊后擴(kuò)張應(yīng)用研究
- 心理護(hù)理對(duì)突發(fā)性聾患者預(yù)后的影響
- 縮宮素聯(lián)合小劑量米索前列醇用于足月妊娠羊水指數(shù)臨界產(chǎn)婦的引產(chǎn)效果評(píng)價(jià)
