突觸蛋白Synapsin在氧糖剝奪模型中的表達及意義
劉洪雨,莽 靖,楊 樂,胥桂華,李宗樹,王嬌琦,何金婷*,徐忠信*
(1.吉林大學中日聯誼醫院,吉林 長春130033;2.吉林省人民醫院,吉林 長春130021)
突觸蛋白(Synapsin)是反映神經元、突觸功能狀況的內在標志物[1],本研究應用PC12細胞進行氧糖剝奪處理,建立缺血性腦損傷模型,采用Western blot方法檢測不同時間氧糖剝奪模型細胞中的Synapsin蛋白表達,探討Synapsin蛋白在氧糖剝奪模型中的表達及意義。
1 材料與方法
1.1 細胞株
PC12細胞株(大鼠腎上腺嗜鉻細胞瘤)購自北京銀紫晶生物技術公司。
1.2 主要試劑和儀器
DMEM培養基購自美國Gibco公司;胎牛血清購自北京鼎國公司;鼠神經生長因子(NGF)、胰蛋白酶均購自美國Sigma公司;抗突觸素抗體購自武漢博士德生物技術公司;Model550酶聯分析儀:美國BIO-RAD;激光共聚焦顯微鏡:日本OLYMPUS。
1.3 實驗方法
PC12細胞經NGF刺激6 d后應用含有連二亞硫酸鈉的無糖DMEM培養液洗滌細胞3次,繼而繼續應用無糖DMEM培養液孵育細胞,并放入37℃孵箱內的缺氧罐內繼續培養[2]。
接種于6孔板內的PC12細胞經NGF(100 ng/ml)連續刺激后,分別進行氧糖剝奪3 h,6 h, 9 h,12 h和24 h,而后消化、收集細胞,RIPA冰上裂解20 min,12 000轉/min,離心5 min,取上清液。SDS-PAGE電泳后轉膜,恒流1 mA/cm2,轉移1.5 hr。轉移結束后,50%甲醇脫色至背景清晰,雙蒸水清洗,風干夾于兩層濾紙中保存。用0.01M PBS洗膜,5 min×3次。加入包被液,室溫平穩搖動2 h。棄包被液,0.01M PBS再次洗膜,5 min×3次。一抗4℃孵育過夜,而后0.01M PBS洗膜,5 min×4次。使用辣根過氧化物酶偶聯的二抗(按合適稀釋比例用0.01M PBS稀釋),室溫孵育2 h。棄二抗,用0.01M PBS洗膜,5 min×4次。加入顯色液,避光顯色至出現條帶時放入雙蒸水中終止反應[2-3]。
1.4 統計學方法
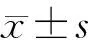
2 結果
2.1 PC12細胞形態學變化
培養3天后,PC12細胞開始停止分裂。并逐漸分化為具有交感神經元特征的細胞,開始長出神經突起,培養5天后,大多數PC12細胞轉變為類似于交感神經元的形態,突起逐漸增多并延長,形成稀疏的網絡。隨著培養時間的延長,交感神經元樣細胞的胞體逐漸增大[4]。
2.2 MTT法檢測氧糖剝奪后細胞活力
用MTT法檢測氧糖剝奪后3 h、6 h、9 h、12 h、16 h、24 h的細胞存活率,如圖1所示,隨OGD時間的延長,細胞存活率明顯下降,而OGD12 h后細胞存活率下降更明顯,OGD24 h細胞存活率為65.8%,與對照組比,差異顯著(P<0.05)。
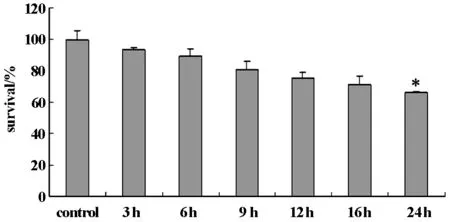
圖1 PC12 氧糖剝奪后不同時間細胞活力
2.3 Synapsin蛋白的表達變化
應用Western Blot檢測氧糖剝奪模型處理的PC12細胞內Synapsin蛋白的表達,如圖2和對照組相比較,隨NGF誘導時間的延長,與對照組(P<0.05),相比細胞Synapsin蛋白的表達逐漸變淺。
3 討論
缺血性腦損傷是一個復雜、多因素、多層次的病理變化過程,其中腦缺血發生后引發的一系列缺血級聯反應是其根本因素。因此,針對缺血性腦損傷發生機制的研究具有重要意義。PC12細胞來源于鼠腎上腺嗜鉻細胞瘤(一種交感神經系統的腫瘤)主要分泌產物為兒茶酚胺類遞質包括多巴胺、去甲腎上腺素等。膜上有NGF受體,受生理水平NGF誘導后停止分裂,長出神經突起,分化為具有交感神經元特性的細胞,常被用于分析神經元分化和NGF作用分子機制的研究,也被用于研究生長因子調節神經細胞基因表達改變的機制[5]。
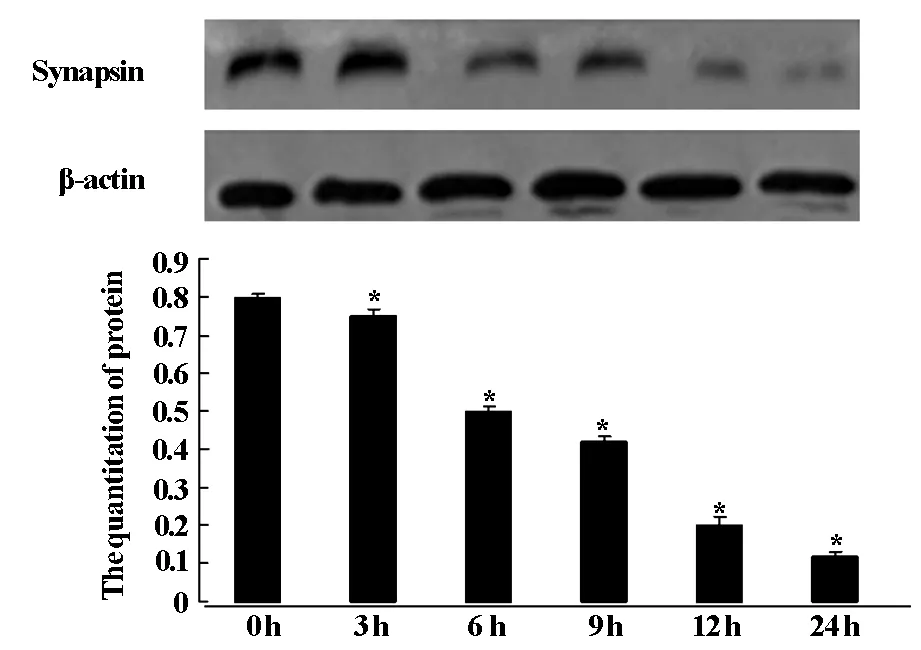
圖2 OGD不同時間synapsin蛋白的表達變化
氧糖剝奪(oxygen glucose deprivation/OGD)是在細胞水平上模擬缺血/低氧刺激的經典模型。通過對細胞培養條件的改變,包括將細胞放入低氧箱或者更換無糖的培養基,可模擬細胞在缺血/低氧情況下的損傷,細胞會產生壞死、凋亡、自噬等現象[6]。本研究應用PC12細胞模擬細胞缺血/低氧損傷后,建立氧糖剝奪模型,分別觀察OGD3 h、6 h、9 h、12 h、24 h不同時間,并采用MTT法分析細胞的存活率,結果顯示,隨氧糖剝奪時間增加,神經元存活率由99.7%下降至64.3%,表明模擬缺血缺氧對神經元產生了影響。
突觸蛋白(Synapsin)是一種與突觸相關同時具有神經元特異性的磷酸蛋白,是一種反應神經元及突觸功能狀況的內在標志物,突觸素(Synaptophysin)可以調節神經元突起的延長、參與突觸發生的過程[7]。通過磷酸化和非磷酸化來調節神經遞質釋放對神經元的早期發育和再生也起著至關重要的作用。關于腦缺血后突觸蛋白的表達變化,國內外研究結果并不一致[8]。本研究表明氧糖剝奪后突觸蛋白表達和PC12細胞活率呈正相關,Synapsin蛋白參與突觸囊泡的介導轉運、神經遞質的釋放、突觸囊泡循環,參與突觸發生[9],研究證實,突觸蛋白是反映神經元和突觸反映神經元、突觸功能狀況的內在標志物,本研究同時采用Western Blot檢測氧糖剝奪PC12細胞內Synapsin蛋白表達變化,結果顯示,與對照組相比,隨著氧糖剝奪時間的延長,Synapsin蛋白表達水平逐漸降低,提示神經元缺血后隨時間變化,神經細胞的神經元特性、突觸功能逐漸減低。突觸蛋白在神經遞質釋放過程中起著至關重要的調節作用,并參與中樞神經元早期發育,因此,調節腦缺血后突觸蛋白的表達可能作為診治腦缺血后病理、生理改變的一種方法,也為研究腦缺血后神經再生和可塑性提供一種途徑。
作者簡介:劉洪雨,女,在讀碩士,主要研究方向:缺血性腦損傷與保護研究。
參考文獻:
[1]Kumar MR,Bhat,Nityanand Maddodi.Transcriptional regulation of human MAP2 gene in melanoma:role of neuronal bHLH factors and Notch1 signaling[J].Nucleic acids research,2006,34(13):3819.
[2]Chunli Mei,Jinting He,JingMang.NGF combined with OGD induces neural ischemia tolerance in PC12 cells[J].AJBR,2011,5(10):315.
[3]Koji Ikegami,Masahiro Mukai.TTLL7 is a mammalian -tubulin polyglutamylase required for growth of MAP2-positive neurites[J].The journal of biological chemistry,2006,281(41):30707.
[4]Jae Young Lee,Joo-Woon Lee.Neuroactive conducting scaffolds:nerve growth factor conjugation on active ester-functionalized polypyrrole[J].J R Soc Interface,2009,6:801.
[5]Katarzyna Mnich,David P.Inhibition by anandamide of 6-hydroxydopamine induced cell death in PC12 cells[J].International journal of cell biology volume,2010,97:10.
[6]Ronchini C,Capobianco AJ.Induction of cyclin D1transcription and CDK2ac tivity by Notch (ic):implication for cell cycle disruption in transformation by Notch(ic)[J].Mol Cell Biol,2001,21:592 5.
[7]Damian C,Genetos,Whitney K.Oxygen tension modulates neurite outgrowth in PC12 cells through a mechanism involving HIF and VEGF[J].J Mol Neurosci,2010,40:360.
[8]BaonzaA,FreemanM.Control of cell proliferationin the Drosophila eye by Notch signaling[J].Dev Cell,2005,8:529.
[9]Larsena EC,Hatchera JF.Effect of D609 on phospholipid metabolism and cell death during oxygen-glucose deprivation in PC12 cells[J].Neuroscience,2007,146(3):946.

