國際注冊中的運輸驗證探討
王建仕 丁恩峰 高海燕
(1.石家莊龍澤制藥有限公司,河北石家莊 050031;2. 英國施達化學集團中國代表處,河北石家莊 050031;3. 北京賽銘醫藥科技有限公司,北京 100054)
隨著中國藥品生產質量管理規范(2010 年修訂) (GMP)的實施推進,以及國際藥品貿易的廣泛開展,如何保障藥品在運輸環節的質量穩定,成為國際注冊和國際貿易的重要話題和關注熱點。筆者長期跟蹤研究藥品國際認證和注冊,以及藥品運輸過程中的穩定性,搜集并分析了關于運輸環節藥品質量保證的相關法規和指南,進行系統研究,撰寫此文希望為中國藥品企業提供借鑒和幫助。
1 運輸驗證的概念和應用
運輸驗證(shipment validation)指的是針對藥品運輸的工具、運輸路線和約束條件進行驗證,以證明藥品的運輸工具和運輸條件可以滿足藥品質量的要求,可以確保藥品在運輸過程中的質量穩定性。在運輸驗證中,需要提供書面的、持續性的證據來證明運輸條件被控制在合格限度內,藥品質量是穩定可靠的。
2 各國醫藥法規對運輸驗證的要求
隨著世界各國貿易交往越來越頻繁和廣泛,藥品貿易也快速發展起來。傳統制藥企業的質量體系,把主要精力集中于藥品生產地址和藥品使用環節的質量保證,而往往忽視了藥品在運輸環節的質量穩定情況。隨著國際貿易發展,藥品在運輸環節所存在的時間越來越長,遇到各類突然情況也越來越多,因此,需要加強對運輸環節的質量管理和控制。
下面詳細列舉了國內和國際關于藥品運輸環節質量管理的法規要求[1-4]。
3 運輸驗證實施中的關鍵考慮點
在藥品運輸驗證中,一般分為兩部分工作:一部分工作是針對運輸設備的驗證,例如:冷藏車的驗證;另外一部分是針對運輸條件和運輸路線的驗證,即:運輸驗證。
3.1 關于運輸工具的驗證要點
運輸工具的驗證,以冷藏車為例,包括如下要點需要考慮。
設計確認階段:
—核實供應商資質是否符合要求;
—核實隨機攜帶文件是否符合合同和URS 的要求;
—核實FAT 報告和SAT 報告是否具備,內容是否符合合同要求;
—核實設備關鍵參數和采購合同的一致性;
—核實設備關鍵參數和URS 的一致性;
—核實相關售后服務協議。
安裝確認階段:
—核實DQ 報告是否完成,內容是否符合要求;
—開箱檢查,核實設備和URS,以及供貨合同的一致性;
—核實裝箱單和實際部件到貨情況;
—儀表校驗情況核實;
—人員培訓情況,IQ 階段的人員培訓主要包括:安裝人員和設備使用人員的培訓,培訓內容主要是如何安裝;

表1 國內外關于運輸驗證的法規和指南

法規/指南名稱 內容EU Guidelines on Good Distribution Practice of Medicinal Products for Human Use[3]9.4.產品運輸要求的特殊條件◆對于溫度敏感的藥品,應該使用經過確認的設備(例如:溫度控制箱、冷包、溫度控制車輛)來確保正確的運輸條件被使用。◆如果使用溫度控制車輛,在運輸過程中使用的溫度監控設備應該被定期維護和校準。應該針對代表性情況進行溫度分布測試,還要考慮季節變化的影響。◆如果需要,客戶應該可以提供信息以證實產品儲存溫度符合要求的條件。◆如果在箱子里面使用冷包,必須仔細布置,確保冷包和藥品不是直接接觸。使用人員必須被培訓相關規程,如何組裝包裝箱和拆卸包裝箱,并且要學會如何重復使用冷包。EU GMP 附錄15《確認和驗證》[4]5.0 運輸確認5.1 要明確規定運輸路線,由于存在可變因素應進行挑戰性的運輸驗證。也要考慮到運輸過程季節的變化。5.2 風險評估中除了考慮溫度還要考慮運輸過程中其它條件的影響,如:濕度、震動、交接、耽擱、數據無法記錄、產品敏感性和其它相關因素。5.3 由于運輸過程中可能出現的變化條件,例如:在機場的耽擱,需要對產品可能面臨的關鍵的環境條件進行持續監控。
—相關文件起草任務布置,在這個階段,要根據供應商提供的說明書和手冊,結合工人經驗,起草設備操作SOP、設備維護SOP 和設備清潔SOP 等;
—安裝情況核實,主要包括:設備的自身組裝檢查、設備安裝情況檢查、公用系統(水、電、氣等系統)的安裝情況;
—IQ 階段的變更處理;
—IQ 階段的偏差處理;
—IQ 初步結論和IQ 報告的完成。
運行確認階段:
—核實IQ 報告完成情況;
—核實儀表校驗情況,在OQ 之前,相關儀表應該校驗完畢,而且校驗合格;
—核實人員培訓情況,這個階段的培訓任務包括:驗證文件的培訓和相關設備運行SOP 的培訓;
—核實設備運行SOP、維護SOP 和清潔SOP 的起草情況,尤其是設備運行SOP 和維護SOP,應該已經起草并批準;
—OQ 項目完成情況,例如:冷藏車的運行操作、各儀器顯示狀態、各部件協調運行的情況,以及冷藏車內部空載的溫度分布情況;
—如果有樣品,需要包括樣品處理和檢驗的檢查;
—OQ 階段的變更情況;
—OQ 階段的偏差情況;
—OQ 的結論和報告撰寫。
性能確認階段:
—核實OQ 報告完成情況;
—核實儀表校驗情況,這個階段核實的儀表主要是QC 實驗室的儀表,因為PQ 階段會產生很多樣品,需要用到QC 儀器來檢測;
—核實人員培訓情況,這個階段培訓任務主要包括:驗證文件的培訓和樣品檢驗SOP 的培訓;
—核實文件起草和批準情況;
—PQ 項目檢查核實,主要核實在裝載了藥品的情況下,冷藏車是否可以在規定時間達到控制溫度,溫度均勻度情況、濕度均勻度情況,以及開門和關門后,冷藏車的溫度波動情況和恢復到規定溫度的時間。
—PQ 階段的樣品處理和檢驗;—PQ 階段的變更情況;—PQ 階段的偏差情況;
—PQ 階段的結論和驗證總的結論。
3.2 關于運輸路線和運輸條件的驗證要點
關于運輸路線的驗證,包括兩方面的工作:第一方面工作就是針對運輸路線進行驗證;第二方面就是驗證后的日常監控工作。
運輸線路的驗證是為了說明在該線路規定的條件下,運輸的條件可以滿足要求,取決于驗證研究的范圍,驗證內容通常包含但不局限于以下內容:驗證范圍、工作職責、運輸過程的起點和終點(如:出發的省、市、區縣、街道和到達的省、市、區縣、街道)、運輸的產品、運輸產品的儲存要求,如:溫度和濕度要求等、運輸的時間、運輸方式:海運,路運,航空等,還是多種方式組合運輸、所用的設備(如:承運商必須采用封閉的貨車,是否有溫濕度記錄儀,運輸箱的類型等)、不同季節的影響、最高溫度和最低溫度,如果可能,最高溫度和最低溫度的持續時間、平均動力學溫度(MKT)(若適用)、風險分析(如果需要)。
3.2.1 驗證方案起草
每個公司關于驗證文件都有不同的制度,要做好運輸驗證工作,首先要起草一份科學、清楚、準確的驗證方案。一般而言,驗證方案都是使用部門負責起草,質量部門負責審核和批準。在起草驗證方案時,配套的驗證記錄也要同時準備好。一份完整的驗證方案,包括如下項目:
(1)驗證目的
(2)驗證范圍
(3)方案要求
(4)設備/設施描述
(5)儀表校驗情況
(6)員工培訓情況
(7)驗證過程(DQ/IQ/OQ/PQ)
(8)驗證樣品處理
(9)驗證數據收集和評估
(10)偏差管理和變更管理
(11)驗證結論
(12)再驗證要求
3.2.2 人員培訓
驗證方案起草完畢并且批準之后,應該對參加驗證的人員進行培訓。同時,培訓內容還要包括一些相關的SOP 和記錄如何使用;另外,一些安全操作方面的問題,也要在培訓中講明。
3.2.3 儀表校驗
在驗證方案執行之前,要確保驗證中使用的所有儀表和檢驗儀器,都校驗合格并處于校驗周期內。
3.2.4 驗證過程的實施
(1)模擬線路問題
因為在實際運輸線路中收集數據具有較大難度,可以采用模擬線路來完成運輸驗證。
a 模擬線路要包括各類情況,例如:產品裝卸、雨天、烈日天、上坡路、下坡路、過橋、海運環境、空運環境等;
b 模擬時間要跨越最大時間跨度;
c 要詳細描述各個路段情況和合格標準,并如實記錄;
d 最好每隔不同路段有照片證據;
e 一般需要進行連續3 次測試。
(2)模擬產品問題
可以采用實際產品,也可以采用模擬產品,但是要采用包裝承受外力最差的產品。一般而言,液體玻璃產品做模擬產品。
(3)溫度監控問題
在運輸的每個環節,都進行如實記錄溫濕度監控數據,包括藥品裝卸、陸路運輸、海運運輸和空運運輸環節。要如實記錄最高溫度和最低溫度,必要時,記錄MKT 溫度。如果有偏差,要進行評估以判斷是否對藥品產生不可接受的不利影響。
(4)特殊天氣問題
運輸線路的驗證需考慮到當地最惡劣的天氣條件(如:冬季或夏季;再例如:雨天和烈日天氣)。如果不能模擬該氣候條件,要在實際的氣候條件下進行運輸。
(5)臨時變更運輸路線問題
如果指定的運輸路線有較大可變性(如多種方式的運輸,臨時的貯藏等),質量部和物流管理的相關人員需一起進行風險評估,如果可能的話,在確認或驗證報告中闡明是否對每一次運輸都進行溫度的監控或者進行日常監控。
3.2.5 偏差和變更處理
在驗證過程中發生的偏差和變更問題,都應該按照相關的偏差管理規程和變更管理規程進行處理。如果發生的偏差和變更會影響到驗證的有效性,應該重新進行再次驗證。
3.2.6 驗證數據收集和結果評價
驗證結束后,應該將驗證過程中產生的所有數據進行收集,根據驗證方案的要求進行統計分析,并和預先確定的標準進行比較,以判斷驗證順利通過。如果驗證順利實施并符合要求,可以確定藥品儲存設備可以投入使用。
在驗證完成后,整個過程中沒有發生溫度等偏差,那么這條運輸線路才被認可。或者發生偏差,但是經過評估,認為偏差處理情況可以滿足要求,也可以認可運輸線路。
是否需要對以后的每一次產品運輸都進行溫度的監控,企業可根據自身情況和產品性質等綜合因素自行決定。
關于驗證過程中發生的變更,驗證管理人員,尤其是質量部負責評審驗證數據的人員,應該根據變更情況和性質,進行判斷,以評價驗證中的變更是否可以接受。例如運輸路線發生變化 (如:多種方式的運輸、臨時的貯藏等)。
根據確認/驗證結果制定相應的監測和監控規程,并每年需考慮制定日常監控計劃。
4 運輸設備驗證案例介紹
運輸設備是在運輸環節保證藥品質量的關鍵部分,需要被高度重視。運送對溫度敏感藥品的設備,例如:冷藏車等,都需要進行空載溫度分布和負載溫度分布。下面就詳細舉例介紹如何實施溫度分布驗證。
在對冷藏設備進行布點之前,先要仔細觀察設備內部結構和空間特點。一般布點原則就是幾何均勻布點原則。任何設備都需要有傳遞通道,因此,傳遞通道處,要增加布點。圖1 就是一個冷藏設備布點圖。
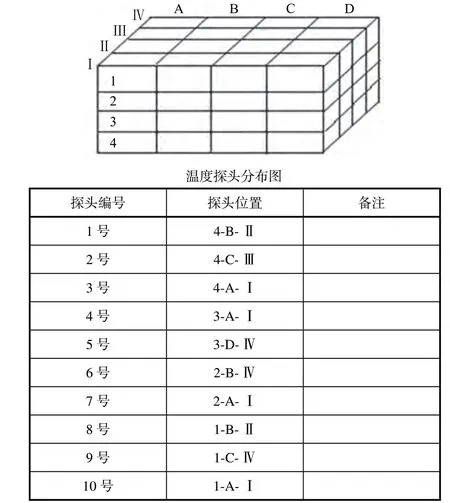
圖1 冷藏設備布點圖
根據布點位置,分別給每個取樣點的探頭給予編號,編號位置要詳細描述,便于以后分析數據和判斷溫度分布均勻性。
根據《藥品經營質量管理規范》(2012 年修訂)的附錄3:溫濕度自動監測的要求:第四條 系統溫濕度測量設備的最大允許誤差應當符合以下要求:
(1)測量范圍在0 ~40℃之間,溫度的最大允許誤差為±0.5℃;
(2)測量范圍在-25 ~0℃之間,溫度的最大允許誤差為±1.0℃;
(3)相對濕度的最大允許誤差為±5%RH。
為了滿足上述要求,不管是設備自帶的溫濕度監控儀表,還是驗證用溫度探頭,都必須滿足這個精度要求。
5 結束語
綜上所述,在符合現代制藥質量體系的架構中,運輸環節的藥品質量管理必須得到重視。運輸驗證包括運輸設備的驗證和運輸路線的驗證,都對藥品質量有關鍵影響,都需要足夠重視。
[1] 中華人民共和國衛生部.藥品生產質量管理規范.(2010 年修訂版)[S].
[2] 藥品經營質量管理規范.(2012 年修訂版)[S].
[3] EU GDP 2013[S].
[4] EU GMP annex 15 2014[S].

