離子液體制備及其化工應用進展
蔣平平,李曉婷,冷炎,董玉明,張萍波
(江南大學化學與材料工程學院,江蘇 無錫 214122)
離子液體(或稱室溫熔融鹽[1])是由離子組成的液體,是低溫下(<100℃)呈液態的鹽,由陰、陽離子兩部分組成。常規的離子化合物只有達到了一定的溫度才能轉變為液態,而離子液體在室溫附近很寬的溫度范圍內(從低于或接近室溫到300℃)均為液態。自1914年Walden等[2]報道了第一個離子液體以來,離子液體經歷了從鹵化鋁酸鹽型酸性離子液體到咪唑、吡啶、季銨鹽型等離子液體,再到現今受到越來越多關注的功能化離子液體這3個發展階段[3]。室溫離子液體因具有一系列突出的理化特性,引起了化工領域廣泛的關注,目前正在被成功應用于化工萃取分離、有機合成、電化學、納米材料等化工及功能新材料各個領域,成為綠色化學中最具前景的反應介質和非常理想的催化體系。
1 離子液體的分類與構效關系
離子液體的陰、陽離子均具有很寬的選擇范圍,故離子液體的種類越來越多。根據有機陽離子的不同,離子液體主要分為4類,分別為:咪唑鹽類(Ⅰ)、吡啶類(Ⅱ)、季銨鹽類(Ⅲ)和季磷鹽類(Ⅳ)(如圖1所示)。目前研究的最多的離子液體是二烷咪唑類離子液體,因為它易于合成且性質穩定。當然離子液體的種類不止這4種,其他代表性的陽離子還有胍鹽類離子液體、硫鹽離子液體、吡咯型離子液體等。組成離子液體的陰離子主要分為兩類:一類是單核陰離子,這些陰離子主要呈中性或堿性,其特點是離子液體遇水或空氣較穩定,如Cl-、Br-、BF4-、PF6-、CH3CO2-、CH3SO3-、OTf-、OH-等,其中以BF4-和PF6-兩種陰離子的離子液體研究最多;另一類是多核陰離子,這類離子液體對水及空氣敏感,需要在真空或惰性氣體保護下進行處理和應用,如Al3Cl10-、Fe2C7-、Cu2Cl3-、Au2Cl7-等。

圖1 常見離子液體的陽離子
與其他固態或液態化合物相比,離子液體具有一系列突出的優點:①幾乎沒有蒸氣壓,液態范圍寬;②有較強的溶解能力,可以溶解有機物、無機物、金屬有機化合物及聚合物;③有較大的極性可調性,可以與其他溶劑形成兩相或多相體系,適合作反應溶劑、分離溶劑或構成反應/分離耦合新體系;④毒性低、清潔環保,主要用于高溫和高真空體系;陰、陽離子靈活可調,可以根據反應需要調節其溶解性能、酸堿性、催化性能等。這些優良的性能主要取決于陰陽離子的結構、組合與內部作用力。例如,離子液體的熔點與陽離子烷基鏈碳數的變化密切相關,其原因在于離子液體的不對稱性及色散力的變化。離子液體完全由離子組成,離子間的作用力不同于普通分子型液態介質與電解質溶液。傳統的觀點認為,離子液體是通過靜電力相互作用的,而近期的研究發現,離子液體中廣泛地存 在著氫鍵網絡結構[4](如圖2所示),并且是除靜電作用之外最重要的作用力。氫鍵在離子液體的應用中發揮著重要的作用,增加了離子液體的溶解性能,例如在合成環碳酸酯的反應中,由于其對離子液體催化劑正負離子協同催化作用的影響,促進了其對CO2加成生成碳酸酯的催化效果[5]。因此,不能簡單地將離子液體看作完全電離的離子體系,也不能將其視為締合的分子或離子體系。而在微觀尺度上,離子液體體系存在著離子、離子簇等特殊結構,團簇將影響離子液體在反應體系中的分散性,從而導致溶劑或催化劑的效果下降,而通過改變不同反應體系反應過程的條件(如溫度的升高、其他組分的加入等),這些離子簇便會隨著這些條件的改變而發生變化[6]。
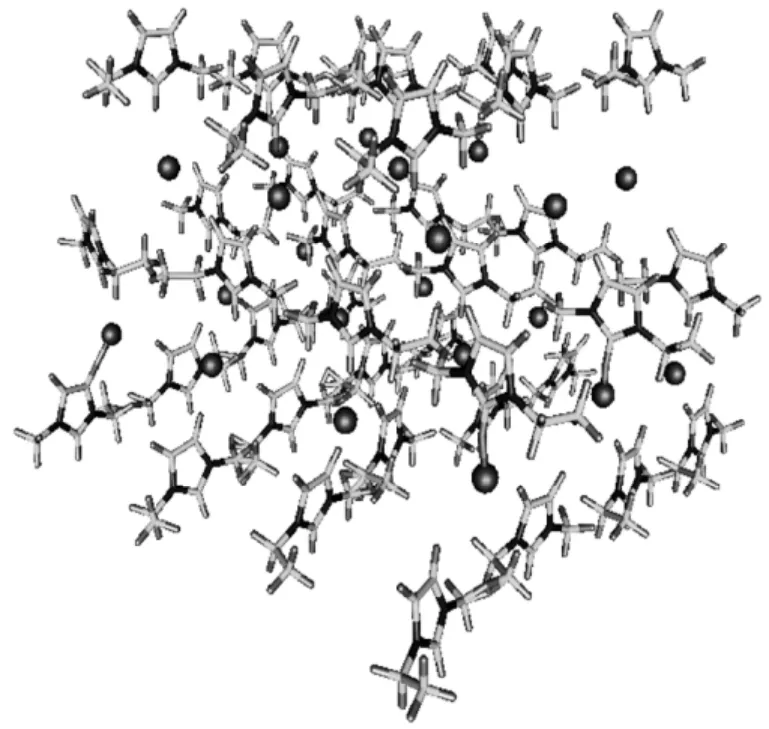
圖 2 三維氫鍵網絡結構
2 離子液體的制備方法
離子液體的合成與制備是離子液體研究的基礎與核心。最早的室溫離子液體——硝酸乙基銨([C2H5NH3][NO3]),是由Walden等[2]在1914年合成出來的,其合成方法較為簡單,將濃硝酸加入到乙胺中,經過蒸餾除去水后就可以得到純的硝酸乙基銨離子液體。盡管早期的這種常規合成路線和制備方法存在著一定的缺點,但這一思路卻一直沿用至今。而為了克服常規合成法存在的一些問題,近年來,新型離子液體的合成方法也不斷涌現出來。
2.1 常規合成法
常規合成法包括一步合成法和兩步合成法。離子液體的合成方法主要取決于目標離子的結構和組成,迄今為止,在合成的數百種離子液體中,最常見的合成方法就是一步法和兩步法。
2.1.1 一步合成法
一步合成法包括由親核試劑——叔胺(包括吡啶、咪唑等)與鹵代烷烴或酯類物質(羧酸酯、磷酸酯和硫酸酯)發生親核加成反應,或利用胺的堿性與酸發生中和反應而一步生成目標離子液體的方法。例如,Sun等[7]利用2-甲基吡咯啉與碘丙烷在溶劑乙腈中通過親核加成得到了1-丙基-2-甲基吡咯啉碘化物[MP3I],并用同樣的方法合成了1-丁 基-2-甲基吡咯啉碘化物[MP4I],收率分別為96%和89%。Yang等[8]將二乙基硫酸酯逐滴滴加到等摩爾的1-甲基咪唑的苯溶液中,在氮氣氣氛條件下,合成了1-乙基-3-甲基咪唑乙基硫酸鹽(EMISE)離子液體。反應式見圖3。
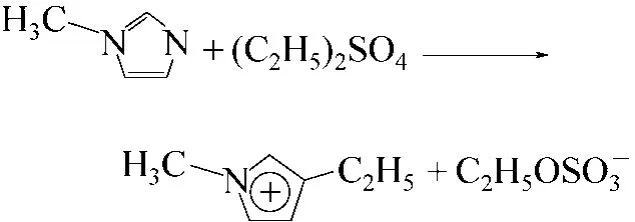
圖3 乙基-3-甲基咪唑乙基硫酸鹽離子液體的合成路線
2.1.2 兩步合成法
當一步合成法難以得到目標離子液體時,就必須采用兩步合成法。兩步合成法合成離子液體的路線如圖4所示。第一步先由叔胺與鹵代烴反應合成季銨的鹵化物;第二步再通過離子交換、絡合反應、電解法或復分解反應等方法,將鹵素離子轉換為目標離子液體的陰離子。
離子交換法是將含目標陽離子的離子液體前體配成水溶液,然后通過含目標分子陰離子的交換樹脂,通過離子交換反應得到目標離子的水溶液,然后蒸發除水得到產品。陰離子絡合反應主要是利用鹵素離子與過渡金屬鹵化物的絡合反應生成單核或多核的絡合陰離子,這些陰離子包括[AlCl3]-、[Al2Cl7]-、[FeCl4]-、[ZnCl3]-、[CuCl2]-、[SnCl3]-等[9-11]。電解法是直接電解含目標陽離子的氯化物 前體水溶液,生成氯氣和含目標陽離子的氫氧化物,后者再與含目標陰離子的酸發生中和反應。復分解反應是離子液體合成的最常用的方法,將分別包含目標陰陽離子的兩種電解質通過復分解反應得到所需的離子液體。應特別注意的是,在用目標陰離子(Y-)交換(X-)陰離子的過程中,必須盡可能地使反應進行完全,確保沒有X-陰離子留在目標離子液體中,因為離子液體的純度對于其應用和物理化學特性的表征至關重要[12]。
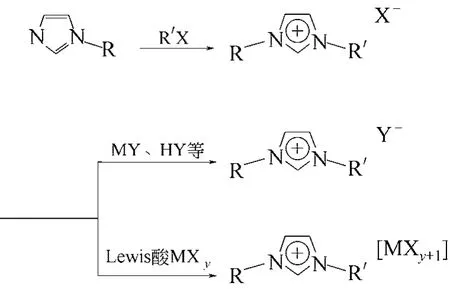
圖4 兩步法合成離子液體路線
2.2 新型合成方法
離子液體的常規制備方法通常需要使用大量的有機溶劑作為反應介質或用于洗滌純化,產物收率偏低,這不符合綠色化學的原則,且需要加熱回流很長時間。微波[13]和超聲波[14]輔助的有機合成方法產生于20世紀80年代,目前這兩種方法在實驗室以及工業上被廣為應用。微波和超聲波等新型合成方法的運用,使離子液體的制備反應能夠快速有效地進行,為尋求更為高效經濟且環境友好的離子液體制備技術提供了可能。
2.2.1 微波輔助合成離子液體
微波輔助合成離子液體不需要溶劑,反應時間可以縮短至幾小時甚至幾分鐘。其原理是極性分子在快速變化的電磁場中不斷改變方向,從而引起分子的摩擦發熱,屬于體相加熱技術。微波加熱升溫速度快,而且分子的不斷轉動本身也是一種分子級別的攪拌作用,因此可以極大地提高反應速率,甚至產率和選擇性。Horikoshi等[15]采用微波一步無溶劑法制備了[Bmim]BF4,并針對合成過程中微波頻率、時間和溫度的影響作了詳細考察,在5.8GHz的微波頻率下反應30min,產物收率達到了87%。Mouslim等[16]用微波輔助制備了24種一系列功能化的1-烷基-3-乙基咪唑以及10種雙核離子液體,并將其與傳統的制備方法進行比較,不但極大地縮短了合成反應的時間,避免了大量使用有機溶劑,且大部分離子液體都得到了更高的產率。但是微波輔助合成方法同時也存在著一定的弊端,其最大的缺點是反應不容易控制、有副反應發生。
2.2.2 超聲波輔助合成離子液體
超聲波借助于超聲空化作用可以在液體內部形成局部的高溫高壓微環境,而且由于超聲波的震動攪拌作用可以極大地提高反應速率,尤其是非均相化學反應。同樣,Mouslim[17]用超聲波輔助合成了26種新型功能化咪唑離子液體,結果發現,使用超聲波輔助合成相比于常規合成方法,大大縮短了反應時間,提高了產品轉化率,并且克服了微波輔助合成反應不容易控制的缺點,得到更高的產品純度。
此外,還有將微波和超聲兩種制備技術組合起來的微波-超聲組合法制備離子液體,這種組合能更加有效的提升過程的經濟性,提高制備離子液體的效率[18]。
3 離子液體的應用
由于具有優良的特性,離子液體被廣泛應用于化工過程的不同方面。目前離子液體被廣泛應用于化工分離過程、電化學、化學反應中,不僅是許多反應的優良溶劑,還可以用作反應的催化劑。
3.1 離子液體在萃取分離中的應用
液-液萃取分離過程作為一種有效的分離方法,應用范圍非常廣泛。由于考慮到萃取效果的因素,以往的萃取劑大多選擇揮發性強、毒性大的有機溶劑,導致對環境產生了嚴重的危害。而離子液體作為一種綠色的溶劑,內部存在氫鍵,具有一定的極性,其選擇性的溶解能力和合適的液態范圍使其在多種萃取分離中得到了廣泛的研究和應用。
3.1.1 萃取有機物
因離子液體蒸氣壓低、熱穩定性好,萃取完成后通過蒸餾提取萃取相,易于循環利用,故在萃取有機物方面具有很大的優勢。一方面,離子液體能與溶劑有強烈的相互作用,因此具有很強的選擇性;另一方面,由于離子液體幾乎不揮發,因此在使用和回收過程中溶液損失幾乎為零。
Khachatryan等[19]報道了用[Bmim][PF6]從水溶液中萃取酚類化合物,考察了pH值、酚濃度、體積比對萃取的影響,結果表明不同的酚化合物在離子液體/水中的分配系數有很大的差別,其中1-萘酚、2-萘酚的分配系數最大。
關衛省等[20]研究了醇與離子液體二元體系共同作用萃取鹽酸多西環素,其萃取效率高達90.26%~95.71%,比單純的離子液體/無機鹽雙水相和醇/鹽雙水相體系的萃取效率都要高。
3.1.2 萃取金屬離子
若用普通的離子液體萃取金屬離子,金屬的分配系數D(離子液體中濃度/水中濃度)小于1。因此要設法提高分配系數D值,一般有兩種方式:一是加入另一種萃取劑,二是在離子液體的陽離子上引入配位原子或配位結構。
離子液體應用于金屬離子的研究是從1999年發展起來的,Dai等[21]用離子液體作溶劑,以二環己基18冠6為萃取劑,從Sr(NO3)2水溶液中萃取Sr2+。結果發現,用離子液體[Emim][NTf2] ([Emim]為1-ethyl-3-methylimidazolium)作溶劑,Sr2+在兩相的分配比高達1.1×104,比相同條件下以甲苯作溶劑的分配比大了近4個數量級。自此,離子液體分離化學己成為金屬離子分離研究的前沿和趨勢。
Nur等[22]用離子液體1-丁基-3-甲基咪唑雙(三氟甲磺酰)亞胺鹽作溶劑,以螯合劑鄰二氮菲為萃取劑,對馬來西亞北吉蘭丹含水層中的鐵離子進行選擇性萃取,研究發現,水相中pH值對Fe(Ⅲ)和Fe(Ⅱ)的萃取有很大的影響,地下水樣品中鐵的萃取率超過了95%,但是由于離子交換的影響,離子液體的重復利用率很低(只有25%~60%)。對于在離子液體中引入配位原子萃取金屬離子也有不少 研究。
Lee[23]制備了9種不同功能化的吡啶、吡咯、哌啶雙(三氟甲磺酰)亞胺鹽,在取代基上引入了烯基、雙硫基和腈基,并研究在不同pH值(5.9、2.8、3.4)下各種離子液體從水相中萃取Ag+、Pd2+和Au3+的能力,發現含有烯基、雙硫基和腈基的離子液體對Pd2+和Au3+都有很好的萃取效果,而對于Ag+,含有烯基的離子液體對其的萃取能力遠不如含有雙硫基和腈基的離子液體,且后兩者可以將Ag+從水相中完全萃取出來。
3.1.3 離子液體用于萃取脫硫
離子液體作為一種新型的溶劑也被用于萃取脫硫,用于萃取脫硫的離子液體主要有咪唑類、吡啶類、胍基、醇胺類離子液體[24-26]。影響離子液體脫硫效果的因素主要歸因于離子液體的水溶性、結構及陰離子大小等,一般來說,陰離子尺寸越大,萃取效果越明顯,因此可通過調整陰陽離子的大小、結構設計符合需要的離子液體。
李珂等[27]通過兩步法合成了1-庚基-3-甲基咪唑四氟硼酸鹽離子液體,以30%的雙氧水為氧化劑,考察了其在不同萃取時間、萃取溫度、攪拌速率下對汽油的脫硫效果,在確定了最佳脫硫條件后又做了三組平行多級逆流萃取脫硫的串級實驗,結果發現,一次脫硫率可以達到77%,采用四級逆流萃取脫硫后,脫硫率達到94%,汽油回收率達到95%,具有較好的工業應用前景。
Hong等[28]制備了一系列[(C4H9)4N]4NiMo6-xWxO24H6(x=2,4,6)型離子液體,并將其應用于催化氧化脫硫系統中,以除去樣品柴油中的苯并噻吩、二苯并噻吩及它們的衍生物,發現在雙氧水和萃取劑[Bmim]PF6的存在下,[(C4H9)4N]4NiMo6O24H6呈現了非常高的催化效果,二苯并噻吩在30℃下3h內就能達到98%的脫除率;二苯并噻吩的脫除效果取決于該離子液體中Mo原子的含量,當Mo原子含量不斷增加時,二苯并噻吩的脫除效果越好;此外,該脫硫體系在催化劑回收10次以后脫硫效果仍未見明顯降低。
3.1.4 離子液體用于氣體分離
離子液體對氣體具有獨特的選擇性溶解及吸收性能,因此國內外對于其在氣體分離中的研究作了大量的研究。除了一些外界因素如溫度、壓強、離子液體的理化性質等的影響,氣體在離子液體中的溶解度主要受到離子液體與氣體之間相互作用的影響。目前研究較多的是酸性氣體的分離。通過對酸性氣體CO2在離子液體中的溶解度的研究發現,離子液體的陰離子起到了主要作用[29];而Huang 等[30]發現,決定SO2溶解度大小的主要因素是離子液體的陽離子。因此,離子液體與氣體溶解度之間的構效關系還有待研究。通過增加陰陽離子的碳鏈長度和離子液體的堿性,都可以增加這兩種酸性氣體的溶解性。氣體在離子液體中的溶解度差異決定了氣體在離子液體中的分離,但是由于離子液體黏度較大,混合時接觸面積較小,不利于氣體的分離,因此通常將離子液體固定到有機高分子或無機材料上,制得多孔離子液體材料,如離子液體固定化顆粒及多孔材料膜進行固載化,以利于分離。
對于酸性氣體,大多使用堿性較強的離子液體進行分離。Zhang等[31]將四甲基胍鹽離子液體[TMGL]負載到硅膠顆粒上,利用硅膠比表面積大的特點,增加了SO2的吸附率,在15~30mim內,每克TMGL對SO2/N2體系中SO2的吸附量達到了0.6g,在17 h后吸附率仍能達到0.15gSO2/gTMGL。更值得一提的是,TMGL-SiO2固體顆粒在使用很多次之后吸附量不發生任何變化并且即使是在130℃的高溫下也不會受到影響。
光催化產氫技術是一種環境友好的生產氫氣的方法,但是在生產過程中會伴隨著氧氣的產生,因此Pornravee等[32]制備了一種基于全氟辛醇型離子液體的材料膜以吸收H2/O2中的O2,達到分離的目的。這種膜由兩部分不同粒徑的多孔α-AlCl3組成,研究表明,該支撐離子液體膜在40℃時對H2/O2的選擇性達到了100%,增加溫度和氣流速度并不會影響效果,但是會減少膜的使用壽命,而增加壓力則會減少氫氣在膜中的滲透。H2和O2在膜中的擴 散 率 和 溶 解 性 分 別 為1.4×10-4cm2/s、3.2×10-5cm2/s以及4.4×10-4mol/(m3·Pa)、5.4×10-4mol/(m3·Pa)。
3.1.5 離子液體在生物質溶解方面的應用
生物質作為一種可再生的碳源具有產量大,含硫、含氮量低,二氧化碳凈排為零等特點。因此研究者們將離子液體與生物質這兩部分聯系起來,在解決能源問題的同時對環境綠色友好,而要將這兩種物質聯系起來首先要研究的問題是離子液體對生物質的溶解。生物質是指植物通過光合作用生成的有生命的有機物質,離子液體對生物質尤其是纖維素、木質素等碳水化合物有較好的溶解性能,因此主要集中在這方面的研究。
離子液體對生物質的溶解要追溯到1934年,Graenacher提出熔融的N-乙基吡啶氯鹽能溶解纖維素,但是由于該鹽熔點高,使得這一發現沒有受到重視。而真正開始受到廣泛關注的是2002年Rogers的研究小組[33-34]首先提出應用離子液體溶解纖維素。研究發現,離子液體1-丁基-3-甲基咪唑對纖維素有較好的溶解性。研究表明,相對較小的陽離子對生物質的溶解性能較好,增加碳鏈長度將會導致溶解性能的下降;而離子液體的陰離子能與纖維素中的羥基形成氫鍵從而破壞原有的組織氫鍵使其溶解。隨后,眾多的研究者開始了對這方面的研究。
周紅霞等[35]合成了5種磷酸酯類離子液體,實驗表明,在這5種離子液體中,1,3-二甲基咪唑磷酸甲酯鹽[Mmim]DMP對木質素具有最好的溶解性能,在70℃攪拌120mim,木質素的溶解度可達到45%。值得一提的是經離子液體溶解再生后木質素的形貌發生了顯著的變化,離子液體溶解性能的增強使得所得再生木質素的顆粒更加均勻、分散性更好且彌散衍射特征越強,并且所用離子液體循環使用5次后對木質素仍有很好的溶解性能。
3.2 離子液體在有機合成反應中的應用
3.2.1 離子液體作為溶劑
目前在有機合成中所使用的溶劑大多數為有機溶劑,這些有機溶劑存在著易揮發、有毒、易燃易爆等因素,因此綠色無毒無污染的合成是現在化學工業所追求的重要目標。離子液體相比于這些有機溶劑,具有極低的蒸氣壓、不易揮發、無毒、不易燃易爆、有較高的熱穩定性和化學穩定性,并且在離子締合與溶劑化效應共同存在的作用下,體系內部存在的氫鍵、離子、離子簇等結構增加了反應物在離子液體中的溶解性,促進了反應的進行,近年來在Friedel-Crafts反應、Diels-Alder反應、碳-碳偶聯反應、氧化還原反應、酯化反應、加成反應等各種有機反應得到了廣泛的應用。
(1)離子液體作為溶劑用于Friedel-Crafts反應 Friedel-Crafts反應包括F-C烷基化反應和F-C酰基化反應,是在烷基或芳基上接上碳骨架和合成芳香酮的重要方法,被廣泛應用于很多染料的合成。
Somayeh等[36]在離子液體1-丁基-3-甲基雙三氟甲磺酰基酰亞胺鹽([Bmim][NTf2])與二氧化碳的均相體系中對二茂鐵進行酰基化反應生成乙酰基二茂鐵。與傳統工業相比,在離子液體中的Friedel-Crafts酰基化反應轉化率高,選擇性好,易于回收,環境污染少。值得一提的是,在通常的反應中,盡管離子液體具有諸如低飽和蒸氣壓、低毒、高溶解性能的優點,但是在反應結束后還是要加入有機溶劑將產物萃取出來,這樣就不能做到完全綠色,因此該課題組通過加入超臨界二氧化碳來實現產物的分離。實驗證明,超臨界二氧化碳可以將反應物從體系中萃取出來。原因在于咪唑型離子液體中的氫鍵網絡能夠很好地容納CO2,使CO2在離子液體中有很好的溶解能力,而大多數離子液體卻不能溶解在CO2中,因此實驗中通過改變壓力與CO2的濃度控制其與離子液體的相互溶解性,很好地實現了產品的“綠色”分離。
(2)離子液體作為溶劑用于Diels-Alder反應 含有一個活潑雙鍵或三鍵的烯或炔和二烯或多烯共軛體系發生1,4加成,產物通常為六元環狀化合物(如圖5所示)。該反應稱為Diels-Alder雙烯加成反應,是有機化學合成反應中非常重要的碳碳鍵形成的重要方法,也是現代有機合成里常用的反應 之一。
關于離子液體的性質對Diels-Alder反應的影響,Cinzia等[37]采用多線性溶劑化能關系和理論分析對其進行了研究:動力學和立體化學研究表明,溶劑和親二烯體的結構決定了反應的速率和選擇性,同時還影響著親二烯體的特定基團和離子液體化合物之間的相互作用,離子液體中陰、陽離子的 性質共同影響了Diels-Alder反應活性。
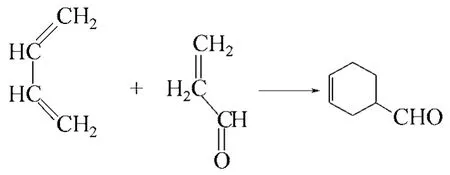
圖5 Diels-Alder雙烯合成反應
Diganta等[38]用稀土金屬三氟甲磺酸酯在離子液體中催化Diels-Alder反應,對不同的二烯烴和親二烯體進行考察,發現在離子液體中進行反應可有效促進催化劑的催化能力,提高產品的收率及內/外立體選擇性,并且,催化劑在回收6次后活性基本不變。
(3)離子液體作為溶劑用于C—C偶聯反應 C—C偶聯反應為多種精細化學品的合成提供了可能,在有機合成中應用非常廣泛。Suzuki偶聯反應是鹵代芳烴或烯丙基鹵化物與有機硼在鈀等催化下的偶聯反應,在常規有機溶劑中的反應存在著很多的缺點,如催化劑回收困難、試劑溶解度低等。而在離子液體中,反應可以在較溫和的條件下進行,產率和轉化率得到了明顯的提高[39]。
Li等[40]制備了一系列咪唑型離子液體,并將其作為溶劑進行Suzuki偶聯反應,在K2CO3和2.0%PdCl2存在下,芳香硼酸和芳香碘化物反應得到了非常高的產率,且產物能通過簡單的乙醚萃取從反應溶液中分離出來,而剩余反應液通過水洗除去無機鹽,真空干燥后能直接用于下一次反應。催化劑PdCl2循環7次后活性未見明顯降低。
(4)離子液體作為溶劑用于氧化反應 氧化反應包括烯烴的環氧化及二醇化、醇的氧化、芳烴的氧化、烷烴的催化氧化、含硫化合物的氧化及Baeyer-Villiger反應等。對于氧氣為氧源的反應,通常在使用揮發性有機溶劑時,由于其會被在氣相生成爆炸性混合物的爆炸極限所限制,在使用方面受到很大的限制。而采用非揮發性的離子液體作為溶劑就不會產生這樣的問題。
2000年,Howarth[41]以離子液體[Bmim][PF6]作為溶劑、Ni(acac)2作為催化劑、氧氣為氧源,在常壓下催化氧化各種芳香醛成相應的羧酸,從此開始了離子液體作為溶劑在氧化反應中的應用。
Bose等[42]考察了在不同氧化劑(如叔丁基過氧化氫、亞碘酰苯、次氯酸鈉)下Fe吡咯和Mn吡咯在離子液體[Bmim][PF6]中對共軛烯烴和非共軛烯烴的環氧化效果。結果表明,相比于其他有機溶劑,在離子液體中能取得更高的轉化率和選擇性,在離子液體和氧化劑次氯酸鈉水溶液形成的兩相體系中得到了最好的環氧化效果。
(5)離子液體作為溶劑用于酯化反應 酯化 反應是一類典型的有機化學反應,是醇跟羧酸或含氧無機酸生成酯和水的反應。酯化反應分為羧酸與醇反應、無機含氧酸與醇反應、無機強酸與醇的反應3類。
Yuan等[43]將楊樹木材溶解在離子液體1-丁 基-3-甲基咪唑氯鹽中,并在溫和的條件下對其進行均相酯化,發現在三乙胺作為中和劑存在的情況下能得到很高的酯化率,木材的質量分數從反應前的121.5%增加到了297.4%;同時,結果表明,在離子液體中對楊樹木材的均相酯化提高了木材與合成聚合物的相容性且很好地改善了其加工性能。
Galonde等[44]制備了9種離子液體,考察了它們的陰、陽離子結構和性質對酶催化甘露醇酯化的影響。結果表明,在含有OTf-陰離子的離子液體中,酯化反應有最好的收率和初始速率。在離子液體[Bmim][OTf]中,24h的產率達到了64.9%,在[Bmpyrr][OTf]中達到了最高的產率70.9%,而在含有其他陰離子的離子液體中只達到了29.7%和44.5%的產率。
(6)離子液體作為溶劑用于Michael加成反 應 Michael加成反應是有機合成中最常用的碳-碳成鍵反應之一,它是由活潑亞甲基化合物形成的碳負離子,對α,β-不飽和羰基化合物的碳碳雙鍵進行親核加成,是活潑亞甲基化合物烷基化的一種重要方法。
Brangdy等[45]以咪唑鹽型離子液體和磷鹽型離子液體作為溶劑,對乙酰乙酸乙酯和丙烯基2-乙基己基酯進行Michael加成反應。結果發現,與其他有機溶劑如甲苯、THF和DMF等相比,在離子液體中進行反應的效果得到了明顯的改善;同時對其反應動力學進行研究后發現,反應速率取決于堿性催化劑的類型和濃度以及反應物乙酰乙酸乙酯和丙烯基2-乙基己基酯的濃度。當加入的堿性催化劑量確定之后,由于是在丙烯基2-乙基己酯加入前,乙酰乙酸乙酯平衡了催化劑的堿性,所以烯醇的濃度約等于催化劑的濃度。這就導致了烯醇的濃度在反應過程中恒定不變,且其反應速率符合了準一級動力學方程:Rate=Kobs[Acrylate]。
3.2.2 離子液體作為催化劑
離子液體在有機反應中的應用,早期主要集中用于代替傳統的有機溶劑,提供一個更加綠色的反應體系。后來研究發現,離子液體作為反應介質,可以提高反應的速率和催化活性,更重要的是離子液體本身也可以作為一種“綠色環保”的高效新催化材料,代替有毒、污染嚴重的傳統催化劑,就連最簡單的[Bmim]BF4也可以作為催化劑使用,其原因就在于離子液體的陰離子電荷離域,它的抗衡陽離子就有潛在的Lewis酸性,也就是說該離子液體可以作為酸催化反應的催化劑。離子液體的這一性能為構建綠色催化反應過程提供了新的途徑。而近年來,更多的研究被投入到功能化的離子液體的催化中,根據反應和催化過程本身的特點作適當調變,大大拓寬了其在催化反應過程中的應用范圍與前景,成為當今綠色化工的熱點研究方向。
(1)酸性離子液體催化劑 酸催化是化學工 業中最重要的技術之一[1],但是傳統的強酸催化劑如HF、H2SO4等都會產生一系列的環境問題,AlCl3也存在著一定的毒性和腐蝕性,且在水的存在下會產生大量的HCl。因此,很多科學家正不斷探索酸性離子液體來取代這些強酸,實現綠色可持續發展。
酸性離子液體主要包括Lewis酸性離子液體和Bronsted酸性離子液體。Lewis酸性離子液體是指能夠接受電子對的離子液體,其中最具代表性的是氯鋁酸類離子液體。如在Friedel-Crafts烷基化反應中,對于芳烴的烷基化,最初也是最常用的是無水三氯化鋁,后來的研究證明,其他一些催化劑也有同樣的催化效果,其催化活性依次為AlCl3>FeCl3> SnCl4>BF3>TiCl4> ZnCl2,反應中常用的溶劑為石油醚、氯苯等。而烷烴烷基化反應的催化劑常用濃硫酸和HF酸等,其催化活性依次為HF>H2SO4> P2O5>H3PO4。萘類的Friedel-Crafts烷基化反應的產率非常低,因為它能與傳統的催化劑發生反應,另外雜環類化合物的產率一般也較低。因此,需要尋求一種新型的催化劑以提高其產率。而具有Lewis酸性的離子液體在該反應中可以起到兼作溶劑和催化劑的雙重功能,代替了傳統的有機溶劑和催化劑,克服了濃硫酸的強腐蝕性和AlCl3在許多溶劑中不溶的缺點,反應條件溫和,反應效果好,產物易分離。Chen等[46]用一系列Lewis酸性離子液體作為催化劑,催化蒽和2-氯丙烷的烷基化反應,得到2-異丙基蒽,采用的離子液體有:[Emim]Cl-AlCl3,[Emim]Cl-FeCl3,[Emim]Cl-ZnCl2,[Bmim]Cl-AlCl3,以及[Omim]Cl-AlCl3([Emim]+為1-乙基-3-甲基咪唑陽離子,[Bmim]+為1-丁基-3-甲基咪唑陽離子,[Omim]+為1-辛基-3-甲基咪唑陽離子)。其中[Emim]Cl-AlCl3在該烷基化反應中表現出了最好的催化效果,2-異丙基蒽的轉化率可以達到74.5%,選擇性達到了82.9%,并且催化劑在回收6次后仍能表現出很好的催化活性。該反應中產品易分離且催化劑有較好回收效果,這對合成2-異丙基蒽的綠色及環境友好戰略的實施有著重要的意義。除此之外,Lewis酸性離子液體還被應用于催化Diels-Alder反應[47]、羰基化反應[48]等。
Bronsted酸性離子液體多指在離子液體中含有質子的離子液體,被廣泛應用于催化反應過程,例如吡啶類質子離子液體[2-MPyH]OTf可以成功地催化苯酚烷基化反應[49]、胺基質子離子液體[Et3NH][HSO4]在Knoevenagel縮合反應中取得了良好的催化效果[50]。Davis等將磺酸基團引入咪唑,首次合成磺酸功能化離子液體,為酸性離子液體的催化領域開辟了一條新道路,自此,一大批磺酸功能化的離子液體被制備出來。李穎等[51]合成了7種不同的酸性離子液體,以油酸和甲醇為原料,探討了這些離子液體作為催化劑催化合成生物柴油的活性。研究表明,離子液體酸性越強,催化酯化活性越高,且引入磺酸基團后可大大增強離子液體的Bronsted酸性,促進酯化反應的進行,提高了產率,其中([BHSO3mim]HSO4的催化效果最好,且連續使用10次后催化效果仍能達到95.6%。
(2)堿性離子液體催化劑 酸性離子液體已 經被很好地報道并成功應用于許多有機反應中,然而關于堿性離子液體的報道還不是很多。堿性離子液體現已被應用于羥醛縮合反應、Knoevenagel反應、烯醇式互變異構反應等。而目前,對堿性離子液體催化酯交換合成生物柴油的研究比較多。在傳統工藝中,常采用強酸強堿作為酯交換反應的催化劑,但是強酸作為催化劑時存在設備腐蝕嚴重、產物分離困難、環境污染嚴重、后處理困難等缺點。而用堿作為催化劑時,雖然反應條件溫和、反應速度快,腐蝕性也比酸性催化劑弱很多,但由于其對游離脂肪酸比較敏感,因此油脂原料的酸值要求比較高,對于高酸值的原料,需要經過脫酸或預酯化后才能進行堿催化的酯交換反應。堿性離子液體就能克服上述缺點。左同梅等[52]用兩步法合成了嗎啉陰離子型堿性離子液體1-丁基-3甲基嗎啉鹽,并通過離子交換得到了堿性離子液體(圖6),用于催化酯交換制備生物柴油。結果表明,該堿性離子液體具有較好的催化活性,在60℃、醇油摩爾比為6.5∶1.0、催化劑用量為3%的條件下,反應2h得到了最好的催化效果,產物脂肪酸甲酯的產率可以達到95.80%,且該催化劑穩定性較好,重復使用5次后仍有較好的催化活性。
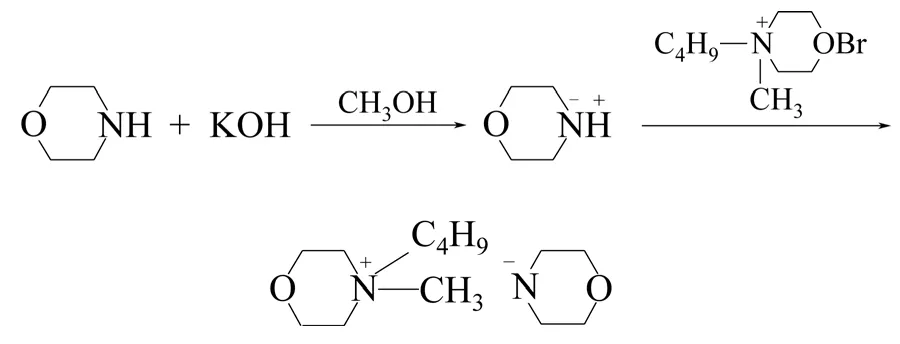
圖6 1-丁基-3甲基嗎啉鹽合成路線結構
(3)負載型離子液體催化劑 近年來,雖然離子液體催化劑層出不窮,且能達到非常好的催化效 果,但是很多反應都是均相反應,催化劑回收困難,且在使用一次后流失非常嚴重,難于用于后續的反應。因此,越來越多的研究將離子液體與其他材料通過共價鍵結合起來,使催化劑在循環使用多次后仍能保持很好的催化活性,這將會大大改善催化劑的使用效能,同時也符合現代綠色化學的要求。
Shen等[53]用離子液體支載的咪唑烷酮化合物(圖7)作為催化劑,在溫和的條件下催化α,β不飽和醛和環戊二烯的Diels–Alder反應,發現在該離子液體催化劑存在下得到了很高的效率,給出了很高的產率和對應選擇性,更加值得一提的是,該催化劑在循環使用5次后仍能保持很好的催化活性。
Yun 等[54]以乙酰丙酮和乙二胺為原料,經多步反應得到吡啶類離子液體支載的席夫堿銅催化劑(圖8)。用該催化劑催化氧氣氧化環己烯,支載后同樣也大大提高了轉化率和選擇性。研究結果表明,不同的陰離子對催化劑活性有不同影響,而且溶劑也能改變陰、陽離子之間的反應,可以通過改變陰、陽離子和選擇合適的溶劑提高催化劑的活性。此外,催化劑回收5 次活性只是略微下降。
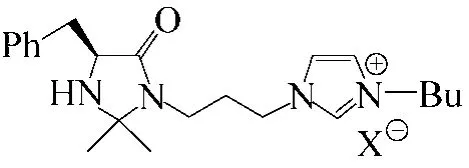
圖7 離子液體支載的咪唑烷酮化合物
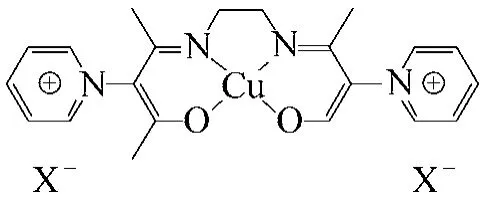
圖8 吡啶類離子液體支載的席夫堿銅催化劑
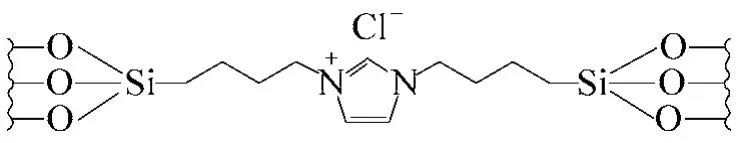
圖9 有機硅負載的離子液體
Suzuki偶聯反應常用的催化劑是均相鈀配體催化劑,雖然其反應效率高,但是產物難以分離,不能循環使用,因此越來越多的人們把重點放在如何回收鈀催化劑,提高循環使用效率,以提高成本,實現良好的經濟效益。Karimi等[55]合成了一種新型的基于負載鈀催化劑的離子液體有序介孔有機硅體 系(圖9)。在該介孔軌道中,咪唑型離子液體可以均勻地分布在其中間,因而使Pd也能牢固均勻的分散在介孔軌道內。將該催化劑用于催化含有不同取代基的鹵代芳香基與芳香硼酸的Suzuki偶聯反應,顯示出了良好的催化活性,對于不活潑的氯代芳烴,其產率也達到了70%以上,同時該催化劑回收5次后催化活性未見明顯下降。
溫室效應是目前全球人類共同關注的熱點問題,而二氧化碳作為產生溫室效應的主要氣體,對全球氣候產生了巨大的影響。目前,科學家們正不斷探索減少二氧化碳排放的方法。而二氧化碳和活潑環氧化物進行環加成得到環碳酸酯的反應能夠合理利用二氧化碳,使之作為反應原料消耗在化學反應中。環碳酸酯具有較好的溶解性和生物降解性,也是許多化學反應(如二甲基碳酸酯、聚碳酸酯等)的起始原料,在化學合成、電化學及金屬萃取方面都有廣泛的應用,因此這一方法既減少了二氧化碳的排放,又為化學合成提供了廉價的原料。目前,二氧化碳和環氧化物合成環碳酸酯主要的催化劑有各種堿金屬及其氧化物、卟啉配合物、金屬salen化合物等,近年來,離子液體用于催化二氧化碳與環氧化物環加成反應也受到了越來越多的關注。Sun等[56]合成了一種殼聚糖功能化的1-乙基-3-甲基咪唑鹵鹽(圖10),在無溶劑和沒有其他金屬助催化劑的情況下催化CO2與一系列的環氧化物合成五元環環狀碳酸酯,得到了很高的轉化率和選擇性,催化劑可以通過很簡單的方法回收,且循環使用5次后轉化率和選擇性依然很高。同時,他們還提出了一個可能的催化循環:殼聚糖可能對反應起到了兩種作用,首先是氫鍵能輔助環氧化物的開環,其次是親核基團叔胺對CO2起到了誘導活化的作用。

圖10 殼聚糖功能化的1-乙基-3-甲基咪唑溴鹽
Luo等[57]將單金屬salen鋁配合物與含有聚醚鍵的咪唑型離子液體通過共價鍵的方式結合起來, salen試劑結合在5,5’位的兩邊(圖11)。由于存在聚醚鏈和金屬鋁催化中心,在沒有溶劑和助催化劑存在的條件下,該催化劑在溫和的條件下顯示出了優良的捕獲CO2的性能,碳酸酯的產率超過了90%。催化劑簡單易回收,在回收6次后催化活性和選擇性沒有明顯降低。
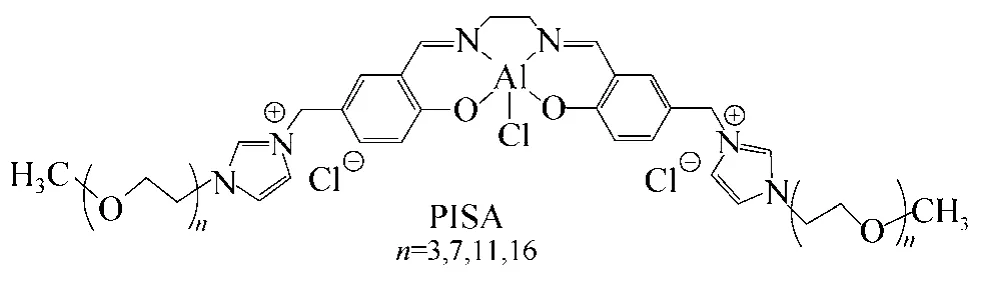
圖11 離子液體支載的salen鋁配合物
(4)磁性離子液體材料催化劑 磁性納米顆 粒是指粒徑在1~100nm之間的磁性材料,目前已成功應用于固載酶、過渡金屬催化劑和有機催化劑。磁性粒子的復合材料兼具有機/無機的眾多優良特性,具有高活性和高選擇性,而且可以在外加磁場的作用下簡單回收利用。
2009年,Luo等[58]首次合成了磁性納米顆粒負載的離子液體催化劑。該磁性催化劑對于低CO2壓力的條件(1MPa)下,CO2的環加成反應具有較高的活性(與單純用離子液體催化的活性幾乎相同),且催化劑循環使用11次仍沒有明顯的活性降低。
Pourjavadi等[59]將磁性納米粒子包埋在鎢酸功能化的聚合離子液體母體中,制備出了磁性可回收氧化反應催化劑,并以H2O2為氧源,以醇、硫化物、烯烴等為原料,進行了一系列的選擇性氧化反應,都取得了很高的轉化率及選擇性,并且催化劑可以重復利用至少10次,且催化活性降低很少。
Amin等[60]合成出一種磁性離子液體[Bmim][[FeCl4]用于催化油酸合成生物柴油的酯化反應,在甲醇-油酸摩爾比為22∶1、催化劑為0.003mol、反應3.6h的條件下得到了最優的酯化效果,轉化率和選擇性均達到83.4%,催化劑回收6次后催化活性沒有明顯降低。該結果相比于其他均相或非均相的油酸酯化反應較低,因此磁性離子液體[Bmim][[FeCl4]在催化生物柴油的合成方面具有很好的應用前景
(5)基于離子液體的有機-無機雜多酸材料催化劑 有機-無機雜化材料兼具有機和無機材料的特性,是當今材料科學與技術領域中的研究熱點。雜多化合物熱穩定性好,且對氧穩定,配位原子一般以最高氧化態存在,是一類兼具有氧化性和酸性的雙功能催化劑,又由于離子液體存在高度的可設計性和可調配性,許多研究者根據這一思路先將適合特定反應體系的功能化離子液體與相應的多酸或雜多酸結合,制備基于離子液體的固體催化劑,在很多有機反應,如氧化反應、酯化反應、氧化還原反應中都有很好的應用。
Kakati等[61]對陰離子進行修飾,合成出了以釩為活性中心的離子液體雜多酸催化劑 [(C6H5CH2)(CH3)3N]3[H3V10O28]3H2O ,并用于苯甲醇選擇性氧化成苯甲酮的反應,反應在室溫下1min轉化率就達到了98%。孫曉云等[62]合成了一種鎢離子液體[(CH3)N(n-C8H17)3]2W2O11,并將該催化劑用于無溶劑下催化環己醇得到環己酮,取得了很好的效果,且該反應綠色環保,操作簡單,無副產物生成。在氧源雙氧水用量15mmol、反應溫度65℃、環己醇用量5mmol、催化劑用量50mmol的條件下回流8 h,得到了最好的氧化效果,環己酮的產率達到了99%以上,催化劑通過簡單的回收后可循環使用4次。
Leng等[63]將羧酸功能化的離子液體與Keggin型含V的雜多酸進行離子交換,得到了一種基于離子液體的離子液體-雜多酸催化劑(圖12),并將該催化劑用于苯的羥基化反應,考察了在H2O2為氧化劑、乙腈為溶劑時的催化性能。結果表明,該聚合物顯示了很高的非均相催化性能,酚的產率達到了26.9%,選擇性達到100%,催化劑循環使用4次后產率仍能達到17.8%。2014年,該課題組[64]又制備了一種新型的有機金屬-多金屬氧酸鹽雜化物(圖13)用于催化苯的羥基化反應,用離子液體支載V-shiff堿作為陽離子,磷鉬釩酸離子作為陰離子,形成了具有兩個V催化中心的化合物,該催化劑在苯羥基化非均相反應中顯示出了優異的催化活性,達到了19.6%的產率和100%的選擇性;反應結束后,催化劑通過簡單的過濾回收用于重復利用,且使用4次后結構未發生改變。同年,他們又將該聚合離子液體-雜多酸催化劑負載到磁性材料中,合成了一種基于雜多酸的離子高分子磁性復合催化劑 Fe3O4@ PIL-PMoV[65],實現了催化劑的高效快速 回收。
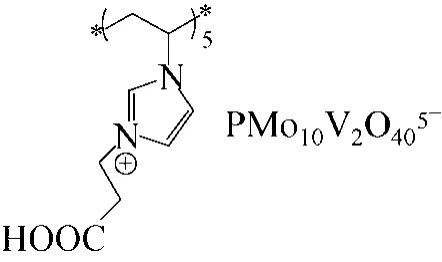
圖12 聚合酸性離子液體-雜多酸催化劑
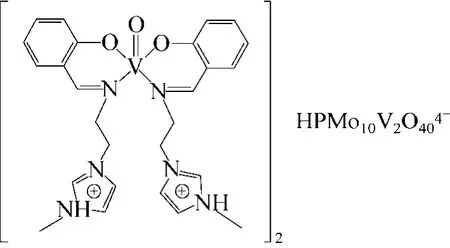
圖13 離子液體支載的Vshiff堿-POM催化劑
工業上常用濃硫酸作為酯化反應的催化劑,濃硫酸價格低廉,具有較好的催化活性及吸水性,能夠有效地促性反應向生成酯的方向進行,從而提高了反應的轉化率,因而其應用最為廣泛。但濃硫酸對設備腐蝕非常嚴重,并伴隨著嚴重的環境污染,且產品的選擇性低,著色度不高。因此,采用雜化催化劑來代替濃硫酸既克服了上述的弊端又提高了催化劑的回收利用率。Leng等[66]設計合成了雜多酸型磺酸功能化聚合離子液體催化劑(其合成路線如圖14所示),并用于無溶劑下催化多種酯化反應。結果表明,該新型催化劑催化效果及選擇性都很高,而且催化劑易回收,重復使用性好。
環氧化物是一類極其重要的有機原料和化工中間體,被廣泛應用于精細化工、石油化工和有機合成等領域。目前傳統的環氧化方法主要是氯醇法和哈孔法。氯醇法工藝大體可分為氯醇化、皂化及精制3個過程;哈孔法是用有機過氧化物催化碳碳不飽和雙鍵環氧化的方法,在過氧羧酸的條件下,以質子酸(硫酸或磷酸)為催化劑制備環氧化物。這兩種方法均存在生產成本高、環境污染嚴重、工藝 復雜以及副產品多等缺點。隨著研究的深入,越來越多綠色環保的高效催化劑被開發出來[67]。目前國內外研究較多的環氧化催化劑有金屬化合物、仿生類化合物、分子篩、類水滑石、雜多化合物及離子液體等多種高效的環氧化催化劑,而基于離子液體的有機-無機雜化材料因具有綠色環保、清潔有效、可回收利用的優勢在催化環氧化方面得到了廣泛研究[68-69]。
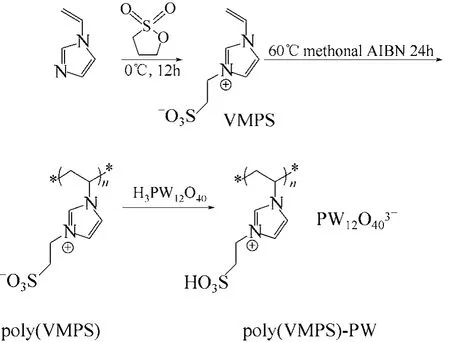
圖14 雜多酸型磺酸功能化聚合離子液體的合成
Raisa等[70]制備了3種不同磷鎢酸支載的四丁基銨鹽和1-乙基-3甲基咪唑鹽:[(n-C4H9)4N]3{PO4[WO(O2)2]4}, [(n-C4H9)4N]5Na0.6H1.4[PW11O39],[(C2H5)(CH3)C3H3N2]5NaH[PW11O39]。以34%的雙氧水為氧化劑、乙腈為溶劑,對丁二烯進行環氧化,發現1,3-丁二烯轉化為3,4-環氧-1-丁烯的轉化率可以達到97%,雙氧水的利用率幾乎達到了100%。且[(C2H5)(CH3)C3H3N2]5NaH[PW11O39]顯示了最好的催化活性。
Wang等[71]合成出一種介孔的雙羥基功能化雜多酸離子液體催化劑(圖15),并以H2O2為氧源,催化環辛烯環氧化反應,反應過程為非均相體系,結果表明,其催化效果為均相催化劑的4倍,為無孔催化劑的14倍。
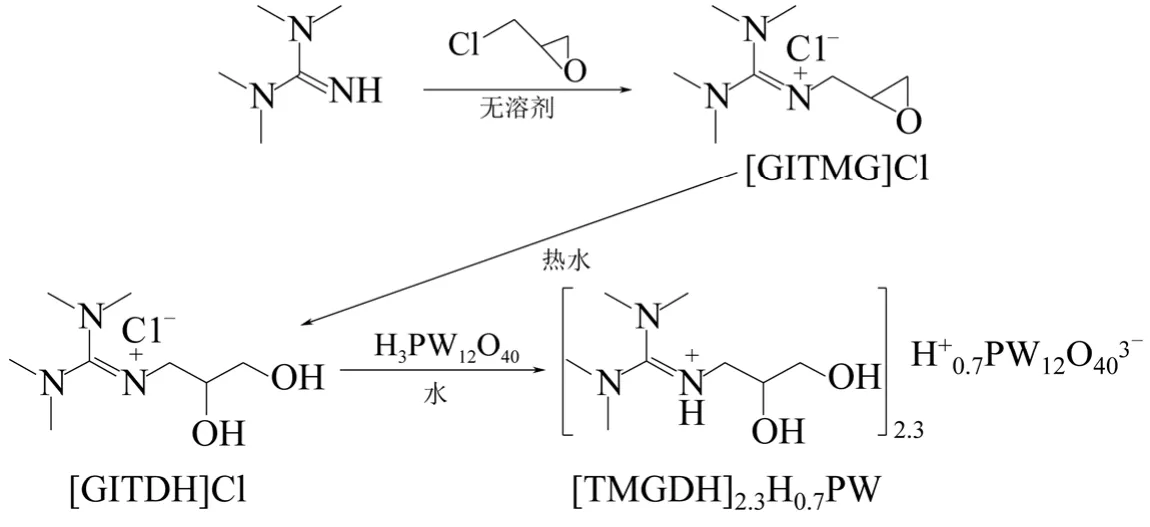
圖15 雙羥基功能化雜多酸離子液體的合成
Wu等[72]合成了一類雙核長鏈烷基咪唑陽離子修飾的過氧磷鎢酸鹽催化劑[Dnmim]1.5PW4O24(圖16),考察了催化劑在雙氧水為氧源的烯烴環氧化反應中的催化活性。研究表明,這類催化劑在反應過程中表現出相轉移催化現象,且具有較高的催化活性和選擇性,雙核十二烷基咪唑雜多酸催化劑對環己烯的轉化率和環氧環己烷的選擇性分別達到了97.7%和96.3%。催化劑通過簡單的離心分離便可循環使用,重復使用4次后,環己烯的轉化率和環氧環己烷的選擇性仍可達到72.4%和96.3%。同時,他們又將該類催化劑用于催化大豆油的環氧化[73]。在無溶劑、雙氧水為氧源的條件下,考察了有機陽離子碳鏈長度對環氧化反應的影響、催化劑的重復使用情況,并且對各種反應條件進行了單因素考察。結果表明,該類催化劑顯示了良好的催化活性及重復使用性。
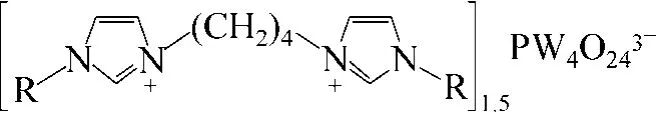
圖16 雙核烷基咪唑過氧磷鎢酸鹽催化劑
總體來說,離子液體作為溶劑和催化劑參與化學反應,大多表現為均相過程。雖然,均相反應可以增加反應物之間的接觸,獲得良好的催化效果,但是,它同時帶來了分離回收困難的問題。當前,越來越多的研究人員開始了對離子液體的非均相化,以有效分離回收離子液體,從而實現其循環利用,提高經濟效益。基于離子液體具有靈活的可調變性,可以通過改變陰、陽離子的親水親油性能,將其制成雙親性的非均相催化劑,實現高效的相轉移催化效能。在此基礎上,還可以將其制成聚合物或各種孔道材料,增加活性中心與反應物的接觸面,提高催化活性。因此,離子液體在非均相催化領域具有更廣闊的應用前景。
4 離子液體在其他方面的應用
4.1 離子液體在納米材料方面的應用
近年來,離子液體在材料制備領域也得到了廣泛的應用,研究范圍包括離子液體中聚合物的合成、無機納米材料的制備、天然高分子的加工等。離子液體的界面張力和界面能低,因而可導致較高的成核速率,產生的粒子非常細小、不易長大且結構規整有序。另外,離子液體對許多有機物和無機物都有很好的溶解性能,因而可以在離子液體中制備各種材料。
Liu等[74]在離子液體1-丁基-3-甲基咪唑四氟硼酸鹽和水的混合溶劑中成功合成了空心的鐵氧體微球,并對反應時間、反應溫度、沉淀劑量、Co、Fe摩爾比對微球結構和磁性的影響進行了考察,發現在60~80℃、反應12~16h、沉淀劑(NH4)2CO3為0.15g/mL、nCo/nFe為0.5/1、煅燒溫度在550℃時,所制得的空心鐵氧體微球表現出最為均一的形態以及最好的磁性。
4.2 離子液體在電化學方面的應用
離子液體是完全由離子組成的液體,可以作為電解質應用于電化學中。離子液體以優良的電子導電性能,在電化學反應、電池、電容器等方面都具有廣泛的應用前景。
電還原二氧化碳是人工光合作用的重要組成部分,但是由于反應過程中需要非常高的超電勢來推進反應進程,因此在很大程度上受到了阻礙。Brian等[75]報道了一個電解體系,在低于0.2V的超電勢下將二氧化碳還原成一氧化碳。這一體系用離子液體1-丁基-3-甲基咪唑雙(三氟甲基磺酰基)亞胺鹽(Bmim-NTf2)作為電解質,通過絡合作用降低中間體(CO)-的能量,從而降低了最初的還原勢壘。用銀電極催化形成最終產物,研究表明這一體系在法拉第效率高于96%的情況下生產一氧化碳至少可以持續7h。
5 結 語
(1)在過去的十幾年中,離子液體在化工各領域的應用得到了飛速的發展,人們對離子液體的研究也越來越重視。離子液體作為溶劑和催化劑參與化學反應,應用于化工萃取分離、有機合成、電化學、納米材料等化工及功能新材料各個領域,成為綠色化學中最具前景的反應介質和催化體系;離子液體今后在化工領域將突出在節能減排、非均相高效催化方面有更廣泛應用,尤其是在作為溶劑和催化體系的可循環利用方面將扮演著重要的角色。
(2)離子液體在展現出誘人前景的同時,還有一些問題有待解決,即離子液體種類繁多,但是目前對離子液體的研究大多集中在咪唑、吡啶、季銨鹽等陽離子的離子液體,對其他類型分子結構的離子液體的研究相對較少,開發具有低成本高活性的新型離子液體將是今后合成與應用領域的主要 方向。
[1] Jason P,Hallett,Tom W. Room-temperature ionic liquids:Solvents for synthesis and catalysis[J].Chem. Rev.,2011,111:3508-3576.
[2] Walen P,Acad B. Molecular weights and electrical conductivity of several fused salts[J].Bull AcadImper Sci.(St Petersburg),1914,1800:405-422.
[3] Chaturvedi D. Recent developments on task specific ionic liquids[J].Curr. Org. Chem.,2011,15:1236-1248.
[4] Dong K,Zhang S,Wang D,et al. Hydrogen bonds in imidazolium ionic liquids[J].J. Phys. Chem. A,2006,110:9775-9782.
[5] Sun J,Cheng W G,Fan W,et al. Reusable and efficient polymer-supported task-specific ionic liquid catalyst for cycloaddition of epoxide with CO2[J].Catal. Today,2009,148:361-367.
[6] Liu X,Zhao Y,Zhang X. Microstructures and interaction analyses of phosphonium-based ionic liquids:A simulation study[J].J. Phys. Chem. B,2012,116:4934-4942.
[7] Sun J,McFarlane D R,Forsyth M. A new family of ionic liquids based on the 1-alkyl-2-methylpyrrolinium cation[J].Electrochim. Acta,2003,48:1707-1711.
[8] Yang J Z,Lu X M,Guic J S,et al. A new theory for ionic liquid-the interstice model. Part 1. The density and surface tension of ionic liquid EMISE[J].Green Chem.,2004,6:541-543.
[9] Zhang S G,Zhang Q L,Zhang Z C. Extractive desulfurizaion and denitrogenation of fules using ionic liquids[J].Ind. Eng. Chem. Res.,2004,43:614-622.
[10] Hsiu S I,Huang J F,Sun I W,et al. Lewis acidity dependency of the electrochemical window of zinc chloride-1-ethyl-3- methylimidazolium chloride ionic liquids[J].Electrochim. Acta,2002,47:4367-4372.
[11] Zhang Q G,Yang J Z,Lu X M,et al. Studies on an ionic liquid based on FeCl3and its properties[J].Fluid Phase Equilibria,2004,226:207-211.
[12] Deetlefs M,Seddon K R. The Green Synthesis of Ionic Liquids:In Handbook of Green Chemistry[M]. Germany:Wiley,2010:3-38.
[13] Gozde G M,Fatma I,Ahmed E K. Microwave-assisted synthesis and myorelaxant activity of 9-indolyl-1,8-acridinedione derivatives[J].Eur. J. Med. Chem.,2014,75:258-266.
[14] Cravotto G,Cintas P. Power ultrasound in organic synthesis:Moving cavitational chemistry from academia to innovative and large-scale applications[J].Chem. Soc. Rev.,2006,35(2):180-196.
[15] Horikoshi S,Hamamura T,Kajitani M,et al. Green chemistry with a novel 5.8GHz microwave apparatus. prompt one-pot solvent-free synthesis of a major ionic liquid:The 1-butyl-3-methylimidazolium tetrafluoroborate system[J].Org. Process. Res. Dev.,2008,12:1089-1093.
[16] Messali M,Moussa Z,Alzahrani A Y,et al. Synthesis,characterization and the antimicrobial activity of new eco-friendly ionic liquids[J].Chemosphere,2013,91(11):1627-1634.
[17] Messali M. An efficient and green sonochemical synthesis of some new eco-friendly functionalized ionic liquids[J].Arab. J. of Chem.,2014,7(1):63-70.
[18] Cravotto G ,Cintas P. The combined use of microwaves and ultrasound:Improved tools in process chemistry and organic synthesis[J].Chem. Eur. J.,2007,13:1902-1909.
[19] Khachatryan K S,Smirnova S V,Torocheshnikova I I,et al. Solvent extraction and extraction-voltammetric determination of phenols using room temperature ionic liquid[J].Anal. Bioanal. Chem.,2005,381(2):464-470.
[20] 關衛省,黎文娟,韓娟.醇與離子液體二元雙水相體系萃取鹽酸多西環素[J].分析化學測試報,2012,31(5):600-604.
[21] Dai S,Ju Y H,Barnes C E. Solvent extraction of strontium nitrate by a crown ether using room temperature ionic liquid[J].Chem. Soc. Dalton. Trans.,1999,8:1201-1202.
[22] Hussin N H,Yusoff I,Alias Y,et al. Ionic liquid as a medium to remove iron and other metal ions:A case study of the North Kelantan Aquifer,Malaysia[J].Environ. Earth Sci.,2014,71:2105–2113.
[23] Lee J M. Extraction of noble metal ions from aqueous solution by ionic liquids[J].Fluid Phase Equilibria,2012,319:30-36.
[24] Lee K Y,Kim,C S,Kim H,et al. Effects of halide anions to absorb SO2in ionic liquids[J].Bulletin of the Korean Chemical Society,2010,31 (7):1937-1940.
[25] Hong S Y,Im J,Palgunadi J,et al. Ether-functionalized ionic liquids as highly efficient SO2absorbents[J].Energy & Environmental Science,2011,4(5):1802-1806.
[26] Shang Y,Li H P,Zhang S J,et al. Guanidinium-based ionic liquids for sulfur dioxide sorption[J].Chem. Eng. J.,2011,175:324-329.
[27] 李珂,王強,李國嬖,等.離子液體合成及多級逆流萃取脫硫的串級實驗法驗證研究[J].石油煉制與化工,2014,45(2):26-29.
[28] Lü H Y,Ren W Z,Wang H Y,et al. Deep desulfurization of Diesel by ionic liquid extraction coupled with catalytic oxidation using an anderson-type catalyst [(C4H9)4N]4NiMo6O24H6[J].Applied Catalysis A:General,2013,453:376-382.
[29] Muldoon M J,Anderson J L,Dixon J K,et al. Improving carbon dioxide solubility in ionic liquids[J].J. Phys. Chem. B,2007,111:9001-9009.
[30] Huang J,Riisager A,Wasserscheid P. Reversible physical absorption of SO2by ionic liquids[J].Chem. Commun.,2006,38:4027-4029.
[31] Zhang Z G,Wu L B,Dong J,et al. Preparation and SO2sorption/desorption behavior of an ionic liquid supported on porous silica particles[J].Ind. Eng. Chem. Res.,2009,48:2142-2148.
[32] Leelachaikul P,Castro-Dominguez B,Takagaki A,et al. Perfluorooctanol-based liquid membranes for H2/O2separation[J].Separation and Purification Technology,2014,122:431-439.
[33] Rogers R D,Swatloski R P,Spear S K, et al. Dissolution of cellose with ionic liquids[J].Am. Chem. Soc.,2002,124(18):4974-4975.
[34] Rogers R D,Turner M B,Spear S K,et al. Production of bioactive cellulose films reconstituted from ionic liquids[J].Biomacromol.,2004,5(4):1379-1384.
[35] 周紅霞,李露,劉仕偉,等.磷酸酯基離子液體對木質素的溶解性能[J].高分子材料科學與工程,2012,28(3):49-52.
[36] Kazemi S,Peters Cor J,Kroon M C. Phase behavior of the ternary system acetylferrocene,the ionic liquid 1-butyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide,and carbon dioxide to be applied in friedel-crafts acylation reactions[J].J. Chem. Eng. Data,2013,58(4):951-955.
[37] Chiappe C,Malvaldi M,Pomelli C S. The solvent effect on the Diels-Alder reaction in ionic liquids:Multiparameter linear solvation energy relationships and theoretical analysis[J].Green Chem.,2010,12:1330-1339.
[38] Sarma D,Kumar A. Rare earth metal triflates promoted Diels-Alder reactions in ionic liquids[J].Applied Catalysis A:General,2008,335(1):1-6.
[39] Nicholas E,Leadbeater. Opening an Aladdin’s cave:The Suzuki coupling in a room-temperature ionic liquid[J].Chem. Commun.,2014,50:1515-1518.
[40] Li L Y,Wang J Y,Wu T,et al. Click ionic liquids:A family of promising tunable solvents and application in Suzuki-Miyaura cross-coupling[J].Chem. Eur. J.,2012,18:7842-7851.
[41] Howarth J. Oxidation of aromatic aldehydes in the ionic liquid [Bmim][PF6][J].Tetrahedron Lett.,2000,41(34):6627-6629.
[42] Bose S,Pariyan A,Biswas A N,et al. Selective olefin epoxidation catalyzed by metallocorroles in ionic liquid medium at room temperature[J].J. Mol. Catal. A:Chem.,2013,378 :179-183.
[43] Yuan T Q,Sun S N,Xu F,et al. Homogeneous esterification of poplar wood in an ionic liquid under mild conditions:Characterization and properties[J].J. Agric. Food. Chem.,2012,60 (22):5621-5628.
[44] Nadine G,Katherine N,Gaetan R. Study of the influence of pure ionic liquids on the lipase-catalyzed (trans)esterification of mannose based on their anion and cation nature[J].Chem. Eng. J.,2013,221:99-104.
[45] Bradford B N,Miller K M. Michael addition kinetics of ethyl acetoacetate and 2-ethylhexyl acrylate in ionic liquids[J].Tetrahedron Lett.,2012,53(14):1855-1858.
[46] Chen M,Luo Y,Li G,et al. Alkylation of anthracene to 2-isopropylanthracene catalyzed by lewis acid ionic liquids[J].Korean J. Chem. Eng.,2009,26(6):1563-1567.
[47] Kumar A,Pawar S S. Converting exo-selective Diels-Alder reaction to endo-selective in chloroloaluminate ionic liquids[J].Org. Chem.,2004,69(4):1419-1420.
[48] Zhang W C,Zhao W J,Zhuo G L,et al. Selective carbonylation of toluene top-olualdehyde catalyzed by ionic liquids[J].Chinese Journal of Catalysis,2006,27(1):36-40.
[49] Fang D. A green procedure for the protection of carbonyls catalyzed by novel task-specific room-temperature ionic liquid[J].Catal. Commun.,2007,8(10):1463-1466.
[50] Siddiqui,Zeba N,Khan Kulsum. [Et3NH][HSO4]-catalyzed efficient,eco-friendly,and sustainable synthesis of quinoline derivativesviaknoevenagel condensation[J].ACS Sustainable Chemistry & Engineering,2014,2(5):1187-1194.
[51] Li Y,Hu S L,Cheng J H,et al. Acidic ionic liquid-catalyzed esterification of oleic acid for biodiesel synthesis[J].Chin. J. Catal.,2014,35:396-406.
[52] 左同梅,李為民,趙強,等.新型堿性離子液體催化酯交換合成生物柴油[J].燃料化學學報,2014,42(2):200-206.
[53] Shen Z L,Cheong H L,Lai Y C,et al. Application of recyclable ionic liquid-supported imidazolidinone catalyst inenantioselective Diels-Alder reactions[J].Green Chem.,2012,14: 2626-2630.
[54] Yun X,Hu X,Jin Z,et al. Copper-salen catalysts modified by ionic compounds for the oxidation of cyclohexene by oxygen[J].J. Mol. Catal. A:Chem.,2010,327(12):25-31.
[55] Karimi B,Elhamifar D,Clark J H,et al. Ordered mesoporous organosilica with ionic-liquid framework:An efficient and reusable support for the palladium-catalyzed suzuki-miyaura coupling reaction in water[J].Chem. Eur. J.,2010,16:8047-8053.
[56] Sun J,Wang J Q,Cheng W G,et al. Chitosan functionalized ionic liquid as a recyclable biopolymer-supported catalyst for cycloaddition of CO2[J].Green Chem.,2012,14:654-660.
[57] Luo R C,Zhou X T,Chen S Y,et al. Highly efficient synthesis of cyclic carbonatesfrom epoxides catalyzed by salen aluminum complexes with built-in “CO2capture” capability under mild conditions[J].Green Chem.,2014,16:1496-1506.
[58] Zheng X X,Luo S Z,Zhang L,et al. Magnetic nanoparticle supported ionic liquid catalysts for CO2cycloaddition reactions[J].Green Chem.,2009,11,455-458.
[59] Pourjavadi A,Hosseini S H,Moghaddam F M,et al. Tungstate based poly(ionic liquid) entrapped magnetic nanoparticles:A robust oxidation catalyst[J].Green Chem.,2013,15:2913-2919.
[60] Fauzi A H M,Amin N A S,Mat R. Esterification of oleic acid to biodiesel using magnetic ionic liquid:Multi-objective optimization and kinetic study[J].Applied Energy,2014,114:809-818.
[61] Dewan A,Sarma T,Bora U,et al. Rapid and selective oxidation of benzyl alcohols to aldehydes and ketones with novel vanadium polyoxometalate under solvent-free conditions[J].Tetrahedron Letters,2011,52:2563-2565.
[62] 孫曉云,岳爽,李靜,等.鎢離子液體催化氧化環己醇制得環己酮的性能[J].化工進展,2013,32(3):588-591.
[63] Leng Y,Liu J,Jiang P P,et al. Carboxylic acid-functionalized phosphovanadomolybdate-paired ionic polymer as a green heterogeneous catalyst for hydroxylation of benzene[J].Catal. Commun.,2013,40:84-87.
[64] Leng Y,Liu J,Jiang P P,et al. Organometallic-polyoxometalate hybrid based on V-Schiff base and phosphovanadomolybdate as a highly effective heterogenous catalyst for hydroxylation of benzene[J].Chem. Eng. J.,2014,239:1-7.
[65] 劉建,張晨軍,蔣平平,等.基于磷鉬釩的離子高分子/Fe3O4磁性復合催化劑及其苯羥基化性能[J].精細化工,2014,31(2):197-211.
[66] Leng Y,Jiang P P,Wang J. A novel br?nstedacidic heteropolyanion-based polymeric hybrid catalyst for esterification[J].Catal. Commun.,2012,25:41-44.
[67] O’Callaghan N,Sullivan J A. Towards selective catalytic oxidations using in situ generated H2O2[J].Appl. Catal. B:Environ.,2014,146:258-266.
[68] Song Y F,Tsunashima R. Recent advances on polyoxometalate-based molecular and composite materials[J].Chem. Soc. Rev.,2012,41(22):7384-7402.
[69] Leng Y,Liu J,Jiang P P,Wang J. Heteropolyanion-based polymeric hybrids:Highly efficient and recyclable catalysts for oxidation of alcohols with H2O2[J].Rsc. Adv.,2012,2:11653-11656.
[70] Raisa I M,Lidia I K,Raisa I M,et al. Epoxidation of butadiene with hydrogen peroxide catalyzed by the salts of phosphotungstate anions:Relation between catalytic activity and composition of intermediate peroxo complexes[J].Catal. Lett.,2011,141:1442-1450.
[71] Chen G J,Zhou Y,Zhao P P,et al. Mesostructured dihydroxy-functionalized guanidinium-based polyoxometalate with enhanced heterogeneous catalytic activity in epoxidation[J].Chem. Plus. Chem.,2013,78(6):561-569.
[72] Wu J H,Jiang P P,Leng Y,et al. Synthesis of Dicationic alkyl imidazolium peroxopolyoxotungsten-based phase transfer catalyst and its catalytic activity for olefin epoxidation[J].Chin. J. Catal.,2013,34:2236-2244.
[73] Wu J H,Jiang P P,Qin X J,et al. Peroxopolyoxotungsten-based ionic hybrid as a highly efficient recyclable catalyst for epoxidation of vegetable oil with H2O2[J].Bull. Korean Chem. Soc.,2014,35(6):1-6.
[74] Liu J C,Jiao Q Z,Cao W J. Preparation and magnetic properties of hollow ferrite microspheres by a gas-phase diffusion method in an ionic liquid/H2O mixed solution[J].Journal of Materials Science,2014,49(10):3795-3804.
[75] Rosen B A,Salehi-Khojin A,Thorson M R,et al. Ionic liquid-mediated selective conversion of CO2to CO at low overpotentials[J].Science,2011,334:643-644.

