糖尿病大鼠的胰腺組織損傷及其氧化應激的變化
安增梅 董興剛 過源 周佳亮 秦濤
糖尿病是一種常見病及多發病。糖尿病的主要并發癥之一是糖尿病腎病,也是糖尿病患者病死的主要原因[1]。糖尿病腎病的發病及其進展與氧化應激密切相關[2],但是與胰腺損傷的關系研究較少。因此,本研究檢測糖尿病大鼠胰腺的氧化應激反應,探討糖尿病大鼠胰腺的損傷機制。
一、材料與方法
1.動物分組和模型制作:雄性SD清潔級健康大鼠20只,8周齡左右,體質量(200±30)g,由復旦大學醫學院動物學部提供。飼養環境為每籠5只,溫度(22±2)℃,相對濕度(55±2)%。適應性喂養1周后,將20只大鼠按數字表法隨機分為糖尿病組和對照組,各10只。采用鏈脲佐菌素(streptozotocin,STZ)一次性腹腔注射60 mg/kg體質量的方法制備糖尿病模型。STZ購自美國Sigma公司,臨用前用新配制的0.1 mmol/L的枸櫞酸緩沖液(pH4.5)配成1%濃度的STZ溶液。對照組腹腔注射等容積的檸檬酸-檸檬酸鈉緩沖液。72 h后,糖尿病組大鼠經尾靜脈采血,用血糖儀及血糖試紙測定大鼠血糖,以其血糖≥16.7 mmol/L,大鼠出現明顯的多食、多飲、多尿癥狀確認模型成功。在12周末用摘眼球取血采樣后斷頸椎方法處死大鼠,取部分胰腺、腎臟組織置10%甲醛液固定,部分胰腺組織經液氮速凍后置-80℃冰箱保存。
2.尿蛋白、血糖、血胱抑素C(CytC)、超氧化物歧化酶(SOD)及丙二醛(MDA)水平檢測:采用雙縮脲法測定24 h尿蛋白定量,采用羅式血糖測定儀測定血糖,免疫比濁法檢測血清CytC水平,采用淀粉酶測定試劑盒(速率法)測定淀粉酶活性,采用比色法檢測大鼠血清SOD水平,采用ELISA法檢測血清MDA水平。
3.胰腺及腎臟病理學檢查:取固定的胰腺和腎臟組織,常規石蠟包埋、切片,行HE染色、PAS染色、Masson染色,顯微鏡下觀察胰腺和腎臟的病理變化。
4.大鼠胰腺組織中硝基化酪氨酸(NT)蛋白檢測:采用免疫組化法檢測胰腺組織NT蛋白的表達。小鼠抗大鼠NT單抗試劑盒購自英國abcam公司,工作濃度1∶200,以PBS緩沖液替代一抗作陰性對照。
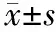
二、結果
1.一般情況:對照組大鼠在實驗12周期間無明顯癥狀,精神狀態良好,反應靈敏,皮毛有光澤,體重正常增長,無死亡。糖尿病組1只大鼠制模未成功,未納入實驗,1只于第42天死亡,8只實驗持續12周。所有糖尿病組大鼠倦怠,豎毛,皮毛萎枯,反應遲鈍,體形消瘦,均出現多食、多尿、多飲癥狀。實驗結束時對照組大鼠的體質量為(490±40)g,糖尿病組體質量為(330±35)g,兩組差異具有統計學意義(P<0.001)。
2.大鼠血糖、血CytC水平、24 h尿蛋白排泄量及血淀粉酶活性的變化:對照組大鼠血糖、血CytC水平、24 h尿蛋白排泄量及血淀粉酶活性分別為(6.7±1.3)mmol/L、(3.94±0.35)mg/L、(3.9±2.3)mg/d、(2 124±235)U/L;糖尿病大鼠為(21.7±5.2)mmol/L、(5.23±0.54)mg/L、(29.2±13.4)mg/d、(2 129±209)U/L,糖尿病組的血糖、血CytC水平、24 h尿蛋白排泄量均較對照組顯著升高,差異具有統計學意義(P值均<0.01),兩組的血淀粉酶活性差異無統計學意義。
3.大鼠血SOD、MDA水平的變化:對照組大鼠血SOD、MDA水平分別為(155.3±61.9)U/L、(5.13±0.91)nmol/L;糖尿病大鼠為(98.6±29.8)U/L、(7.75±0.94)nmol/L,糖尿病組血SOD水平較對照組顯著降低,而MDA水平較對照組顯著升高,差異均有統計學意義(P值均<0.05)。
4.大鼠胰腺及腎臟組織的病理變化:對照組大鼠胰腺腺泡和胰島正常;糖尿病組大鼠胰腺腺泡明顯減少,外分泌腺與胰島之間周界模糊,胰島體積縮小,外形不規則,胰島細胞胞質減少,細胞排列紊亂,間質間膠原物質增多(圖1)。對照組大鼠腎臟結構無明顯變化;糖尿病大鼠近曲腎小管上皮細胞有空泡變性,腎小球結構模糊(圖2)。
5.大鼠胰腺組織NT的表達:胰腺NT的表達定位于胰腺腺泡腔和胰島細胞的胞質。對照組大鼠胰腺有較弱的NT表達;糖尿病組大鼠的胰腺腺泡腔和胰島細胞的胞質呈強陽性表達,并伴有細胞的變性(圖3)。
討論STZ介導的糖尿病大鼠模型是一個病理、生理改變都接近于人類糖尿病的動物模型[3-4]。因為STZ對大鼠的胰島β細胞有選擇性破壞作用,能誘發產生糖尿病,有報道選用雄性大鼠制作模型的成模率明顯高于雌性大鼠,因此本研究全部采用雄性大鼠。

圖1 對照組(左)、糖尿病組(右)大鼠胰腺組織的病理改變[PAS染色(上),Masson染色(下) ×400]

圖2 對照組(左)、糖尿病組(右)大鼠腎臟組織的病理改變(HE ×400)

圖3 對照組(左)、糖尿病組(右)大鼠胰腺NT的表達(免疫組化 ×400)
本實驗結果顯示,糖尿病組大鼠血清抗氧化標志物SOD的水平顯著降低,而氧化應激指標MDA含量顯著升高,表明糖尿病存在氧化應激反應異常,與文獻[5]的研究基本一致。
已有研究證實[5-7],在糖尿病的發病過程中,人體在高血糖和高脂肪酸的刺激下產生大量氧自由基,氧自由基引起氧化應激,是導致胰島β細胞功能損傷的主要原因。高濃度葡萄糖進入細胞內使活性氧簇產生增多,促發氧化應激,啟動核轉錄因子-кB途徑,增加誘生型一氧化氮合酶的轉錄和表達,使一氧化氮生成增加,過量的一氧化氮可與超氧陰離子迅速結合生成氧化作用更強的過氧亞硝基陰離子,雖然在體內過氧亞硝基陰離子很易降解,但是它具有很強的細胞毒性,引起DNA氧化斷裂,導致細胞凋亡[8]。
過氧亞硝基陰離子很不穩定,不易檢測。但因其可使蛋白質酪氨酸殘基或游離酪氨酸發生硝基化反應,形成最終產物NT,因此,可通過檢測NT的生成量間接反映過氧亞硝基陰離子的產生水平[9-11]。
大量的基礎和臨床研究表明,糖尿病存在氧化應激反應可引起腎病,但是對胰腺損傷的研究較少。本研究結果顯示,糖尿病組大鼠胰腺腺泡上皮細胞和胰島結構受損變性,說明糖尿病大鼠存在胰腺損傷。但糖尿病大鼠血清淀粉酶并不升高,這可能是糖尿病大鼠胰腺損傷的特點。本研究結果顯示,糖尿病組大鼠胰腺NT的表達顯著增加,表明胰腺氧化和抗氧化平衡嚴重失調,處于氧化應激狀態。氧化應激機制參與了糖尿病大鼠的胰腺損傷。
參 考 文 獻
[1] Mima A.Inflammation and oxidative stress in diabetic nephropathy:new insights on its inhibition as new therapeutic targets[J]. J Diabetes Res, 2013, 2013:248563.
[2] Tavafi M.Diabetic nephropathy and antioxidants[J].J Nephropathol, 2013, 2(1):20-27.
[3] 安增梅.2型糖尿病腎病動物模型常用研制方法的研究進展[J].醫學綜述,2013,19(23):4324-4325.
[4] Kong LL, Wu H, Cui WP, et al. Advances in murine models of diabetic nephropathy[J].J Diabetes Res, 2013, 2013:797548.
[5] Stanton RC.Oxidative stress and diabetic kidney disease[J].Curr Diab Rep, 2011,11(4):330-336.
[6] 李兆申.2013年胰腺病研究進展回顧與展望[J].中華胰腺病雜志,2014,14(1):1-2.
[7] Oliver CN,Ahn BW,Moerman EJ,et al.Age related changes in oxidized protein[J].J Biol Chem,1987,262(12):5488-5491.
[8] 向旭,朱海航.糖尿病并發急性胰腺炎發病機制研究展望[J].中華胰腺病雜志,2014,14(2):143-144.
[9] 馬邵,葉青.蛋白質酪氨酸硝基化與糖尿病關系的研究進展[J].山東醫藥,2009, 49(7):115-117.
[10] 李榕,王文清,張海鋒,等.高血脂通過氧化/硝基化雙重作用介導大鼠血管內皮功能失調[J].中國病理生理雜志, 2010, 26(8):1494-1497.
[11] 孫笑天,廖專,李兆申.慢性胰腺炎的抗氧化和抗纖維化藥物治療[J].中華胰腺病雜志,2013,13(4):286-288.

